Прикладная биохимия и микробиология, 2019, T. 55, № 2, стр. 166-171
Физико-химические и регуляторные свойства лактатдегидрогеназы из листьев гороха (Pisum sativum L.) в условиях дефицита кислорода
А. Т. Епринцев 1, *, Н. Р. Комарова 1, М. И. Фалалеева 1
1 Воронежский государственный университет
394006 Воронеж, Россия
* E-mail: bc366@bio.vsu.ru
Поступила в редакцию 14.05.2018
После доработки 11.09.2018
Принята к публикации 25.09.2018
Аннотация
При культивировании в условиях затопления в листьях гороха (Pisum sativum L.) индуцировалась активность лактатдегидрогеназы. Фермент был очищен до электрофоретически гомогенного состояния многостадийной очисткой, включающей фракционирование сульфатом аммония, ионобменную хроматографию на ДЭАЭ-целлюлозе и гель-хроматографию на Сефадексе G-200. Степень его очистки составила 101 раз, выход – 26.8%, а удельная активность 41.9 Е/мг белка. Изучены физико-химические свойства фермента. Определена молекулярная масса нативной молекулы лактатдегидрогеназы, равная 148 кДа, и показано, что она состоит из четырех одинаковых субъединиц, молекулярная масса которых, определенная методом электрофореза в ПААГ в присутствии ДДС-Na, равнялась 37 кДа. Изучены кинетические и регуляторные свойства фермента, включающие значения констант Михаэлиса и константы его ингибирования субстратом, а также влияние концентрации ионов водорода и температуры на его прямую и обратную реакцию.
Лактатдегидрогеназа (ЛДГ), катализирующая обратимое превращение пирувата в лактат, обеспечивая восстановление пировиноградной кислоты в гипоксических условиях, широко распространена в природе. При недостатке кислорода ее роль в растениях чрезвычайно важна при осуществлении метаболических приспособлений, связанных с изменениями путей клеточного дыхания. Для функционирования этого процесса необходима постоянная регенерация НАД+, катализируемая ЛДГ [1]. Фермент достаточно хорошо изучен у бактерий и животных. Ранее было установлено, что растительная ЛДГ участвует в краткосрочном (4 ч) ответе на гипоксический стресс [2]. В дополнение к предлагаемой ее роли в краткосрочном ответе на дефицит кислорода было показано участие в адаптивной реакции на действие гипоксии на растение в течение длительного (>8 ч) периода. Так, у растений ячменя, пшеницы, кукурузы и ржи уровень активности ЛДГ остается повышенным, по меньшей мере, в течение 6 сут [3, 4].
При электрофорезе фермента, экстрагированного из других растений, было обнаружено несколько компонентов, обладающих активностью ЛДГ, что интерпретировалось как присутствие изоэнзимов, которые представляли собой тетрамеры, образованные двумя различными пептидными последовательностями [5]. В работе [6] показано неравномерное присутствие двух субъединиц в гипоксических корнях и проростках риса.
В настоящее время отсутствуют достаточное количество данных о физико-химических свойствах, кинетике и регуляции активности ЛДГ в растительных тканях. Для их изучения необходимо получить электрофоретически гомогенный фермент, поскольку ферментативная утилизация лактата, в некоторых растительных организмах осуществляется совместно со вспомогательным ферментом гликолатоксидазой [1].
Цель работы – выделение и очистка до электрофоретически гомогенного состояния ЛДГ из листьев гороха, выращенного в условиях кислородного дефицита, и изучение ее физико-химических и регуляторных свойств.
МЕТОДИКА
Растительный материал. В качестве объекта исследований использовали 9-суточные проростки гороха (Pisum sativum L., сорт Амброзия), выращенные гидропонным методом при 25°С. Эти проростки был погружены в воду на 2–3 см выше корневой шейки для имитации условий дефицита кислорода. Через 48 ч растения были использованы для исследований [7].
Фермент экстрагировали из гомогенизированных листьев растений. Экстракт подвергали гель-фильтрации на колонке (1.5 × 20 см) с сефадексом G-25 (“Pharmacia”, Швеция), а затем ионообменной хроматографии на колонке (1.5 × 15 см) с ДЭАЭ-целлюлозой (“GE Healthcare”, Швеция) и целевой белок гель-хроматографировали на колонке (2.0 × 30 см) с сефадексом G-200 (“GE Healthcare”, Швеция) по методике, описанной в работе [3].
Активность фермента измеряли на спектрофотометре (“ЛОМО СФ-56”, Россия) по скорости окисления НАДН при 340 нм. Реакционная среда содержала 2 мл 50 мМ трис-HCl-буфера, рН 7.4, 0.06 мМ НАДН и 1 мМ пирувата натрия. Реакцию запускали добавлением пирувата натрия [8]. Активность ЛДГ в прямой реакции измеряли в 50 мМ трис-HCl-буфере, рН 7.4, содержавшем 0.5 мМ НАД+ и 25 мМ лактата натрия. За единицу ферментативной активности принимали количество фермента, которое в течение 1 мин при 25°C образовывало (прямая реакция) или превращало (обратная реакция) 1 мкмоль НАДН.
Молекулярную массу белка определяли методом гель-фильтрации на колонке с сефадексом G-200, для калибровки которого был использован Dextran blue (2000 кДа). Для расчета использовали формулу
Молекулярную массу субъединиц оценивали методом электрофореза в 12%-ном ПААГ в присутствии ДДС-Na. В качестве белков-маркеров молекулярной массы использовали набор стандартных белков (кДа): b-галактозидаза (116.0), БСА (66.2), овальбумин (45.0), ЛДГ (35.0), REase Bspl98 (25.0), b-лактоглобулин (18.4) и лизоцим (14.4). Гели окрашивали нитратом серебра по методике [9].
Электрофорез ЛДГ проводили в 8%-ном ПААГ по методу Девиса в не денатурирующих условиях [10]. Для окрашивания гелей применяли нитрат серебра [9], для специфического определения фермента – тетразолиевый метод [11]. Определение белка проводили по методу Лоури.
Влияние рН на скорость ферментативной реакции изучали в 50 мМ трис-HCl-буфере, рН 5.0–10.0 [5].
Кинетические константы прямой и обратной реакций, катализируемых ЛДГ из листьев гороха, были определены методом Лайнуивера–Берка. Каталитические константы Kм, Vmax и Еакт для субстратов пируват и L-лактат определяли в стандартной реакционной смеси при рН 7.5 и 25°С. Концентрацию субстратов варьировали от 0 до 60.0 мМ, а концентрации других компонентов поддерживали постоянными [1].
Влияние температуры на скорость ферментативных реакций ЛДГ изучали в диапазоне температур реакционной смеси от 15 до 60°С.
Эксперименты проводили в 4–6 биологических повторностях, а аналитические определения – в трех. В табл. и на рис. приводятся результаты типичных опытов, каждое значение которых является средним арифметическим трех определений. Для расчета их достоверности использовали метод вариационной статистики с помощью критерия Стьюдента. Обсуждаются статистически достоверные различия при р ≤ 0.05 [12]. Для построения графиков использовали данные, обработанные с помощью программ линейной и параболической аппроксимации.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Было установлено, что в листьях гороха, корни которого инкубированы в условиях недостатка кислорода, индуцировалась лактатдегидрогеназная активность. Максимальная активность ЛДГ была обнаружена после 2 сут их инкубирования (рис. 1), при этом уровень активности фермента увеличивался в 10–11 раз по сравнению с контрольными растениями. Для получения ЛДГ в высокоочищенном состоянии использовали листья гороха, инкубированные в условиях дефицита кислорода в течение 2 сут. Результаты очистки ЛДГ из листьев гороха приведены в табл. 1.
Рис. 1.
Динамика изменения активности ЛДГ в листьях гороха в контроле (1) и в растениях после кислородного голодания (2).
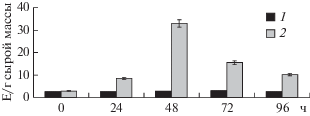
Таблица 1.
Этапы очистки ЛДГ из листьев гороха Pisum sativum L. (n = 3, p ≤ 0.05)
| Стадия очистки | Общий объем, мл | Общая активность, Е | Белок, мг | Удельная активность, Е/мг |
Степень очистки |
Выход, % |
|---|---|---|---|---|---|---|
| Супернатант | 21.0 | 87.5 ± 2.6 | 211.7 ± 6.4 | 0.41 ± 0.01 | 1.0 | 100 |
| Фракционирование сульфатом аммония (35–65%) |
5.0 | 85.9 ± 2.6 | 56.1 ± 1.7 | 1.54 ± 0.05 | 3.7 | 98.2 |
| Гель-фильтрация через сефадекс G-25 | 2.5 | 72.5 ± 2.2 | 29.6 ± 1.0 | 2.45 ± 0.07 | 5.9 | 82.9 |
| Ионообменная хроматография на ДЭАЭ-целлюлоза | 3.0 | 28.1 ± 1.0 | 2.16 ± 0.07 | 13.0 ± 0.4 | 31.5 | 32.1 |
| Гель-хроматография на сефадексе G-200 | 2.5 | 23.4 ± 0.7 | 0.56 ± 0.01 | 41.9 ± 1.3 | 101.3 | 26.8 |
В результате многостадийной очистки был получен электрофоретически гомогенный фермент с высокой удельной активностью (41.9 Е/мг белка) и выходом (26.8%). При ионообменной хроматографии на ДЭАЭ-целлюлоза максимальное количество лактатдегидрогеназной активности было десорбировано с носителя при элюции 350–500 мМ NaCl. При электрофорезе в ПААГ был обнаружен один белковый компонент с Rf – 0.38, который окрашивался нитратом серебра (рис. 2). Этот компонент взаимодействовал с тетразолиевым синим, используемым для специфического определения активности ЛДГ (рис. 2). Таким образом, полученные результаты свидетельствовали о том, что очищенный белок ЛДГ был электрофоретически гомогенен и обладал лактатдегидрогеназной активностью.
Рис. 2.
Электофорез в ПААГ очищенной лактатдегидрогеназы при pH 7.5. Гели окрашены нитратом серебра (1) и специфическим тетразолиевым синим (2); F – фронт (бромфеноловый синий).

Сравнение значений молекулярных масс нативной ЛДГ, полученной гель-хроматографией на сефадексе G-200, и фрагментов ЛДГ, определенных методом электрофореза в присутствии ДДС-Na, (рис. 3) позволило предположить, что молекула фермента обладала четвертичной структурой. Поскольку молекулярная масса его нативной молекулы составляла 148 кДа, а молекулярная масса одной субъединицы 37.1 кДа, то можно было допустить, что молекула ЛДГ из гороха представляла собой тетрамер.
Рис. 3.
Электрофорез в ПААГ в присутствии ДДС-Na очищенной лактадегидрогеназы (8). Белки-маркеры молекулярной массы (кДа): 1 – b-галактозидаза (116.0); 2 – БСА (66.2); 3 – овальбумин (45.0); 4 – ЛДГ (35.0); 5 – REase Bspl98 (25.0); 6 – β-лактоглобулин (18.4); 7 – лизоцим (14.4).

Были установлены каталитические характеристики очищенного фермента. Значение константы Михаэлиса по пирувату составило 15 мкМ, что свидетельствовало о его высоком сродстве к субстрату (рис. 4). Низкая величина Kм ЛДГ при использовании пирувата могла свидетельствовать о высокой скорости окисления гликолитического НАДН [13].
Рис. 4.
Определение значений Км ЛДГ из листьев гороха после кислородного голодания в течение 48 ч для пирувата (а), НАДН (б), лактата (в) и НАД+ (г).
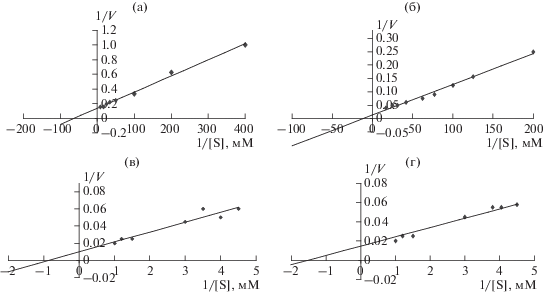
Известно что, величина Kм ЛДГ из томата при использовании в качестве субстрата пирувата составляет 200 мкМ [14], а фермента, экстрагированного из мышц кролика – 48 мкМ [15]. Величина Kм при взаимодействии ЛДГ из листьев гороха с НАДН составила 71 мкМ (рис. 4), что свидетельствовало о ее достаточно высоком сродстве к данному коферменту. При этом показано, что значение этой константы колеблется от 8 до 77 мкМ для ЛДГ из мышц кроликов и из картофеля соответственно [5, 15, 16].
Для субстратов обратной реакции значения Kм выделенной ЛДГ оказались значительно выше, показывая меньшее сродство фермента к лактату и НАД+. Так, значение Kм по лактату составило 600 мкМ, а по НАД+ – 1.17 мМ (рис. 4). Аналогичные результаты изменения сродства ЛДГ к субстратам обратной реакции были получены и для ферментов из других источников. Так, значения Kм по лактату для ЛДГ из мышц кролика и картофеля составили 553–853 мкМ [15] и 11 мМ [5] соответственно, а для НАД+ – от 0.2 мМ для фермента из картофеля до 3.2 мМ ‒ из печени крыс [5, 16].
О возможном сдвиге реакции, катализируемой очищенной ЛДГ из листьев гороха в сторону утилизации лактата, свидетельствовало низкое значение константы ингибирования субстратом – 1.15 мМ (рис. 5).
Рис. 5.
Определение значения константы ингибирования для ЛДГ из листьев гороха после кислородного голодания в течение 48 ч
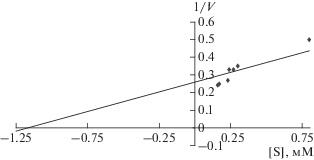
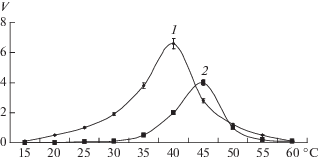
Была изучена термостабильность выделенной ЛДГ в интервале от 15 до 60°C. Температурный оптимум действия фермента при восстановлении пирувата составил 40°С, а при окислении лактата – 45°С (рис. 6). Это согласовывалось с температурными оптимумами ЛДГ из разных организмов, которые, как правило, находятся в пределах 30–60°С [6, 17]. Однако было установлено, что ЛДГ из растений (томат и картофель) обладают максимальной активностью около 40°С [6, 18].
Рис. 6.
Влияние температуры на скорость реакций восстановления пирувата (1) и окислении лактата (2), катализируемых ЛДГ из листьев гороха.
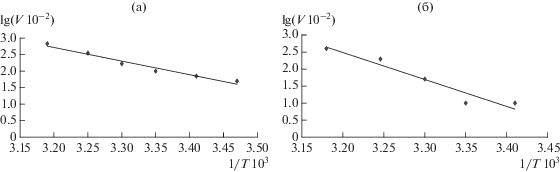
На основе полученных данных были построены графики Аррениуса для реакций восстановления пирувата и окисления лактата (рис. 7), позволившие рассчитать значения энергии активации (Еакт) для переходного состояния фермент-субстратного комплекса. Графики Аррениуса для ЛДГ из листьев гороха описывались прямыми линиями, что свидетельствовало о том, что молекула фермента обладала одним конформационным состоянием [19]. Вычисленные значения энергии активации выделенной ЛДГ составили для прямой и обратной реакций 4.7 и 5.3 кДж/моль соответственно. Следует отметить, что эти значения варьируют у ферментов, выделенных из различных организмов. Так, у растений ячменя ЛДГ характеризуется энергией активации, равной 11 кДж/моль [5], у креветки и трески 44.8 [16] и 55 кДж/моль [20] соответственно.
Рис. 7.
График Аррениуса для ЛДГ из листьев гороха при восстановлении пирувата (а) и при окислении лактата (б).
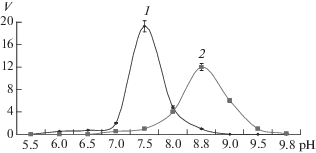
Изучение влияния концентрации ионов водорода на активность выделенной ЛДГ показало, что оптимальное значение рН для протекания прямой реакции составляло 7.5 и для обратной – 8.8 (рис. 8). По данным работ [21, 22] при рН 7.0 равновесие реакции смещено в сторону образования лактата, а в щелочной среде in vivo реакция осуществляется в обратном направлении. По мере изменения рН ионизация групп, как активного центра фермента, так и субстрата может изменяться, что влияет на скорость связывания субстрата с активным центром. ЛДГ у большинства организмов проявляет максимальную активность при значениях рН, близких к нейтральным [15, 23, 24].
Рис. 8.
Зависимость скорости реакции от pH среды для ЛДГ из листьев гороха при восстановлении пирувата (1) и при окислении лактата (2).
При использовании гомогенного препарата ЛДГ важное значение приобретает разработка способа сохранения его активности. Было установлено, что очищенная ЛДГ полностью сохраняла стабильность при хранении в морозильной камере при –74°С в течение 6 мес.
Таким образом, с помощью многостадийной очистки из листьев гороха, корни которого инкубировались в условиях недостатка кислорода, была получена электрофоретически гомогенная ЛДГ. Были изучены физико-химические и каталитические свойства фермента. Установлено, что его молекула представляла собой гомотетрамер, состоящий из четырех одинаковых субъединиц. Показано, что ЛДГ из листьев гороха обладала более высоким сродством к пирувату, по сравнению с лактатом, что позволяло ей активно участвовать в реокислении гликолитического НАДН. Оптимальная для работы выделенного фермента температура составляла 40°С для прямой и 45°С для обратной реакции. Обнаружено, что оптимальное значение рН для катализа восстановления пирувата – 7.5, и окисления лактата – 8.8 [1, 16]. Полученные данные открывают перспективы для изучения роли ЛДГ (совместно с гликолатоксидазой, подобной L-лактат-цитохром с-оксидоредуктазе дрожжей) в адаптивной реакции клеточного метаболизма к гипоксическим условиям, возникающим в корне при затоплении [1].
Работа выполнена при финансовой поддержке гранта Российского фонда фундаментальных исследований (№ 17-04-01039).
Список литературы
Engqvist M.K.M., Schmitz J., Gertzmann A., Florian A., Jaspert N., Arif M., Balazadeh S., Mueller-Roeber B., Fernie A.R., Maurino V.G. // Plant Physiol. 2015. V. 169. № 2. P. 1042–1061.
Davies D.D., Grego S., Kenworthy P. // Planta. 1974. V. 118. № 4. P. 297–310.
Hoffman N.E., Hanson A.D. // Plant Physiol. 1986. V. 82. № 3. P. 664–670.
Good A.G., Crosby W.L. // Plant Physiol. 1989. V. 90. № 3. P. 860–866.
Mulcahy P., O’Carra P. // Phytochemistry. 1997. V. 45. № 5. P. 889−896.
Rivoal J., Richard B., Pradet A. // Plant Physiol. 1991. V. 95. № 3. P. 682−686.
Jain V., Singla N.K., Jain S., Gupta K. // Physiol. Mol. Biol. Plants. 2010. V. 16. № 3. P. 241–247.
Setsuko K., Takahiro M., Hiroshi Y. // PLos One. 2013. V. 8. № 6. URL: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3683008.
Shevchenko A., Wilm M., Vorm O. // Anal. Chem. 1996. V. 68. №. 5. P. 850–858.
Davis B.J., Ornstein L. // Ann. N.Y. Acad. Sci. 1964. V. 121. № 2. P. 404–427.
Fieldes M.A. // Electrophoresis. 1992. V. 13. № 1–2. P. 82–86.
Лакин Г.Ф. Биометрия. М.: Высшая школа, 1990. 352 с.
Zheng Y., Si X., He Q., Jin S., Hong J. // Essays Biochem. 2008. 2015. V. 59. P. 1−41. https://www.ncbi. nlm.nih.gov/pubmed/26504249.
Davies D.D., Davies S. // Biochem. J. 1972. V. 129. № 2. P. 831–839.
Kohashi M., Kasuya Y., Watanabe T. // Biosci., Biotechnol. Biochem. 1996. V. 60. № 2. P. 284–287.
Fregoso-Peñuñuri A.A., Valenzuela-Soto E.M., Figueroa-Soto C.G., Peregrino-Uriarte A.B., Ochoa-Valdéz M., Leyva-Carrillo L., Yepiz-Plascencia G. // Protein Expr Purif. 2017. V. 137. P. 20–25. URL: https://www.ncbi. nlm.nih.gov/pubmed/28625911.
Xia J.-H., Roberts J.K.M. // Plant Physiol. 1994. V. 105. № 2. P. 651−657.
Rivoal J., Hanson A.D. // Plant Physiol. 1994. V. 106. № 3. P. 1179−1185.
Блюменфельд Л.А. Решаемые н нерешаемые проблемы онкологической физики. М.: Едиториал УРСС, 2002. 160 с.
Zakhartsev M.V., Pörtner H.O., Blust R. // Anal. Biochem. 2004. V. 330. № 1. P. 10–20.
Бepecтoвcкaя B.C. // Terra Medica. 2008. № 1. C. 17.
Артюхов В.Г., Наквасина М.А. Биологические мембраны: структурная организация, функции, модификация физико-химическими агентами. Воронеж: ВГУ, 2000. 296 с.
Sweetlove L.J., Dunford R., Ratcliffe R.G., Kruger N.J. // Plant Cell Environ. 2000. V. 23. № 8. P. 873–881.
Xia J.-H., Saglio M. // Plant Physiol. 1992. V. 100. № 1. P. 40−46.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


