Прикладная биохимия и микробиология, 2019, T. 55, № 2, стр. 172-180
Гидролиз белков сои и рапса экстрактом из пилорических придатков трески
Д. В. Зинченко 1, *, Т. А. Муранова 1, Л. А. Меланьина 1, А. И. Мирошников 1
1 Московский государственный университет им. М.В. Ломоносова, биотехнологический факультет
119991 Москва, Россия
* E-mail: zdv@bibch.ru
Поступила в редакцию 12.04.2018
После доработки 03.09.2018
Принята к публикации 25.09.2018
Аннотация
Проведено сравнительное изучение процесса гидролиза белков сои и рапса экстрактом из пилорических придатков трески и полученные гидролизаты проанализированы методами ПААГ-электрофореза в присутствии ДДС-Na, ВЭЖХ и масс-спектрометрии. В работе использовали коммерческий белковый изолят сои, а белки рапса получали из жмыха щелочной экстракцией после удаления ультрафильтрацией низкомолекулярных примесей, экстрагируемых вместе с ними. Показано, что степень гидролиза белков зависела от соотношения субстрата и ферментного экстракта, времени гидролиза, концентрации белка и температуры. Ферментолиз белков рапса и сои экстрактом из пилорических придатков трески при соотношении ферментный экстракт/белок 1 : 20 (вес/вес по белку), времени гидролиза 20 ч и 37°С приводил к полному расщеплению исходных белков. Растворимая часть гидролизата белков рапса состояла из олигопептидов с молекулярным весом менее 14 кДа, а также свободных аминокислот и коротких пептидов, выходящих при электрофорезе за пределы геля, что в сумме составляло 77% (в том числе 6% свободных аминокислот) от исходного белкового материала. По результатам аминокислотного анализа растворимая часть гидролизата белков сои содержала набор олигопептидов и свободных аминокислот, в сумме составляющих 83% по весу от количества исходного белкового материала (в том числе свободные аминокислоты составляли 20.16%).
В настоящее время растительные белки широко используются как белковая составляющая ряда продуктов в пищевой промышленности и кормопроизводстве для животных, птицы и аквакультуры (замена рыбной муки в связи с нарастающей экспансией аквакультуры во всем мире, являющейся следствием продолжающегося исчерпания морских биоресурсов). Соя и рапс являются наиболее перспективными источниками белка растительного происхождения. Огромные объемы производства этих масличных культур обеспечивают широкую доступность продуктов их переработки в виде жмыха, шротов, муки и получаемых из них белковых концентратов и изолятов, характеризующихся высоким содержанием в них белков [1, 2]. По литературным данным содержание белков в семенах рапса составляет 30–45% по весу. В составе соевой муки белки в среднем составляют 35–50% в зависимости от сорта. Аминокислотный состав соевых и рапсовых белков хорошо сбалансирован, содержит все необходимые аминокислоты, но характеризуется пониженным содержанием цистеина и метионина [2]. Однако введение белковых изолятов и концентратов из сои и рапса в рацион животных осложняется присутствием таких антипитательных веществ, не усваиваемых и даже вредных для здоровья и развития животных и снижающих переваривание и адсорбцию пищевых компонентов, как ингибиторы пищеварительных ферментов, глюкозинолаты, производные фенола, сапонины, фитиновая кислота и ряд других соединений [3]. Это требует введения дополнительной стадии очистки этих растительных белков. Второй проблемой является достаточно большой их размер, склонность к агрегации и желированию (особенно соевых белков), а также их частичная денатурация при тепловой обработке в процессе отжима и экстракции масла из семян этих масличных культур. Получение белковых гидролизатов расширяет возможности использования белков сои и рапса в кормопроизводстве, увеличивая доступность белкового материала растительного происхождения для пищеварительной системы животных [4]. Особенное значение получение белковых гидролизатов приобретает при введении белковых добавок растительного происхождения в стартовые корма для рыбной молоди, выращиваемой в аквакультуре. Традиционно в них используются гидролизаты рыбной муки. В связи с тем, что сокращаются запасы пород рыб, используемых для приготовления рыбной муки, разработка альтернативных кормов становится все более актуальной. Так как активность щелочных и кислых протеиназ кишечника у личинок рыб недостаточно высока, белок корма на стадии их постэмбрионального развития должен быть представлен свободными аминокислотами, ди- и олигопептидами, а также низкомолекулярными растворимыми белками в соотношениях, близких к составу планктонных организмов, являющихся естественной пищей большинства рыб, в том числе молоди [5]. Однако, в настоящее время исследований, касающихся получения продуктов диспергированного белка растительного происхождения c заданной глубиной гидролиза недостаточно. Опубликованы работы по получению гидролизатов белков сои с использованием протеолитических ферментных препаратов Flavourzyme 1000L, Novozyme FM 2.0 L, Alcalase 2.4 L [6], комплекса панкреатических ферментов [7] и препарата subtilysin Carlsberg [8], а также – белков рапса при использовании таких протеолитических ферментных препаратов, как Alcalase, Pronase и Neutrase [4, 9, 10].
В предыдущих работах были охарактеризованы гидролизаты белков сои и рапса, полученные при использовании ферментного препарата из гепатопанкреаса камчатского краба [11, 12], а также протосубтилина [13]. В данной работе для гидролиза белков сои и рапса использован экстракт из пилорических придатков трески (мешковидные выросты в начале желудочно-кишечного тракта). Число их у разных рыб неодинаково. У лососей, например, число их составляет 300–400, а у осетровых рыб они срослись вместе и образовали один железистый орган. Изучение пилорических придатков трески, лосося и некоторых пород окуня подтверждают, что они играют важную роль в переваривании пищи [14]. Оказалось, что у всех четырех видов рыб слепая кишка (пилорические придатки) является тем главным местом, в котором сахара, аминокислоты и дипептиды были обнаружены в гораздо большем количестве, чем в основном кишечнике лосося и трески. Щетинные мембраны пилорических придатков содержат гидролитические ферменты, которые делают слепую кишку у рыб результатом их адаптации для увеличения площади поверхности кишки. Доказано, что в пилорических придатках разных рыб имеются ферменты (в том числе трипсин), расщепляющие белки, углеводы и жиры [15, 16]. В настоящее время внутренности рыб являются объектами интенсивного изучения как потенциального источника различных ферментов [17, 18]. Так, трипсин и трипсиноподобные ферменты из пилорических придатков были выделены и охарактеризованы для большого спектра как холодноводных, так и тепловодных рыб [19, 20]. Пилорические придатки трески, использованные в данной работе, представляют собой дешевый источник высокоактивных ферментов, так как треска является одной из важнейших промысловых рыб.
Цель работы – изучение возможности использования ферментного препарата из пилорических придатков трески для получения гидролизатов белков сои и рапса.
МЕТОДИКА
Материалы. В работе использовали: соевый изолят ШАНЬСУН-90 (группа предприятий “ЯНТА”, “Атлант”, Россия) с содержанием по данным производителя сырого протеина 92%, а также жмых рапсовый (“Грейнлюкс”, Россия, ГОСТ 11048-95, содержание сырого протеина 37.3%). Пилорические придатки трески в замороженном виде получены от ОАО “Мурманский траловый флот”, Россия). Реактивы – фирмы “Sigma” (США).
Получение экстракта из пилорических придатков трески (ЭППТ). Замороженный материал гомогенизировали в 0.1%-ном NaCl при соотношении 1 : 20 (вес/объем), гомогенат фильтровали через мембрану 100 кДа, фильтрат высушивали лиофильно. Далее лиофилизованный материал гомогенизировали в 0.4 М трис-HCl буфере, рН 7.5, при соотношении 1 : 25 (вес/объем), нерастворимый материал отделяли центрифугированием при 25 000 g в течение 15 мин на центрифуге J2-21 (“Beckman”, США). Супернатант концентрировали до концентрации белков 2.5 мг/мл ультрафильтрацией через мембрану 3 кДа и использовали для гидролиза белков.
Получение белковых препаратов из жмыха рапса [12]. По литературным данным содержание белков в рапсовом жмыхе составляет 32–40% в зависимости от сорта. Исходный материал растирали в ступке в течение 15 мин до получения тонкого порошка. Порошок промывали 60%-ным этиловым спиртом в течение 30 мин при перемешивании, затем центрифугировали при 25 000 g в течение 15 мин на центрифуге J2-21 (“Beckman”, США). Осадок высушивали на воздухе. Далее проводили экстракцию в течение 2 ч белков из подсушенного препарата раствором 0.5 М NaCl при рН 10.5, комнатной температуре и интенсивном перемешивании, соотношение порошок – жидкость составляло 1–3%. Нерастворимые растительные остатки удаляли центрифугированием при 35 000 g в течение 20 мин на центрифуге J2-21 (“Beckman”, США). Супернатант подвергали ультрафильтрации через мембрану с размерами пор 10 кДа для удаления низкомолекулярных соединений, экстрагирующихся вместе с белками. В процессе ультрафильтрации раствор белков над мембраной несколько раз разбавляли либо водой (рН 8.0), либо буферным раствором (рН 8.0) для сохранения их концентрации, близкой к концентрации в исходном экстракте. Для удаления соли белки осаждали 80%-ным этиловым спиртом в течение 2 ч при 4°С, центрифугировали, осадки белков суспендировали либо в воде и высушивали лиофильно, либо в 0.1 M трис-HCl буфере, pH 8.0, и использовали для ферментативного гидролиза.
Оценка содержания суммарного белка в исходном материале. Оценку проводили методом Кьельдаля [21].
Анализ белковых препаратов на полифенолы. Анализ проводили качественной цветной реакцией с хлоридом железа(III) [22]. При прибавлении к водным растворам полученных белковых препаратов 2–3 капель 5%-ного раствора FeCl3 изменения окраски растворов не происходило, что указывало на отсутствие в них соединений фенола.
Концентрация белков. Концентрацию определяли методом Брэдфорд [23].
Электрофорез в ПААГ. Электрофорез белковых препаратов и гидролизатов проводили по методу Лэмли [24] в 15%-ном ПААГ в присутствии 10%-ного ДДС-Na.
Аминокислотный анализ. Для проведения аминокислотного анализа высушенные гидролизаты гидролизовали 5.6 М HCl при 110°С в течение 24 ч. Анализ проводили на аминокислотном анализаторе SYKAM S430 (“Sykam”, Германия). Суммарное содержание свободных аминокислот в гидролизатах определяли без кислотного гидролиза.
Гидролиз коммерческого соевого белкового изолята и белков рапса. Гидролиз проводили при концентрации белков в растворе 3 мг/мл, рН 8.0, комнатной температуре или 37°С в течение 1, 3, 20 ч. Соотношение ЭППТ/белок составляло 1 : 20 или 1 : 100 (вес/вес по белку). Реакцию останавливали нагреванием реакционной смеси при 90°С в течение 5 мин. Гидролизаты охлаждали и хранили в замороженном состоянии при –20°С.
Масс-спектрометрический анализ белковых гидролизатов. Анализ осуществляли после разделения пептидов на нанопотоковом хроматографе EASY-nLC 1000 (“Thermo Scientific”, США). В качестве детектора использовали масс-спектрометр высокого разрешения OrbiTrap Elite (“Thermo Scientific”, США). Регистрацию панорамных спектров осуществляли в диапазоне от 500 до 2000 m/z с разрешением 240 000, фрагментацию ионов проводили в камере диссоциации высокого давления HCD, спектры фрагментации записывали при разрешении 60000. Пептиды разделяли на капиллярной колонке (150 мм × 75 мкм, “Acuity UHPL BEN300 C4 1.7 µм”, США), уравновешенной 0.05%-ной муравьиной кислотой, в градиенте концентрации ацетонитрила 0–95%. Детекцию пептидов осуществляли при 220 нм.
Хроматографический анализ гидролизатов. Анализ выполняли, на колонке Phenomenex Luna C18(2) (100 Å, 5 мкм, 250 × 4.6 мм), уравновешенной 0.1%-ной трифторуксусной кислотой, в градиенте концентрации ацетонитрила (2% → 95% в течение 30 мин) при скорости элюции 1 мл/мин и температуре колонки 30°С, используя хроматографическую систему высокого давления BREEZE (“Waters”, США). На колонку наносили 20 мкл гидролизата. Детекцию пептидов осуществляли при 215 нм.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Продукты переработки масличных культур вызывают все возрастающий интерес в мире как источник доступных белков. В настоящее время в качестве глобального источника белка растительного происхождения для пищевой промышленности и кормопроизводства на первом месте стоит соя. Это обусловлено доступностью продуктов ее переработки и относительно высоким содержанием в них белков. Рапс входит в пятерку наиболее культивируемых в мире масличных культур, занимая пятое место после сои, хлопка, арахиса и подсолнечника. Поскольку рапс является более холодостойкой культурой по сравнению с ними, то при климатических условиях России он приобретает особое значение как источник растительного белка. Основные белки рапса – глобулины (молекулярная масса ~300 кДа) состоят из 6 субъединиц и обладают четвертичной структурой. Полипептидные цепи субъединиц частично связаны между собой дисульфидными мостиками. Альбумины характеризуются низкой молекулярной массой (~12–14 кДа) и хорошо растворимы в воде. Белки рапса по балансу аминокислот вполне соответствуют полноценной диете рыб с использованием корма на основе рыбной муки [2]. Аминокислотный состав рапсовых [25] и соевых белков [2] хорошо сбалансирован и содержит достаточное количество серосодержащих аминокислот и лизина.
Основными белками соевых бобов являются глобулины, глицинин и β-конглицинин в соотношении 75/115, составляющие 80% от белка сои [26, 27]. Белки обладают сложной четвертичной структурой. Глицинин состоит из 5 субъединиц и имеет коэффициент седиментации 11S, а β-конглицинин (коэффициент седиментации 7S) состоит из 3 субъединиц (76, 72 и 53 кДа) [28]. Кроме глобулинов, нерастворимых в воде, но растворимых в растворах нейтральных солей, в сое содержатся водорастворимые белки, характеризующиеся более низкой молекулярной массой. К ним относятся минорный γ-конглицинин и относительно небольшое количество других белков, включая “сывороточные белки”, в сумме составляющие от 9 до 15% массы белков сои. Обладая сложной четвертичной структурой, которая формируется крупными полипептидами, глобулины сои в определенных условиях быстро денатурируются с разворачиванием полипептидных цепей. На основании результатов целого ряда работ по ферментативному гидролизу соевых белков был сделан вывод, что белки сои вследствие компактной четвертичной и третичной структуры, по-видимому, малодоступны для ферментативного гидролиза, так как многие их участки закрыты и труднодоступны для ферментов [29–31].
Белки рапса получали из обезжиренного жмыха, по методике, описанной ранее [12], предусматривающей получение белковых препаратов, не содержащих антипитательные вещества, присутствующих в жмыхе рапса. Измельченный до тонкого порошка рапсовый жмых промывали 60%-ым этиловым спиртом для удаления растворимых в спирте окрашенных соединений и некоторых примесей. При этом удаляется 75% фенольных соединений [33], а также около 50% моно- и олигосахаридов [2]. Белки экстрагировали 0.5 М NaCl при рН 10.5 и концентрации муки не более 3% (w/v). Экстрагирующиеся вместе с белками антипитательные низкомолекулярные соединения отделяли ультрафильтрацией экстрактов через мембраны с порами, пропускающими молекулы с молекулярной массой не более 10 кДа. Для удаления NaCl белки осаждали этиловым спиртом при соотношении 1 : 9 (вес/вес) и 4°С, затем их суспендировали в воде и высушивали лиофильно. По данным аминокислотного анализа содержание белка в полученных белковых препаратах составляло около 92%. При проведении реакции с хлоридом железа(III) не было обнаружено изменение окраски растворов белков, что свидетельствовало об отсутствии в них соединений фенола [22]. Аминокислотный состав белковых препаратов был сопоставимым с аминокислотным составом рыбной муки, но несколько отличался по содержанию ряда аминокислот [11].
Для гидролиза белков рапса и коммерческого соевого белкового изолята использовали экстракт из пилорических придатков трески (ЭППТ) 0.1%-ным раствором NaCl. Концентрацию белков в экстракте использовали при расчете соотношения ферментного препарата и гидролизуемого белка. Поскольку в составе белков рапса содержатся альбумины с pI около 10 [32] и глобулины (~70% общего белка), значения pI которых колеблются от 4 до 7 [33], а значения pI белков сои – от 4.5 до 6.4, то гидролиз проводили при рН 8.0.
Коммерческий белковый изолят сои и белки рапса (3 мг/мл) гидролизовали ЭППТ при соотношении ЭППТ/белок 1/20 или 1/100 (вес/вес по белку) в течение 1, 3 и 20 ч либо при комнатной температуре, либо 37°C. Предварительная денатурация белков не оказывала влияния на глубину гидролиза. Полученные гидролизаты анализировали методами ПААГ-электрофореза в присутствии ДДС-Na, В-ЭЖХ, масс-спектрометрически, а также определяли в них содержание свободных аминокислот.
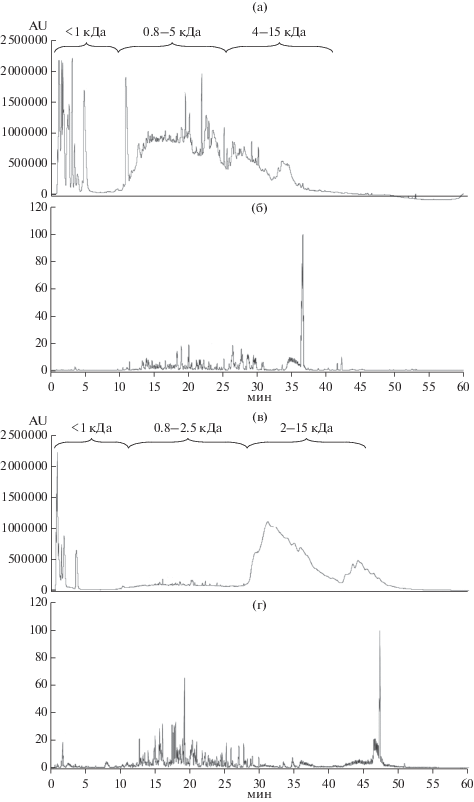
На рис. 1 (дорожки 9–14) приведены электрофореграммы гидролизатов белков рапса, полученных при комнатной температуре. Видно, что, при соотношении ЭППТ/белок 1/20 практически все высокомолекулярные белки гидролизовались полностью в течение 3 ч, при этом часть гидролизата состояла из олигопептидов с молекулярной массой менее 14 кДа. Остальной белковый материал, составляющий большую часть общего белка, гидролизовался до свободных аминокислот и коротких пептидов, при электрофорезе выходящих за пределы геля. При соотношении ЭППТ/белок 1 : 100 такой результат достигался только после 20 ч гидролиза, но при этом в гидролизате присутствовало некоторое количество исходного белкового материала массой около 20 кДа. Однако среди продуктов гидролиза присутствовали нерастворимые фрагменты. На рис. 2 приведены ВЭЖХ-хроматограммы гидролизатов белков рапса, полученных после гидролиза Эк.ППТ в течение 20 ч при различных соотношениях ЭППТ/белок. При сравнении площади пиков исходного белкового материала и гидролизатов, видно, что и при соотношении ЭППТ/белок 1 : 20 (рис. 2а), и 1 : 100 (рис. 2б) за указанное время исходный белковый материал практически полностью гидролизовался с образованием низкомолекулярных олигопептидов. Однако, видно, что за одинаковое время гидролиза гидролиз исходного белкового материала при соотношении 1 : 20 происходил полнее, чем при соотношении 1 : 100. По результатам аминокислотного анализа растворимая часть гидролизата составляла по весу только 18.7% от исходного белка при соотношении белок/ЭППТ 1:100 и 36.4% при соотношении 1 : 20. Как показал масс-спектрометрический анализ (рис. 3а–г) в растворимых продуктах гидролиза присутствовали очень короткие пептиды массой менее 1 кДа, а также олигопептиды массой 1–10 кДа.
Рис. 1.
Электрофорез в ПААГ в присутствии ДДС-Na исходных коммерческого белкового изолята сои (1) и белков рапса (8) и гидролизатов белкового изолята сои (дорожки 2–7) и белков рапса (дорожки 9–14) ЭППТ при комнатной температуре и соотношении ЭППТ/белок 1 : 20 (дорожки 2–4 сои и 9–11 рапса), 1 : 100 (дорожки 5–7 сои и 12–14 рапса) и времени гидролиза 1 ч (дорожки 2, 5, 9, 12), 3 ч (3, 6, 10, 13) и 20 ч (дорожки 4, 7, 11, 14)
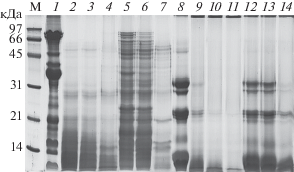
Рис. 2.
ВЭЖХ исходных белков рапса (1) и его гидролизатов (2) ЭППТ при соотношении ЭППТ/белок 1 : 20 (а) и 1 : 100 (б), время гидролиза 20 ч; пики, соответствующие белковым компонентам ЭППТ обозначены звездочкой
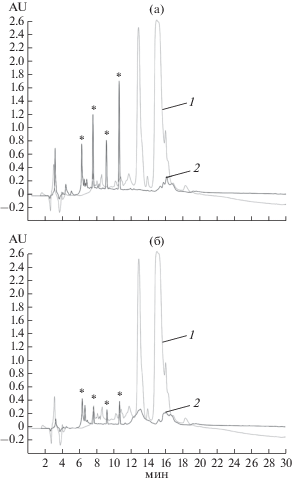
Рис. 3.
Масс-спектрометрический анализ продуктов гидролиза белков рапса ЭППТ при соотношении ЭППТ/белок 1 : 20 (а, б) и 1 : 100 (в, г) в течение 20 ч; а, в – хроматограммы гидролизатов (см. раздел “Методики”), б, г – масс-хроматограммы компонентов хроматографического элюата; указаны диапазоны молекулярных масс продуктов гидролиза, определяемые масс-спектрометрическим методом.
Гидролиз коммерческого белкового изолята сои проводили препаратом ЭППТ в тех же условиях, что и гидролиз белков рапса. Полученные результаты показали, что гидролиз соевых белков в тех же условиях проходил гораздо медленнее, чем гидролиз белков рапса. В процессе этого гидролиза наблюдалось помутнение реакционной смеси, не исчезавшее до его конца, которое, по-видимому, было связано с образованием некоторого количества нерастворимых белковых фрагментов. На рис. 1 (дорожки 2–7) приведены электрофореграммы соевого гидролизата. На них видно, что гидролиз как соевых, так и белков рапса, протекал быстрее при более высокой нагрузке ферментов (ЭППТ/белок 1 : 20). В течение 1 ч гидролиза при соотношении ЭППТ/белок 1 : 20 все белки сои расщеплялись, гидролизат содержал белковые фрагменты с молекулярной массой ниже 30 кДа, в основном, ниже 20 кДа. В течение следующих 20 ч происходил дальнейший гидролиз образовавшихся белковых фрагментов, а конечный гидролизат содержал в основном пептидные фрагменты с молекулярной массой ниже 16 кДа. Гидролиз соевых белков при соотношении ЭППТ/белок 1 : 100 протекал гораздо медленнее. Так, через 3 ч от начала гидролиза в гидролизате все еще присутствовало значительное количество высокомолекулярных белковых фрагментов. Однако, через 20 ч степень гидролиза белков сои была приблизительно такой же, как и при соотношении ЭППТ/белок 1 : 20, но в гидролизате присутствовало некоторое количество высокомолекулярных фрагментов белков с молекулярной массой около 50–30 кДа. Растворимую часть гидролизатов белкового изолята сои анализировали методом ВЭЖХ (рис. 4). На представленных хроматограммах видно, что в обоих гидролизатах, полученных при разном соотношении ЭППТ/белок, даже после 20 ч гидролиза, присутствовало некоторое количество крупных молекул белка. Масс-спектрометрический анализ растворимой части гидролизатов белков сои (рис. 5) показал, что после гидролиза в течение 20 ч и соотношении ЭППТ/белок как 1 : 20, так и 1 : 100 в растворимой части гидролизата содержались очень короткие пептиды массой менее 1 кДа и набор олигопептидов массой 1–10 кДа. Однако, по результатам аминокислотного анализа растворимой части гидролизата было установлено, что после гидролиза при комнатной температуре растворимая часть гидролизата, полученного при соотношении белок/ЭППТ 1 : 20, содержала только 10.16% (по весу) белка от исходного количества, а при соотношении 1 : 100 – 22%.
Рис. 4.
ВЭЖХ исходных белков сои (1) и растворимой части гидролизатов белков сои (2) ЭППТ при соотношении ЭППТ/белок 1 : 20 (а) и 1 : 100 (б) в течение 20 ч; пики, соответствующие белковым компонентам, обозначены звездочкой.
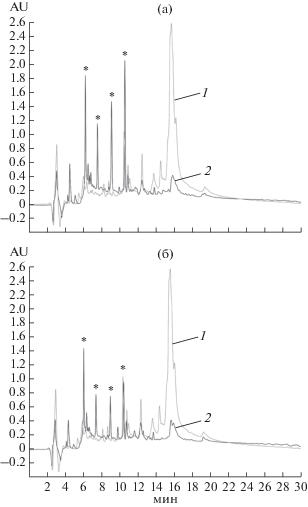
Рис. 5.
Масс-спектрометрический анализ растворимой части гидролизатов белков сои ЭППТ при соотношении ЭППТ/белок 1 : 20 (а, б) и 1 : 100 (в, г) в течение 20 ч; а, в – хроматограммы гидролизатов (см. раздел “Методики”); б, г – масс-хроматограммы компонентов хроматографического элюата, (указаны диапазоны молекулярных масс продуктов гидролиза, определяемые масс-спектрометрическим методом).
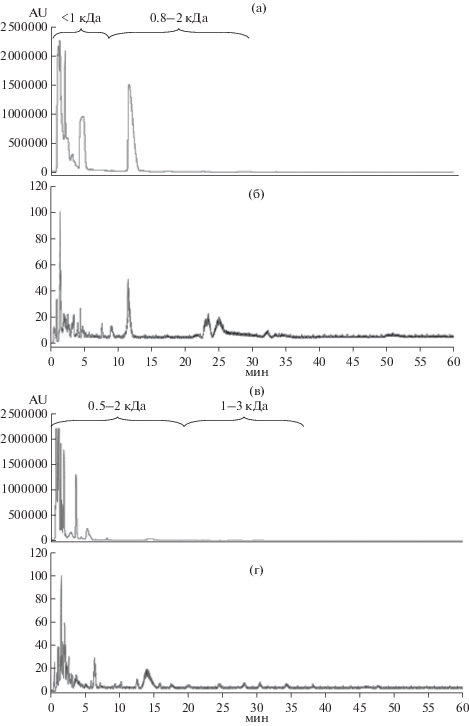
Таким образом, при комнатной температуре, являющейся экономически более выгодной при получении белковых гидролизатов для кормов, гидролиз белков сои и рапса препаратом ППТ проходил недостаточно полно с образованием нерастворимых фрагментов. В данной работе показано, что более глубоко белки сои и рапса гидролизовались при 37°С при прочих равных условиях. Аминокислотным анализом гидролизатов установлено, что при этой температуре выход растворимых продуктов гидролиза соевых белков при соотношении ЭППТ/белок 1 : 20 составлял по весу 82.7% от количества исходного белка, в том числе в них присутствовало 20.16% свободных аминокислот. При соотношении 1 : 100 растворимая часть гидролизата составляла 88.4%. Этот анализ также показал, что при +37°С выход растворимых продуктов гидролиза белков рапса при соотношении белок/ЭППТ 1 : 20 составлял по весу 72% от количества исходного белка и 5.7% свободных аминокислот.
Полученные результаты показали, что ферментный экстракт из пилорических придатков трески содержал ферменты, проявляющие высокую протеолитическую активность, обеспечивающую высокую глубину гидролиза даже таких сложных белков, как белки сои. Это имеет особое значение при создании стартовых кормов для аквакультуры, использующихся при подращивании личинок до момента перехода на активное питание, что является одним из важных технологических этапов искусственного выращивания рыб. В этот период отмечают высокую смертность (свыше 50%) молоди, обусловленную тем, что у них недостаточно высока активность щелочных и кислых протеиназ кишечника. В связи с этим считается необходимым вводить в состав личиночных (стартовых) кормов значительное количество низкомолекулярных белковых веществ, способных перевариваться и усваиваться в процессе мембранного и внутриклеточного пищеварения [5].
Работа выполнена при финансовой поддержке Российского Научного Фонда (проект № 16-14-00133).
Список литературы
Salunkhe D.K., Adsule R.N., Chavan J.K., Kadam S.S. World Oilseeds. Chemistry, Technology and Utilization. N.Y.: Springer, 1992. 554 p.
Shahidi, F. Canola and Rapeseed. Production, Chemistry, Nutrition and Processing Technology / Ed. F. Shahadi. N.Y.: Springer Science & Business Media, 1990. 359 p.
Francis G., Makkar H., Bekker K. // Aquacult. 2001. V. 199. № 3. P. 197–227.
Vioque J., Sanchez-Vioque R., Clemente A., Pedroche J., Bautista J., Millan F. // JAOCS. 1999. V. 76. № 7. P. 819–823.
Грозеску Ю.Н., Бахарева А.А., Шульгина Е.А. // Рыбоводство и рыбное хозяйство. 2011. № 4. С. 49–52.
Hrĉková M., Rusňáková M., Zemanoviĉ J. // Czech. J. Food Sci. 2002 V. 20. № 1. P. 7–14.
Caldéron De La Barca A.M., Ruiz-Salazar R.A., Jara-Marini M.E. // J. Food Sci. 2000. V. 65. № 2. P. 246–253.
Kuipers B.J.,Gruppen H., Voragen A.G. // J. Agric. Food Chem. 2005. V. 53. № 4. P. 1031–1038.
Rodrigues I.M., Coelho J.F.J., Carvalho M.G. // J. Food Eng. 2012. V. 109. № 3. P. 337–346.
Kim C.H., Kim H.S., Lee J.S., Kang Y.J. // Ibid. 1992. V. 21. № 4. P. 519–524.
Muranova T.A., Zinchenko D.V., Kononova S.V., Belova N.A., Miroshnikov A.I. // Appl. Biochem. Micr-o. 2017. V. 53. № 6. P. 680–687.
Muranova T.A., Zinchenko D.V., Melanina L.A., Miroshnikov A.I. // Appl. Biochem. Micro. 2018. V. 54. № 1. P. 76–82.
Zinchenko D.V., Muranova T.A., Melanina L.A., Belova N.A., Miroshnikov A.I. // Appl. Biochem. Micro. 2018. V. 54. № 3. P. 294–300.
Buddington R.K., Diamond J.M. // PNAS. 1986. V. 83. № 3. P. 8012–8014.
Mankura M., Kayama M., Saito S. // Bulletin JSSF. 1984. V. 50. № 12. P. 2127–2131.
Khantaphant S., Benjakue S. // Food Chem. 2010. V. 120. № 3. P. 658–664.
Hau P.V., Benjakul S. // J. Food Biochem. 2006. V. 30. № 3. P. 478–495.
Li B.J., Zhou L.G., Cai Q.F., Hara K., Maeda A., Su W.J., Cao M.J. // Food Chem. 2008. V. 110. № 2. P. 352–360.
Simpson B.K., Haard N.F. // Comp. Biochem. Phys. B. 1984. V. 79. № 4. P. 613–622.
Klomklao S., Benjakul S., Visessanguan W., Kishimura H., Simpson B.K. // J. Agric. Food Chem. 2006. V. 54. № 15. P. 5617–5622.
Бусев А.И. Колориметрические (фотометрические) методы определения неметаллов. М.: Изд-во Иностранной литературы, 1963. 70 с.
Запрометов М.Н. Биохимия катехинов. М.: Наука, 1964. 295 с.
Bradford M.M. // Anal. Biochem. 1976. V. 72. № 7. P. 248–254.
Laemmly U.K. // Nature. 1970. V. 227. № 8. P. 680–685.
Cheftel J.C., Cuq J.L., Lorient D. Protéines Alimentaires. Biochimie – Propriétés Fonctionnelles – Valeur Nutritionnelle–Modifications Chimiques. Paris: Technique et Documentation – Lavoisier, 1985. 295 p.
Nielsen N.S. Structure of Soy Protein / Eds. Altschul A.M., Wilcke H.L. N.Y.: Academic Press, 1985. P. 26–66.
Nishinary K.Y., Fang S. Guo, Philips G.O. // Food H-ydrocolloid. 2014. № 3. V. 39. P. 301–318.
Sexton P.J., Paek N.C., Shibles R.M. // Field Crops Res. 1998. V. 59. № 1. P. 1–8.
Tsumura K., Saito, T., Kugimiya, W., Inouye K. // J. Food Sci. 2004. V. 69. № 5. P. 363–367.
Chen Lin, Jianshe Chen, Jianyan Ren, Mouming Zhao // Food Hydrocolloid. 2011. V. 25. № 5. P. 887–897.
Xiang Dong Sun // Int. J. Food Sci. Technol. 2011. V. 46. № 12. P. 2447–2459.
Krause J.P., Schweke K.D. // Colloids Surf B Biointerfaces. 2001. V. 21. № 1. P. 29–36.
Chabanon G., Chevalot I., Framboisier X., Chenu S., Marc I. // Process Biochem. 2007. V. 42. № 10. P. 1419–1428.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


