Прикладная биохимия и микробиология, 2019, T. 55, № 2, стр. 181-190
Возрастание потенциала адаптации к повышенной освещенности растений ячменя, колонизированных ризобактериями P. putida bs3701
Д. В. Ветошкина 1, *, И. Ю. Позднякова-Филатова 2, Е. М. Журикова 1, А. А. Фролова 2, 3, И. А. Найдов 1, Б. Н. Иванов 1, М. М. Борисова-Мубаракшина 1
1 Институт фундаментальных проблем биологии РАН
142290 Пущино, Россия
2 Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина РАН
142290 Пущино, Россия
3 Тульский государственный университет
300012 Тула, Россия
* E-mail: vetoshkina_d@mail.ru
Поступила в редакцию 28.05.2018
После доработки 05.09.2018
Принята к публикации 25.09.2018
Аннотация
Изучено влияние колонизации растений ячменя (Hordeum vulgare L.) ассоциативными микроорганизмами Pseudomonas putida BS3701 на адаптацию фотосинтетического аппарата к высокой интенсивности света. Обнаружен ряд отличий в функционировании и строении фотосинтетического аппарата контрольных растений и растений, колонизированных Р. putida BS3701, выращенных при 100 мкмоль квантов/м2 с. Показано, что растения ячменя, колонизированные Р. putida BS3701, обладали повышенной устойчивостью к высокой интенсивности света (1000 мкмоль квантов/м2 с) по сравнению с контрольными растениями. Установлено, что адаптационное уменьшение размера антенны ФС2 характеризовалось одинаковым молекулярным механизмом и в контрольных, и колонизированных растениях. Однако уменьшение размера антенны ФС2 оказалось значительнее выражено в колонизированных растениях. Можно предположить, что это и явилось причиной более эффективной защиты фотосинтетического аппарата растений, колонизированных Р. putida BS3701, от фотоингибирования при повышенном освещении.
Выяснение молекулярного механизма сопротивляемости растений неблагоприятным факторам среды является одной из актуальных задач современной прикладной биохимии. Такие климатические колебания, как изменения среднегодовых температур и количества выпавших осадков, негативно влияют на функционирование растений, приводя к снижению урожайности сельскохозяйственных культур. Одно из направлений поиска средств их защиты является применение непатогенных почвенных микроорганизмов. Почвенные микроорганизмы, заселяющие ризосферу, способны к образованию симбионтов “растение – микроорганизм”. В результате такого симбиоза растение может приобретать не только повышенную устойчивость к неблагоприятным абиотическим факторам среды, но и повышенную сопротивляемость по отношению к фитопатогенным грибам и бактериям.
Известно, что для микроорганизмов, способных стимулировать рост растений, увеличивать их продуктивность и устойчивость к фитопатогенам, биотическим и абиотическим факторам, принято название “plant growth-promoting rhizobacteria” (PGPR) [1]. В настоящее время имеются данные о влиянии колонизации PGPR на устойчивость растений к засухе, засолению почвы, повышению температуры, изменению содержания углекислого газа в атмосфере и присутствию в почве тяжелых металлов [2]. Однако не менее важным фактором, влияющим на рост и развитие растения, является уровень их освещенности. При избыточной освещенности оптимизация фотосинтетической активности происходит на разных уровнях организации растения, от регулирования поворота листа до регулирования уровня экспрессии генов, кодирующих белки фотосинтетической электрон- транспортной цепи. При перевозбуждении электрон-транспортной цепи в условиях повышенной освещенности растения не способны использовать всю получаемую энергию в фотохимических реакциях, поэтому один из адаптационных механизмов к высокой интенсивности света связан с уменьшением размера антенны фотосистемы 2 (ФС2) [3, 4], которое приводит к уменьшению абсорбции световой энергии и предотвращению перевосстановления электрон-транспортной цепи. Уменьшение размера антенны ФС2 при долговременной повышенной освещенности требует уменьшения биосинтеза ее светособирающих белков. Для растений Arabidopsis thaliana дикого типа было показано, что уменьшение размера антенны ФС2 осуществляется путем подавления биосинтеза внешних белков Lhcbl, Lhcb2, Lhcb3 и Lhcb6 и наблюдается на транскрипционном или постранскипционном этапе [5], в то время как количество белков Lhcb4 и Lhcb5 не изменяется [3, 4]. Было показано, что размер антенны ФС2 уменьшается после 3 сут нахождения растений в условиях повышенной освещенности при постоянном освещении.
Цель работы – изучить влияние на адаптацию к высокой интенсивности света колонизации растений ячменя (Hordeum vulgare L.) ассоциативными ризобактериями Pseudomonas putida sp. BS3701, которые входят в состав консорциума, эффективно деградирующего нефтепродукты [6, 7].
МЕТОДИКА
Условия культивирования микроорганизмов. Для колоницации семян использовали культуру Р. putida BS3701 (штамм получен из ИБФМ РАН. Пущино), выращенную в течении 16 ч на богатой питательной среде LB, содержавшей (г/л): бакто-триптон – 10, дрожжевой экстракт – 5 и NaCl – 10. Для определения выживаемости Р. putida BS3701 в ризосфере ячменя использовали селективную питательную среду King В, следующего состава (г/л): протеазный пептон – 20, гидрофосфат калия – 1.5, сульфат магния (6-водный) – 1.5 и агар-агар – 20.
Условия выращивания растений. Контрольные и колонизированные семена ячменя проращивали в темноте в течение 24 ч, затем переносили в термостатируемую камеру (21°С) и выращивали в течение 6 сут на нестерильной почве в условиях умеренной интенсивности света 100 мкмоль квантов/м2 с, светопериод 8 ч день/16 ч ночь. Проростки (7 сут) контрольных и растений, колонизированных Р. putida BS3701, переносили в условия высокой интенсивности света (1000 мкмоль квантов/м2 с) и постоянного освещения без изменения его спектрального состава. Измерение интенсивности света проводили с помощью прибора LI-250 Quantum Sensor (“LI-COR”, США).
Определение колонизирующей способности ризосферных бактерий. Для определения способности бактерий колонизировать корни растений и ризосферу проводили смыв с корней на 7 сут после начала проращивания семян. Корни освобождали от крупных комков земли, помещали в физраствор (1 г влажной биомассы на 100 мл раствора) и перемешивали на мульти-ротаторе Multi Bio RS-24 (“Biosan”, Латвия) при скорости 30 об./мин в течение 30 мин После стандартных серийных разведений высевали на селективную среду King В для идентификации микроорганизмов рода Pseudomonas.
Было показано, что Р. putida BS3701 сохранялся в ризосфере в течение всего эксперимента, концентрация бактериальной культуры составляла ~6 × 106 КОЕ/г влажной биомассы. Общая микробная обсемененность колонизированных растений (оценивались культивируемые формы) составила ~108 КОЕ/г влажной биомассы. Штамм Р. putida BS3701 не обнаруживался при смыве с корней не колонизированных растений, их общая микробная обсемененность составляла ~7 × 107 КОЕ/г влажной биомассы.
Измерение индукционных кривых быстрой флуоресценции, ОЛР-кинетик. Быструю фазу индукции флуоресценции хлорофилла ФС2 (ОЛР) в промежутке времени 0.01–1.0 с фиксировали с помощью флуориметра Handy PEA (“Hansatech Instruments”, Германия) при подаче вспышки насыщающего света 3500 мкмоль квантов/м2 с.
Данные были обработаны с помощью программы Pea Plus. Ниже приведены формулы расчета основных параметров флуоресценции, используемых в работе: Fv = Fm – F0 – переменная флуоресценция в определенный момент времени; Sm = area/(Fm – F0) –нормированная площадь над индукционной кривой флуоресценции OJIP, отражающая емкость пула электронных акцепторов до полного восстановления QA; ABC/RC = (M0/Vj)(Fv/Fm) – усредненное поглощение потока фотонов хлорофиллом антенны ФС2 (отражает кажущийся размер антенны ФС2); PIabs = (RC/ABS) – показатель функциональной активности ФС2; Fm – максимальный уровень флуоресценции, когда все реакционные центра ФС2 закрыты; F0 – минимальный уровень флуоресценции, когда все реакционные центры ФС2 открыты; М0 – начальный наклон фазы О-J роста флуоресценции (отражает скорость закрывания РЦ ФС2); Vj = (Fj – F0)/Fv – относительная амплитуда О-J фазы (отражает количество РЦ, которые закрываются при подаче насыщающей вспышки, по отношению к общему числу РЦ); Area – площадь над индукционной кривой флуоресценции (OJIP).
Определение количества пероксида водорода в листьях. Измерение количества пероксида водорода было основано на перекисном окислении люминола [8]. Листья (50–100 мг) замораживали в жидком азоте, переносили в 0.4 мл 2 М трихлоруксусной кислоты и гомогенизировали. Пероксид водорода экстрагировали 3 мл 0.05 М К-фосфатного буфера, pH 8.5. Для удаления пигментов суспензию инкубировали в течение 1 ч с активированным углем (250 мг). Полученную смесь центрифугировали при 10 000 g в течение 20 мин Супернатант отбирали и доводили 2 М КОН до рН 8.5. Для определения содержания пероксида водорода использовали 50 мкл полученного экстракта, в который с помощью дозатора вносили 1 мл смеси люминола (2.26 × 10–4 М) и пероксидазы (1 × 10–6 М). Для построения калибровочной кривой использовали растворы с известной концентрацией пероксида водорода. Уровень хемилюминесценции регистрировали с помощью программы PowerGraph.
Определение концентрации хлорофилла. Для определения содержания хлорофилла 20 мкл пробы растворяли в 1 мл 95%-ного этанола и центрифугировали при 3400 g на центрифуге “MiniSpin” (“Eppendorf”, Германия). После этого измеряли оптическую плотность супернатанта на спектрофотометре “СФ 2000" ("Спектр”, Россия) при 664.2 и 648.6 нм. Концентрацию хлорофилла определяли, используя уравнение [9].
Полимеразная цепная реакция в режиме реального времени. Количественный анализ уровня мРНК проводили методом ПЦР в режиме реального времени (ПЦР-РВ), дополненного реакцией обратной транскрипции. Для ее постановки использовали набор RevertAid RT Reverse Transcription Kit (“Fermentas”, США) и универсальный праймер Oligo (dT)18. Реакцию проводили в соответствии с протоколом производителя. Для количественной ПЦР использовали набор реагентов для проведения ПЦР-РВ в присутствии красителя SYBR Green I (“Синтол”, Россия). Для каждого из определяемых генов ячменя аскорбатпероксидазы (арх), глутатионпероксидазы (gpx) и каталазы (cat) [10] были подобраны специфические праймеры: IhcbS и lhcb6 [11], lhcb4 (Fw 5'-CTCTTAAGTGGTCGGTGGT-3', Rv 5'-TCCTATGTGATCGGACCAGC-3'), Ihcb5 (Fw 5'-GATCTACTTGCCCAACGG-3', Rv 5'-CATGGATGAGCTCAAAGGCC-3').
Режим амплификации: генов act, apx, cat, l-hcb3–5: 95°C 5 мин, 95°C 20 c, 60°C 20 c, 72°C 5 с, количество циклов – 50, а генов act, gpx, lhcb6: 95°C 5 мин, 95°C 20 c, 64°C 20 c, 72°C 5 с, количество циклов – 50.
Вестерн-блот анализ. Разделение белков проводили с помощью электрофореза в денатурирующих условиях в 16%-ном полиакриламидном геле [12] в камере Mini-PROTEAN (“BioRad”, США). К образцам тилакоидных мембран добавляли 200 мМ трис-HCl буфер, pH 6.8, содержащий 8% ДДС-Na, 32% глицерина, 0.4% бромфенолового синего и 400 мМ дитиотреитола, нагревали при 95°С в течение 5 мин и центрифугировали при 4500 g на MiniSpin (“Eppendorf”, Германия) в течение 15 мин Все образцы тилакоидов были выровнены по содержанию хлорофилла (0.5 мкг на один трек геля). Также на гель наносили 5 мкл предварительно окрашенных белков-маркеров PageRuler Prestained Protein Ladder (“Thermo Scientific”, США). После электрофореза белки переносили на PVDF мембрану с использованием мокрого блоттинга Mini Trans-Blot Cell (“BioRad”, США). После трансфера белков мембраны отмывали в TBS буфере. Далее их помещали в раствор первичных антител против белков Lhcbl, Lhcb2, Lhcb5, Lhcb6 и D1 (“Agrisera”, США), и инкубировали в течение ночи при 4°С. В качестве вторичных антител использовали в разведении 1 : 3000 антитела, связанные с щелочной фосфатазой (Goat Anti-Rabbit lgG (H + L, “Bio-Rad”, США). Визуализацию проводили с помощью набора субстрата и щелочной фосфатазы (АР Conjugate Substrate Kit, “Bio-Rad”, США). Результаты колориметрической реакции оценивали с помощью денситометрии, для анализа использовали программу Gel-Pro Analyser 3.1.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
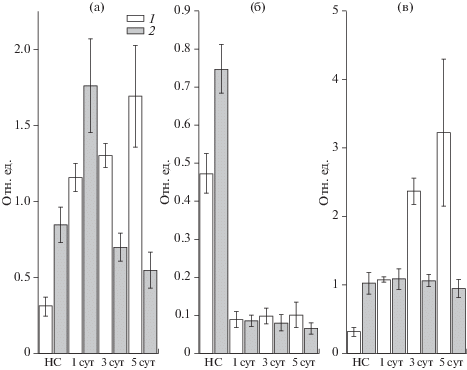
Для изучения различий в протекании адаптационных механизмов у контрольных растений и колонизированных Р. putida BS3701 в течение 5 сут в условиях высокой интенсивности света, проводили измерение быстрой фазы индукции флуоресценции хлорофилла а (OJIP-кинетик). На их основе рассчитывали следующие параметры: Fv/Fm – максимальный квантовый выход ФС2, Pi – индекс жизнеспособности, а также параметр Sm, характеризующий окислительно-восстановительное состояние пула пластохинона, и параметр ABS/RC, характеризующий видимый размер антенны ФС2 (рис. 1).
Рис. 1.
Влияние 1–5 сут инкубации 7-суточных контрольных проростков (1) и колонизированных Р. putida BS3701 (2) растений ячменя в условиях высокой интенсивности света (ВС, 1000 мкмоль квантов/м2 с) на максимальный квантовый выход ФС2 (Fv/Fm, а), индекс жизнеспособности (Pi, б), редокс состояние пула пластохинона (Sm, в) и кажущийся размер антенны ФС2 (ABS/RC, г). НС – показатели до переноса растений в условия ВС. (Статистическая обработка: боксы представляют собой диапазон значений, в который попадали 75% всех измерений; среднее значение обозначено точкой внутри столбиков; горизонтальная линия внутри столбиков – медиана).
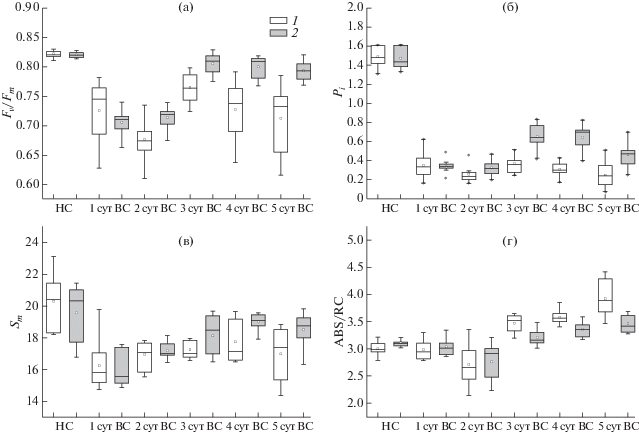
До переноса растений в условия высокой интенсивности света не было обнаружено достоверных различий значений максимального квантового выхода ФС2 (Fv/Fm между контрольными и колонизированными растениями. Однако через 2–3 сут после их переноса в условия высокой интенсивности света эти значения для листьев, колонизированных Р. putida BS3701, оказывались достоверно выше по сравнению со значениями для контрольных листьев. При этом данный эффект усиливался на 3 и 5 сут после начала адаптации. Более высокие значения максимального квантового выхода в стрессовых условиях отражали более высокую устойчивость фотосинтетического аппарата листьев растений, колонизированных Р. putida – BS3701. Показатель жизнеспособности (Pi) также оказывался достоверно выше на 3–5 сут адаптации к свету в колонизированных растениях, что дополнительно свидетельствовало о повышении эффективности протекания адаптационных механизмов в колонизированных растениях по сравнению с контрольными.
При сравнении параметров Sm, характеризующих окислительно-восстановительное состояние пула пластохинона, не было обнаружено различий в контрольных и колонизированных растениях до их переноса в условия высокой интенсивности света. Через 24 ч после переноса растений в условия высокой интенсивности света значения параметра Sm снижались, что отражало возрастание уровня восстановления пула пластохинона как в контрольных, так и в колонизированных растениях. Увеличение степени восстановления пула пластохинона после переноса в условия высокой интенсивности света является сигналом для запуска ряда адаптационных изменений, которые способствуют оптимизации строения и функционирования фотосинтетического аппарата в новых условиях освещения [13–16]. Уменьшение степени восстановления пула пластохинона после 72 ч нахождения контрольных и колонизированных растений в условиях высокой интенсивности света свидетельствовало о произошедшей адаптации фотосинтетического аппарата, что отражалось в увеличении максимального квантового выхода и индекса жизнеспособности в контрольных и колонизированных растениях.
Одним из адаптационных механизмов, приводящим к восстановлению функционирования фотосинтетической электрон транспортной цепи при увеличении освещенности, связан с уменьшением размера антенны ФС2, которое приводит к снижению количества поглощаемых квантов света, и, таким образом, к защите ФС2 от фотоингибирования. Параметр ABS/RC, характеризующий видимый размер антенны ФС2, оказывался выше в растениях, колонизированных Р. putida BS3701 до переноса растений в условия высокой интенсивности света, что свидетельствовало о большем размере антенны ФС2 в колонизированных растениях при использованных условиях выращивания. После переноса растений в условия высокой интенсивности света на 3 сут данный параметр снижался, как в колонизированных, так и контрольных растениях примерно до одинакового уровня. Необходимо отметить, что на 4–5 сут после переноса растений в условия высокой интенсивности света наблюдалось увеличение параметра ABS/RC в контрольных и колонизированных растениях. Можно предположить, что причиной такого увеличения являлось разрушение части реакционных центров и внутренней антенны ФС2. Как показали данные, представленные на рис. 1, это разрушение более выражено именно в контрольных растениях. Для наиболее правильной интерпретации параметра ABS/RC необходима дополнительная оценка количества мажорных белков реакционных центров.
С помощью вестерн-блот анализа (рис. 2) было показано, что количество белка D1 реакционного центра ФС2 не изменялось при высокой интенсивности света в контрольных и колонизированных растениях в течение 3 сут, однако впоследствии, особенно на 5 сут, наблюдалась деградация белка D1. При этом деградация, действительно, оказалась более выраженной в контрольных растениях.
Рис. 2.
Вестерн-блот анализ (I) и содержание (II%) белков Lhcbl (a), Lhcb2 (б), Lhcb5 (в), Lhcb6 (г), D1 (д) ФС2 после инкубации листьев контрольных (1, 3, 5, 7) и колонизированных Р. putida BS3701 (2, 4, 6, 8) растений ячменя до переноса в условия высокой интенсивности света (НС) и в условиях высокой интенсивности света ( ВС, 1000 мкмоль квантов/м2с) в течение 5 сут. М – белки-маркеры молекулярных масс. (За 100% принято содержание соответствующего белка в контрольных растениях до переноса в условия ВС, полученное по результатам денситометрии).
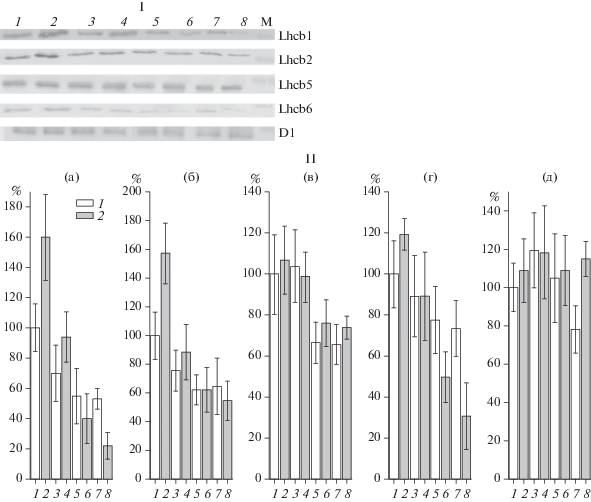
Известно, что антенные коровые субъединицы ФС2 и мажорные тримерные комплексы ФС2 характеризуются различным содержанием хлорофилла a (Chа) и b (Chb). Коровые субъединицы СР47 и СР43 связывают Сhl а, в то время как минорные антенные белки Lhcb4, Lhcb5 и Lhcb6, а также мажорные комплексы (Lhcbl + Lhcb2 + + L-hcb3) – не только Сhl а, но и Сhl b. У высших растениях уменьшение размера антенны ФС2 при долговременной повышенной освещенности происходит в основном за счет уменьшения количества мажорных белков, что приводит к уменьшению количества Сhl b [21]. Поэтому увеличение в отношении Сhlа/Chlb отражает уменьшение размера антенны ФС2 [21]. В связи с этим для обнаружения различий в адаптационном изменении размера и состава светособирающей антенны ФС2 определяли изменение отношения содержаний хлорофилла а к хлорофиллу b (Сhlа/Chlb). До переноса в условия высокой интенсивности света растения, колонизированные бактериями штамма Р. putida BS3701, характеризовались более низким значением Сhlа/Chlb (2.12 ± 0.08 по сравнению с 2.33 ± 0.05). Более низкое значение Сhlа/Chlb соответствовало большему размеру антенны ФС2 и согласовывалось с измеренным при этом параметром ABS/RC (рис. 2). Через 3 сут после переноса растений в условия высокой интенсивности света наблюдалось увеличение Сhlа/Chlb как в контрольных (2.54 ± 0.08), так и в колонизированных (2.50 ± 0.13) растениях, что указывало на уменьшение размера антенны ФС2. На 5 сут адаптации растений к высокой интенсивности света Сhlа/Chlb снижалось в контрольных листьях (2.34 ± 0.05). В растениях, колонизированных бактериями штамма Р. putida BS3701, на 5 сут Сhlа/Chlb не изменялось и составило 2.49 ± 0.08. На основании данных, представленных на рис. 4, можно предположить, что в контрольных листьях проходила деструкция части белков реакционного центра ФС2, связывающих Сhlа.
Для детального изучения изменения количества белков антенны ФС2 при переносе растений в условия высокой интенсивности света оценивали содержание мажорных белков Lhcbl и Lhcb2, а также минорных белков Lhcb5 и Lhcb6 антенны ФС2, участвующих в уменьшении размера антенны ФС2 при увеличении интенсивности света (рис. 2). Для этого выделяли тилакоиды из листьев контрольных и колонизированных растений и затем с помощью вестерн-блот анализа разделяли белки тилакоидов по молекулярной массе, как описано ранее [12].
Были обнаружены различия в строении фотосинтетического аппарата контрольных растений и растений, колонизированных Р. putida BS3701, выращенных в условиях нормального освещения (100 мкмоль квантов/м2с). При этом количество белков Lhcbl, Lhcb2 и Lhcb6 было выше в растениях, колонизированных бактериями штамма Р. putida BS3701, что являлось следствием более высокого уровня экспрессии их генов (рис. 3). Таким образом, растения, колонизированные Р. putida BS3701, обладали достоверно большим размером светособирающей антенны ФС2 по сравнению с контрольными растениями. Это согласовывалось с данными, полученными при определении отношения Сhlа/Chlb и параметра ABS/RC. Известно, что растения ячменя относятся к светолюбивым, поэтому больший размер антенны ФС2 колонизированных растений при умеренной интенсивности света (100 мкмоль квантов/м2с) может привести к большему приросту биомассы и, следовательно, большей их продуктивности при улавливании большего количества квантов света по сравнению с контрольными растениями.
Рис. 3.
Уровень экспрессии (отн. ед.) генов lhcb3 (a), lhcb4 (б), lhcb5 (в) и lhcb6 (г) в 7-семисуточных контрольных (1) и колонизированных Р. putida BS3701 (2) проростках ячменя (НС) и их листьях после инкубации в течение 1–3 сут в условиях высокой интенсивности света. (Данные были нормализованы по экспрессии гена актина; результаты представлены как среднее ±SE).
На 1 сут после переноса растений в условия высокой интенсивности света наблюдалось уменьшение количества белков Lhcbl, Lhcb2 и Lhcb6, именно тех белков, которые в первую очередь участвовали в модуляции размера антенны ФС2 при изменении условий освещения [11]. Уменьшение количества данных белков происходило и в контрольных, и в колонизированных растениях, достигая примерно одинакового количества.
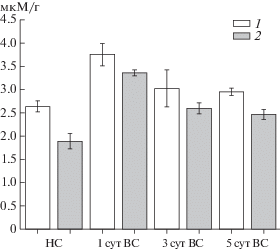
Рис. 4.
Содержание пероксида водорода (мкМ/г сырого веса листа) в 7-суточных проростках (НС) и листьях контрольных (1) и колонизированных P. putida BS3701 (2) растений ячменя после инкубации в течение 1–5 сут в условиях высокой интенсивности света. (Результаты представлены как среднее ±SE.)
Однако до переноса в условия высокой интенсивности света растения, колонизированные Р. putida BS3701, содержали большее количество белков Lhcbl и Lhcb2 по сравнению с контрольными (рис. 2) то есть в растениях, колонизированных бактериями штамма Р. putida BS3701 за первые 24 ч после переноса в условия высокой интенсивности света происходило более значительное уменьшение размера антенны ФС2. Через 5 сут адаптации количество белков Lhcbl, Lhcb2 и Lhcb6 оказывалось меньшим в растениях, колонизированных Р. putida BS3701 (рис. 2). Содержание белка Lhcb5, который, как предполагают [3, 4], не участвует в модуляции размера антенны ФС2, не изменялось в ходе 5-суточной адаптации как в контрольных, так и колонизированных растениях.
Для того, чтобы определить, на каком этапе биосинтеза белков светособирающей антенны ФС2 происходит регуляция их количества в растениях, определяли уровни экспрессии генов, кодирующих белки Lhcb3, Lhcb 4, Lhcb5 и Lhcb 6 (рис. 3). Через 1 сут после переноса растений в условия высокой интенсивности света значительно снижались уровни экспрессии всех изученных генов как в контрольных, так и колонизированных растениях. На 5 сут их уровень экспрессии снизился до не детектируемых значений (не показано).
Таким образом, в данной работе было показано, что уменьшение размера светособирающей антенны ФС2 как у контрольных, так и растений, колонизированных Р. putida BS3701, происходило на уровне экспрессии генов, кодирующих ее белки. Полученные результаты согласуются с данными, полученными ранее для растений Arabidopsis thaliana дикого типа [5]. В целом, уменьшение размера антенны ФС2 протекало по одинаковому механизму в контрольных и колонизированных растениях, который включал уменьшение уровня экспрессии соответствующих генов, однако это уменьшение оказалось более значительным в колонизированных растениях.
Уровень экспрессии гена, кодирующего белок Lhcb5, также снижался через 3 сут после переноса растений в условия высокой интенсивности света, однако его содержание не изменялось в течение 5 сут адаптации (рис. 2). Снижение уровня экспрессии приводило к подавлению биосинтеза белков. Известно, что при высокой интенсивности света на 2 сут происходит активация протеазы – фермента, осуществлявшего расщепление тех белков, синтез которых подавлен [21]. Белок Lhcb5 входит в состав белков внутренней антенны, и доступ протеазы к этому белку затруднен присутствием внешних белков Lhcbl, Lhcb2 и Lhcb6. Только после деградации этих белков возможно и его удаление.
Поскольку в работе [17] были получены данные о том, что сигналом для уменьшения размера антенны ФС2 при увеличении интенсивности света является не непосредственно окислительно-восстановительное состояние пула пластохинона, как считалось ранее, а количество пероксида водорода, образованного с участием компонентов пула пластохинона, то можно предположить, что увеличение размера антенны ФС2 в колонизированных растениях при 100 мкмоль квантов/м2 с происходило вследствие меньшего количества пероксида водорода в них. В результате реакции между полностью восстановленным пластохиноном и супероксидным анион радикалом образование пероксида водорода протекает внутри тилакоидной мембраны [18], при этом показано, что супероксидный анион радикал образуется внутримембранными компонентами ФС1 [19]. При увеличении интенсивности света образование пероксида водорода увеличивается именно внутри тилакоидной мембраны, что коррелирует с возрастанием степени восстановления пула пластохинона и может служить сигналом для запуска адаптации антенны ФС2 [20].
Общее содержание пероксида водорода до переноса растений в условия высокой интенсивности света было достоверно ниже в растениях, колонизированных Р. putida BS3701, по сравнению с контрольными (рис. 4). Через 1 сут после переноса растений в условия высокой интенсивности света происходило значительное, но примерно до одинакового уровня, увеличение содержания пероксида водорода в контрольных и колонизированных растениях. После 5 сут нахождения растений в условиях высокой интенсивности света изменения, произошедшие в функционировании и строении фотосинтетического аппарата, приводили к снижению содержания пероксида водорода в контрольных и колонизированных листьях по сравнению с первыми сутками. Увеличение содержания пероксида водорода в контрольных и колонизированных листьях через 24 ч после переноса растений в условия высокой интенсивности света и уменьшение количества пероксида водорода через 3–5 сут адаптации коррелировали с увеличением степени восстановления пула пластохинона в первые сут и снижением этого уровня через 3 сут адаптации.
Таким образом, количество пероксида водорода может передавать информацию об окислительно-восстановительном состоянии пула пластохинона и служить сигналом для запуска адаптационного уменьшения размера антенны ФС2. Поскольку через 1 сут в колонизированных растениях уровень пероксида водорода возрастал существеннее, чем в контрольных (учитывая то, что до переноса на высокую интенсивность света в колонизированных этот уровень был достоверно ниже), то именно это в большей степени уменьшало размер их антенны ФС2.
Пероксид водорода, содержание которого определялось, образовывался в результате двух параллельно протекающих процессов: его образования и разложения антиоксидантными ферментами. Можно предположить, что колонизация Р. putida BS3701, увеличивая активность антиоксидантных систем, приводила к уменьшению концентрации пероксида водорода в листьях и, таким образом, к увеличению размера антенны ФС2. Для оценки содержания антиоксидантных ферментов в клетках контрольных и колонизированных растений были проанализированы изменения уровней экспрессии генов аскорбатпероксидазы, локализованной в хлоропластах, а также каталазы и глутатионпероксидазы, расположенных в пероксисомах и цитоплазме соответственно (рис. 5). К первому звену последовательности окислительно-восстановительных реакций с участием аскорбата, глутатиона и НАДФН, так называемого аскорбат-глутатионового цикла относится аскорбатпероксидазная реакция, которая обеспечивает нейтрализацию пероксида водорода в хлоропластах с его последующим восстановлением до молекул воды. Каталаза выполняет аналогичную функцию, катализируя разложение его молекул.
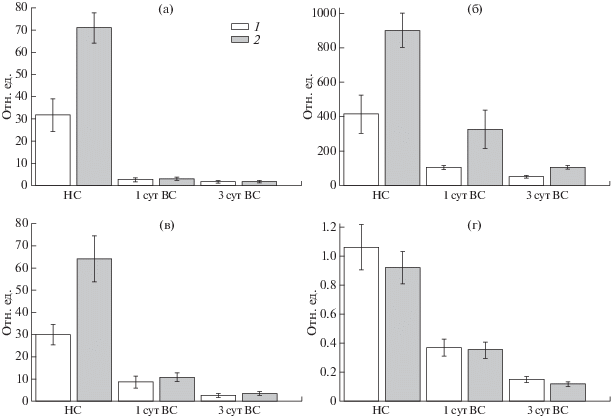
Рис. 5.
Уровень экспрессии генов аскорбатпероксидазы (а), каталазы (б) и глутатионпероксидазы (в) в нормально освещенных (НС) 7-суточных проростках и листьях контрольных (1) и колонизированных Р. putida BS3701 (2) растений ячменя после инкубации в течение 1–5 сут в условиях высокой интенсивности света (1000 мкмоль квантов/м2 с); данные были нормализованы по экспрессии гена актина; результаты представлены как среднее ±SE.
Полученные данные показали, что до переноса в условия высокой интенсивности света растения, колонизированные Р. putida BS3701, обладали достоверно более высоким уровнем экспрессии генов, кодирующих изучаемые антиоксидантные ферменты, что приводило к более низкому содержанию в них пероксида водорода (рис. 4). Через 1 сут после переноса растений в условия высокой интенсивности света наблюдалось возрастание уровня экспрессии гена, кодирующего аскорбатпероксидазу как в контрольных, так и колонизированных растениях. Возрастание уровня экспрессии аскорбатпероксидазы отвечало на увеличение количества пероксида водорода, продуцируемого хлоропластами при повышении интенсивности освещения листьев. В растениях, колонизированных Р. putida BS3701, уровень экспрессии гена, кодирующего аскорбатпероксидазу, через 3 сут адаптации к высокой интенсивности света возвращался к значению до переноса растений в условия высокой интенсивности света, что свидетельствовало о снижении продукции пероксида водорода в хлоропластах колонизированных растений в результате адаптации фотосинтетического аппарата к новым световым условиям. В контрольных растениях уровень экспрессии аскорбатпероксидазы сохранялся на высоком уровне даже после 5 сут адаптации растений к высокой интенсивности света, что указывало на высокий уровень образования пероксида водорода в хлоропластах контрольных листьев.
Каталаза, эффективно разлагающая Н2O2 в аэробных организмах, не была обнаружена в хлоропластах, поскольку в клетках растений она сосредоточена, в основном, в пероксисомах. Уровень экспрессии гена, кодирующего каталазу, снижался через 1 сут после переноса растений в условия высокой интенсивности света и в контрольных, и в колонизированных растениях. Это свидетельствовало о том, что образование пероксида водорода в пероксисомах не увеличивалось, а повышенная экспрессия аскорбатпероксидазы, осуществляющей утилизацию пероксида водорода в хлоропластах, свидетельствовала об увеличении продукции пероксида водорода именно внутри хлоропластов и контрольных, и колонизированных растений. Глутатионпероксидаза катализирует восстановление перекисей липидов в соответствующие спирты и, таким образом, способствует защите организмов от перекисного окисления липидов [22]. После переноса растений в условия высокой интенсивности света уровень экспрессии кодирующего ее гена в растениях, колонизированных Р. putida BS3701, не изменялся, в то время как в увеличивался в ходе всей адаптации к высокой интенсивности света. Это указывало на то, что в хлоропластах контрольных растений при этом происходило развитие окислительного стресса.
Таким образом, полученные данные показали, что колонизация растений ячменя Р. putida BS3701 положительно влияла на их адаптацию к условиям высокой интенсивности света. В колонизированных растениях наблюдалось более выраженное уменьшение количества белков светособирающей антенны ФС2 и, соответственно, большее уменьшение ее размера. Оказалось, что в условиях высокой интенсивности света это эффективнее защищало их фотосинтетический аппарат от фотоингибирования. В этих условиях, благодаря более слаженной работе антиоксидантах систем, колонизированные растения способны быстрее восстанавливать нормальное функционирование фотосинтетической цепи и других физиологических процессов, в то время как в не колонизированных растениях развивался окислительный стресс, приводящий к деструктивным процессам.
Авторы выражают благодарность лаборатории биологии плазмид Института биохимии и физиологии микроорганизмов им. Г.К. Скрябина РАН за предоставление штамма Р. putida BS3701, а также сотруднику лаборатории Р.А. Кузницыну за проведение денситометрического анализа результатов вестерн-блот анализа.
Работа выполнена при финансовой поддержке Российским Научным Фондом (проект № 17-76-10058).
Список литературы
Kloepper J.W., Leong J., Teintze M., Schroth M.N. // Nature. 1980. V. 286. № 5776. P. 885–886.
Dimkpa C., Weinand T., Asch F. // Plant Cell Environ. 2009. V. 32. № 12. P. 1682–1694.
Ballottari M., Dall’Osto L., Morosinotto I., Bassi R. // J. Biol. Chem. 2007. V. 282. № 12. P. 8947–8958.
Wientjes E., van Amerongen H., Croce R. // BBA-Bioenergetics. 2013. V. 1827. № 3. P. 420–426.
Борисова-Мубаракшина M.M., Ветошкина Д.В., Руденко H.Н, Ширшикова Г.Н., Федорчук Т.П., Найдов И.А., Иванов Б.Н. // Биохимия. 2014. Т. 79. № 6. С. 661–665.
Овчинникова А.А., Ветрова А.А., Филонов А.Е. // Известия ТулГУ. Естественные науки. 2008. № 1. С. 211–220.
Ovchinnikova A.A., Vetrova A.A., Filonov A.E., Boronin A.M. // Microbiology. 2009. V. 78. № 4. P. 433–439.
Cormier M.J, Prichard P.M. // J. Biol. Chem. 1968. V. 243. № 18. P. 4706–4714.
Lichtenthaler H.K. // Methods Enzymol. 1987. V. 148. P. 350–382.
Metwally A., Finkemeier I., Georgi M., Dietz K.J. // Plant Physiol. 2003. V. 132. № l. P. 272–281.
Frigerio S., Campoli C., Zorzan S., Fantoni L.I, Crosatti C., Drepper F., Haehnel W., Cattivelli L., Morosinotto T., Bassi R. // J. Biol. Chem. 2007. V. 282. №. 40. P. 29457–29469.
Ballottari M., Govoni C., Caffarri S., Morosinotto T. // FEBS J. 2004. V. 271. № 23–24. P. 4659–4665.
Horton P., Allen J.F., BlackM. T., Bennett J. // FEBS Lett. 1981. V. 125. № 2. P. 193–196.
Yang D.H., Andersson B., Aro E.M., Ohad I. // Photosynth. Res. 2001. V. 68. № 2. P. 163–174.
Fey V., Wagner R., Brautigam K., Pfannschmidt T. // J. Exp. Bot. 2005. V. 56. № 416. P. 1491–1498.
Lepetit B., Sturm S., Rogato A., Gruber A., Sachse M., Falciatore A., Lavaud J. // Plant Physiol. 2013. V. 161. № 2. P. 853–865.
Borisova-Mubarakshina M.M., Ivanov B.N., Vetoshkina D.V., Lubimov V.Y., Fedorchuk T.P., Naydov I.A., Rudenko N.N., Bassi R. // J. Exp. Bot. 2015. V. 66. № 22. P. 7151–7164.
Mubarakshina M.M., Ivanov B.N. // Physiol. Plant. 2010. V. 140. № 2. P. 103–110.
Kozuleva M., Klenina I., Mysin I., Kirilyuk I., Opanasenko V., Proskuryakov I., Ivanov B. // Free Radio. Biol. Med. 2015. V. 89. P. 1014–1023.
Vetoshkina D.V., Borisova-Mubarakshina M.M., Naydov I.A., Kozuleva M.A., Ivanov B.N // JBLS. 2015. V. 6. № 2. P. 50–60.
Lindahl M., Yang D.H., Andersson B. // FEBS J. 1995. V. 231. № 2. P. 503–509.
Eshdat Y., Holland D., Faltin Z., Ben-Hayyim G. // Physiol Plant. 1997. V. 100. № 2. P. 234–240.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


