Прикладная биохимия и микробиология, 2019, T. 55, № 4, стр. 360-365
Зависимый от цАМФ транскрипционный фактор Mycobacterium tuberculosis, кодируемый геном rv3676, как возможная мишень при создании противотуберкулезных соединений
М. О. Шлеева 1, *, Т. К. Кондратьева 2, А. В. Гончаренко 1, А. С. Апт 2, 3, А. С. Капрельянц 1
1 Институт биохимии им. А.Н. Баха, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Россия
2 Центральный научно-исследовательский институт туберкулеза РАН
107564 Москва, Россия
3 Московский государственный университет им. М.В. Ломоносова, биологический факультет
119991 Москва, Россия
* E-mail: margoshleeva@gmail.com
Поступила в редакцию 18.09.2018
После доработки 23.11.2018
Принята к публикации 20.02.2019
Аннотация
Аденилатциклаза Rv2212 играет ключевую роль в росте Mycobacterium tuberculosis (Mtb) и его реактивации из состояния покоя. Потенциально этот фермент мог бы стать хорошей мишенью при создании новых противотуберкулезных препаратов. Однако для метаболизма организма-хозяина также важны ферменты этого типа, что делает сомнительным применение для лечения заболевания их ингибиторов. В геноме Mtb аннотирован цАМФ-зависимый транскрипционный фактор, кодируемый геном Rv3676 и отсутствующий в организме человека. Был сконструирован штамм Mtb с гиперэкспрессией этого гена, который ускоренно рос in vitro и in vivo в стрессовых условиях. Бактерии нового штамма сохраняли плазмиду с геном Rv3676 in vivo даже в отсутствие селектирующего агента, что указывало на возникновение преимуществ для выживания при повышенной экспрессии цАМФ-ТФ. Полученные результаты демонстрировали важность Rv3676 для поддержания жизнеспособности клеток Mtb при неблагоприятных условиях in vitro и их вирулентности in vivo, и оказались подобны полученным при гиперэкспрессии аденилатциклазы Rv2212. Транскрипционный фактор Rv3676 может стать новой мишенью при создании лекарственных препаратов, направленных на борьбу с туберкулезом.
Туберкулез (ТБ) по-прежнему остается одним из наиболее опасных заболеваний на Земле, уносящем около 1.7 млн жизней и поражающем около 9 млн человек в год (данные ВОЗ, 2014). Ситуация осложняется еще и тем, что в РФ среди штаммов Mycobacterium tuberculosis (Mtb), выделенных от больных, фиксируется большой процент штаммов, резистентных к антибиотикам первого и второго ряда, что делает необходимым поиск мишеней для новых лекарственных препаратов, направленных на борьбу с этим заболеванием. Большую проблему представляет также латентный туберкулез (ЛТБ), при котором инфицированные люди без заметных симптомов заболевания в течение долгого времени являются носителями патогена, находящегося в состоянии покоя. У некоторых из этих латентно инфицированных людей инфекция может переходить в активное состояние, что серьезно влияет на эпидемическую ситуацию [1]. Условия, при которых покоящиеся M. tuberculosis (Mtb) переходят к активному размножению (реактивации), так же, как и механизмы перехода в такое состояние плохо изучены, а препараты против латентной формы микобактерий практически отсутствуют. Таким образом, в настоящее время проблема развития и реактивации ЛТБ, наряду с устойчивостью к действию лекарств, является одной из важнейших в инфекционной медицине.
В экспериментальных моделях, которые имитируют состояния покоя и реактивации микобактерий, была получена значительная информация о молекулярных механизмах этих явлений in vitro [2, 3]. В частности, с помощью модели реактивации покоящихся форм M. smegmatis была выяснена роль аденилатциклазы (AC), кодируемой геном MSMEG_4279. Было показано, что реактивация штамма M. smegmatis, несущего нокаутирующую мутацию в гене MSMEG_4279, не наступает спонтанно и требует внесения экзогенного цАМФ [4]. Среди продуктов всех 16 биохимически активных AC-кодирующих генов, присутствующих в геноме, продукт гена Rv2212, являющегося гомологом M-SMEG_4279 в Mtb, относится к основному производителю цАМФ [5, 6]. В стрессовых условиях гены Rv2212 и MSMEG_4279 способствуют сохранению активного метаболического состояния Mtb, обеспечивая увеличение производства цАМФ, что приводит к поддержанию жизнеспособности Mtb при неблагоприятных условиях in vitro и in vivo, а также к быстрой реактивации из состояния покоя [7].
Можно предположить, что ингибирование АС должно приводить к снижению жизнеспособности возбудителя туберкулеза, однако применение таких ингибиторов для его лечения проблематично, поскольку в организме млекопитающих имеются собственные аденилатциклазы, необходимые для нормального метаболизма. Следует отметить, что молекулярные механизмы, обеспечивающие жизнеспособность микобактерий при повышенных концентрациях цАМФ, остаются неясными. Известно значение внутриклеточного цАМФ как второго мессенджера для широкого круга бактериальных биохимических процессов [8], но последующие процессы, связывающие продукцию цАМФ и жизнеспособность бактерий на транскрипционном уровне, до настоящего времени остаются не определенными. У Mtb были описаны два транскрипционных фактора, связанных с цАМФ внутри клетки – CRPMt (Rv3676) и Cmr (Rv1675c) [6]. Известно также, что CRPMt связан с синтезом белка RpfA, который принимает активное участие в процессах реактивации и роста микобактерий [9]. В связи с этим можно предположить, что транскрипционный фактор Rv3676 является следующим звеном в цАМФ-зависимом механизме поддержания жизнеспособности микобактерий в стрессовых условиях. Для проверки этой гипотезы был сконструирован новый штамм Mtb с повышенной экспрессией гена Rv3676 под контролем тетрациклинового промотора (цАМФ-ТФ Rv3676 = pMindRv3676). Оказалось, что у бактерий pMindRv3676 был повышен рост в неблагоприятных условиях in vitro и in vivo, что позволило рассматривать продукт этого гена Rv3676 в качестве перспективной мишени для создания новых противотуберкулезных соединений.
Цель работы – сравнить in vitro и in vivo фенотипы нового и контрольного штамма, содержащего пустой вектор (pMind).
МЕТОДИКА
Бактериальные штаммы, среды роста и условия культивирования. В работе использовали штамм Mtb дикого типа H37Rv и его производные, несущие плазмиды pMindRv3676 (см. ниже) и pMind (контрольный штамм с пустой плазмидой). Гигромицин В (50 µг/мл) добавляли в среду роста для штаммов, содержащих плазмиды. Все штаммы выращивали на стандартной среде Сатона, содержавшей в 1 л H2O 0.5 г KH2PO4, 1.4 г MgSO4 ⋅ 7H2O, 4 г L-аспарагина, 60 мл глицерина, 0.05 г цитрата железа(III)-аммония, 2 г цитрата натрия и 0.1 мл 1%-ного ZnSO4 ⋅ 7H2O. Устанавливали рН буфера, равным 7.0, 1 М NaOH и добавляли АДС, содержавший бычий сывороточный альбумин (БСА), глюкозу, NaCl и 0.05% твина 80 [10].
Покоящиеся “некультивируемые” микобактерии, утратившие способность расти на плотных средах (“некультурность”, НК) вследствие постепенного подкисления среды в течение стационарной фазы роста, были получены, как описано ранее [2]. Бактерии выращивали в колбах объемом 100 мл на орбитальном шейкере (200 об./мин) в течение 12–15 сут в 50 мл среды Сатона с добавлением 0.05% твин-80 и АДС. Эти бактериальные культуры использовали для пересева в модифицированную среду Сатона для получения НК Mtb. Модификация среды Сатона включала замену твина 80 на 0.025% тилоксапола и АДС на 0.5% БСА (“Sigma”, США). Начальные значения рН в модифицированных средах составляли 6.2, что отличалось от рН = 7.0 в стандартной среде Сатона. Модифицированную среду Сатона (200 мл) помещали в колбу объемом 500 мл (3–5 колб на один эксперимент) и инкубировали при перемешивании в течение 40–60 сут при 37°С. Периодически измеряли значение рН среды и, когда оно достигало 6.0–6.2, культуры переносили в плотно закрывающиеся пластиковые пробирки (на 50 мл) и добавляли 2-(N-морфолино)этансульфоновую кислоту (МЭС) до конечной концентрации 20 мМ для предотвращения дальнейшего подкисления при длительном хранении. Инкубацию продолжали в статических условиях (то есть без перемешивания) в темноте в течение 200 сут после засева при комнатной температуре. Периодически из разных пробирок отбирали образцы для оценки жизнеспособности бактерий методами КОЕ.
Реактивацию “некультивируемых” бактерий проводили в специальной среде, содержавшей смесь (1 : 1) стандартной среды Сатона и питательного бульона E (NBE) (“HiMedia”, Индия), содержавших 0.05% твина 80 и АДС. Покоящиеся формы Mtb, полученные как описано выше, промывали 3 раза в 50 мМ фосфатном буфере, повторно ресуспендировали в 200 мл реактивационной среды до исходного значения ОП600 = 0.04–0.05, помещали в колбу объемом 500 мл и инкубировали при перемешивании 100–120 об./мин в течение 20 сут при 37°C. Периодически измеряли оптическую плотность реактивирующихся культур.
Оценка способности бактерий формировать КОЕ. Бактериальные суспензии серийно разбавляли в свежей среде Сатона, и 100 мкл каждого разведения высевали в чашки Петри с агаризованной средой Сатона с добавлением АДС и инкубировали в течение 21 сут при 37°С, а затем подсчитывали количество КОЕ. Предел обнаружения составлял 10 КОЕ в мл.
Манипуляции с ДНК. Клонирование. Амплификацию гена Rv3676 осуществляли с помощью праймеров
Up Rv3676 5'atc aac gcg tcg gaa agt tga aga ggc aac gt 3'
и
Low Rv3676 5'cta cta gtg agg agg cta gct cgc tcg gtt g3'
(сайты рестрикции MluI и SpeI выделены жирным шрифтом). ПЦР-продукт клонировали в вектор pGEM-T (“Promega”, США), затем подвергали расщеплению по сайтам MluI и SpeI и лигировали в вектор pMind, предварительно обработанный теми же рестриктазами. Правильность клонированных нуклеотидных последовательностей подтверждали секвенированием. Клонирование проводили в штамме E. coli TG1.
Трансформация. Для трансформации использовали электропоратор MicroPulser (“Bio-Rad”, США).
Получение компетентных клеток E. сoli. Ночную культуру E. сoli штамм BMH (40 мкл) инокулировали в 4 мл среды Nutrient Broth (“Himedia”, Индия) и выращивали до оптической плотности ОП600 = 0.8 в течение 3 ч. После этого клетки осаждали центрифугированием (12 000 g, 1 мин) и трижды промывали на холоду раствором 10%-ного глицерина в стерильной деионизованной воде. Отмытые клетки ресуспендировали в 40 мкл раствора 10%-ного глицерина.
Получение компетентных клеток M. tuberculosis. Жидкую культуру M. tuberculosis проводили через два пассажа в среде Сатона и затем выращивали до оптической плотности ОП600 = 1.0. Клетки осаждали центрифугированием, осадок ресуспендировали в 2 мл 10%-ного глицерина и промывали, как указано выше для E. сoli. Отмытые клетки ресуспендировали в 40 мкл 10%-ного глицерина.
Трансформация. Клетки M. tuberculosis штамм H37RV и E. coli TG1 трансформировали по следующей схеме: ДНК (5 нг) для E. coli и (20 нг) для M. tuberculosis добавляли к отмытым компетентным клеткам. Клетки E. coli выдерживали 2 мин при 4°С, M. tuberculosis – 10 мин при комнатной температуре. Электропорацию проводили согласно протоколу (“Bio-Rad”, США).
Анализ КОЕ ex vivo. Микобактериальные колонии (N = 50), полученные из гомогенатов легких, анализировали с помощью ПЦР для подтверждения присутствия введения гена Rv3676. Амплификацию проводили с использованием специфических праймеров для pMind:
Up-pMind 5'CCGGGCCCCGAGCAACACG3'
Low-pMind 5'CCGCAGGCTCGCGTAGGAATCATC3'
Все полученные продукты имели длину около 1300 bp, что соответствовало размеру введения гена.
Инфицирование мышей. Мышей инбредных штаммов I/StSnEgYCit (I/St) и C57BL/6JCit (B6) выращивали и поддерживали в стандартных условиях в виварии Центрального института туберкулеза (международный код – CIT) в соответствии с приказом Министерства здравоохранения России № 755, а также в соответствии с сертификатом № A5502-11 OLAW, NIH. Вода и корм давались ad libitum. В начале экспериментов были использованы самки в возрасте 8–12 нед. Все экспериментальные процедуры были одобрены комитетом по этике (IACUC) “ЦНИИТ”. Мышей инфицировали внутривенно в дозе 5 × 106 бактерий на мышь в 0.5 мл стерильного PBS. Для оценки количества микобактерий в легких через 3 нед после заражения гомогенаты (0.2 мл) органов, полученных индивидуально от 4 мышей в каждой группе, высевали на агар Дюбо с последовательными 10-кратными разведениями, и после инкубации в течение 21–23 сут при 37°С подсчитывали колонии. Были проведены два независимых эксперимента и их результаты объединены.
Статистика. ОП и КОЕ выражали как среднее ± SEM. Значение различий для экспериментов in vivo оценивалось с помощью ANOVA, P < 0.05 считалось значимым.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
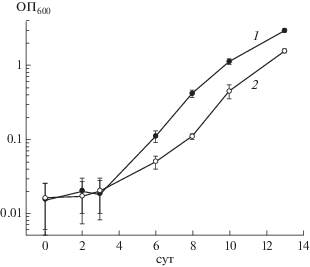
В данной работе представлены несколько доказательств, свидетельствующих о важности экспрессии гена цАМФ-ТФ Rv3676 для поддержания жизнеспособности Mtb при росте в неблагоприятных условиях. Для изучения влияния цАМФ-ТФ на рост Mtb был сконструирован штамм pMindRv3676 гиперэкспрессирующий ген этого белка под контролем тетрациклинового промотора (Tet) и проведено сравнение роста этого штамма с контрольным штаммом (содержащим “пустой” вектор pMind) в жидкой среде Сатона. Как показано на рис. 1, в жидкой среде Сатона бактерии pMindRv3676 росли быстрее, чем бактерии pMind штамма. При этом существенная разница в скоростях роста была заметна, если исходная доза бактерий была относительно невелика (около 102 кл./мл), что создавало менее благоприятные условия для инициации роста. Такие культуры с низким содержанием бактерий трудно выращивать [11, 12], и чаще всего требуется внесение дополнительных внешних факторов роста, чтобы инициировать их активную репликацию [11]. Напротив, если для инициирования жидкой культуры использовалось большое количество микобактерий, гиперэкспрессия гена Rv3676 не влияла на динамику роста. Так, увеличение начальных концентраций клеток в 1000 раз приводило к практически одинаковой скорости роста (данные не приводятся). Эти результаты сходны с недавно опубликованными данными по поведению штамма Мtb с гиперэкспрессией аденилатциклазы Rv2212 [7].
Рис. 1.
Кривая роста рекомбинантного штамма M. tuberculosis, содержащего вектор pMindRv3676 (1) и пустой вектор pMind (2), в стандартной среде Сатона (200 об./мин, 37°С, в 3-кратной повторности).
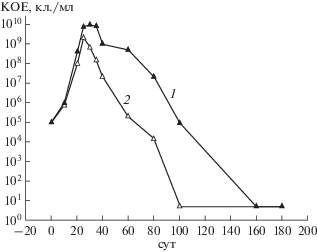
Важность цАМФ-ТФ была подтверждена в экспериментах по получению покоящихся “некультивируемых” бактерий in vitro в условиях постепенного закисления среды. Для оценки того, как гиперэкспрессия гена Rv3676 влияет на переход активно растущих бактерий в покоящееся состояние, использовали ранее разработанную модель, в которой при постепенном закислении среды во время продолжительной стационарной фазы происходило образование покоящихся овоидных клеток микобактерий. Полученные в этих условиях клетки Mtb обладали определенной морфологией и характеризовались “некультивируемостью”, то есть временной потерей способности расти на плотных средах [2]. Как показано на рис. 2, в подобных условиях клетки штамма pMindRv3676 также образовывали “некультивируемые” покоящиеся клетки, но с замедленной динамикой по сравнению с клетками контрольного штамма pMind.
Рис. 2.
Образование покоящихся “некультивируемых” форм рекомбинантными штаммами M. tuberculosis, содержащими вектор pMindRv3676 (1) или пустой вектор pMind (2) и выращенными в модифицированной среде Сатона (200 об./мин, 37°С). Минима-льное количество детектируемых КОЕ – 10 кл./мл. Стандартное отклонение при определении КОЕ составило 20%.
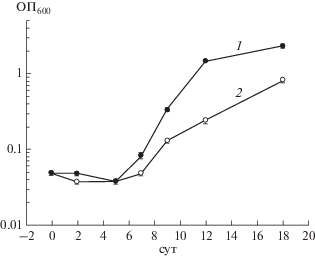
При реактивации полученных НК бактерий pMindRv3676 отмечалась значительно укороченная лаг-фаза и более быстрая реактивация по сравнению с контрольным штаммом pMind (рис. 3). Ранее было обнаружено, что реактивация НК M. smegmatis может быть вызвана экзогенными жирными кислотами, которые активировали аденилатциклазу MSMEG_4279 (ортолог Rv2212) с последующим увеличением внутриклеточной концентрации цАМФ. При этом повышалась экспрессия гена RpfA [4], который способствовал реактивации и росту покоящихся микобактерий [9]. Мутантный штамм M. smegmatis с делецией гена MSMEG_4279 не был способен к реактивации в присутствии жирных кислот до тех пор, пока не был добавлен экзогенный цАМФ [4]. Таким образом, в экспериментах in vitro прослеживалась связь аденилатциклазы с цАМФ-ТФ Rv3676 в поддержании жизнеспособности микобактерий в неблагоприятных условиях.
Рис. 3.
Реактивация покоящихся “некультивируемых” клеток M. tuberculosis штаммов pMindRv3676 (1) и pMind (2), полученных после 180 сут инкубации в модифицированной среде Сатона (показано среднее квадратичное отклонение двух экспериментов).
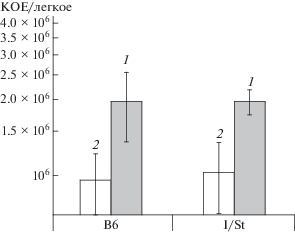
Для изучения влияния гиперэкспрессии цАМФ-ТФ Rv3676 на течение реальной туберкулезной инфекции (ТБ) использовали мышей двух инбредных линий с различной генетической восприимчивостью к ней – более резистентных B6 и гиперчувствительных I/St [13]. Мышей заражали бактериями штаммов pMindRv3676 и pMind и определяли параметры размножения микобактерий в органах. Оказалось, что повышенный уровень экспрессии Rv3676 в Mtb стимулировал размножение микобактерий в органах мышей (рис. 4). Ранее было показано, что повышенная экспрессия гена аденилатциклазы Rv2212 в клетках Mtb приводила к улучшению их выживаемости в неблагоприятных условиях, в том числе в организме хозяина [7]. Опубликован ряд доказательств того, что продукция цАМФ имеет важное значение для выживания патогена внутри клеток хозяина [14–17].
Рис. 4.
Размножение микобактерий штаммов pMindRv3676 (1) и pMind (2) в легких зараженных мышей (Р < 0.01, ANOVA).
В отсутствие селектирующего агента микобактерии часто элиминируют введенную плазмиду, если встроенный в нее ген не обеспечивает какого-либо преимущества (неопубликованные данные). Для оценки стабильности присутствия плазмиды гомогенаты легкого на 15 сут инфекции были высеяны на агар Дюбо, и в полученных бактериальных колониях методом ПЦР было оценено присутствие плазмиды. Все анализируемые колонии содержали плазмиду с интактной вставкой Rv3676 даже при отсутствии селектирующего гигромицина, что убедительно указывало на пользу гиперэкспрессии цАМФ-ТФ для бактерий, размножающихся в хозяине под давлением иммунного ответа. Этот вывод был подкреплен тем фактом, что в одинаковых условиях роста колонии pMindRv3676 были заметно увеличены по сравнению с колониями pMind (рис. 5).
Рис. 5.
Колонии бактерий контрольного штамма pMind (а), изолированных из легких мышей, зараженных (В6), и pMindRv3676 (б) после роста на агаре Дюбо в течение 3 нед. при 37°С.
Таким образом, в настоящей работе обнаружено, что повышенная экспрессия транскрипционного фактора CRPМt, кодируемого геном Rv3676, приводила к стимулированию роста Mtb в неблагоприятных условиях, а также более быстрой реактивации клеток из покоящегося состояния и приобретения повышенной вирулентности для мышей. Полученные результаты свидетельствовали в пользу предположения о том, что данный фактор служит промежуточным звеном передачи сигнала от аденилатциклазы через цАМФ по пока не установленному механизму, стимулирующему размножение бактерий. Такой механизм, возможно, связан с экспрессией RpfA у Mtb, находящегося под контролем цАМФ-зависимого транскрипционного фактора Rv3676 [18]. Несомненная важность CRPMt для размножения патогена in vivo и отсутствия данного белка у человека позволяет рассматривать продукт этого гена в качестве перспективной мишени при создании новых противотуберкулезных соединений.
Работа выполнена при финансовой поддержке гранта Российского научного фонда (проект № 16-15-00245, опыты in vitro) и Российского Фонда Фундаментальных Исследований (проект № 17-04-00119А, опыты in vivo).
Список литературы
Barry C.E., Boshoff H., Dartois V., Dick T., Ehrt S., Flynn J., Schnappinger D., Wilkinson R.J., Young D. // Nat. Rev. Microbiol. 2009. V. 7. № 12. P. 845–855.
Shleeva M.O., Kudykina Y.K., Vostroknutova G.N., Suzina N.E., Mulyukin A.L., Kaprelyants A.S. // Tuberculosis. 2011. V. 91. № 2. P. 146–154.
Shleeva M.O., Bagramyan K., Telkov M.V., Mukamolova G.V., Young M., Kell D.B., Kaprelyants A.S. // Microbiology. 2002. V. 148. № 5. P. 1581–1591.
Shleeva M., Goncharenko A., Kudykina Y., Young D., Young M., Kaprelyants A. // PLoS One. 2013. V. 8. № 12. P. e82914.
Motaal A.A., Tews I., Schultz J.E., Linder J.U. // FEBS J. 2006. V. 273. № 18. P. 4219–4228.
Knapp G.S., McDonough K.A. // Microbiol. Spectr. 2014. V. 2. № 2. P. 1–14.
Shleeva M.O., Kondratieva T.K., Demina G.R., Rubakova E.I., Goncharenko A.V., Apt A.S., Kaprelyants A.S. // Front. Cell. Infect. Microbiol. 2017. V. 7. № 370. eCollection 2017. https://doi.org/10.3389/fcimb.2017.00370
Baker D.A., Kelly J.M. // Mol. Microbiol. 2004. 2004.V. 52. № 5. P. 1229–1242.
Никитушкин В.Д., Демина Г.Р., Капрельянц А.С. // Биохимия. 2016. Т. 81. № 13. С. 1719–1734.
Connell N.D. // Methods Cell Biol. 1994. V. 45. № 6. P. 107–125.
Mukamolova G., Turapov O., Young D.I., Kaprelyants A.S., Kell D.B., Young M. // Mol. Microbiol. 2002. V. 46. № 3. P. 623–635.
Drancourt M., Raoult D. // PLoS Negl. Trop. Dis. 2007. V. 1. № 2. P. e83.
Nikonenko B.V., Averbakh M.M., Apt A.S., Lavebratt C., Schurr E. // Tuber. Lung Dis. 2000. V. 80. № 1. P. 15–25.
Kalamidas S.A., Kuehnel M.P., Peyron P., Rybin V., Rauch S., Kotoulas O.B., Houslay M., Hemmings B.A., Maximiliano G., Gutierrez M.G., Anes E., Griffiths G. // J. Cell Sci. 2006. V. 119. № 17. P. 3686–3694.
Agarwal N., Lamichhane G., Gupta R., Nolan S., Bishai W.R. // Nature. 2009. V. 460. № 7251. P. 98–102.
Gazdik M.A., McDonough K.A. // J. Bacteriol. 2005. V. 187. № 8. P. 2681–2692.
Pedroza-Roldán C., de Jesús Aceves-Sánchez M., Zaveri A., Charles-Niño C., Elizondo-Quiroga D.E., Hernández-Gutiérrez R., Allen K., Visweswariah S. // Folia Microbiol. 2015. V. 60. P. 21–31.
Rickman L., Scott C., Hunt D.M., Hutchinson T., Menéndez M.C., Whalan R., Hinds J., Colston M.J., Green J., Buxton R.S. // Mol. Microbiol. 2010. V. 56. № 5. P. 1274–1286.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


