Прикладная биохимия и микробиология, 2019, T. 55, № 4, стр. 356-359
Мукоадгезивные гидрогели на основе альгината натрия
М. Ю. Горшкова 1, *, И. Ф. Волкова 1, Л. В. Ванчугова 1, И. Л. Валуев 1, Л. И. Валуев 1
1 Институт нефтехимического синтеза им. А.В. Топчиева Российской академии наук
119991 Москва, Россия
* E-mail: mgor@ips.ac.ru
Поступила в редакцию 16.11.2018
После доработки 05.12.2018
Принята к публикации 20.02.2019
Аннотация
Изучена возможность использования гидрогелей альгината натрия в качестве мукоадгезивных носителей лекарстенных средств для интраназального применения. Показано, что скорость выделения лекарств определялась их растворимостью в воде, концентрацией на носителе и степенью сшивания альгината.
Интраназальное введение физиологически активных веществ в организм является одним из старейших безболезненных путей лекарственной терапии. Площадь слизистой оболочки носа у человека составляет около 150 см2. Она обильно снабжена кровеносными сосудами, что обеспечивает быстрое поглощение большинства лекарственных средств, создает их высокую концентрацию в системном кровотоке и позволяет избежать разрушения лекарства при его прохождении через печень, с чем приходится считаться при других способах введения.
При интраназальном применении лекарственных веществ (ЛВ) в виде растворов, спреев или мазей их большая часть всасывается в кровь, однако, как было обнаружено в последние годы, меньшая часть ЛВ по чувствительным нервам попадает непосредственно в мозг и далее распространяется по структурам головного мозга по механизмам, не связанным с кровотоком [1]. Это позволяет рассматривать интраназальный путь как своеобразный аналог внутримозгового введения препаратов человеку. Возможность прямого поступления лекарств в мозг, минуя гематоэнцефалический барьер, открывает новые перспективы для эффективного лечения заболеваний центральной нервной системы и опухолей мозга. Особенно это важно при заболеваниях центральной нервной системы сосудистого генезиса, так как несмотря на наличие тромба в кровеносных сосудах, доставка препаратов непосредственно к клеткам головного мозга оказывается возможной, причем не позднее нескольких мин после введения. Обычно это время не превышает 30 мин и уже через 10–15 мин лекарства, введенные интраназально, обнаруживаются в мозге [2]. Учитывая необходимость предотвращения нежелательного проникновения лекарств в кровоток, задача создания препаратов сводится к их адгезии непосредственно в месте введения на слизистой носа, последующему его растворению и выделению активного начала с контролируемой скоростью для достижения области поражения головного мозга.
Цель работы – изучение возможности использования гидрогелей на основе альгината натрия в качестве мукоадгезивных носителей, способных удерживаться на слизистой оболочке в течение времени, сопоставимого со временем выделения лекарственного соединения.
МЕТОДИКА
В работе использовали альгинат натрия из бурых водорослей с вязкостью 1.95 дл/г, измеренной в 0.1 М растворе хлористого натрия, тирозин и фенилаланин (“Sigma-Aldrich”, США), хлористый натрий (“ЛабТех”, Россия). Фосфатный буфер, рН 7.4, содержащий физиологические концентрации солей готовили из концентрата (“Sigma-Aldrich”, США). Все растворы готовили с использованием бидистиллированной воды.
Гидрогели получали смешиванием растворов компонентов и навесок аминокислот. К раствору альгината (20 мг/мл) добавляли небольшое количество хлористого натрия, затем вносили навеску аминокислоты и смесь обрабатывали ультразвуком (УЗВ-3) в течение 5–10 мин, после чего добавляли расчетное количество 2% (вес.) раствора сшивающего агента, хлорида кальция, и вновь обрабатывали ультразвуком до получения гомогенной композиции. Весовое соотношение альгинат:аминокислота в гидрогелях составляло 1 : 2, 1 : 1 и 2 : 1.
Концентрацию аминокислот в растворах определяли методом УФ-спектроскопии на приборе Specord M 40 (“Carl Zeiss Jena”, Германия) по поглощению при 275 нм для тирозина и 257.8 нм для фенилаланина по полученным ранее калибровочным зависимостям.
Для изучения скорости выделения аминокислот гидрогель (60 мг) наносили на поверхность пластины из сшитого полигидроксиэтилметакрилата, моделирующей слизистую оболочку [3], которую помещали на дно стеклянного стакана, аккуратно добавляли 20 мл 0.14 М фосфатного буфера, рН 7.4, и оставляли без перемешивания при 22°С. Через заданные промежутки времени отбирали пробы для определения количества аминокислоты в растворе, после измерения пробу возвращали обратно в стакан. Результаты представляли в виде графической зависимости (АКтек/АКисх) × 100% от времени, где АКтек – количество аминокислоты в растворе, определенное для каждого момента времени, мг, АКисх – количество аминокислоты, взятое в эксперимент, мг.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Повышенное сродство к слизистым оболочкам муколитической природы глаза, ротовой полости, желудочно-кишечного тракта, органов дыхания и т.д., получившее название мукоадгезия, в последние годы достаточно широко используется при создании нового поколения лекарственных препаратов. По данным Национального Центра биотехнологической информации США (National Center for Biotechnology Information) только за последний год опубликовано около сотни работ в этом направлении.
Подавляющее большинство мукоадгазивных полимеров представляют собой природные или синтетические гидрофильные макромолекулы, содержащие гидроксильные, карбоксильные или аминогруппы, способные образовывать водородные связи [4–8].
В настоящей работе были использованы гидрогели на основе нетоксичного природного мукоадгезивного полисахарида альгината натрия, уже нашедшего применение в пищевой и косметической промышленности, а также в медицине в качестве гемостатического препарата, обладающего противовоспалительными и репаративными свойствами [9]. В используемых гидрогелях макромолекулы альгината сшиты в единую сетку ионами кальция за счет образования солевых связей с карбоксильными группами альгината. Время растворения гидрогеля можно достаточно легко регулировать путем изменения соотношения между альгинатом и хлоридом кальция: чем больше концентрация хлорида кальция, тем ниже скорость перехода гидрогеля в раствор. В соответствии с поставленной задачей создание мукоадгезивных препаратов, растворяющихся в течение 15–30 мин, в работе были использованы гидрогели с соотношением альгината и хлорида кальция 10 : 1, 7.14 : 1 и 5 : 1, характеризующиеся заданной скоростью растворения.
В качестве модельных лекарственных соединений были выбраны фенилаланин и тирозин, близкие по строению, но сильно различающиеся по растворимости в воде аминокислоты. Растворимость фенилаланина составляет 30 мг/мл, а тирозина существенно меньше – 0.5 мг/мл (вода, 25°С) [10]. Выбор этих соединений обусловлен тем, что именно аминокислоты составляют основу проникающего в мозг препарата Семакс – синтетического пептида, который применяют для повышения адаптационных возможностей организма человека при стрессах в экстремальных ситуациях [11].
Различная растворимость используемых аминокислот в воде определяла и разный характер их взаимодействия с альгинатом.
Известно, что связывание ароматических соединений с полимерами в растворах приводит к изменению их спектральных характеристик, в том числе, к снижению оптической плотности [12]. Примером может служить образование комплексов хитозана с красителем метиленовым голубым, в структуре которого содержатся ароматические ядра, или образование комплексов лекарственных веществ с полимерами, описанное в работах [13, 14].
Именно такие изменения наблюдали в УФ‑спектрах комплексов фенилаланина с альгинатом (рис. 1а). Снижение оптической плотности в спектрах смесей фенилаланина с альгинатом по сравнению со спектрами свободной аминокислоты при равных ее концентрациях свидетельствовало о выраженном характере взаимодействия фенилаланина с альгинатом, которое, по-видимому, приводило к ассоциации аминокислоты, причем, чем больше соотношение фенилаланин/альгинат, тем выше оказывалась степень ассоциации. В то же время введение альгината натрия в растворы труднорастворимого тирозина не приводило к изменениям в его спектре (рис. 1б). Известно, что тирозин склонен к самоассоциации с образованием достаточно устойчивых ассоциатов [15], что и наблюдалось в изученной смеси. Добавка альгината не изменяла ассоциированного состояния тирозина.
Рис. 1.
Спектры растворов, содержащих 0.147 мг/мл фенилаланина (1) и его смеси с альгинатом (2) (а), 0.04 мг/мл тирозина (1) и его смеси с альгинатом (2) (б) при мольным соотношении альгинат /аминокислота = 1/1.
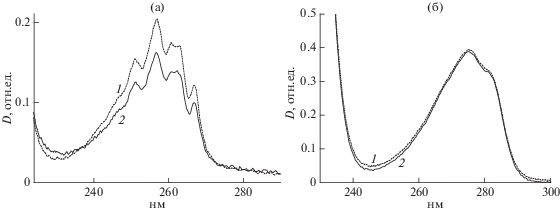
Следует отметить, что спектральные данные получены для альгината натрия в растворах, т.е. в свободном, несшитом состоянии. При получении гелей между карбоксилатной группой полимера и катионом кальция образовывалась солевая связь, то есть уменьшалось количество свободных кислотных групп, что могло существенно влиять на характер его взаимодействия с аминокислотами.
Степень ассоциации аминокислот в гидрогеле оказалась решающим фактором, определяющим кинетику растворения препарата и выделение аминокислот в раствор. На рис. 2 и 3 приведены кинетические кривые зависимости накопления тирозина и фенилаланина в растворе от степени сшивки геля при равном содержании в них аминокислот. Видно, что увеличение степени сшивки замедляло выделение более гидрофобного тирозина. Так, если из плотно сшитого геля (соотношение альгинат : хлорид кальция 5 : 1) за 15 мин выделялось приблизительно 15% введенного тирозина, то из гидрогеля с соотношением альгинат : хлорид кальция 10 : 1 за это же время – около 60%.
Рис. 2.
Высвобождение тирозина из гелей альгинат/CaCl2 со степенью сшивки 10/1 (1), 7.14/1 (2) и 5/1 (3) при соотношении альгинат/Тир = 1/1.
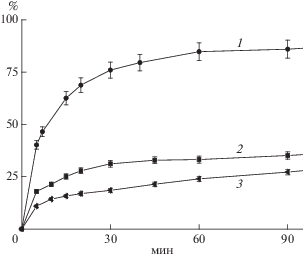
Рис. 3.
Высвобождение фенилаланина из гелей альгинат/CaCl2 со степенью сшивки 10/1 (1), 7.14/1 (2) и 5/1 (3) при соотношении альгинат/Фен = 1/1.
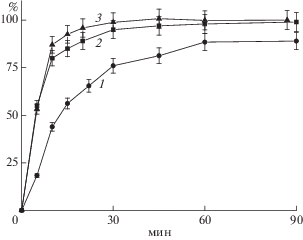
Совершенно иное влияние степень сшивки носителя оказывала на скорость выделения ассоциированного в гидрогеле фенилаланина (рис. 3). Увеличение плотности сшивки, то есть уменьшение количества свободных карбоксилатных групп в макромолекуле альгината, и, соответственно, расширение гидрофобных областей в гидрогеле приводило к “выталкиванию” легко растворимой аминокислоты и ускорению ее выделения в раствор.
Существенные различия в поведении молекул тирозина и фенилаланина наблюдали и при изучении зависимости скорости их накопления в растворе от концентрации аминокислоты в гидрогеле (рис. 4). Увеличение содержания тирозина в геле существенно замедляло скорость его высвобождения, что, вероятнее всего, вызвано увеличением вклада гидрофобных взаимодействий.
Рис. 4.
Выделение тирозина из гелей со степенью сшивки альгинат/CaCl2 7.14, при различном молярном соотношении альгинат/Тир (а) и альгинат/Фен (б) за 10 (1), 30 (2) и 60 мин (3).
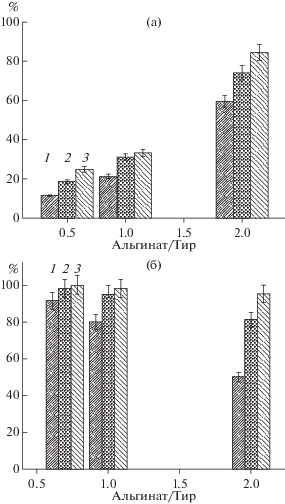
В тоже время с увеличением содержания более гидрофильной молекулы фенилаланина скорость ее выделения несколько увеличивалась. Следует отметить, что полученные в работе данные свидетельствуют о менее выраженной зависимости скорости выделения гидрофильного соединения от параметров системы. Согласно литературным данным, создание систем доставки хорошо растворимых лекарственных веществ представляет более сложную задачу по сравнению с доставкой гидрофобных лекарств [16]. Вместе с тем, в настоящей работе удалось достичь некоторого регулирования скорости выделения фенилаланина.
Таким образом, полученные результаты показали принципиальную возможность использования альгината натрия в качестве носителя лекарств, обеспечивающего их доставку в мозг при растворении адгезированной на слизистой оболочке носа полимерной композиции. Изменяя строение гидрогеля и состав композиции, можно в широких пределах контролировать скорость выделения лекарства.
Работа выполнена в рамках Государственного задания ИНХС РАН.
Список литературы
Привалова А.М., Гуляева Н.В., Букреева Т.В. // Нейрохимия. 2012. Т. 29. № 2. С. 93–105.
Leary A.C., Dowling M., Cussen K., O’Brien J. // J. Diabetes Sci. Technol. 2008. V. 2. № 6. P. 1054–1060.
Коков Л.С., Цыганков В.Н., Петрушин К.В., Лучкин В.М. // Современные технологии и возможности реконструктивно-восстановительной и эстетической хирургии. Материалы 2-й межд. конф. М.: ФГУ “Институт хирургии им. А.В. Вишневского, 2010. С. 84.
Odeniyi M.A., Khan N.H., Peh K.K. // Acta Pol. Pharm. 2015. V. 72. № 3. P. 559–567.
Smart J.D. // Adv. Drug Deliv. Rev. 2005. V. 57. № 11. P. 1556–1568.
Cui F., Qian F., Yin C. // Int. J. Pharm. 2006. V. 316. № 1–2. P. 154–161.
Serra L., Domenech J., Peppas N.A. // Eur. J. Pharm. Biopharm. 2006. V. 63. № 1. P. 11–18.
Adamczak M.I., Martinsen O.G., Smistad G., Hiorth M. // Int. J. Pharm. 2017. V. 527. № 1–2. P. 72–78.
Lee Y., Mooney D.J. // Prog. Polym. Sci. 2012. V. 37. № 1. P. 106–126.
Khoshkbarchi M.K., Vera J.H. // Ind. Eng. Chem. Res. 1997. V. 36. № 6. P. 2445–2451.
Шевченко К.В., Нагаев И.Ю., Алфеева Л.Ю., Андреева Л.А., Каменский А.А., Левицкая Н.Г., Шевченко В.П., Гривенников И.А., Мясоедов Н.Ф. // Биоорганическая химия. 2006. Т. 32. № 1. С. 64–70.
Свердлова О.В. Электронные спектры в органической химии. Л.: Химия, 1985. 246 с.
Izumrudov V.A., Volkova I.F., Gorshkova M.Yu. // Macromol. Chem. Phys. 2010. V. 211. № 4. P. 453–460
Peyratout C., Donath E., Daehne L. // Photochem. Mi-crobiol. A. 2001. V. 142. № 1. P. 51–57.
Menard-Moyon C., Venkatesh V., Krishna V., Bonachera F., Verma S., Bianco A. // Chem. Eur. J. 2016. V. 21. P. 11681–11686.
Arpicco S., Battaglia L., Brusa P., Cavalli R., Chirio D., Dosio F., Gallarate V., Milla P., Peira E., Rocco F., Sapino S., Stella B., Ugazio E., Ceruti M. // J. Drug Delivery Sci. Tech. 2016. V. 32. B. P. 298–312.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


