Прикладная биохимия и микробиология, 2019, T. 55, № 4, стр. 386-395
Влияние основных характеристик низкомолекулярного хитозана на рост фитопатогенного гриба Botrytis сinerea
Н. В. Карпова 1, *, Б. Ц. Шагдарова 1, Т. С. Лялина 1, А. В. Ильина 1, В. М. Терешина 2, В. П. Варламов 1
1 Институт биоинженерии, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Россия
2 Институт микробиологии им. С.Н. Виноградского, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Россия
* E-mail: ashatanr@mail.ru
Поступила в редакцию 29.10.2018
После доработки 14.01.2019
Принята к публикации 20.02.2019
Аннотация
Изучено влияние основных характеристик низкомолекулярного хитозана с молекулярной массой (Mw) 2–100 кДа, степенью дезацетилирования (СД) 60–98% и полидисперсностью (Mw/Mn) 1.9–2.7, полученного в результате ферментативного и химического гидролиза, на рост Botrytis сinerea. Наибольший ингибирующий эффект на рост гриба (индекс прорастания конидий менее 50%) оказывали хитозаны с Mw 2–13 кДа, СД 85–98% и Mw/Mn 2–2.5. Среди них наиболее эффективным оказался хитозан с Mw 13 кДа, СД 98%, ингибирующий рост мицелия гриба при концентрации 0.938 мг/мл. Этот хитозан и его комплекс с ионами меди (75 м.д.) значительно подавляли метаболическую активность гриба (до 20 и 11% соответственно), что указывало на возможность их использования при разработке фунгицидных препаратов.
Растительные патогены представляют огромную группу микроорганизмов, которые вызывают серьезные заболевания растений, снижают урожайность и качество получаемой продукции. Фитопатогенные грибы наносят значительный экономический ущерб, и ежегодные потери оцениваются более чем 200 млрд. долларов США [1].
Грибы рода Botrytis распространены повсеместно и входят в список наиболее опасных патогенов [2]. Грибы паразитируют на различных органах растений, ослабляя его и значительно снижая количественные и качественные показатели урожайности. Наиболее часто встречается вид Botrytis cinerea [3]. В настоящее время борьбу с патогеном осуществляют, применяя пестициды (фунгициды) для протравливания семян, обработки почвы и растений в период покоя и во время вегетации. Однако фунгициды оказывают многостороннее негативное влияние на окружающую среду, а также здоровье человека, часто вызывая головные боли и тошноту, а также хронические заболевания, рак и нарушение репродуктивной и эндокринной системы [4]. Альтернативным и более безопасным способом защиты растений от растительных патогенов является использование соединений природного происхождения. К их числу можно отнести полиаминосахарид ‒ хитозан, его производные и композиты на его основе [5]. Хитозан – это дезацетилированное производное хитина, получаемое в результате его щелочной обработки. Экономически выгодными источниками хитина служат панцири ракообразных, некоторые насекомые и грибы [6].
Благодаря разнообразию природных источников получения, возможности биодеградации, совместимости с организмами и низкой токсичности [7], хитозан является привлекательным биополимером и поэтому активно изучается, находя применение в различных отраслях промышленности, в том числе в сельскохозяйственной [8]. Противогрибная активность, присущая хитозану, вызывает несомненный интерес, что связано с решением проблемы замены применения небезопасных для окружающей среды синтетических фунгицидов. В ряде работ [2, 9–14] было изучено влияние молекулярной массы (ММ) хитозана на противогрибные свойства. Это одна из основных характеристик, которая влияет на проявляемую полимером биологическую активность. Сообщалось [9], что гидрохлориды хитозана с ММ 360 и 6 кДа со степенью дезацетилирования (СД) 90% эффективно ингибировали рост мицелия и прорастание спор Monilinia fructicola, при этом эффект характеризовался концентрационной зависимостью. Ингибирующий эффект на рост мицелия при концентрации 0.1–0.4 г/л оказался больше для хитозана с ММ 6 кДа, а – 2 г/л действие обоих хитозанов оказалось сопоставимым. Так, минимальная ингибирующая концентрация (МИК50) была 0.7 и 0.5 г/л для ММ 360 и 6 кДа соответственно. Оба хитозана сильнее ингибировали рост мицелия и в меньшей степени прорастание спор. Известно о фунгицидной активности гидрохлоридов высоко- и низкомолекулярного хитозана, характеризующихся вязкостью 100–150 (с ММ более 100 кДа) и 5 мПa (с ММ менее 50 кДа) и СД 85%, а также их олигомеров и N-ацетилглюкозамина по отношению к микроорганизмам Candida albicans, C. krusei и C. glabrata. Оказалось, что эта активность уменьшалась по мере снижения ММ и отсутствовала у N‑ацетилглюкозамина [10]. Оказалось, что ММ этих хитозанов влияла только на активность по отношению к C. albicans. Так, МИК50 составляла 0.00699 и 0.02616% для высоко- и низкомолекулярного хитозана соответственно. Их влияние на C. krusei и C. glabrata было сопоставимым. Так, для C. krusei МИК50 было 0.01218 и 0.01313%, а C. glabrata – 0.01815 и 0.01840% для обоих хитозанов соответственно.
Изучалось влияние ММ хитозана на фунгицидную активность, проявляемую по отношению к шести растительным патогенам: Alternaria alternata (Pleosporaceae), Fusarium graminearum (Nectriaceae), F. oxysporum (Nectriaceae), F. solani (Nectriaceae), Phytophthora Сравнивали антигрибное действие хитозанов с ММ 22-387 846 кДа, при этом активность последнего оказалась существенно ниже. Эффективная концентрация, при которой наблюдалось 50%-ное ингибирование роста мицелия, находилась в интервале от 480 до 3037 мг/мл. Патогены F. graminearum, F. oxysporum и R. solani оказались менее чувствительными к действию хитозана по сравнению с A. аlternata, F. solani и P. infestans [2]. Изучали влияние ММ водорастворимого хитозана (ММw 1, 3, 5 и 10 кДа, СД 93%) на фунгицидную активность по отношениюк различным патогенным дрожжам и мицелиальным грибам. Было установлено, что низкомолекулярный хитозан обладал значительной активностью по отношению к Aspergillus fumigatus (ATCC 6145), A. parasiticus (ATCC 6598), F. oxysporum (ATCC 16909), F. solani (KCTC 6326), Penicillium verrucosum var. verrucosum (KCTC 6265) и B. cinerea (KACC 40573). Хитозан с ММw 10 кДа проявлял наибольшую фунгицидную активность по отношению ко всем тестируемым микроорганизмам, МИК50 был <0.04 мг/мл. Только для хитозана с ММw 1 кДа МИК50 по отношению к B. cinerea (KACC 40573) составляла <0.08 мг/мл, для всех остальных образцов была <0.04 мг/мл [11]. Изучалось влияние ММ хитозана (ММ 5, 37, 57 и 270 кДа) in vitro и in vivo на рост мицелия B. cinerea (Pers.), поражавшего спелые плоды томатов (Solanum lycopersicum L. var. lycopersicum) [12]. Минимальная эффективная концентрация (50%-ное ингибирование роста мицелия) хитозанов снижалась с уменьшением ММ. Так, для хитозана с ММ 5 кДа она составляла 1392 мг/л, а с ММ270 кДа – 2407 мг/л. В работе [13] изучали влияние степени полимеризации (СП) хитозана (СП = 206–9, что соответствует ММ ≈ 34.5–1.5 кДа), СД 85% на прорастание конидий B. cinerea (BC 101 и BCBD). Было показано, что при инокуляции B. cinerea BC 101 и BCBD наибольшим ингибирующим эффектом обладали хитозаны со СП = 23 (ММ ≈ 4.7 кДа) и 40 (ММ ≈ 6.7 кДа) в первом случае и СП 15–40 во втором.
Важной характеристикой, влияющей на проявление биологической активности хитозана, является не только ММ, но и СД [15]. Существенное влияние СД на фунгицидную активность отмечалось в ряде работ [16, 17]. Показано антигрибное действие хитозана (СД > 50%) на 46 видов тестируемых грибов с различным составом клеточной стенки [18]. Оказалось, что хитозан при концентрации 125–1000 мг/л подавлял рост 32 видов грибов, в то время как хитин (СД < 50%) при концентрации 1 мг/мл только 6. При этом эти 6 видов в равной или даже большей степени были чувствительными к хитозану, чем к хитину. Предполагают, что катионная форма первичных аминогрупп звеньев глюкозамина в полимерной цепи в результате электростатического взаимодействия с анионными группами на поверхности клеточной стенки приводит к ее дестабилизации и формированию пор, что в конечном итоге приводит к гибели патогена [19]. Сообщалось также, что соли алкилированного хитозана, у которых NH2–группы частично преобразованы в четвертичные аммониевые, характеризовались большим положительным зарядом по сравнению с не модифицированным хитозаном [20]. У производного N,N,N-триметилхитозана, имеющего меньший объем заместителя по сравнению с N,N-диэтил-N-метилхитозаном, заряд оказался более доступным для взаимодействия с поверхностью клеточной стенки. Хлорид N,N,N-(триэтил)хитозана со степенью замещения 21% эффективнее ингибировал рост мицелия B. cinerea (Pers.) по сравнению с не модифицированным хитозаном (ЕС50 – эффективная концентрация, вызывающая 50%-ное подавление роста микроорганизма – 449 и 859 мг/л соответственно), благодаря наличию большего суммарного положительного заряда в структуре [1]. В работе [21] сообщалось об увеличении противогрибной активности производных хитозана в комплексе с ионами металлов, в частности, с ионами меди. Так же известно, что ионы кальция в концентрации 500 ммоль/л увеличивают ингибирующее действие антибиотиков по отношению к B. cinerea [22].
Цель работы – изучение влияния основных характеристик низкомолекулярного хитозана – молекулярной массы, степени дезацелирования и полидисперсности на прорастание конидий B. cinerea, а также ионов кальция и меди, используемых в растворе с хитозаном, на противогрибную активность.
МЕТОДИКА
Среды и условия культивирования. В работе использовали штамм Botrytis cinerea Persoon ВКМ F-2712. Штамм выращивали на агаризованной среде следующего состава (г/л): картофель – 200, глюкоза – 20, агар – 20 в течение 7 сут при 25°С. Готовую культуру хранили течение 1 мес при 4°С.
Получение производных хитозана. В работе использовали хитозан с ММ 100 и 60 кДа, СД 90 и 60% (Х100/90, Х100/60, Х60/90 и Х60/60), а также с ММ 2, 5, 13 кДа и СД 85, 85 и 98% – Х2/85, Х5/85 и Х13/98 соответственно и кватернизированное производное со степенью замещения (СЗ) 98%, синтезированное на основе хитозана ММ 20 кДа, СД 98% (КХ20/98) согласно методике описанной в работе [27].
Х60/90, Х20/98 и Х13/98 были получены в результате деполимеризации хитозана ММ 1000 кДа, СД 87% (ООО “Биопрогресс”, Россия) с использованием неорганических кислот по методикам, изложенным в работе [23, 24] и Х100/90, Х5/85 и Х2/85 – с применением ферментных препаратов согласно методикам [25]. Образец Х2/85 дополнительно фракционировали методом ультрафильтрации. Хитозаны Х100/60 и Х60/60 получали реацетилированием образцов Х100/90 Х60/90, согласно методике [26]. Кватернизированное производное КХ20/98 получали по методике, описанной в работе [23]
Определение характеристик производных хитозана. Молекулярно-массовые характеристики хитозанов определяли методом высокоэффективной гель-проникающей хроматографии на хроматографе S 2100 (“Sykam”, Германия) на колонке (7.8 × 300 мм) с Ultahydrogel-250 (“Waters”, США) с предколонкой (4 × 3 мм) GFC-4000 (“Phenomenex”, США).
Степень дезацетилирования определяли методом спектрометрии протонного ядерного магнитного резонанса (1Н-ЯМР) на спектрометре AVANCE III (“Bruker”, Германия), рабочая частота по протону 600 МГц, температура 30°С. Образцы были приготовлены в Н2О + 10% D2O, с добавлением соляной кислоты до полного растворения. Дзета-потенциал хитозанов определяли в 0.01M KCl, рН 7.0, при 25.0 ± 0.1°С, измерения проводили на приборе 90 Plus Particle Size Analyser (“Brookhaven Instruments Corporation”, Vernon Hills, IL, США) с использованием дополнительной приставки Zeta-PALS. Среднее значение дзета-потенциала рассчитывали из 5 независимых измерений значений (как минимум), представленных с учетом среднего отклонения анализатора.
Получение растворов хитозана с ионами Са2+ и Сu2+. К навеске хитозана Х13/98, растворенной в 0.5%-ной уксусной кислоте (1.875 и 0.938 мг/мл), добавляли расчетное количество раствора соли (2.4%) CaCI2 или CuSO4. Конечная концентрация ионов Са2+ 150 и 300 м.д., Сu2+ 75, 150 и 300 м.д. в растворах хитозанов.
Исследование прорастания спор. Анализ влияния хитозана и его производных на прорастание спор B. cinerea проводился в плоскодонных 96-луночных планшетах (“SPL Life Sciences”, Korea) с использованием жидкой картофельно-глюкозной среды. Для получения конидий в пробирку с семисуточной культурой B. cinerea на картофельно-глюкозном агаре вносили 10 мл жидкой питательной среды и готовили суспензию, содержащую конидии и мицелий гриба. Суспензию фильтровали через стерильную вату для удаления остатков мицелия. Хитозан растворяли в 0.5%-ной уксусной кислоте в концентрации 15 мг/мл. Для определения концентрационной зависимости делали серию двукратных разведений, диапазон концентраций составил 0.234–1.875 мг хитозана/мл среды. Добавляли суспензию конидий в питательной среде, при этом концентрация конидий в лунке составляла 2.5 × 104 конидий/мл. Инкубировали в течение 4 ч при 25°С. Затем процесс прорастания останавливали добавляя в среду 50 мкл 2%-ного раствора параформальдегида. Индекс прорастания конидий определяли путем подсчета проросших конидий в поле зрения с использованием инвертированного микроскопа при 200-кратном увеличении. Проросшими считали конидии, ростковая трубка которых имела размер не менее чем диаметр конидии. Общее количество спор в поле зрения составляло 300–450. Долю проросших конидий (Дпр) в поле зрения вычисляли по формуле:
Индекс прорастания конидий (ИП) рассчитывали по формуле:
Изучение влияния производных хитозана на метаболическую активность гриба B. cinerea (колориметрический метод). Получение суспензии спор и серии разведений препаратов хитозана в 96-луночных планшетах проводили, как описано в методике изучения прорастания спор [27]. Подготовленные планшеты инкубировали в течение 24 ч при 25°С. Далее в каждую лунку добавляли по 10 мкл раствора хлорида йодонитротетразолия (5 мг/мл красителя, растворенного в 0.1 М фосфатном буфере, рН 7.4) в присутствии 4 мг/мл 1-метокси-феназин-метосульфата и инкубировали в течение 4 ч при 37°С. Надосадочную жидкость аккуратно сливали, а к окрашенному осадку добавляли по 30 мкл ДМСО для растворения образовавшихся кристаллов формазана. Растворение осуществляли в течение 16 ч при 37°С при перемешивании (100 об/мин). Оптическую плотность в каждой лунке измеряли при 540 нм, используя фотометр микропланшетного формата (“Thermo Scientific Multiskan FC”, США). Измерения проводили трижды. Результаты получены с учетом контроля (влияние уксусной кислоты). Метаболическую грибную активность вычисляли по формуле:
Таблица 1.
Физико-химические характеристики производных хитозана
| Производное хитозана | ММ, кДа | СД, % | Mw/Mn | Ζ-потенциал, мВ |
|---|---|---|---|---|
| Х100/90 | 100 | 90 | 2.7 | 24 ± 2.5 |
| Х100/60 | 100 | 60 | 2.7 | 15 ± 2.8 |
| Х60/90 | 60 | 90 | 2.0 | 25 ± 2.7 |
| Х60/60 | 60 | 60 | 2.0 | 19 ± 2.0 |
| Х20/98 | 20 | 98 | 1.9 | 35 ± 2.0 |
| Х13/98 | 13 | 98 | 2.5 | 35 ± 3.5 |
| Х5/85 | 5 | 85 | 2.0 | 32 ± 2.5 |
| Х2/85 | 2 | 85 | 2.0 | 32 ± 2.5 |
| КХ20/98 | 20* | 98** | Не определяли | 33 ± 5.0 |
Исследование влияния хитозана на рост гриба B. cinerea. Противогрибную активность препарата хитозана оценивали in vitro по отношению к B. cinerea по методике [28]. Хитозан растворяли в 0.5%-ной уксусной кислоте и вносили в расплавленную агаризованную картофельно-глюкозную среду до достижения концентрации 0.234, 0.469, 0.938 и 1.875 мг/мл. Приготовленные среды затем переносили в стерильные чашки Петри диаметром 70 мм. После застывания среды в центр испытуемых чашек помещали диск диаметром 7 мм с суточной культурой B. cinerea и инкубировали при 25°С. Изучение завершали, когда мицелий гриба достигал края чашки Петри в контрольном варианте (без добавления хитозана). Противогрибную активность вычисляли по формуле:
Были выполнены три повторности каждого теста, для расчета брали среднеарифметическое значение.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Хитозаны с ММ 200–1000 кДа характеризуются низкой ($ \ll $1 мг/мл) растворимостью в водных растворах при рН 6, что обусловлено практически полным отсутствием в их структуре протонированных аминогрупп и агрегацией молекул за счет внутри- и межмолекулярных водородных связей. При применении в качестве растворителя органических кислот (уксусной, молочной и др.) образуются вязкие растворы хитозанов с ММ более 200 кДа. Обычно для снижения вязкости этих растворов и увеличения его растворимости осуществляют реакцию деполимеризации полимерной цепи хитозана. Для изучения влияния основных характеристик биополимера на прорастание конидий B. cinerea методами химической и ферментативной деполимеризации были получены производные низкомолекулярного хитозана с ММ 2–100 кДа, различающиеся по количеству аминогрупп (СД) после реацетилирования (табл. 1).
Оценку ингибирующего действия хитозанов на прорастание спор B. cinerea проводили в плоскодонных 96-луночных планшетах. В данном эксперименте изучали ИП в диапазоне концентраций хитозанов 0.015–1.875 мг/мл. Производные с ММ 100 и 60 были взяты с СД 60 и 90 (рис. 1а).
Рис. 1.
Зависимость индекса прорастания конидий от концентрации производного хитозана: а – Х100/60 (1), Х100/90 (2), Х60/60 (3) и Х60/90 (4); б – Х2/85 (1), Х5/85 (2) Х13/98 (3) и КХ20/98 (4) при обработке B. cinerea.
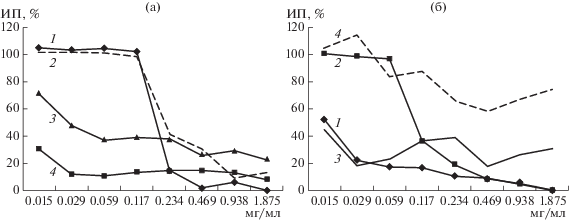
Следует отметить, что производное Х60/90 (рис. 1а, вариант 4) с большим содержанием протонированных аминогрупп (при рН 5.6) характеризовалось большим положительным зарядом и ИП конидий оказался ниже 50% во всем диапазоне исследуемых концентраций, а у Х60/60 (рис. 1а, вариант 3) ИП снижался, только начиная с концентрации 0.029 мг/мл. Однако, даже при максимальной рабочей концентрации 1.875мг/мл для этих двух хитазанов не наблюдалось полного подавления прорастания конидий. Для Х100/90 и Х100/60 ИП резко уменьшался при концентрации от 0.234 до 1.875 мг/мл, что коррелировало со снижением ММ от 100 до 60 кДа и увеличением СД от 60 до 90%.
Уменьшение ММ хитозана до 2 и 13 кДа при СД 85 и 98% эффективно влияло на прорастание конидий B. cinerea во всем диапазоне исследуемых концентраций (рис. 1б, варианты 1 и 3).
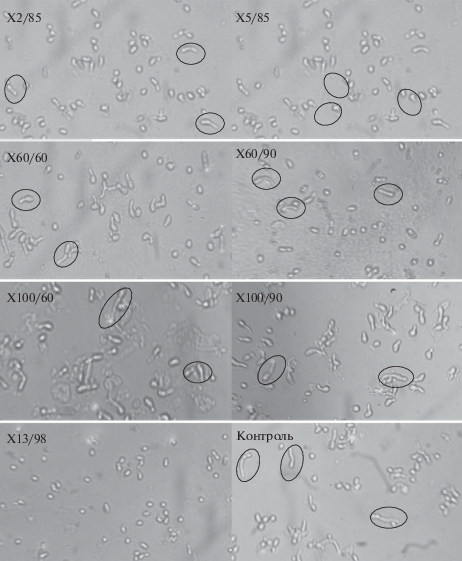
Рис. 2.
Влияние производных хитозана в концентрации 0.015 мг/мл на прорастание конидий B. сinerea при 4-часовой инкубации (увеличение в 200 раз).
ИП конидий менее 50% отмечали для хитозана Х5/85 в диапазоне концентраций 0.117–1.875 мг/мл (рис. 1б, вариант 2). Как Х5/85, так и Х2/85 полностью ингибировали прорастание конидий B. сinerea при максимальной концентрации 1.875 мг/мл. Интересно отметить, что Х5/85 и Х2/85 с одинаковой СД, полидисперсность и близкие значения ММ, но отличались по способу выделения, и проявляли противогрибное действие при концентрациях, различающихся на порядок. Можно предположить, что это связано с потерей активной составляющей в структуре Х2/85, отвечающей за проявляемую активность [29]. Следует отметить, что хитозан Х2/85 был получен дополнительным фракционированием гидролизата хитозана с использованием метода ультрафильтрации.
При сравнении действия образцов хитозана Х5/85 и Х13/98, которые характеризовались полидисперсностью 2 и 2.5 соответственно, было показано, что Х13/98 эффективнее подавлял рост конидий B. сinerea. Можно предположить, что это связано с более высокой растворимостью, обусловленной большей СД и полидисперсностью. Обычно с увеличением полидисперсности в условиях гидролиза кислотой возрастает количество коротких молекулярных фрагментов, ослабляющих межмолекулярные взаимодействия в структуре. Таким образом, полученные результаты подтверждали влияние обеих характеристик хитозана на проявляемый биологический эффект.
Ранее сообщалось, что кватернизированные производные низкомолекулярного хитозана характеризуются более высокой противогрибной активностью по сравнению с хитозаном [30]. Это объясняли структурой вводимого заместителя при четвертичном атоме азота. Кватернизированное производное, используемое в данной работе, не оказывало такого положительного эффекта. Оказалось, что при сопоставимых значениях суммарного положительного заряда для производных КХ20/98 и Х13/98 ИП конидий оказался значительно выше 50% для всех используемых концентраций (рис. 1б, вариант 4 и 3). Полученные результаты можно объяснить удаленностью положительного заряда на четвертичном атоме азота от главной полисахаридной цепи на расстояние 0.5–0.6 нм алкильного заместителя (‒CH2–CH(OH)–CH2–) [31], что возможно препятствует взаимодействию с отрицательно заряженными группами на поверхности клеточной стенки гриба. В то же время протонированные аминогруппы хитозана в производных Х2/85, Х5/85 и Х13/98 расположены значительно ближе к основной цепи биополимера, поэтому они оказывали более сильное ингибирующее действие.
При визуальном контроле с помощью световой микроскопии действия хитозанов с ММ от 2 до 100 кДа на прорастание конидий гриба B. сinerea, наибольший ингибирующий эффект был отмечен для производного Х13/98 (рис. 2, Х13 /98), в то время как в остальных вариантах опыта и контроле наблюдалось значительное увеличение ростовых трубок конидий гриба.
Рис. 3.
Зависимость изменения метаболической активности гриба B. сinerea от концентрации (мг/мл) от концентрации (мг/мл): 1 – 1.875; 2 – 0.938; 3 – 0.469; 4 – 0.234; 5 – 0.117, при обработке хитозаном: I – X20/98, II – KX20/98, III ‒ X13/98, IV-X2/85.
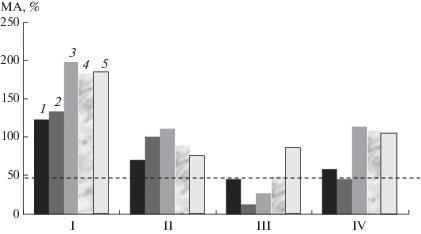
Влияние хитозанов на метаболическую активность гриба B. сinerea оценивали с использованием модифицированного тетразолиевого метода (МТТ-тест). Использованный в работе колориметрический метод оценки с помощью соли тетразолия (йоднитротетразолия хлорида) физиологического состояния клеток по активности НАДФ-H-зависимых оксидоредуктаз, основан на ее восстановлении и переходе в водонерастворимую форму – формазан. По количеству образующегося формазана (пурпурное окрашивание) оценивали метаболическую активность клеток. Снижение интенсивности окраски свидетельствовало о повреждении грибной клетки. Для данного метода были использованы те производные хитозана, которые проявили себя в качестве ингибиторов прорастания спор в предыдущем эксперименте. Производные Х60/60, Х60/90, Х100/60 и Х100/90 не оказывали эффективного противогрибного действия. Можно предположить, что в результате увеличения времени инкубации с 4 до 24 ч происходило разрушение хитозановой пленки, покрывающей конидии B. cinerea, гидролитическими ферментами, синтезируемыми грибной культурой.
Рис. 4.
Рост B. cinerea на агаризованной среде с различной концентрацией производного хитозана Х13/98 при инкубации в течение 168 ч.

Из полученных результатов также следовало, что эффект от действия производного хитозана КХ20/98 приблизительно в два раза выше (рис. 3, вариант II) чем от не модифицированного хитозана Х20/98 (рис. 3, вариант I), однако для обоих производных ИП конидий был значительно выше 50% (в интервале изученых концентраций). Самым эффективным производным, проявившим максимальную ингибирующую активность, оказался хитозан с ММ 13 и СД 98% в концентрации 0.938 мг/мл, что согласовывалось с результатами предыдущего эксперимента. В связи с этим в дальнейшем изучали хитозан Х13/98.
Противогрибную активность хитозана Х13/98 по отношению к B. cinerea оценивали in vitro по скорости роста мицелия. Диапазон изученных концентраций хитозана составил 0.234–1.875 мг/мл. На 168 ч роста культуры B. сinerea, когда в контрольном варианте мицелий гриба достигал краев чашки Петри, противогрибная активность оказалась ниже 50% при концентрации хитозана в агаризованной среде, 1.875 и 0.938 мг/мл (рис. 4).
Рис. 5.
Изменение метаболической активности гриба B. cinerea при обработке хитозаном, а также под вздействием ионов Са2+ и Сu2+: а − I – контроль Х13/98, II – комплекс Х13/98 с Са2+ (300 м.д.), III – Са2+(300 м.д.), IV – комплекс Х13/98 с Сu2+ (300 м.д.), V – Сu2+(300 м.д.); б − I – контроль (Х13/98), II – комплекс Х13/98 с Са2+ (150 м.д.), III – Са2+(150 м.д.), IV – комплекс Х13/98 с Сu2+: 1 – 75, 2 – 150, 3 – 300 м.д.; V – Сu2+: 1 – 75, 2 – 150, 3 – 300 м.д.
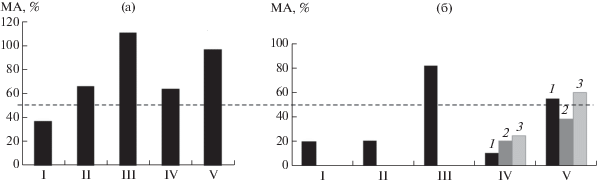
Рис. 6.
Изменение противогрибной активности во времени при различных концентрациях хитозана Х13/98 (мг/мл): 1 – 1.875, 2 – 0.938, 3 – 0.469, 4 – 0.234.
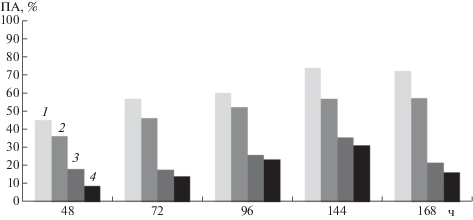
Ранее сообщалось, что неорганические соли оказывают влияние на рост мицелия B. cinerea [32]. Изучение влияния ионов Са2+ на B. cinerea показало, что соли кальция оказывали тормозящее действие (на 23%) на рост гриба (при концентрации 300 м.д.) [33]. В этих экспериментах были использованы растворы хитозана Х13/98 с ионами Са2+ и Сu2+ в концентрациях 150 и 300 м.д. Как видно на рис. 5а II, добавление в раствор Х13/98 (1.875 мг/мл) ионов Са2+ (300 м.д.) не увеличивало противогрибную активность, а метаболическая активность оказалась выше чем в контроле (рис. 5а I). Можно предположить, что это связано с появлением тонкодисперсной взвеси, уменьшающей прозрачность тестируемых растворов Х13/98 в присутствии ионов Са и Сu, и как следствие завышающей фиксируемую оптическую плотность. Похожий результат наблюдали при снижении концентрации ионов Са2+ (150 м.д.) в растворе Х13/98 (0.938 мг/мл) (рис. 5б II). Производное Х13/98, содержащее ионы меди (75, 150 и 300 м.д.) оказывало существенное противогрибное действие (рис. 5б IV), а величина метаболической активности по хитозану была в два раза ниже, чем в контрольном варианте. При увеличении концентрации ионов меди до 300 м.д. в растворе Х13/98 метаболическая активность практически не отличалась от величины, фиксируемой в контроле по хитозану (рис. 5б V). Следует отметить, что использование качестве контроля растворов, содержащих только ионы кальция или меди в концентрации 150 и 300 м.д., стимулировало рост B. сinerea (метаболическая активность более 50%) (рис. 5б).
В работе установлено, что показатели ИП зависели от времени инкубации культуры в присутствии производных хитозана. После 4 ч инкубации прорастание конидий ингибировали как хитозаны с ММ 60 кДа, так и ММ 2 и 13 кДа. Увеличение времени инкубации до 24 ч привело к тому, что значительное ингибирующее действие проявил только хитозан Х13/98 при концентрациях от 0.234 до 1.875 мг/мл. Было показано, что при использовании Х13/98 в комплексе с ионами меди наблюдался синергетический эффект. Так, через 7 сут роста при использовании in vitro Х13/98 в концентрации 1.875 мг/мл противогрибная активность составила 72.6% (рис. 6).
Таким образом, с помощью визуального изучения с помощью световой микроскопии, колориметрического метода анализа и определения скорости роста мицелия было установлено влияние основных характеристик низкомолекулярного хитозана на рост B. сinerea. Для хитозанов с ММ 2–13 кДа, СД 85–98% и полидисперсностью 2–2.5 регистрировали ИП конидий менее 50% при концентрации 0.117–1.875 мг/мл. Метаболическая активность гриба при действии хитозана ММ 13 кДа, СД 98% (0.938 мг/мл) и его комплекса с ионами меди (75 м.д.) соответствовала 20 и 11%. Это позволяет рекомендовать хитозан с ММ 13 кДа и СД 98% и его комплекс с ионами меди для использования в качестве перспективного противогрибного агента по отношению к B. cinerea.
Авторы выражают благодарность С.А. Лопатину (лаборатория инженерии биополимеров, Институт биоинженерии ФИЦ Биотехнологии РАН) за проведение высокоэффективной гель-проникающей хроматографии хитозанов.
Список литературы
Tan W., Li Q., Dong F., Wei L., Guo Z. // Int. J. Biol. Macromol. 2016. V. 92. P. 293-298.
Badawy M.E.I., Rabea E.I., Ismail R.I.A. // Curr. Bioact. Compd. 2015. V. 11. № 4. P. 264–273.
Abu Qamar S., Moustafa K., Tran L.-S.P. // Crit. Rev. Biotechnol. 2017. V. 37. № 2. P. 262–274.
Badawy M.E.I., Rabea E.I. // Int. J. Carbohydr. Chem. V. 2011, Article ID 460381, 29 pages https://doi.org/10.1155/ 2011/460381
Sharp R. // Agronomy. 2013. V. 3. № 4. P. 757–793.
Ghormade V., Pathan E.K., Deshpande M.V. // Int. J. Biol. Macromol. 2017. V. 104 (Pt B). P. 1415–1421.
Kean T., Thanou M. // Adv. Drug Deliv. Rev. 2010. V. 62. № 1. P. 3–11.
Katiyar D., Hemantaranjan A., Singh B., Bhanu A.N. // Adv. Plants Agric. Res. 2014. V. 1. № 1. P. 1–8.
Yang L.-Y., Zhang J.-L., Bassett C.L., Meng X.-H. // LWT – Food Sci. Technol. 2012. V. 46. № 1. P. 254–259.
Seyfarth F., Schliemann S., Elsner P., Hipler U.-C. // Int. J. Pharm. 2008. V. 353. № 1–2. P. 139–148.
Yoonkyung P., Kim M.-H., Park S.-C., Cheong H., Jang M.-K., Nah J.-W., Hahm K.-S. // J. Microbiol. Biotechnol. 2008. V. 18. № 10. P. 1729–1734.
Badawy M.E.I., Rabea E.I. // Biol.Technol. 2009. V. 51. № 1. P. 110–117.
Rahman M.H., Hjeljord L.G., Aam B.B., Sørlie M., Tronsmo A. // Eur. J. Plant Pathol. 2015. V. 141. № 1. P. 147–158.
Лялина Т.С., Терешина В.М., Варламов В.П. // Известия Уфимского научного центра РАН. 2017. № 3(1). С. 110–113.
Aranaz I., Mengíbar M., Harris R., Paños I., Miralles B., Acosta N., Galed G., Heras Á. // Curr. Chem. Biol. 2009. V. 3. № 2. P. 203–230.
Badawy M.E.I. // J. Appl. Polym. Sci. 2010. V. 117. № 2. P. 960–969.
Falcón A.B., Cabrera J.C., Costales D., Ramírez M.A., Cabrera G., Toledo V., Martínez-Téllez M.A. // World J. Microbiol. Biotechnol. 2008. V. 24. № 1. P. 103–112.
Allan C.R., Hadwiger L.A. // Experimental Mycol. 1979. V. 3. № 3. P. 285–287.
Choi B.-K., Kim K.-Y., Yoo Y.-J., Oh S.-J., Choi J.-H., Kim C.-Y. // Int. J. Antimicrob. Agent. 2001. V. 18. № 6. P. 553–557.
Sadeghi A.M.M., Dorkoosh F.A., Avadi M.R., Saadat P., Rafiee-Tehrani M., Junginger H.E. // Int. J. Pharm. 2008. V. 355. № 1–2. P. 299–306.
Liu W., Qin Y., Liu S., Xing R., Yu H., Chen X., Li K., Li P. // Carbohydr. Polym. 2017. V. 160. № 7. P. 97–105.
Hudecova D., Varečka L., Vollek V., Betina V. // Folia Microbiol. 1994. V. 39. № 4. P. 269–275.
Шагдарова Б.Ц., Ильина А.В., Варламов В.П. // Прикл. биохимия и микробиология 2016. Т. 52. № 2. С. 237–241.
Шагдарова Б.Ц., Ильина А.В., Лопатин С.А., Карташов М.И., Арсланова Л.Р., Джавахия В.Г., Варламов В.П. // Прикл. биохимия и микробиология. 2018. Т. 54. № 1. С. 68–73.
Хасанова Л.М., Ильина А.В., Варламов В.П., Синицына О.А., Синицын А.П. // Прикл. биохимия и микробиология. 2014. Т. 50. № 4. С. 422–428.
Ильина А.В., Варламов В.П. // Прикл. биохимия и микробиология. 2004. Т. 40. № 6. С. 688–692.
Park Y., Kim M.-H., Park S.-C., Cheong H., Jang M.-K., Nah J.-W., Hahm K.-S. // J. Microbiol. Biotechnol. 2008. V. 18. № 10. P. 1729–1734.
Qiu M., Wu C., Ren G., Liang X., Wang X., Huang J. // Food Chem. 2014. V. 155. P. 105–111.
Куликов С.Н., Чирков С.Н., Ильина А.В., Лопатин С.А., Варламов В.П. // Прикл. биохимия и микробиология. 2006. Т. 42. № 2. С. 224–228.
Guo Z., Xing R., Liu S., Zhong Z., Ji X., Wang L., Li P. // Carbohydr. Polym. 2008. V. 71. P. 694–697.
Yevlampieva N.P., Gubarev A.S., Gorshkova M.Yu., Okrugin B.M., Ryumtsev E.I. // J. Polym. Res. 2015. V. 22. P. 166.
Yoon C.S., Yeoung Y.R., Kim B.S. // Kor. J. Hort. Sci. Technol. 2010. V. 28. № 6. P. 1072–1077.
Boumaaza B., Benkhelifa M., Belkhoudja M. // Int. J. Microbiol. V. 2015. Article ID 572626, http://dx.doi.org/https://doi.org/ 10.1155/2015/572626
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


