Прикладная биохимия и микробиология, 2020, T. 56, № 1, стр. 76-89
Влияние состава питательного субстрата и продолжительности культивирования на продуктивность, биологическую активность и хроматографические профили экстрактов Stagonospora cirsii S-47
А. О. Берестецкий 1, *, М. Ю. Белозерова 1, Д. С. Прокофьева 2
1 Всероссийский научно-исследовательский институт защиты растений
196608 С.-Петербург, Россия
2 Научно-исследовательский институт гигиены, профпатологии и экологии человека ФМБА России
188663 Ленинградская обл., п., Кузьмоловский, Россия
* E-mail: aberestetskiy@vizr.spb.ru
Поступила в редакцию 27.02.2019
После доработки 01.08.2019
Принята к публикации 30.08.2019
Аннотация
Для определения токсигенного потенциала микогербицида на основе гриба Stagonospora cirsii S-47 исследовали влияние состава твердых и жидких питательных субстратов на выход экстрактивных веществ (ВЭВ) из культур этого микромицета, а также спектр биологической активности и хроматографические профили полученных экстрактов. Максимальный ВЭВ из культурального фильтрата (около 250 мг/л) был получен через 2 нед. культивирования S. cirsii S-47 на жидкой питательной среде с соевой мукой. Такое же время инкубации было необходимо для получения максимального ВЭВ (около 1.5 г/кг) при культивировании гриба на перловой крупе. Экстракты из культуральных фильтратов проявляли более широкий спектр биологической активности, по сравнению с экстрактами из твердофазных культур S. cirsii S-47. Максимальная фитотоксическая и антибиотическая активность обнаружена у экстракта (экстрагент – хлористый метилен) трехнедельной культуры гриба на жидкой модифицированной среде Чапека, в таком же экстракте двухнедельной культуры обнаружена антиэстеразная активность. Цитотоксическую активность в отношении линии опухолевых клеток линии U251 проявлял экстракт (экстрагент этилацетат) из культурального фильтрата трехнедельной культуры гриба на жидкой среде ДМГ. Способ культивирования, а также состав питательной среды оказывали существенное влияние на набор продуцируемых грибом метаболитов.
Биологические и биорациональные гербициды – это препараты для борьбы с сорными растениями на основе соответственно фитопатогенных микроорганизмов и их метаболитов. Токсикологические аспекты их применения, в том числе, селективность гербицидного действия, спектр биологической активности, экологическая безопасность, еще недостаточно изучены [1]. При этом хорошо известно, что многие фитопатогенные грибы являются продуцентами фитотоксинов и микотоксинов, которые могут обладать как широким, так и узким спектром биологической активности [2].
В настоящее время известны грибы родов Fusarium и Myrothecium, патогенные для сорных растений, экстракты которых обладают гербицидной активностью, однако их применение еще весьма ограничено. Это связано с возможностью образования этими микромицетами микотоксинов, таких как трихотецены, которые могут нанести вред окружающей среде [3–8]. Однако, например, очищенный экстракт из культуральной жидкости Ascochyta caulina − потенциального микогербицида против мари белой, содержащий три полярных фитотоксина, обладал меньшей общей токсичностью в отношении рыб, водорослей, земляных червей, чем стандартные химические гербициды. В то же время высокочувствительной к нему оказалась дафния (Daphnia magna) на уровне 3 класса острой токсичности и 2 класса – хронической [9]. Эльсинохром A – основной токсический компонент экстрактов из культур патогена вьюнка полевого гриба Stagonospora convolvuli, обладал значительными антимикробными и цитотоксическими свойствами, однако не обнаруживался в обработанных микогербицидом растениях [10–12]. Аналогичные исследования проводятся и в отношении продуцентов микоинсектицидов и их метаболитов [13, 14].
Эти и многие другие работы не учитывают, что в изменяющихся условиях культивирования или в природе микроорганизмы–продуценты биопестицидов могут образовывать не только анализируемые в лабораторных условиях, но и совершенно иные метаболиты [15]. С целью выявления новых метаболитов микроорганизмов и уточнения их токсичности возможно использование подхода “один штамм – много метаболитов”. Он основан на том, что с помощью изменения состава среды и способа культивирования можно существенно влиять на образование вторичных метаболитов грибов и получать из одного продуцента различные по структуре и свойствам соединения. Примером может служить гриб Ascochyta agropyrina var. nana, который при выращивании на перловой крупе образовывал папирацилловую кислоту [16], а на жидкой среде – другие фитотоксины – агропиренол и агропиренал [17]. Дрожжевой экстракт, который входит в состав многих жидких питательных сред, полученный от различных производителей, оказывал существенное влияние на количественный и качественный состав метаболитов, образуемых некоторыми штаммами грибов рода Fusarium [18]. На твердых субстратах изменения в составе токсинов Fusarium spp. были не столь значительными [19].
В качестве потенциального продуцента микогербицида интересен гриб Stagonospora cirsii. Штамм VIZR 1.42 этого гриба был изолирован из листьев бодяка полевого (Cirsium arvense) и предложен для биологической борьбы с этим сорняком [20]. Заявлен способ его применения в виде измельченного глубинного мицелия совместно с гербицидом глифосат, что позволяет значительно снизить норму расхода последнего для эффективного уничтожения бодяка [21]. Из больных листьев осота полевого (Sonchus arvensis), который наряду с бодяком полевым является широко распространенным и трудноискоренимым многолетним сорным растением, собранных в различных регионах Российской Федерации, были выделены несколько новых изолятов S. cirsii [22].
Гриб Stagonospora cirsii J.J. Davis, штамм С-163 (VIZR 1.41), выделенный из больных листьев бодяка полевого, оказался продуцентом биологически активных веществ (БАВ) из группы 10-членных макролидов (ноненолидов). Из культурального фильтрата этого гриба был выделен фитотоксин стагонолид А, который в концентрации ~1.0 мМ вызывает некрозы на листьях различных растений и достоверно ингибирует рост корешков проростков бодяка и салата в концентрации ~1.0 мкМ [23]. Этот токсин проявлял антимикробную активность в отношении Candida tropicalis, Bacillus subtilis и Escherichia coli при концентрации 100 мкг/диск. Структурно близок к нему гербарумин I, который выявлен у Phoma herbarum и был синтезирован из стагонолида А восстановлением карбонильной группы [23]. Этот фитотоксин ингибировал рост корешков Amaranthus hypochondriacus в микромолярных концентрациях (ИК50 = 50 мкМ) [24]. Из твердофазной культуры S. cirsii C-163 на пшене были выделены стагонолиды B–H и модиолид А [25, 26]. Из них фитотоксическими свойствами обладали стагонолид Н и модиолид А, которые вызывали некрозы на листьях бодяка в минимальной концентрации ~1.0 мМ и 10 мМ соответственно. При этом было показано, что стагонолид Н (из других грибов был выделен как курвулид B1/B2) не проявлял ни антимикробной, ни цитотоксической активности [27, 28]. Модиолид А, выделенный из твердофазной культуры S. cirsii С-163 и некоторых других грибов, демонстрировал антимикробную активность в отношении Micrococcus luteus и Neurospora crassa в минимальной ингибирующей концентрации около 15–30 мкг/мл [29], а также Bacillus cereus, Listeria monocytogenes, Pseudomonas aeroginosa при 3-12 мкг/мл [30]. Однако в других тестах некоторые мицелиальные грибы и виды бактерий, устойчивых к антибиотикам, были к нему нечувствительными [27, 31]. Синтетический стагонолид F обладал умеренной цитотоксичностью на линиях клеток THP-1 and U-937 (ИК50 около 35 мкг/мл) и слабыми антимикробными свойствами [32]. Цитотокcичность гербарумина I не изучена, однако его региомер обладал слабой цитотоксической и антимикробной активностью [33]. Наряду со многими другими соединениями из группы ноненолидов все перечисленные выше метаболиты, образуемые S. cirsii, к настоящему моменту синтезированы [34, 35].
В представленной работе мы использовали штамм S-47 S. cirsii, выделенный из листьев осота полевого. С целью изучения токсигенного потенциала этого гриба проведена оценка фитотоксической, антимикробной, цитотоксической и антиэстеразной активности его экстрактов в зависимости от состава питательных сред, способа и сроков культивирования.
МЕТОДИКА
Штамм гриба и его культивирование. В работе был использовали штамм S-47 S. cirsii, выделенный из осота полевого (Sonchus arvensis), собранного на юго-востоке Алтайского края. Штамм хранится в коллекции Лаборатории фитотоксикологии и биотехнологии Всероссийского научно-исследовательского института защиты растений.
В качестве посевного материала использовали двухнедельную культуру гриба, полученную на стандартной агаризованной картофельно-сахарозной среде.
Для жидкофазного культивирования гриба использовали три жидкие среды (г/л): СС (сахароза – 60, соевая мука – 15, Mg2SO4 ∙ 7H2O – 0.5, KH2PO4 – 1.0, дрожжевой экстракт – 1.0; модифицированная среда Чапека с витаминами (ЧАВ, сахароза – 45, NaNO3 – 3, KH2PO4 – 1.0, MgSO4 ∙ · 7H2O – 0.5, KCl – 0.5, FeSO4 ∙ 7H2O – 0.01, тиамин – 100 мкг, биотин – 5.0 мкг); ДМГ (дрожжевой экстракт – 4; мальтозный экстракт – 10; глюкоза – 10), рН доводили до 6.0. В конические колбы на 500 мл вносили по 100 мл жидкой питательной среды.
Для твердофазного культивирования готовили субстраты на основе перловой, пшенной и рисовой круп. В конические колбы на 100 мл вносили 15 г крупы и 10 мл водопроводной воды, перемешивали и стерилизовали автоклавированием при 121°С в течение 15 мин. После охлаждения субстрата колбы встряхивали для предотвращения его слипания.
Инокуляцию жидких и твердых субстратов проводили двумя агаровыми блоками, вырезанными из края колонии посевной культуры гриба. S. cirsii выращивали в течение 3 нед. при 24°С. Колбы с твердыми субстратами встряхивали каждые 2 дня, чтобы избежать их комкования.
Получение экстрактов. Метаболиты S. cirsii извлекали из культурального фильтрата (100 мл) последовательной экстракцией хлористым метиленом и этилацетатом (двумя порциями по 75 мл). Экстракты обезвоживали фильтрованием через безводный сернокислый натрий. Растворители отгоняли на ротационном испарителя при 40°С, сухой остаток объединенных экстрактов взвешивали.
Экстракцию метаболитов из твердофазных культур S. cirsii на зерновых субстратах проводили в два этапа. Высушенный биоматериал (5 г) измельчали в лабораторной мельнице, заливали 100 мл 50%-ного водного ацетона и обрабатывали ультразвуком 5 мин. Полученный экстракт фильтровали в испарительную колбу, после чего повторяли извлечение грибных метаболитов. Из объединенных экстрактов отгоняли ацетон, после чего метаболиты переэкстрагировали вновь последовательно n-гексаном (как стадия обезжиривания), хлористым метиленом и этилацетатом (каждым двумя порциями по 75 мл).
Оценка биологической активности. Для исследования фитотоксичности экстрактов использовали хорошо развитые листья осота полевого Sonchus arvensis (осот полевой, сем. Asteraceae) и Elytrigia repens (пырей ползучий, сем. Poaceae). Для оценки фитотоксической активности исследуемый образец сначала растворяли в небольшом количестве этанола и доводили до необходимой концентрации дистиллированной водой, чтобы содержание этанола в растворе составляло 5%. Фитотоксичность 0.5%-ных экстрактов определяли методом листовых дисков [36]. Из листьев 3–5-недельных растений осота пробочным сверлом вырезали диски 1 см в диаметре; листья пырея нарезали на отрезки длиной около 2 см. Высечки и отрезки листьев растений помещали во влажную камеру. Каждую высечку в центре надкалывали острой препаровальной иглой, в область накола наносили 10 мкл исследуемого раствора. Определение диаметра некрозов для осота и длину некроза для пырея проводили через 48 ч инкубации при температуре 24°С и переменном искусственном освещении по 12 ч в день.
Антибиотическую активность полученных экстрактов в концентрации 500 мкг/диск оценивали на 3 тест-микроорганизмах (Escherichia coli; Bacillis subtilis и Candida tropicalis) методом бумажных дисков.
Для оценки цитотоксической активности экстрактов использовали клеточные линии аденокарциномы легких человека A549 и глиобластомы человека U251. Время экспозиции клеток с растворами экстрактов составляло 48 ч. Количества общего белка в лунках с клетками в качестве показателя прироста клеточной массы после воздействия исследуемых экстрактов определяли методом окраски с сульфородамином Б в соответствии с протоколом производителя (TOX6, “Sigma”, США) [14].
Оценку ингибирующего действия экстрактов по отношению к карбоксилэстеразе (КЭ) и бутирилхолинэстеразе (БХЭ) проводили как описано в работе [14] с незначительными модификациями [37, 38].
Хроматографический анализ экстрактов. Для анализа экстрактов методом тонкослойной хроматографии сухой остаток растворяли в ацетоне до концентрации 10 мг/мл. На линию старта пластин для ТСХ (TLC Silica gel 60 F254, “Merсk”, Германия) наносили 5 мкл экстракта. Элюирование экстрактов проводили в системе растворителей гексан–этилацетат 1 : 1 (об./об.). Хроматограммы визуализировали при 254 нм и обработкой реагентом (анисовый альдегид–серная кислота–этанол 5 : 5 : 95, масса/об./об.) с последующим нагревом при температуре 120°С в течение нескольких минут до проявления полос. Учитывали хроматографическую подвижность полос и их цвет.
Для анализа экстрактов методом ВЭЖХ сухой остаток растворяли в ацетонитриле до концентрации 5 мг/мл. Разделение экстрактов производили на колонке Acquity UPLC BEH C18 2.1 × 50 мм с размером частиц 1.7 µм с помощью хроматографической системы Acquity UPLC H-Class (“Waters”, США), снабженной диодно-матричным детектором (СВЭЖХ/ДМД). Объем вводимой пробы составлял 2 мкл. Элюирование экстрактов осуществляли при скорости потока элюента 300 мкл/мин и температуре колонки 40°С в системе ацетонитрил–0.1%-ная муравьиная кислота в градиентном режиме: от 10 до 100% ацетонитрила в течение 5 мин, затем 2 мин – 100% ацетонитрила. Детектирование веществ производили сканированием в диапазоне 190–600 нм при помощи функции MaxPlot программы Empower (“Waters”, США). Учитывали время удерживания и УФ-спектр мажорных соединений (уровень поглощения не менее 0.2). В этих условиях время удерживания (tR) стандартов составляло: 1.7 и 1.8 мин (стагонолид Н = курвулид B1/B2, λмакс < < 200 нм), 3.1 мин (гербарумин I, λмакс < 200 нм), 3.3 мин (стагонолид А, λмакс 234 нм). Варьирование tR в ходе экспериментов не превышало 5%. Указанные вещества были получены из культуры S. cirsii C-163, их структура подтверждена спектральными данными: 1Н и 13С-ЯМР-, УФ-спектроскопия и масс-спектрометрия [23–26].
Статистический анализ. Эксперименты проведены в 3–6 повторностях. Дисперсионный анализ данных проводили с помощью программы Statistica 8. Средние значения сравнивали на основании критерия наименьшей существенной разницы НСР при р = 0.05 [39]. Кластерный анализ методом попарного внутригруппового невзвешенного среднего (UPGMA) проведен с целью сравнения различий экстрактов по хроматографическим профилям на базе матрицы, построенной на основе наличия или отсутствия метаболитов (следовые их количества не учитывали) с определенным временем удерживания и УФ-спектром.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Продуктивность. Дисперсионный анализ полученных результатов показал, что различные крупы, входящие в состав твердого питательного субстрата, и сроки культивирования не оказывали существенного влияния (при р = 0.05) на выход экстрактивных веществ (ВЭВ) из твердофазных культур S. cirsii S-47. Не было существенным и взаимодействие этих факторов. Выбор экстрагента и его взаимодействия с вышеуказанными факторами были достоверными на уровне р < 0.01. Максимальный ВЭВ был достигнут при экстракции метаболитов гексаном из культуры S. cirsii S-47 на пшене (выход ~850 мг/кг), а также хлористым метиленом (выход 620–650 мг/кг) и из двухнедельных культур гриба независимо от состава твердого питательного субстрата (табл. 1). Максимальный суммарный ВЭВ (1.5 г/кг) был получен в результате последовательной экстракции грибных метаболитов тремя растворителями различной полярности из двухнедельной культуры S. cirsii на перловой крупе (табл. 1).
Таблица 1.
Продуктивность и биологическая активность экстрактов из твердофазных культур S. cirsii S-47
| Субстрат | Время, нед |
Экстрагент1 | Выход экстрактивных веществ, мг/кг 2 | Фитотоксическая активность | Антимикробная активность5 | Цитотоксическая активность6 | Антиэстеразная активность7 | ТСХ8 | |||
|---|---|---|---|---|---|---|---|---|---|---|---|
| осот3 | пырей4 | E. coli | B. subtilis | А549 | U251 | ||||||
| Пшенная крупа | 2 | Гексан | 280 | 3.7 | 0 | 0 | 5 | 59 | 45 | 14 | 13 |
| Хлористый метилен | 619 | 1.5 | 0 | 1 | 6 | 70 | 82 | 13 | 14 | ||
| Этилацетат | 475 | 3.5 | 1.3 | 1 | 6 | 82 | 92 | 21 | 15 | ||
| 3 | Гексан | 891 | 3.8 | 0.9 | 0 | 0 | 80 | 79 | 25 | 16 | |
| Хлористый метилен | 294 | 2.8 | 2.1 | 0 | 4 | 74 | 93 | 25 | 17 | ||
| Этилацетат | 93 | 1.1 | 0 | 0 | 4 | 91 | 95 | 23 | 18 | ||
| Рисовая крупа | 2 | Гексан | 381 | 2.7 | 0.8 | 0 | 0 | 93 | 78 | 17 | 1 |
| Хлористый метилен | 622 | 1.8 | 0 | 0 | 5 | 78 | 95 | 21 | 2 | ||
| Этилацетат | 181 | 2.8 | 0 | 0 | 4 | 92 | 93 | 28 | 3 | ||
| 3 | Гексан | 362 | 1.8 | 1 | 0 | 1 | 36 | 10 | 21 | 4 | |
| Хлористый метилен | 410 | 2.6 | 0 | 0 | 2 | 85 | 82 | 19 | 5 | ||
| Этилацетат | 199 | 1.6 | 1 | 0 | 3 | 92 | 89 | 28 | 6 | ||
| Перловая крупа | 2 | Гексан | 521 | 3 | 0.8 | 0 | 3 | 89 | 82 | 16 | 7 |
| Хлористый метилен | 665 | 1 | 0 | 0 | 6 | 93 | 102 | 32 | 8 | ||
| Этилацетат | 315 | 1.8 | 0 | 0 | 6 | 90 | 107 | 27 | 9 | ||
| 3 | Гексан | 281 | 1.4 | 0 | 0 | 0 | 98 | 92 | 24 | 10 | |
| Хлористый метилен | 263 | 1.5 | 0.9 | 0 | 0 | 96 | 82 | 21 | 11 | ||
| Этилацетат | 335 | 1.7 | 0 | 0 | 0 | 92 | 102 | 23 | 12 | ||
Примечание. 1 – последовательная экстракция тремя растворителями; 2 – мг/кг сухого субстрата, НСР0.05 = 190; 3 – диаметр некроза, мм, НСР0.05 = 1.4; 4 – длина некроза, мм, НСР0.05 = 0.8; 5 – зона лизиса, мм; 6 – концентрация белка в лунках с клетками, % к контролю; 7 – ингибирование карбоксилэстеразы, % к контролю; 8 – дорожка на ТСХ-хроматограмме (рис. 1).
Состав жидкой питательной среды и сроки культивирования оказывали существенное влияние (р < 0.001) на выход биомассы S. cirsii S-47, который варьировал от 1.7 до 25 г/л. Наиболее благоприятной для роста мицелия была среда СС: через 2 нед. культивирования наблюдали максимальный для эксперимента выход биомассы. Через 1 нед. культивирования гриба на среде СС дальнейшего прироста биомассы не наблюдали. При росте S. cirsii S-47 на средах ДМГ и ЧАВ рост биомассы гриба продолжался и на третьей неделе инкубации. Через 3 нед. культивирования выход мицелия гриба увеличивался в 3.6 раза на среде ДМГ и в 2.7 раза – на среде ЧАВ по сравнению со второй неделей (табл. 2).
Таблица 2.
Выход сухой биомассы S. cirsii S-47 в зависимости от состава питательной среды и сроков культивирования
| Субстрат | Сроки культивирования, нед |
Биомасса, г/л |
|---|---|---|
| ДМГ | 2 | 1.7а |
| 3 | 6.1б | |
| ЧАВ | 2 | 5.7б |
| 3 | 15.7в | |
| СС | 2 | 25.2г |
| 3 | 24.9г |
Состав жидкой питательной среды и экстрагент оказали существенное влияние (р < 0.001) на ВЭВ из культурального фильтрата S. cirsii S-47, тогда как влияние сроков культивирования на этот показатель не было достоверным (при р = 0.05). Без учета продолжительности культивирования и экстрагента средний ВЭВ из культур гриба на среде СС был в 2 раза выше, чем на среде ДМГ и в 6 раз выше, чем на среде ЧАВ. При последовательной экстракции грибных метаболитов из культурального фильтрата S. cirsii S-47 растворителями различной полярности при использовании хлористого метилена ВЭВ был существенно (примерно на 70%) выше, чем ВЭВ при использовании этилацетата. Наиболее продуктивной по ВЭВ оказалась двухнедельная культура гриба на среде СС: выход экстрактов (хлористый метилен) составил около 180 мг/л, этилацетатных – около 85 мг/л (табл. 3).
Таблица 3.
Продуктивность и биологическая активность экстрактов из культуральных фильтратов S. cirsii S-47, полученных при разном времени выращивания
| Суб-страт | Вре-мя, нед |
Экстрагент1 | Выход экстрактивных веществ, мг/л2 | Фитотоксическая активность | Антимикробная активность5 | Цитотоксическая активность6 | Антиэстеразная активность | ТСХ9 | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| осот3 | пырей4 | E. coli | B. subtilis | А549 | U251 | КЭ7 | БХЭ8 | |||||
| ДМГ | 2 | Хлористый метилен | 82.7 | 4.0 | 2.2 | 6 | 8 | 77 | 47 | 12 | 52 | 19 |
| Этилацетат | 50.0 | 2.0 | 1.4 | 2 | 6 | 88 | 98 | 28 | 94 | 20 | ||
| 3 | Хлористый метилен | 56.8 | 3.2 | 3.2 | 6 | 11 | 78 | 55 | 20 | 85 | 21 | |
| Этилацетат | 33.1 | 2.6 | 3.1 | 3 | 9 | 41 | 18 | 19 | 74 | 22 | ||
| ЧАВ | 2 | Хлористый метилен | 32.4 | 2.3 | 2.0 | 5 | 10 | 93 | 49 | 9 | 47 | 27 |
| Этилацетат | 17.0 | 3.7 | 2.1 | 8 | 11 | н/о10 | н/о | н/о | н/о | 28 | ||
| 3 | Хлористый метилен | 27.6 | 6.9 | 5.6 | 11 | 16 | н/о | н/о | н/о | н/о | 29 | |
| Этилацетат | 20.7 | 2.8 | 2.2 | 0 | 5 | н/о | н/о | н/о | н/о | 30 | ||
| СС | 2 | Хлористый метилен | 199.4 | 2.5 | 0 | 11 | 15 | 63 | 67 | 30 | 95 | 23 |
| Этилацетат | 94.7 | 3.3 | 0 | 5 | 11 | 88 | 25 | 23 | 91 | 24 | ||
| 3 | Хлористый метилен | 174.4 | 2.0 | 0 | 6 | 7 | 65 | 26 | 22 | 87 | 25 | |
| Этилацетат | 84.2 | 2.3 | 0 | 3 | 6 | 48 | 22 | 21 | 87 | 26 | ||
Примечание: 1 – последовательная экстракция двумя растворителями; 2 – НСР0.05 = 31; 3 – диаметр некроза, мм, НСР0.05 = 1.5; 4 – длина некроза, мм, НСР0.05 = = 1.4; 5 – зона лизиса, мм; 6 – концентрация белка в лунках с клетками, % к контролю; 7 – ингибирование карбоксилэстеразы, % к контролю; 8 – ингибирование бутирилхолинэстеразы, % к контролю; 9 – дорожка на ТСХ-хроматограмме (рис. 1); 10 – н/о – не определяли.
Биологическая активность экстрактов. Фитотоксическая активность.. Состав твердого питательного субстрата оказал существенное влияние (p < 0.01) на фитотоксическую активность экстрактов из культур S. cirsii S-47 в отношении пырея и осота: вне зависимости от сроков культивирования и экстрагента экстракты из культур гриба на пшене были в 1.5–2 раза токсичнее, чем экстракты из культур на перловой крупе. Различия в фитотоксичности экстрактов из культур S. cirsii S-47, полученных на пшенной и рисовой крупах, были несущественными на уровне р = 0.05. Листья осота были наиболее чувствительными к гексановым экстрактам из двухнедельных культур S. cirsii S-47 на пшене, листья пырея – к хлористометиленовым экстрактам из трехнедельных культур гриба.
Важно отметить, что гексановые экстракты из культуры гриба на пшене вне зависимости от сроков культивирования, а также этилацетатный экстракт из двухнедельной культуры на пшене имели относительно высокую (диаметр некроза на листовых высечках 3.5–4 мм) и селективную фитотоксическую активность в отношении осота (табл. 1). Несколько меньшую фитотоксичность (диаметр некроза 2.5–3 мм) для листьев осота проявили двухнедельные гексановые экстракты из культуры на рисе и перловой крупе, хлористометиленовые экстракты из трехнедельных культур, полученных на пшене и рисе, этилацетатный экстракт из 2-недельной культуры на рисе. Остальные экстракты были фитотоксичны на уровне контроля или достоверно не отличались от него (табл. 1).
Отмечено достоверное влияние (p < 0.01) состава жидкой питательной среды на фитотоксичность экстрактов из культурального фильтрата S. cirsii S-47 в отношении обоих тестируемых растений. Время культивирования гриба не оказывало существенного влияния на токсичность экстрактов в отношении осота (при p = 0.05), тогда как различия в чувствительности пырея к экстрактам жидких культур гриба, полученных в различное время культивирования, были достоверными (на уровне р < 0.01) вне зависимости от экстрагента. Хлористометиленовые экстракты были достоверно более токсичными для осота, чем этилацетатные (на уровне р < 0.05).
Максимальную неселективную фитотоксическую активность (диаметр некрозов около 7 мм на высечках из листьев осота, длина некрозов на отрезках листьев пырея – около 5 мм) проявил экстракт (полученный хлористым метиленом) из трехнедельного культурального фильтрата гриба, выращенного на среде ЧАВ. Фитотоксичность аналогичного экстракта из двухнедельных культур была примерно в 3 раза ниже (табл. 3).
Фитотоксическая активность комплексов экзометаболитов, образующихся при культивировании гриба на среде ДМГ, была в целом ниже, чем при выращивании на среде ЧАВ. Относительно высокую неселективную фитотоксичность (диаметр/длина некрозов более 3 мм) показали хлористометиленовые экстракты из двухнедельной и трехнедельной культур S. cirsii S-47. Экстракты, полученные с помощью этилацетата, были менее фитотоксичны, чем хлористометиленовые (табл. 3).
Относительно невысокую, но специфичную в отношении осота фитотоксическую активность (диаметр некроза 2–3.5 мм) выявили у экстрактов, полученных из фильтрата культур S. cirsii на среде СС. У экстрактов из двухнедельного культурального фильтрата гриба она была выше, чем у экстрактов из трехнедельного фильтрата. При этом, этилацетатные экстракты были более фитотоксичными, чем хлористометиленовые (табл. 3).
Антимикробная активность экстрактов. Escherichia coli и Candida tropicalis оказались нечувствительными к экстрактам S. cirsii S-47, выращенного на твердых средах. Заметная антибиотическая активность экстрактов гриба проявлялась только в отношении Bacillus subtilis. Вне зависимости от зернового субстрата экстракты из 2-недельных культур гриба подавляли рост B. subtilis сильнее, чем экстракты из 3-недельных культур. Уровень активности хлористометиленовых и этилацетатных экстрактов в отношении этой бактерии был примерно одинаковым и превышал антибиотическую активность гексановых экстрактов.
Максимальную антибиотическую активность в отношении B. subtilis (зона лизиса 5–6 мм при концентрации экстрактов 500 мкг/диск) показали экстракты из двухнедельных культур гриба на пшенной и перловой крупах. Несколько пониженным уровнем антибиотической активности обладали экстракты, полученные из двухнедельной культуры гриба рисовой крупе (табл. 1).
Рост тест-бактерий E. coli и B. subtilis был достоверно подавлен экзометаболитами S. cirsii S-47 из культурального фильтрата, тогда как дрожжевой гриб C. tropicalis был чувствительным лишь отдельным экстрактам. При культивировании гриба на жидких средах ДМГ и ЧАВ максимальная антимикробная активность экстрактов из культурального фильтрата проявлялась через 3 нед. культивирования, на более богатой по составу среде СС – через 2 нед.
Максимальную антибиотическую активность (зона лизиса колоний B. subtilis ~ 15 мм, E. сoli ~ 11 мм при концентрации экстрактов 500 мкг/диск) наблюдали у экстрактов, полученных с использованием хлористого метилена, из фильтрата двухнедельной культуры S. cirsii S-47 на среде СС и трехнедельного фильтрата культуры гриба, полученной на жидкой среде ЧАВ. Примерно на 30% ниже антимикробная активность в отношении изученных двух видов бактерий была у экстрактов, полученных с хлористым метиленом, из трехнедельной культуры гриба на среде ДМГ и двухнедельной – на среде ЧАВ, а также у этилацетатных экстрактов из двухнедельных культур на среде ЧАВ и СС (табл. 2).
Цитотоксическая активность. Большинство экстрактов из твердофазных культур S. cirsii S-47 проявляли слабую цитотоксическую активность: при концентрации экстрактов 100 мкг/мл ингибирование роста линий опухолевых клеток на уровне более 50% наблюдалось только при исследовании гексановых экстрактов из двухнедельной культуры гриба на пшеной крупе и трехнедельной – на рисовой. Причем, последний был заметно токсиченее как для клеток линии А549 (~3-кратное ингибирование роста), так и для U251 (10-кратное ингибирование пролиферации клеток по сравнению с контролем, табл. 1).
Значительное ингибирование роста обеих клеточных линий вызывали этилацетатные экстракты из трехнедельного фильтрата культур гриба на ДМГ и СС: рост клеток линии А549 подавлялся на уровне 41–48% от контроля, линии U251 – 18–22%. Клетки линии U251 были чувствительны (примерно 4-кратное ингибирование роста по сравнению с контролем) также к действию экстракта, полученного с использованием хлористого метилена, из двухнедельной культуры и этилацетатному экстракту из трехнедельной культуры гриба на СС. Примерно в 2 раза меньшую степень пролиферации клеток U251 по сравнению с контролем наблюдали при при воздействии экстракта двухнедельных культур S. cirsii S-47 на ДМГ и ЧАВ, полученного при использовании хлористого метилена (табл. 2).
Антиэстеразная активность. Все изученные экстракты, показали высокую ингибирующую активность (9–32% относительно контроля) в отношении КЭ, тогда как активность БХЭ сокращение на уровне более чем 50% подавлял лишь хлористометиленовый экстракт из двухнедельной культуры S. cirsii S-47 на среде ЧАВ. Максимальной ингибирующей активностью (активность снижалась более чем в 10 раз по сравнению с контролем) в отношении КЭ обладал такой же экстракт двухнедельной культуры гриба на ЧАВ (табл. 3).
Экстракты из твердофазных культур S. cirsii S-47, а также экстракты из фильтрата жидких культур гриба на среде СС проявили в целом селективную, но относительно невысокую токсичность в отношении осота (диаметр некроза 3–4 мм), тогда как экстракты из фильтрата культур на ДМГ и ЧАВ были высоко токсичными как для листьев осота, так и пырея (табл. 1, 3). Это предположительно связано с наличием и различным содержанием в них селективного фитотоксина стагонолида Н и неселективного – стагонолида А [23, 26].
Корреляции между фитотоксической и цитотоксической или антиэстеразной активностью экстрактов не обнаружили. Цитотоксичность ноненолидов, в том числе и выявленных у S. cirsii, изучена недостаточно. Как правило, они демонстрируют слабую токсичность для клеточных культур [34, 40]. Необходимо также отметить антиэстеразную активность экстрактов S. cirsii. Часто ее связывают с иммунносупрессивными свойствами, а также с потенциальной инсектицидной активностью. У метаболитов фитопатогенных грибов антиэстеразная активность изучена слабо. Известно лишь, что экстракты некоторых грибов из рода Alternaria способны ингибировать активность ацетилхолин- и бутирилхолинэстераз [41]. Ингибиторы этих ферментов могут быть использованы для лечения болезни Альцгеймера, увеличения стабильности лекарств и инсектицидов, подвергающихся быстрому расщеплению эстеразами [42‒44]. Ингибирующая активность ноненолидов в отношении этих ферментов не изучена. Известно, что гербарумин I обладал сильной ингибирующей способностью в отношении кальмодулин-зависимой фосфодиэстеразы цAMФ на уровне известного ингибитора кальмодулина – хлорпромазина [45].
Хроматографические профили экстрактов. Проявление хроматограмм, полученных при разделении экстрактов с помощью ТСХ в системе гексан–этилацетат 1 : 1, реагентом на основе серной кислоты позволило выявить значительно больше соединений (от 3 до 11), чем при их детектировании в УФ-свете при λ 254 нм (от 1 до 7). При этом, обнаружены заметные различия в качественном составе метаболитных комплексов, выделенных из жидких сред и зерновых субстратов (рис. 1). В экстрактах из твердофазных культур гриба превалировали алифатические соединения, не поглощающие или слабо поглощающие при λ 254 нм. В экстрактах гриба из фильтрата культуральной жидкости обнаруживались мажорные вещества с Rf 0.1, 0.25, 0.7 и 0.8 хорошо поглощающие УФ-свет
Рис. 1.
ТСХ-хроматограммы экстрактов из жидко- и твердофазной культур гриба S. cirsii S-47: а – проявление реагентом на основе серной кислоты и анисового альдегида, б – проявление УФ-светом при 254 нм. Описание “дорожек” (1–30) приведено в табл. 1 и 2. Стрелки указывают обсуждаемые в тексте мажорные полосы.
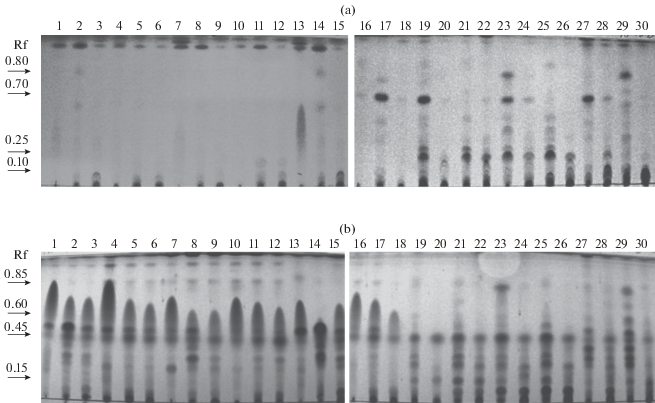
Соединение, проявляемое реагентом в виде синего пятна в диапазоне Rf от 0.5 до 0.75, наблюдали только в экстрактах из твердофазных культур гриба. Вещество с Rf 0.45, окрашенное реагентом в оливковый цвет, присутствовало в экстрактах из культур, полученных как на жидких, так и на твердых субстратах, тогда как соединение с Rf 0.5 – образовывалось грибом преимущественно на твердых субстратах. Полосы с Rf 0.25 и 0.30, окрашенные в оливковый, коричневый, красноватый цвет, обнаружены в хлористометиленовых экстрактах из твердофазных культур сред и из фильтрата культуры на среде ЧАВ. Вещество с Rf 0.15 (фиолетовая окраска реагентом) обнаружено в экстрактах из жидких культур. Более активное его образование наблюдалось при культивировании гриба на средах ДМГ и СС (рис. 1).
При проведении ВЭЖХ экстрактов из культур S. cirsii S-47 выявлено более 30 индивидуальных пиков, характеризующихся определенным временем удерживания и УФ-спектром. Максимальное количество мажорных метаболитов обнаружено в гексановом экстракте из двухнедельной культуры на пшене (14 пиков) и в этилацетатном экстракте из трехнедельной культуры гриба на среде ЧАВ (12 пиков). Типичные ВЭЖХ-хроматограммы экстрактов, проявивших заметную биологическую активность, представлены на рис. 3 и 4.
Рис. 2.
Дендрограмма различий в составе экстрактов S. cirsii S-47 в зависимости от питательного субстрата, продолжительности культивирования и экстрагента. Г – гексан, ХМ – хлористый метилен, ЭА – этилацетат; пш – пшено, рис – рисовая крупа, перл. – перловая крупа; 2, 3 – продолжительность культивирования, нед.
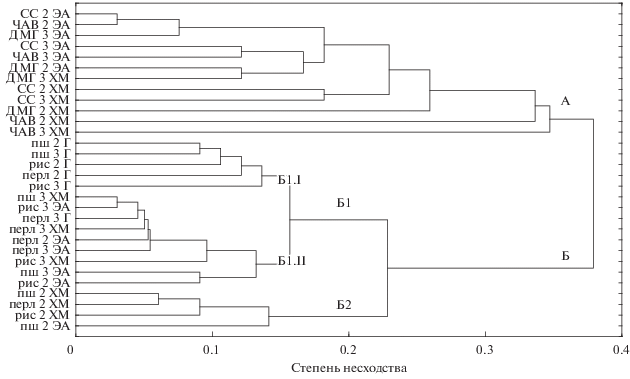
Рис. 3.
ВЭЖХ-хроматограммы экстрактов, полученных из трехнедельных твердофазных культур S. cirsii S-47: а – гексановый экстракт из культуры, выросшей на среде с пшеном; б – этилацетатный экстракт из той же культуры; в – гексановый экстракт из культуры на рисе. Пики с tR 4.8 и 5.2 мин - из растворителя. На врезках приведены УФ-спектры характерных мажорных метаболитов.
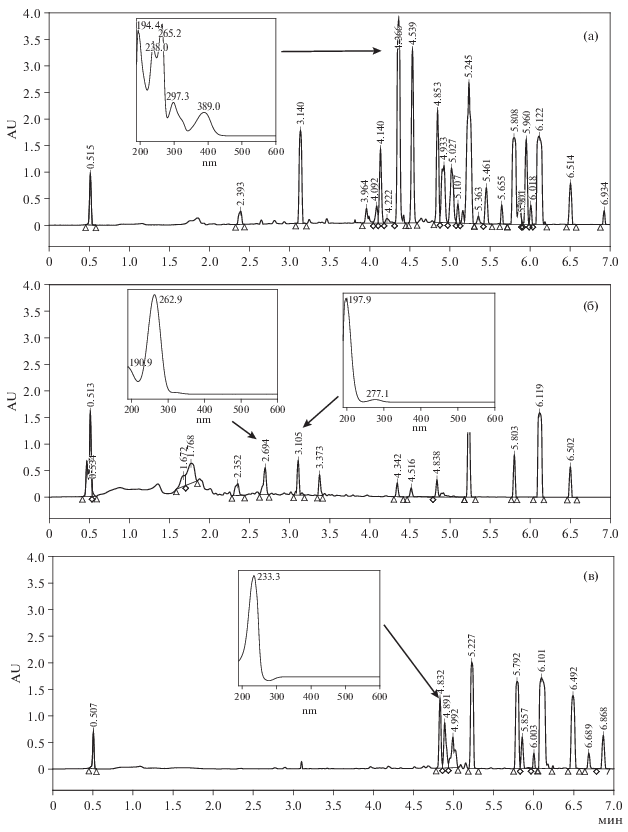
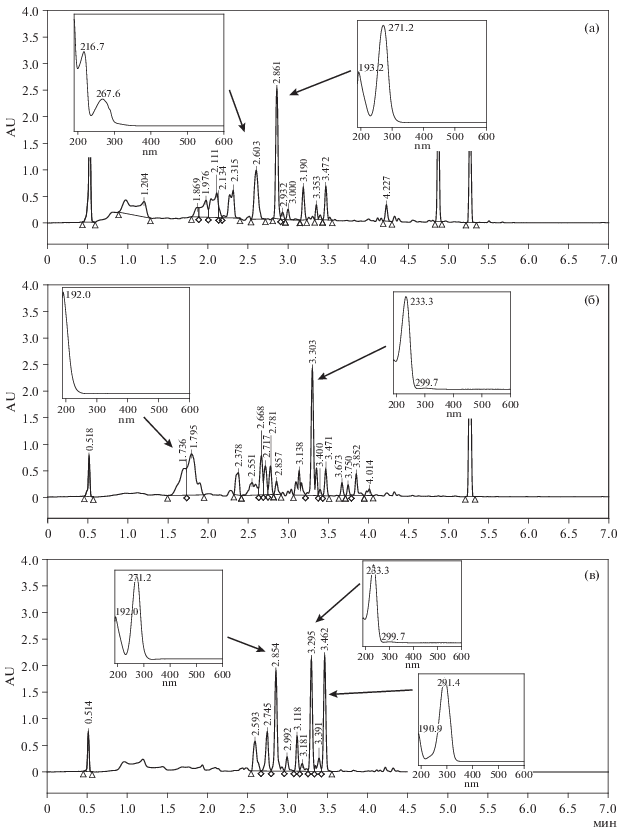
Рис. 4.
ВЭЖХ-хроматограммы экстрактов (хлористый метилен), полученных из культурального фильтрата S. cirsii S-47: а – экстракт из 2-недельной культуры на ДМГ; б – экстракт из 3-недельной культуры на среде Чапека с витаминами; в – экстракт из 2-недельной культуры на среде СС. Пики с tR 4.8 и 5.2 из растворителя.
В результате кластерного анализа состава экстрактов они разделились на 2 основных ветви, различающиеся по способу культивирования S. cirsii S-47. Внутри кластера А, в который вошли экстракты, полученные из культурального фильтрата, необходимо отметить различия метаболитов в экстрактах, полученных с использованием этилацетата и хлористого метилена. Кластер Б составили экстракты, полученные из твердофазных культур гриба, вне зависимости от сроков культивирования и экстрагента. Субкластер Б1 можно разделить на два подкластера: Б1.I – гексановые экстракты, полученные при культивировании гриба на твердых субстратах (преимущественно на пшенной и рисовой крупах); Б1.II – преимущественно хлористометиленовые и этилацетатные экстракты, полученные при культивировании гриба на разных твердых субстратах. В субкластер Б2 вошли преимущественно хлористометиленовые экстракты из двухнедельной твердофазной культуры S. cirsii вне зависимости от состава субстрата (рис. 2).
В гексановом экстракте из трехнедельной культуры S. cirsii S-47 на пшене с широким спектром биологической активности (фитотоксической, антибактериальной и антиэстеразной) обнаружен гербарумин I (tR 3.14 мин). Интересны два неизвестных соединения (tR 4.38 мин и tR 4.55 мин) со сложными УФ-спектрами (λмакс 238, 265, 297, 389 нм и λмакс 233, 256, 300, 363 нм), которые еще не описаны у S. cirsii (рис. 3а). В этилацетатном экстракте также с высоким уровнем биологической активности преобладали среднеполярные и полярные соединения: в нем обнаружены стагонолид Н, гербарумин I и стагонолид А) (рис. 3б).
В гексановом экстракте из трехнедельной культуры на рисе, который проявил заметную антиэстеразную активность в отношении КЭ и цитотоксическую активность в отношении обеих изученных клеточных линий, ранее идентифицированные токсичные метаболиты гриба не обнаружены. Обращает внимание присутствие неизвестных веществ с tR 4.89 мин и 4.99 мин (у обоих УФ λмакс 230 нм), а также неполярных (tR > > 4.5 мин) алифатических соединений (λмакс < < 200 нм) (рис. 3в).
В экстракте, полученным хлористым метиленом, из фильтрата 2 недельной культуры S. cirsii S-47 на ДМГ, продемонстрировавшем высокую антиэстеразную активность и средний уровень антибиотической и фитотоксической активности, обнаружены следовые количества гербарумина I. Основными метаболитами экстракта были неизвестные вещества с tR 2.60 мин (λмакс < 215, 266–287 нм) и tR 2.86 мин (λмакс 271 нм) (рис. 4а). В этилацетатном экстракте, проявившем высокую цитотоксическую активность, обнаружен метаболит с tR 3.1 мин (λмакс 252, 311 нм).
В экстракте, полученным хлористым метиленом, 3-недельной культуры S. cirsii S-47 на среде ЧАВ мажорными метаболитами были стагонолид Н и стагонолид А, что, очевидно, обусловливало его высокую антимикробную и фитотоксическую активность. В экстракте присутствовали также и неизвестные вещества с tR 2.38 мин (λмакс < 200, 256 нм), tR 2.67 мин (λмакс 228 нм), tR 2.56 мин (λмакс 270 нм), tR 3.47 мин (λмакс 291 нм) (рис. 4б).
В показавшем высокую антибактериальную активность экстракте, полученным хлористым метиленом из фильтрата 2-недельной культуры гриба на среде СС, преобладали стагонолид А и два неизвестных вещества с tR 2.86 мин (λмакс 271 нм) и tR 3.46 мин (λмакс 291 нм). (рис. 4в) Этилацетатный экстракт из этой же культуры со средним уровнем фитотоксической активности и высоким – цитотоксической и антиэстеразной, содержал стагонолид Н, гербарумин I, а также неизвестные соединения: tR 2.52 мин (λмакс < 200 нм), tR 2.86 мин (λмакс 271 нм), tR 3.18 мин (λмакс 252, 312 нм).
С помощью ТСХ были показаны прежде всего, существенные различия в компонентном составе экстрактов из твердо- и жидкофазных культур S. cirsii S-47, а также менее существенные, но хорошо детектируемые различия экстрактов из культурального фильтрата (рис. 1). Сравнительное изучение ВЭЖХ-профилей экстрактов и УФ-спектров с использованием стандартов фитотоксинов (стагонолида А, стагонолида Н и гербарумина I) показало, что выделенный из осота полевого штамм S. cirsii S-47, образует те же основные фитотоксические метаболиты (стагонолид А и стагонолид Н), что и штамм С-163, изолированный из листьев бодяка. Гербарумин I выявлен у этого гриба впервые. Кластерный анализ ВЭЖХ/УФ-профилей экстрактов позволил подтвердить существенные качественные различия в их компонентом составе в зависимости от состава питательного субстрата и экстрагента.
Таким образом, в большинстве случаев биологическая активность экстрактов была обусловлена присутствием в них известных токсинов, однако в некоторых экстрактах, проявивших активность, их содержание было незначительным либо они отсутствовали. Следовательно, биологическая активность экстрактов может быть обусловлена и другими их компонентами. Так, практически во всех изученных экстрактах гриба выявлены соединения, ранее не описанные для S. cirsii. В целом следует отметить содержание в экстрактах из твердофазных культур неизученных пигментов, а в экстрактах из культурального фильтрата веществ с λмакс при 260, 270 и 290 нм. Их дальнейшее изучение представляется важным с точки зрения более полной характеристики БАВ продуцента потенциального микогербицида на основе S. cirsii S-47: выявления факторов его вирулентности и для токсикологической оценки.
Работа выполнена при поддержке РНФ (проект № 16-16-00085).
Список литературы
Берестецкий А.О. // Вестник защиты растений. 2017. Т. 91. № 1. С. 5–12.
Берестецкий А.О. // Прикл. биохимия и микробиология. 2008. Т. 44. № 5. С. 501–514.
Ahmed N.E., Sugimoto Y., Babiker A.G.T., Mohamed O.E., Ma Y., Inanaga S., Nakajima H. // Weed Sci. 2001. V. 49. № 3. P. 354–358.
Abouzeid M.A., Boari A., Zonno M.C., Vurro M., Evidente A. // Weed Sci. 2004. V. 52. № 3. P. 326–332.
Anderson K.I., Hallett S.G. // Weed Sci. 2004. V. 52. № 4. P. 623–627.
Hoagland R.E., Weaver M.A., Boyette C.D. // Allelopathy J. 2007. V. 19. № 1. P. 179–192.
Lee H.B., Kim J.-C., Hong K.-S., Kim C.-J. // Plant Pathol. J. 2008. V. 24. № 4. P. 453–460.
Nzioki H.S., Oyosi F., Morris C.E., Kaya E., Pilgeram A.L., Baker C.S., Sands D. // Front. Plant Sci. 2016. V. 7. P. 1121. https://doi.org/10.3389/fpls.2016.01121
Fumagalli P., Andolfi A., Avolio F., Boari A., Cimmino A., Finizio A. // Pest Manag. Sci. 2013. V. 69. № 7. P. 850–856.
Favilla M., Macchia L., Gallo A., Altomare C. // Food Chem. Toxicol. 2006 V. 44. № 11. P. 1922–1931.
Skrobek A., Boss D., Défago G., Butt T.M., Maurhofer M. // Toxicol. Lett. 2006. V. 161. № 1. P. 43–52.
Boss D., Maurhofer M., Schläpfer E., Défago G. // FEMS Microbiol. Ecol. 2007. V. 59. № 1. P. 194–205.
Kouvelis V.N., Wang C., Skrobek A., Pappas KM., Typas M.A., Butt T.M. // Mutat. Res. 2011. V. 722. № 1. P. 1–6.
Berestetskiy A.O., Ivanova A.N., Petrova M.O., Pro-kof’eva D.S., Stepanycheva E.A., Uspanov A.M., Lednev G.R. // Microbiol. 2018. V. 87. № 2. P. 200–214.
Deising H.B., Gase I., Kubo Y. // J. Plant Dis. Prot. 2007. V. 124. https://doi.org/10.1007/s41348-017-0109-5
Evidente A., Berestetskiy A., Cimmino A., Tuzi A., Superchi S., Melck D., Andolfi A. // J. Agric. Food Chem. 2009. V. 57. № 23. P. 11168–11173.
Andolfi A., Cimmino A., Vurro M., Berestetskiy A., Troise C., Zonno M.C., Motta A., Evidente A. // Phytochem. 2012. V. 79. P. 102–108.
Sørensen J.L., Sondergaard T.E. // Int. J. Food Mirobiol. 2014. V. 170. P. 55–60.
Shi W., Tan Y., Wang S., Gardiner D.M., De Saeger S., Liao Y., Wang C. Fan Y., Wang Z., Wu A. // Toxins. 2017. V. 9. https://doi.org/10.3390/toxins9010006
Пaтeнт PФ. 2014. № 2515899.
Пaтeнт PФ. 2015. № 2543665.
Артохин К.С. Сорные растения. М.: Печатный город, 2007. 166 с.
Yuzikhin O., Mitina G., Berestetskiy A. // J. Agric. Food Chem. 2007. V. 55. № 19. P. 7707–7711.
Rivero-Cruz J.F., García–Aguirre G., Cerda–García–Rojas C., Mata R. // Tetrahedron. 2000. V. 56. № 30. P. 5337–5344.
Evidente A., Cimmino A., Berestetskiy A., Mitina G., Andolfi A., Motta A. // J. Nat. Prod. 2008. V. 71. P. 31–34.
Evidente A., Cimmino A., Berestetskiy A., Andolfi A., Motta A. // J. Nat. Prod. 2008. V. 71. № 11. P. 1897–1901.
Greve H., Schupp P.J., Eguereva E., Kehraus S., Kö-nig G.M. // J. Nat. Prod. 2008. V. 71. № 9. P. 1651–1653.
Zheng C.-J., Shao C.-L., Chen M., Niu Z.-G., Zhao D.-L., Wang C.-Y. // Chem. Biodiversity. 2015. V. 12. № 9. P. 1407–1414.
Tsuda M., Mugishima T., Komatsu K., Sone T., Tanaka M., Mikami Y., Kobayashi J. // J. Nat. Prod. 2003. V. 66. № 3. P. 412–415.
Trisuwan K., Rukachaisirikul V., Phongpaichit S., Preedanon S., Sakayaroj J. // Arch. Pharm. Res. 2011. V. 34. № 5. P. 709–714.
Bhilabutra W., Techowisan T., Peberdy J.F., Lumyong S. // Res. J. Microbiol. 2007. V. 2. № 10. P. 749–755.
Perepogu A.K., Raman D., Murty U.S.N., Rao V.J. // Bioorg. Chem. 2009. V. 37. № 1. P. 46–51.
Jangili P., Kashanna J., Kumar C.G., Poornachandra Y., Das B. // Bioorganic Med. Chem. Lett. 2014. V. 24. № 1. P. 325–327.
Sun P., Lu S., Ree T.V., Krohn K., Li L. Zhang W. // Curr. Med. Chem. 2012. V. 19. № 20. P. 3417–3455.
Liu Q.-A., Zheng J.-J., Gu Y.-C., Wang C.-Y., Shao C.-L. // Studies in Natural Products Chemistry. 2015. V. 44. P. 353–401.
Берестецкий А.О., Юзихин О.С., Каткова А.С., Добродумов А.В., Сивогривов Д.Е., Коломбет Л.В. // Прикл. биохимия и микробиология. 2010. Т. 46. № 1. С. 84–88.
Ellman G.L., Courtney K.D., Andres V. Jr., Feather-Stone R.M. // Biochem. Pharmacol. 1961. V. 7. № 1. P. 88–95.
Yang Z.P., Dettbarn W.D. // Biochem. Pharmacol. 1998. V. 55. № 8. P. 1419–1426.
Доспехов Б.А. Методика полевого опыта (с основами статистической обработки результатов исследований). М.: Агропромиздат, 1985. 351 с.
Sudhakar C., Reddy P.R., Kumar C.G., Sujitha P., Das B. // Eur. J. Org. Chem. 2012. V. 2012. № 6. P. 1253–1258.
Singh B., Bhagat J., Chadha B.S., Kaur A. // Biologia. 2014. V. 69. № 1. P. 10–14.
Grossberg G.T. // Curr. Ther. Res. Clin. Exp. 2003. V. 64. № 4. P. 216–235.
Koitka M., Höchel J., Gieschen H., Borchert H.H. // J. Pharm. Biomed. Anal. 2010. V. 51. № 3. P. 664–678.
Čolović M.B., Krstić D.Z., Lazarević–Pašti T.D., Bondžić A.M., Vasić V.M. // Curr. Neuropharmacol. 2013. V. 11. № 3. P. 315–335.
Rivero–Cruz J.F., Macías M., Cerda–García–Ro-jas C.M., Mata R. // J. Nat. Prod. 2003. V. 66. № 4. P. 511–514.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


