Прикладная биохимия и микробиология, 2020, T. 56, № 1, стр. 90-95
Оммохромы Hermetia illucens: получение, исследование антиоксидантных характеристик и антимикробной активности
А. Е. Донцов 1, *, Н. А. Ушакова 2, **, В. С. Садыкова 3, ***, А. И. Бастраков 2
1 Институт биохимической физики им. Н.М. Эмануэля РАН
119334 Москва, Россия
2 Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Россия
3 Научно-исследовательский институт по изысканию новых антибиотиков им. Г.Ф. Гаузе РАН
119021 Москва, Россия
* E-mail: adontsovnick@yahoo.com
** E-mail: naushakova@gmail.com
*** E-mail: sadykova_09@mail.ru
Поступила в редакцию 19.02.2019
После доработки 24.05.2019
Принята к публикации 30.08.2019
Аннотация
Разработана методика выделения и очистки оммохромов – пигментов сложного глаза взрослой мухи Hermetia illucens. Выделенные оммохромы проявляли флуоресценцию с максимумами эмиссии при 460−470 нм и 525–535 нм, интенсивность которой резко возрастала при их окислении пероксидом водорода. Методом тушения хемилюминесценции люминола определена антирадикальная активность оммохромов, величина константы составила (1.2 ± 0.5) × 104 М–1. Мелкодисперсная смесь оммохромов в 0.1 М калий-фосфатном буфере, рН 7.4, с 2.0 мг/мл бычьего сывороточного альбумина проявляла антимикробную активность в отношении B. subtilis АТСС 6633, Candida albicans АТСС 2091 и Aspergillus niger INA 00760 Сделано заключение, что имаго H. illucens – перспективный возобновляемый источник природных пигментов с высокими антиоксидантными характеристиками и антибактериальными свойствами.
Природные пигменты оммохромы широко распространены у беспозвоночных животных, в том числе, насекомых [1]. В настоящее время общепринято, что основные функции оммохромов связаны с экранированием света и антиоксидантной защитой фоторецепторных элементов ретикулярных клеток, а также с регулировкой спектральной чувствительности фоторецепторов, окраской кожных покровов и детоксикацией излишков триптофана [2–5]. Оммохромы подразделяются на два основных типа – относительно высокомолекулярные оммины и низкомолекулярные омматины [1]. Омматины, имеющие в своей структуре феноксазиновое кольцо, более характерны для глаз насекомых. В связи с возможностью масштабного разведения некоторых видов насекомых и получения возобновляемого источника биологически активных веществ, перспективных для практического использования в пищевой, фармацевтической промышленности и др., изучение оммохромов этих насекомых имеет как фундаментальное, так и прикладное значение. Особый интерес представляет муха черная львинка Hermetia illucens, способная утилизировать органические отходы [6]. Ареал распространения этого дневного насекомого – тропики и субтропики [7], что вызывает необходимость защиты глаз мухи от сильного УФ-излучения и определяет функциональную значимость оммохромов.
Цель работы – определение, идентификация и разработка методов получения оммохромов из биомассы голов имаго мухи Hermetia illucens, изучение физико-химических свойств изолированных оммохромов и определение их антиоксидантной активности и антимикробных свойств.
МЕТОДИКА
Объектом исследования служила муха черная львинка Hermetia illucens, которую выращивали в лабораторных контролируемых условиях ИПЭЭ РАН с использованием зерна пшеницы в качестве кормового субстрата для личинок. Имаго (взрослых мух) содержали при искусственном освещении. В качестве источника света применяли люминесцентные светильники 4 × 18 Вт (“Лайтлюкс”, Россия). Интенсивность освещения составляла не менее 5000 лк, световой режим – 12 ч. Из собранных обездвиженных замораживанием насекомых вручную отделяли головы, которые хранили в замороженном виде при –18°C. Масса головы черной львинки не превышала 2.4 ± 0.03 мг, что составляло 8.5 ± 0.5% от тела мухи. В опыте было переработано 150 г мух (5400 особей).
Для экстракции оммохромов из голов имаго применяли 1.0% раствор HCl в метаноле [8]. Для этого 10.2 г голов мухи заливали 500 мл раствора абсолютный метанол–HCl, тщательно перемешивали и оставляли для экстракции в течение 48 ч при температуре 6°С. После этого экстракт фильтровали через бумажный фильтр. Полученный фильтрат интенсивного бордового цвета нейтрализовали 20%-ным аммиаком до нейтральной величины рН. Образовавшийся рыхлый осадок отделяли центрифугированием при 5000 g в течение 15 мин и вновь растворяли в 100 мл раствора метанол–HCl. Процедуру осаждения оммохромов повторяли. Полученный осадок оммохромов промывали дистиллированной водой и высушивали в эксикаторе над безводным хлористым кальцием. В результате из 10.2 г голов мухи получено 400 мг высушенного препарата. Для экспериментов использовали как истинные растворы оммохромов в кислом метаноле, так и тонкодисперсные суспензии оммохромов в 0.1 М калий фосфатном буфере, рН 7.4.
Спектры оптического поглощения измеряли на спектрофотометре “Shimadzu UV –1601PC” (Япония). Спектры флуоресценции регистрировали на флуориметре “Shimadzu RF-5301PC” (Япония). Для обработки полученных данных использовали программное обеспечение RFPC версия 2.0 (“Shimadzu”).
Антирадикальную активность полученных оммохромов определяли с помощью гомогенной гидрофильной хемилюминесцентной системы, состоящей из гемоглобина, пероксида водорода и люминола, как описано в работе [9]. В качестве измеряемых параметров был взят латентный период достижения максимальной интенсивности свечения. Кинетику хемилюминесценции регистрировали на спектрофлуориметре “Shimadzu” RF 5301PC (Япония) при длине волны люминесценции 470 нм при комнатной температуре. Для количественной оценки способности оммохромов взаимодействовать с радикалами, локализованными в водной фазе данной модельной системы, результаты тушения хемилюминесценции пересчитывали в координатах зависимости латентного периода от концентрации пигмента и сравнивали с такой же зависимостью для аскорбата, для которого известна константа тушения хемилюминесценции в данных условиях. Константу тушения хемилюминесценции люминола оммохромами оценивали, принимая молекулярную массу последних равной 440 Да. Среда для инкубации содержала 0.05 М К-фосфатный буфер, рН 7.4, 2.0 мкМ гемоглобина, 100 мкМ люминола, 100 мкМ ЭДТА, и различные концентрации оммохромов в 0.1 М К-фосфатном буфере, рН 7.4 или в растворе метанол-HCl. Реакцию начинали добавлением 100 мкМ пероксида водорода. В качестве контроля использовали буферный раствор без оммохромов.
Для определения антимикробной активности оммохромов получали мелкодисперсную смесь в 0.1 М калий-фосфатном буфере, рН 7.4, содержащем 2.0 мг/мл бычьего сывороточного альбумина. Конечная концентрация оммохромов составила 1.0 мг/мл. Спектр антимикотической активности оммохромов определяли на тест-культурах условно-патогенных грибов и бактерий из коллекции культур Научно-исследовательского института по изысканию новых антибиотиков им. Г.Ф. Гаузе (Москва, Россия). Условно-патогенные грибы принадлежали к роду Aspergillus: A. fumigatus 5К, A. niger INA 00760; дрожжевые условно-патогенные грибы: Candida albicans АТСС 2091, C. tropicalis INA 00763. Спектр антибактериального действия определяли с использованием тест-культур штаммов грамположительных – Bacillus subtilis АТСС 6633, B. coagulans 429 и грамотрицательных бактерий – E. coli АТСС 25922. Антимикробную активность определяли диско-диффузионным способом при двукратном разведений исходного раствора в диапазоне концентраций от 0.25 до 1.0 мг/диск с использованием стерильных бумажных дисков (“НИИ Пастера”, Россия), смоченных в соответствующих растворах и высушенных в стерильных условиях. Контролем чувствительности тест-организма служили стандартные диски с амфотерицином В для грибов (80 мкг/мл, “НИИ Пастера”, Россия) и оксициллином для бактерий (“НИИ Пастера”, 10 мкг/мл).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Особенности жизнедеятельности тропической мухи H. illucens, связанные с обитанием имаго в условиях высокой освещенности с повышенной долей ультрафиолетовых лучей в спектре [10], вызывают необходимость соответствующей защиты глаз. Известно, что у насекомых защитные функции выполняют пигменты оммохромы, присутствующие в омматидиях сложного глаза в высоких концентрациях. Например, содержание ксантомматина в глазу у мухи Calliphora erythrocephala составляет 15–20% сухого веса глаза [11]. В настоящем исследовании показано, что у взрослых мух черной львинки H. illucens также присутствовали оммохромы.
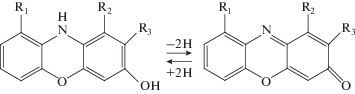
Инкубация голов мухи H. illucens в 1.0%-ном растворе НСl в абсолютном метаноле практически сразу привела к выходу оммохромов в раствор, о чем свидетельствовало красное окрашивание. В конце процесса экстракции интенсивно бордовый раствор содержал содержал 2.0 мг/мл экстрагируемых веществ. Этот экстракт проявлял высокую антирадикальную активность. На рис. 1 показана кинетика хемилюминесценции люминола, индуцированная пероксидом водорода, в присутствии различных концентраций этого экстракта (рис. 1, 1–4). Уже в небольшой концентрации (7 мкг/мл, рис. 1, 1) экстракт вызывал уменьшение интенсивности свечения, а в концентрации 60 мкг/мл значительно ингибировал процесс развития хемилюминесценции, приводя как к уменьшению амплитуды свечения, так и увеличению латентного периода (рис. 1, 4). Это свидетельствовало о высоком содержании антиоксидантов в метанольном экстракте из голов имаго мухи H. illucens. Можно считать, что антирадикальная активность экстракта в основном обусловлена именно содержанием оммохромов, поскольку известно, что эти вещества являются активными антиоксидантами, в то время как другой пигмент меланин, который также присутствует в мухе [12, 13], подкисленным метанолом не экстрагируется. Полученный экстракт был очищен от примесей путем двукратного переосаждения оммохромов при доведении величины рН экстракта до 7.4, что приводило к выпадению оммохромов в осадок. Супернатант, содержащий различные примеси, удаляли, а очищенные и промытые дистиллированной водой оммохромы высушивали до постоянного веса. Из 10 г сырого веса голов мухи было получено 400 мг сухого пигмента, что свидетельствует о его очень высокой концентрации в этом объекте. Очищенные оммохромы имели спектр поглощения с максимумом в видимой области при 470 нм (рис. 2, 1), что характерно для спектра поглощения омматинов и, в частности, для дигидроксантомматина – наиболее часто встречающегося пигмента сложного глаза мух. Окисление оммохромов H. illucens пероксидом водорода (рис. 2, 2 и 3) приводило к исчезновению максимума при 470 нм и пожелтению оммохромов. Такая реакция, по-видимому, характерна для дигидроксантомматина. Возможная схема окисления феноксазинового кольца дигидроксантомматина приведена на рис. 3. В результате окисления образуется пигмент желтого цвета, в данном случае, вероятно ксантомматин. Характер спектров поглощения указывает на возможное присутствие у мухи H. illucens примеси оммохромов класса омминов, что требует отдельного анализа.
Рис. 1.
Кинетика хемилюминесценции люминола в присутствии различных концентраций (7−60 мкг/мл) экстракта оммохромов черной львинки H. illucens. 1 − 7, 2 − 20, 3 − 30, 4 − 60 мкг/мл по сухому веществу экстракта оммохромов.

Рис. 2.
Спектр поглощения очищенных оммохромов H. illucens в калий-фосфатном буфере (рН 7.4). 1 – исходный спектр, 2 и 3 – в присутствии 1%-ного раствора пероксида водорода 20 мин и 2 ч реакции соответственно.
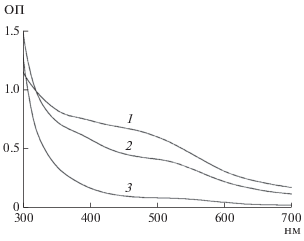
Рис. 3.
Гипотетическая схема реакции окисления феноксазинового кольца оммохромов H. illucens пероксидом водорода.
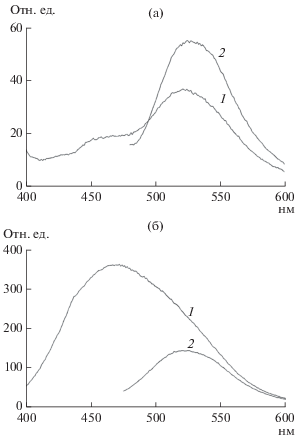
Очищенные оммохромы, выделенные из голов H. illucens, проявляли флуоресценцию в видимых областях спектра. Нативные оммохромы характеризовались небольшой по интенсивности флуоресценцией с максимумом при 460–470 нм и более выраженной с максимумом при 525–535 нм (рис. 4а). При окислении оммохромов пероксидом водорода интенсивность флуоресценции возрастала, причем в значительно большей степени для коротковолнового максимума (рис. 4б).
Рис. 4.
Спектры флуоресценции (нм) нативных очищенных (а) и полностью окисленных 1%-ным пероксидом водорода (б) оммохромов H. illucens в калий-фосфатном буфере при длинах волн возбуждения 380 нм (1) и 460 нм (2).
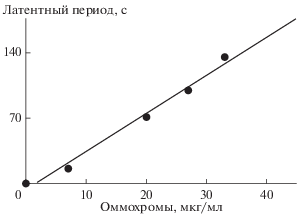
Очищенные оммохромы H. illucens проявляли антирадикальную активность, определяемую по замедлению процесса хемилюминесценции люминола, индуцированного пероксидом водорода. На рис. 5 показана величина латентного периода развития хемилюминесценции в присутствии различных концентраций оммохромов. По этим данным проведена оценка константы тушения хемилюминесценции, которая отражает степень антирадикальной активности оммохромов. В среднем величина константы была равной (1.2 ± 0.5) × 104 М–1, что свидетельствовало о высокой антиоксидантной эффективности экстрагированных и очищенных оммохромов.
Рис. 5.
Зависимость величины латентного периода (с) развития процесса хемилюминесценции люминола от концентрации оммохромов H. illucens (мкг/мл).
Впервые выявлены антибактериальные свойства оммохромов в отношении грамположительных бактерий B. subtilis АТСС 6633 в концентрации 0.5 и 1.0 мг/диск (табл. 1, рис. 6). Действия на B. coagulans 429, Staphylococcus aureus FDA 209 P и грамотрицательный микроорганизм E. coli АТСС 25922 не было отмечено.
Таблица 1.
Антибактериальная активность оммохромов глаза черной львинки H. illucens в отношении условно-патогенных бактерий (диаметр зоны подавления роста, мм)
| Тест-организм | Концентрация оммохромов, мг/диск | Оксициллин, 10 мкг/мл | ||
|---|---|---|---|---|
| 1.0 | 0.5 | 0.25 | ||
| B. subtilis АТСС 6633 | 18 ± 0.2 | 9 ± 0.1 | 0 | 27 ± 0.4 |
| B.coagulans 429 | 0 | 0 | 0 | 25 ± 0.6 |
| Staphylococcus aureus FDA 209 P | 0 | 0 | 0 | 23 ± 0.6 |
| E.coli АТСС 25922 | 0 | 0 | 0 | 27 ± 0.2 |
Рис. 6.
Антимикробная активность оммохромов (2–4) в отношении условно-патогенных микроорганизмов B. subtilis АТСС 6633 (а) и A. niger INA 00760 (б): а: 1 – оксициллин; 2 – 0.25, 3 – 1.0, 4 – 0.5 мг/диск; б: 1 – амфотерицин В, 2 – 1.0, 3 – 0.5, 4 – 0.25 мг/диск.
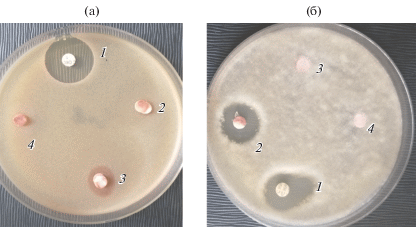
Также показано слабое антифунгальное действие в отношении Candida albicans АТСС 2091 и A. niger INA 00760 в концентрации 1.0 мг/диск (табл. 2).
Таблица 2.
Антифунгальная активность оммохромов глаза черной львинки H. illucens в отношении условно-патогенных грибов (диаметр зоны подавления роста, мм)
| Тест-организм | Концентрация оммохромов, мг/диск | Амфотерицин В, 80 мкг/мл | ||
|---|---|---|---|---|
| 1 | 0.5 | 0.25 | ||
| C. albicans АТСС 2091 | 12 ± 0.1 | 0 | 0 | 18 ± 0.6 |
| C. tropicalis INA 00763 | 0 | 0 | 0 | 18 ± 0.6 |
| A. fumigatus 5К | 0 | 0 | 0 | 12 ± 0.6 |
| A. niger INA 00760 | 9 ± 0.1 | 0 | 0 | 10 ± 0.6 |
Оммохромы – это органические пигменты красного, желто-коричневого и фиолетового цвета, практически нерастворимые в нейтральных растворителях, что определяет специфику их практического использования. Выделенные оммохромы глаз мухи черная львинка H. illucens обладали антиоксидантными, флуоресцентными и антимикробными свойствами. Биоантиоксиданты необходимы живым организмам для поддержания низкой интенсивности стационарного уровня свободнорадикальных автоокислительных процессов. Наличие собственной флуоресценции в видимой части спектра с максимумом 525–535 нм указывает на устойчивое существование выделенных оммохромов в восстановленной форме. Антимикробные свойства оммохромов могут служить дополнительным фактором защиты глаз насекомых от болезней, вызываемых инфекцией, инвазией или травмами.
Впервые установлено, что антимикробные свойства оммохромов черной львинки могут быть связаны с наличием в их структуре феноксазинового кольца, которое входит в структуры актиномицинов например, аурантина [14]. Актиномицины действуют на грамположительные бактерии и некоторые виды грибов, являясь ингибитором синтеза РНК. Слабее выражено действие актиномицинов на грамотрицательные бактерии. Некоторые аурантины обладают также противоопухолевым действием [15]. Полученные в работе результаты не противоречат литературным данным, но требуют дальнейшего исследования.
Антиоксиданты используются как пищевые добавки, пищевые красители, а также для введения в сырье и готовую продукцию в целях предупреждения их порчи, увеличения сроков хранения. Сочетание антиоксидантных свойств с антимикробными у оммохромов черной львинки расширяет спектр их биологической эффективности. Новая перспектива − изучение противоопухолевого действия этих веществ.
Таким образом, относительно простой способ получения пигментов позволил выделить из промышленного разводимого насекомого – мухи H. illucens природные оммохромы, которые могут применяться в различных отраслях народного хозяйства.
Работа выполнена при финансовой поддержке РФФИ (грант № 19-04-00411/19) и Минобрнауки России (ГЗ тема АААА-А18-118042490053-3).
Список литературы
Butenandt A., Schafer W. Ommochromes. Recent Progress in the Chemistry of Natural and Synthetic Coloring Matters and Related Fields / Eds. Gore T.S. et al. N.-Y.: Acad. Press, 1962. P. 13–62.
Донцов А.Е. // Журн. эволюционной биохимии и физиологии. 1981. Т. 17. С. 53–56.
Грибакин Ф.Г., Чеснокова Е.Г. // Успехи современной биол. 1984. Т. 97. С. 69–82.
Островский М.А., Зак П.П., Донцов А.Е. // Известия РАН. Серия биологическая. 2018. № 6. С. 658–668.
Островский М.А., Донцов А.Е. // Известия РАН. Серия биологическая. 2019. № 1. С. 95–108.
Kalová M., Borkovcová M. // Acta Universitatis Agriculturae et Silviculturae Mendelianae Brunensis. 2013. LXI. № 1. P. 77–83.
Sheppard D.C., Newton G.L., Thompson S.A., Savage S.E. // Bioresour. Technol. 1994. V. 50. P. 275–279.
Ostrovsky M.A., Sakina N.L., Dontsov A.E. // An antioxidative role of ocular screening pigments. Vision Res. 1987. V. 27. P. 893–899.
Теселкин Ю.О., Бабенкова И.В, Любицкий О.Б., Клебанов Г.И., Владимиров Ю.А. // Вопросы мед. химии. 1997. Т. 43. С. 87–92.
Sheppard D.C., Tomberlin J.K., Joyce J.A., Kiser B.C., Sumner S.M. // J Med. Entomol. 2002. V. 39. P. 695–698.
Langer H. Properties and Functions of Screening Pigments in Insect Eyes. In: Photoreceptor optics. Berlin-N.Y.: Springer-Verlag, 1975. P. 429–455.
Ushakova N.A., Dontsov A.E., Bastrakov A.I., Garmash N.Y., Pavlov D.S. // Doklady Biochemistry and Biophysics. 2017. V. 473. № 1. P. 102–105.
Ushakova N.A., Dontsov A.E., Sakina N.L., Brodsky E.S., Ratnikova I.A., Gavrilova N.N., Bastrakov A.I., Kozlova A.A., Nekrasov R.V. // Ukrainian J. Ecology. 2017. V. 7. № 4. P. 424–431.
Орлова Т.И., Силаев А.Б. // Антибиотики. 1967. Т. 12. № 4. С. 283–287.
Ашмарин И.П. Молекулярная биология, избранные разделы. М.: Медицина, 1974. 360 с.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


