Прикладная биохимия и микробиология, 2020, T. 56, № 1, стр. 69-75
Определение мицелия и антигенов ряда видов микромицетов в почвенных экстрактах методом иммуноферментного анализа
А. Е. Иванова 1, 2, *, А. С. Шутова 1, А. В. Ганнесен 3, Ю. С. Лебедин 4, С. А. Ерёмин 1
1 Московский государственный университет им. М.В. Ломоносова
119991 Москва, Россия
2 Институт проблем эволюции и экологии им. А.Н. Северцова, РАН
119071 Москва, Россия
3 Институт микробиологии им. С.Н. Виноградского, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” РАН
117312 Москва, Россия
4 ООО “ХЕМА”
105264 Москва, Россия
* E-mail: ivanovaane@gmail.com
Поступила в редакцию 24.12.2018
После доработки 20.08.2019
Принята к публикации 30.08.2019
Аннотация
Изучены 16 вариантов тест-систем (двухсайтовый сэндвич- и конкурентный иммуноферментный анализ) для определения в экстрактах почв концентрации антигенов микромицетов, некоторые из которых известны как условно-патогенные для человека. Проведена оценка корреляция количества биомассы грибов (длины растущего мицелия) и концентраций антигенов. Показано, что методы иммуноферментного анализа (ИФА) обладали высокой эффективностью при длительной (более 5 сут) инкубации образцов почвы для доращивания микромицетов: количество антигенов, выявляемых данными методами, варьировало от 22 ед./мл (Fusarium solani F-142) до 540 ед./мл (Aspergillus niger F-273). Методы оказались малоэффективными при кратковременной инкубации, поскольку корреляции между увеличением длины гиф и количеством детектируемых антигенов в первые сутки культивирования не выявлено. Гифы грибов вырастали в среднем на 20–25 мм (до 53 мм у A. niger F-273), тогда как количество выявляемых антигенов в первые сутки не изменялось относительно контроля. Показана перспективность обоих методов ИФА для детекции ряда почвенных микромицетов – представителей родов Aspergillus (A. flavus, A. fumigatus и A. niger), Fusarium (F. solani и F. poae), и др. (Alternaria alternata, Phoma lingham и Mucor hiemalis), при этом конкурентный ИФА оказался более эффективным.
В настоящее время иммуноферментный анализ (ИФА) является одним из наиболее широко применяющихся методов химической энзимологии [1]. Его отличает стабильность реагентов, простота методов регистрации и высокая чувствительность, позволяющая определять соединения в концентрациях 10–9–10–12 М [2]. Метод считается простым и удобным в использовании, поскольку накоплено множество данных по созданию реагентов и изучены основные закономерности протекания реакций [1]. ИФА применяется для исследования большого количества объектов в различных областях медицины, сельского хозяйства, пищевой и микробиологической промышленности. ИФА можно детектировать пестициды [3–5], в том числе в таких продуктах питания как рыба [6], овощи и фрукты [7, 8], молоко [9], а также определять наличие компонентов технических смазок [11] и антибиотиков [10, 12].
С практической точки зрения для характеристики микробиома почвы наиболее интересно выявление патогенов человека, а также бактерий, улучшающих рост растений. В почвенной микробиологии используются прямой и непрямой методы флуоресцирующих антител, и эти методы хорошо себя проявили при изучении микробных популяций. Если говорить о бактериях, улучшающих рост растений, то метод ИФА использовался для детекции ризосферных микроорганизмов, например, клубеньковых рода Rhizobium [13–15], а также Azospirillum [16, 17] и актиномицетов в почве [18]. Были предприняты попытки выявления методом ИФА почвенных грибов – эндофитного Lolium perenne [19] и эндомикоризных грибов [20, 21]. Из фитопатогенных микроорганизмов интерес представляют широко распространенные представители родов Aspergillus, Fusarium, Mucor, Alternaria и Phoma, вызывающие не только различные заболевания растений, но и порчу растительных продуктов, синтезирующие микотоксины и хорошо сохраняющиеся в почве в виде спор. Некоторые из них могут быть патогенами человека [22–24].
Однако широкого распространения в почвенной микробиологии метод ИФА не получил по ряду причин. Одной из них являются высокие требования, предъявляемые к качеству реагентов, а также ограничение возможности увеличения чувствительности большинства имеющихся систем фоновым содержанием анализируемого соединения в почве, т.е. исследование малочисленных микроорганизмов и популяций часто оказывалось невозможным. Применение большинства существующих систем ИФА с флуоресцентной меткой имеет ряд ограничений, поскольку часто сложно обнаружить свечение изучаемых организмов из-за проявления неспецифической адсорбции флуоресцирующих антител почвенными частицами, тем более что серологическая реакция у разных микроорганизмов может сильно варьировать на уровне штаммов [25].
В то же время при модификации реагентов возможно применение метода ИФА как экспресс-метода при анализе почвенных суспензий, так как он позволяет проводить быстрое качественное выявление и количественную оценку присутствия экологически значимых видов грибов в почве. Применение данного экспресс-метода может быть востребовано при биоконтроле присутствия в разных субстратах и природных местообитаниях видов грибов, патогенных для самых разных групп организмов – растений, животных и человека. Применение метода ИФА актуально для конструирования почв с использованием рекультивационных смесей и в биоконтроле состояния урбо- и агроэкосистем.
Цель работы – оценка возможности применения разработанных экспериментальных экспресс-тестов на основе ИФА для определения присутствия в образцах почвы ряда видов микромицетов, известных как фитопатогенные или потенциально патогенные для человека.
МЕТОДИКА
Объекты исследования и культивирование. Для исследования компанией “Хема-Медика” (http:// xema-medica.com/) были разработаны экспериментальные наборы для ИФА. Выбраны 8 видов почвенных грибов, которые включали A. alternata (Fries) Keissler, A. fumigatus Fresenius, A. flavus Link, A. niger Tieghem, A. niger (Peck) Wollenweber, F.solani (Martius) Saccardo, P. lingam (Tode) Desmazières и M. hiemalis Wehmer. Штаммы данных видов взяты из коллекции кафедры биологии почв факультета почвоведения Московского государственного университета имени М.В. Ломоносова (табл. 1).
Таблица 1.
Штаммы, использованные в работе
| Вид | Номер штамма в коллекции | Место выделения штамма |
|---|---|---|
| A. alternata | F-34 | Дерново-подзолистая почва, Москва |
| A. fumigatus | F-37 | Почва серая лесная, погребенный горизонт А, Тульская обл. |
| A. flavus | F-293 | Почва, пустошь, Архангельская обл. |
| A. niger | F-273 | Серозeм, горизонт А, пустыня Негев, Израиль |
| F. poae | F-145 | Воздух, Москва |
| F. solani | F-142 | Гуминовый препарат, жидкая подкормка для растений |
| P. lingam | F-80 | Дерново-подзолистая почва, горизонт А, Москва |
| M. hiemalis | F-93 | Воздух над урбаноземом, Москва |
В качестве субстрата использовали дерново-подзолистую почву парка Воробьевы горы в (Москва, Россия) с рН вод 6.3, содержащую 4% гумуса.
Подготовка образцов. Дерново-подзолистую почву, предварительно растертую в ступке до однородного состояния, для стерилизации трижды автоклавировали с интервалами в несколько суток. Далее с использованием стерилизованной воды делали почвенную пасту, раскладывали ее по чашкам Петри диаметром 4 см. В 4 чашки вносили споровые суспензии, а 4 чашки оставляли без внесения спор в качестве контроля.
Споровые суспензии готовили смывом с чистых культур штаммов, выращенных в пробирках на скошенной среде Чапека в течение 7–8 сут. Плотность вносимой споровой суспензии проверяли с помощью камеры Горяева. Для достижения концентрации 105–106 спор/г почвы в чашки Петри вносили такой объем суспензии, чтобы масса сухой почвы в чашке оказалась равной 5 г. После внесения споры распределяли по объему почвы перемешиванием стерильной лопаткой. Перед началом инкубации отбирали почвенные пробы из чашек Петри с внесенной споровой суспензией и контрольных чашек. Из отобранных проб готовили материал для ИФА и делали посев почвенной суспензии для определения возможного присутствия каких-либо грибов в исходных почвах и контроля жизнеспособности внесенных спор. Для подбора оптимального времени инкубации осуществляли отбор почвенных проб для ИФА через 6, 9, 12, 24 и 120 ч после начала инкубации.
Определение длины гиф методом мембранных камер. Параллельно подготовке проб для ИФА проводили измерение длины гиф методом мембранных камер Хансена с модификациями [26] для контроля роста грибов в почве. Мембранные фильтры МФАС-ОС-1 (диаметр 35 мм, поры 0.22 мкм, “Владипор”, Россия) стерилизовали кипячением в дистиллированной воде в течение 10 мин и остужали. Затем на фильтры вносили по 50 мкл споровой суспензии (105–106 спор/мл) и накрывали сверху другим мембранным фильтром. Полученные мембранные камеры помещали в часть чашек Петри со стерилизованной почвой и инкубировали в закрытом эксикаторе при комнатной температуре.
Камеры поочередно извлекали через 6, 9, 12, 24 и 120 ч и отбирали пробы на ИФА. Осуществляли подсчет выросшего мицелия, чтобы выявить корреляцию между данными ИФА и длиной гиф. Для этого камеры раскрывали и помещали в стеклянные чашки Петри на предварительно размещенные на дне стерильные диски фильтровальной бумаги, смоченные в растворе красителя (1%‑ный дианиловый голубой в 5%-ном феноле в соотношении 1 : 5). Окрашивали в течение 2–3 ч. Затем фильтры высушивали при комнатной температуре, размещали на предметные стекла и просветляли иммерсионным вазелиновым маслом. После обесцвечивания фильтры микроскопировали и определяли рост мицелия по длине проростков при помощи окуляр-микрометра. Для расчета длины гиф (мкм) анализировали не менее 10 полей зрения на каждом фильтре, после чего находили среднее значение длины гиф для каждого вида.
Оценка влияния способов хранения почвенных проб на выявление микромицетов методом ИФА. Почву, инокулированную спорами разных видов грибов, и контрольные почвы инкубировали в эксикаторах при комнатной температуре в течение 5 сут. Затем отбирали почвы для проведения ИФА и сравнивали их со свежими почвами. При этом половину чашек убирали в морозильную камеру, а вторую половину накрывали крышками и высушивали при комнатной температуре до воздушно-сухого состояния, после чего проводили отбор проб для ИФА. При инокуляции видов P. lingam, F. poae и M. hiemalis почву для ИФА брали также на 2 сут инкубации для прослеживания динамики развития в них мицелия.
Пробоподготовка образцов почв для проведения ИФА. Навеску анализируемой почвы массой 1 г помещали в стерильные пластиковые пробирки со стерильной водой объемом 10 мл. Десорбцию клеток осуществляли на вортексе Heliford при 3500 об./мин в течение 3 мин. Затем частицы почвы в суспензии осаждали центрифугированием при 775 g (3400 об./мин) в течение 10 мин. Супернатант хранили в пробирках Eppendorf объемом 1.5 мл в морозильной камере.
Конкурентный метод ИФА. Анализ почв проводили в соответствии с инструкциями производителя наборов “Хема-Медика”. В рамку планшета с иммобилизованными антигенами помещали нужное количество стрипов или лунок из расчета 12 лунок для калибровочных проб и контрольных образцов и необходимое количество исследуемых образцов в 2 повторностях. Затем вносили в соответствующие лунки по 50 мкл проб для калибровки (0, 5, 20, 100 и 500 ед./мл определяемого антигена). В лунки, предназначенные для исследуемых образцов, вносили по 50 мкл супернатанта. Затем во все лунки вносили по 50 мкл раствора IgG кролика с пероксидазой против определяемых антигенов и перемешивали содержимое лунок осторожными круговыми движениями планшета в горизонтальной плоскости в течение 5–7 с, после чего заклеивали лунки пленкой для заклеивания планшетов. Планшеты инкубировали 60 мин при 37°С, затем стрипы промывали 3 раза отмывочным раствором, приготовленным путем разбавления концентрата в 26 раз. В отмытые лунки вносили 100 мкл конъюгата (иммуноглобулины овцы против IgG кролика с пероксидазой) и инкубировали 30 мин при 37°C, после чего отмывали 5 раз отмывочным раствором. Затем в лунки вносили 100 мкл раствора субстрата (3,3',5,5'-тетраметилбензидин, ТМБ) и инкубировали 15 мин при 20–25°C. По истечении срока инкубации в лунки вносили по 100 мкл стоп-реагента (5.0%-ную H2SO4) и измеряли оптическую плотность (ОП) при 450 нм.
Метод двухсайтового сэндвич-ИФА. Анализ образцов проводили по фабричному протоколу для коммерческого набора “Хема-Медика”. Протокол пробоподготовки до стадии отмывания включительно идентичен используемому для конкурентного ИФА. После отмывки в лунки вносили 100 мкл субстрата ТМБ, инкубировали 15 мин при 20–25°С, и реакцию останавливали добавлением 100 мкл стоп-реагента. ОП измеряли при 450 нм.
Для расчета значений в обоих методах использовали линеаризацию концентрационных зависимостей сигнала ИФА (оптической плотности), построенных в полулогарифмических координатах. Достоверность результатов проверяли построением калибровочной кривой и оценкой ее отклонения от линии тренда. Расчет концентраций по ОП осуществляли при помощи различных функций в программных пакетах Microsoft EXCEL и SlideWrite Plus 7.01.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
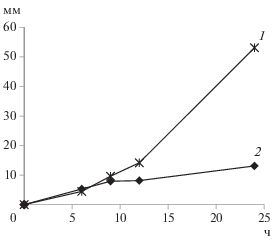
Рост гиф в мембранных камерах. Показано, что в первые сут культивирования длина гиф увеличивалась почти линейно. В среднем у восьми изученных штаммов к концу первых сут культивирования длина достигала 20-25 мм. Наибольшей скоростью роста гиф обладал штамм A. niger F-273, длина гиф которого к концу первых сут культивирования достигала в среднем 53 мм (рис. 1, 1). Наименьшей скоростью роста гиф обладал штамм P. lingam F-80 (рис. 1, 2), средняя длина гиф которого достигала лишь 13 мм после 24 ч культивирования в мембранных камерах.
Рис. 1.
Длина гиф грибов A. niger F-273 (1) и P. lingam F-80 (2), определенная методом мембранных камер.
Аналитические параметры ИФА тест-систем. Чувствительность определения составляла 5 ед./мл антигена Aspergillus. Для ИФА теста Aspergillus не обнаружено значимой перекрестной реакции (<0.1%) со следующими родами и видами: Candida, Saccharomyces cerevisiae, Thamnidium, Phoma, Alternaria, Fusarium; Trichoderma, Phytophtora, Pythium, Penicillium, Cladosporium, Ustilago, Botrytis, Geomyces, Ascochyta, Claviceps, Neurospora, Acremonium, Ophiostoma; Trichophyton и Microspora. Чувствительность и специфичность других ИФА тест систем отличалась для различных видов грибов и соответствовала данным инструкции тест-набора.
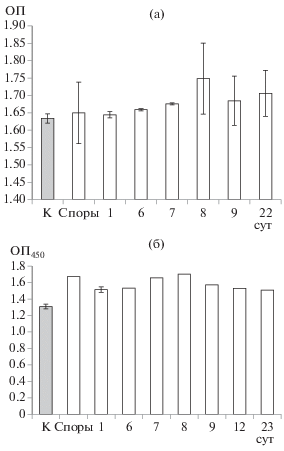
Детекция антигенов грибов методами ИФА в первые сутки культивирования. Несмотря на то, что гифы всех грибов, изученных методом мембранных камер, росли линейно в течение первых суток культивирования, линейного роста антигенов, детектируемых методами ИФА, не было обнаружено (рис. 2). Значения, полученные при применении обоих методов (двухсайтовый сэндвич-ИФА и конкурентный ИФА), не отличались от контрольных и сильно варьировали. Например, если для A. alternara F-34 намечалась слабая тенденция к увеличению количества детектируемого антингена к концу первых суток культивирования по сравнению контролем (рис. 2а), то для A. flavus F-293 (рис. 2б) подобной тенденции не наблюдали. Таким образом, корреляции между детекцией грибов методами ИФА и длиной гиф в первые сутки культивирования не наблюдалось, что, вероятно, являлось следствием недостаточной выработки антигена грибами. Также это может быть свидетельством необходимости доработки системы. О необходимости доработки также говорил тот факт, что значение ОП450 в образцах, куда споры были внесены, было близко к значению в контроле без внесения спор (рис. 2).
Рис. 2.
Детекция антигенов грибов в экстрактах почвы методами ИФА в первые сутки роста A. alternara F-34 двухсайтовым сэндвич-методом (а) и A. flavus F-293 конкурентным методом (б).
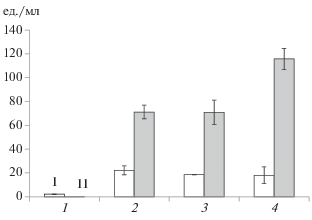
Детекция грибов методами ИФА в образцах после длительной инкубации. При доращивании грибов количество детектируемых их антигенов незначительно изменялось за первые сутки, но после 5 сут инкубации наблюдался значительный прирост (рис. 3). При этом количество антигенов, детектируемое конкурентным методом, было выше, чем двухсайтовым сэндвич-методом. Это различие связано с использованием в двух методах разных препаратов антител. Наблюдали увеличение содержания антигена, детектируемого конкурентным ИФА, в высушенных F. solani F-142. После 5 сут инкубации средняя концентрация антигена, детектируемая сэндвич-методом, была 22 ед./мл (рис. 3а), а детектируемая конкурентным методом – 72 ед./мл (рис. 3б). Заморозка или высушивание образцов, как правило, не влияли на количество детектируемого антигена, хотя в ряде случаев вызывали его увеличение.
Рис. 3.
Детекция антигенов (ед./мл) грибов F. solani F-142 двухсайтовым сэндвич- (I) и конкурентным методами (II) ИФА в экстрактах почвы после 6 сут инкубации: 1 – споры; 2 – образец на 6 сут; 3 – образец после заморозки; 4 – образец после высушивания.
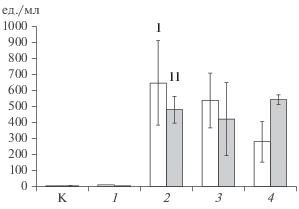
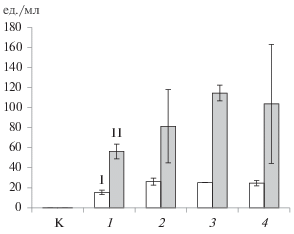
В отличие от F. solani F-142 особенности A. flavus F-293 не позволяли детектировать его даже после инкубации в течение 5 сут. Это могло быть связано как с недостаточным синтезом антигена данным штаммом, так и потенциальными недостатками тестовой системы. При этом штаммы A. niger F-273 и A. fumigatus F-37 детектировались лучше всего (рис. 4). Так, концентрация антигенов A. niger F-273, выявленная конкурентным методом, была в среднем равна 540 ед./мл (рис. 4), а концентрация антигенов A. fumigatus F-37, выявленная сэндвич-методом, – в среднем 480 ед./мл.
Рис. 4.
Детекция антигенов грибов A. niger F-273 конкурентным методом (I), A. fumigatus F-37 – двухсайтовым сэндвич-методом ИФА (II) в экстрактах из почв после 6 сут инкубации: К – контроль; 1 – споры; 2 – свежий образец на 6 сут; 3 – образец после заморозки; 4 – образец после высушивания.
В случае F. poae F-145 (рис. 5) при помощи обоих методов ИФА значительное увеличение концентрации антигена в почве наблюдали уже после 2 сут культивирования. Сэндвич-метод (рис. 5) оказался менее эффективен, нежели конкурентный (рис. 5), и позволил определить 16 и 56 ед./мл антигена соответственно.
Рис. 5.
Детекция антигенов F. poae F-145 в экстрактах почв двухсайтовый сэндвич- (I) и конкурентным (II) методами ИФА после 6 сут инкубации: К – контроль; 1 – споры; 2 – свежий образец на 6 сут; 3 – образец после заморозки; 4 – образец после высушивания.
В целом данные, полученные методами ИФА, коррелировали друг с другом. Несмотря на некоторые неточности, оба метода подтвердили перспективность для качественного и количественного определения антигенов патогенных грибов в почве. В будущем необходимо будет проверить точность и чувствительность разных способов анализа, усовершенствовать количественную оценку получаемых результатов, что довольно затруднительно вследствие сложности морфологии грибов, присутствующих в природе в виде спор и мицелия. Существуют также некоторые сложности при получении антигенов, поскольку организм животных-продуцентов не реагирует или слабо реагирует на введенный им грибной антиген. Это отчетливо видно на примерах A. niger F-273, A. fumigatus F-37 и A. flavus F-293. Тем не менее, в данной работе получены убедительные положительные результаты при использовании экспериментальных тест-систем, что позволяет рассматривать ИФА как перспективный метод определения экологически значимых для человека видов (условных патогенов, аллергенов и патогенов культурных растений). В частности, проведена апробация и показана эффективность экспериментальных иммуноферментных тест-систем для экспрессной детекции патогенов сельскохозяйственных растений A. fumigatus.
Работа выполнена при финансовой поддержке Министерства образования и науки Российской Федерации (уникальный идентификатор RFMEFI60717X0185 проекта “Разработка тест-систем для экспрессной иммунодетекции фитопатогенных грибов в зерновых культурах и создание предпосылок для их успешной коммерциализации в России и на внешних рынках”).
Список литературы
Wu L., Li G., Xu X., Zhu L., Huang R., Chen X. // Trends Anal. Chem. 2019. V. 113. P. 140–156.
Omori A.M., Ono E.Y.S., Hirozawa M.T., de Souza Suguiura I.M., Hirooka E.Y., Pelegrinelli Fungaro M.H., Ono M.A. // Toxins. 2019. V. 11. Article 48.
Schlaeppi J.M., Foery W., Ramsteiner K. // J. Agric. Food Chem. 1989. V. 37. № 6. P. 1532–1538.
Hollaway K.L., Kookana R.S., McQuinn D.J., Moerkerk M.R., Noy D.M., Smal M.A. // Weed Res. 1999. V. 39. № 5. P. 383–397.
Xu Z.-L., Wang H., Shen Y.-D., Nichkova M., Lei H.-T., Beier R.C., Zheng W.-X., Yang J.-Y., She Z.-G., Sun Y.-M. // Analyst. 2011. V. 136. № 12. P. 2512–2520.
Sapozhnikova Y., Simons T., Lehotay S.J. // J. Agric. Food Chem. 2015. V. 63. № 18. P. 4429–4434.
Xu Z.-L., Deng H., Deng X.-F., Yang J.-Y., Jiang Y.-M., Zeng D.-P., Huang F., Shen Y.-D., Lei H.-T., Wang H., Sun Y.-M. // Food Chem. 2012. V. 131. № 4. P. 1569–1576.
Qian G., Wang L., Wu Y., Zhang Q., Sun Q., Liu Y., Liu F. // Food Chem. 2009. V. 117. № 2. P. 364–370.
Rengasamy P. T., Kantharimuthu A., Balaraman M., Sivanesan S. // African J. Food Sci. 2016. V. 10. № 3. P. 41–47.
Li C., Zhang Y., Eremin S.A., Yakup O., Yao G., Zhang X. // Food Chem. 2017. V. 227. № 1. P. 48–54.
Johnson J.C., Van Emon J.M. // Anal. Chem. 1996. V. 68. № 1. P. 162–169.
Aga D.S., O’Connor S., Ensley S., Payero J.O., Snow D., Tarkalson D. // J. Agric. Food Chem. 2005. V. 53. № 18. P. 7165–7171.
Лисичкина Г.А., Кожевин П.А., Звягинцев Д.Г. // Микробиология. 1983. Т. 52. № 4. С. 646–650.
Кириллова Н.П., Кожевин П.А., Звягинцев Д.Г. // Микробиология. 1984. Т. 53. № 1. С. 117–122.
Fuhrmann J., Wollum A.G. // Appl. Environ. Microbiol. 1985. V. 49. № 4. P. 1010–1013.
Лукин С.А., Кожевин П.А., Звягинцев Д.Г. // Сельскохозяйственная биология. 1987. № 1. С. 51–58.
Krol M.J. Bashan Y., González L.E. // Appl. Microbiol. Biotechnol. 1999. V. 51. № 2. P. 262–266.
Efremenkova L., Kozhevin P., Zvyagintsev D. // Microbiology. 1978. V. 47. № 6. P. 916–918.
Musgrave D.R. // New Zealand J. Agric. Res. 1984. V. 27. № 2. P. 283–288.
Wright S.F., Morton J.B., Sworobuk J.E. // Appl. Environ. Microbiol. 1987. V. 53. № 9. P. 2222–2225.
Aldwell F.E.B., Hall I. R., Smith J.M.B. // Soil Biol. Biochem. 1983. V. 15. № 3. P. 377–378.
Ганнибал Ф.Б. Токсигенность и патогенность грибов рода Alternaria злаков / Ред. Дмитриева А.П. Лаборатория микологии и фитопатологии им. А.А. Ячевского ВИЗР. История и современность. СПб: ВИЗР, 2007. С. 82–93.
Марфенина О.Е., Бубнова Е.Н., Семенова Т.А., Иванова А.Е., Данилогорская А.А. // Микология и фитопатология, 2014. Т. 48. № 3. С. 10–24.
Кулько А.Б. // Туберкулез и болезни легких. 2017. Т. 95. № 3. С. 54–60.
Richardson M.D., Page I.D. // Medical Mycology. 2016. V. 55. № 1. P. 48–55.
Hanssen J.F., Thingstad T.F., Goksøyr J. // Oikos. 1974. V. 25. № 1. P. 102–107.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


