Прикладная биохимия и микробиология, 2020, T. 56, № 1, стр. 60-68
Влияние условий культивирования на синтез поли-3-гидроксибутирата клубеньковыми бактериями Rhizobium phaseoli
О. В. Космачевская 1, Е. В. Осипов 1, Чан Ван Ти 2, Фам Тхи Тует Май 2, А. Ф. Топунов 1, *
1 Институт биохимии им. А.Н.Баха, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Россия
2 Университет сельского и лесного хозяйства
251210 Тхайнгуен, Вьетнам
* E-mail: aftopunov@yandex.ru
Поступила в редакцию 09.07.2019
После доработки 20.08.2019
Принята к публикации 30.08.2019
Аннотация
Изучен синтез поли-3-гидроксимасляной кислоты (ПГБ) в клетках клубеньковых бактерий Rhizobium phaseoli, выращенных в глубинной культуре. Модифицирован метод Лоу для определения ПГБ, что позволило выделить и определить количество полимера непосредственно в биомассе. Только S-формы клеток R. phaseoli были способны к синтезу ПГБ. На богатой углеродом среде накопление ПГБ шло сильнее (примерно на 50%), а гранулы полимера были более ярко выражены. Синтез ПГБ увеличивался при понижении аэрации, а максимум содержания достигался к 35−40 ч роста. Было изучено влияние окислительного стресса, вызываемого пероксидом третбутила и бензилвиологеном на рост бактерий, синтезирующих ПГБ. Оба вещества негативно влияли на рост бактерий, при этом рост восстанавливался только у S-формы, синтезирующей ПГБ. Можно сделать вывод, что ПГБ является протектором для клубеньковых бактерий при окислительном стрессе. Максимальное содержание ПГБ в клетках R. phaseoli достигало 54% от сухой массы клеток, что превышает значения, ранее описанные для клубеньковых бактерий. Эта величина близка к значениям, характерным для бактериальных штаммов – продуцентов полимера, использующихся в биотехнологии. Можно сделать вывод, что клубеньковые бактерии, выращенные в глубинной культуре, могут быть потенциальными продуцентами ПГБ и других полигидроксиалканоатов.
Липидоподобные включения, окрашивающиеся липофильными красителями, впервые были обнаружены в бактериях Azotobacter chroococcum в начале прошлого столетия [1]. Состав вещества был выяснен в 1926 г. благодаря наблюдению, что в анаэробных условиях происходит подкисление суспензии Bacillus megaterium.
Образовавшаяся кислота была идентифицирована как 3-гидроксимасляная, а вещество – источник этой кислоты, как поли-3-гидроксибутират (ПГБ) [2]. В конце 1950 гг. была опубликована работа, посвященная синтезу ПГБ у бактерий рода Bacillus, где была описана процедура выделения гранул ПГБ щелочным гипохлоритом [3]. Стало возможным выделять ПГБ из клеток, была исследована динамика роста и синтеза ПГБ для водородоокисляющей бактерии Alcaligenes eutrophus (современное название – Ralstonia eutropha).
Обнаружено увеличение содержания ПГБ в клетках в стационарной фазе, когда число клеток оставалось постоянным [4]. В последующих работах изучался синтез полимера на разных средах, ферменты, участвующие в синтезе. К концу 60 гг. стало ясно, что синтез этого резервного полимера – широко распространенное явление среди грамотрицательных бактерий. В обзоре [5] ПГБ впервые рассматривался как бактериальное резервное вещество, функционально аналогичное крахмалу и гликогену у эукариот. ПГБ – это лишь один из возможных полимеров группы полигидроксиалканоатов (ПГА), которые могут содержать в качестве мономеров и другие подобные гидроксибутирату соединения.
В дальнейшем было описано клонирование генов, участвующих в биосинтезе резервных полиэфиров, были клонированы гены R. eutropha, кодирующие ферменты биосинтеза ПГА, и получены рекомбинантные штаммы Escherichia coli с функционально активным комплексом этих генов [6–8]. Детальные исследования на R. eutropha показали, что только три фермента участвуют в биосинтезе ПГБ из ацетил-КоА. Ключевым является фермент, ответственный за реакцию полимеризации и названный ПГА-синтазой. К настоящему времени клонировано около 40 структурных генов ПГА-синтазы из более чем 30 видов бактерий. Успешное клонирование генов биосинтеза ПГА сделало возможным создание трансгенных растений, которые рассматриваются как возможные продуценты ПГА в будущем [9, 10].
ПГБ был обнаружен у многих азотфиксирующих бактерий, в том числе у Azotobacter и Rhizobium [11], причем у всех исследованных видов этих родов. Практически сразу обмен ПГБ стали связывать с процессом фиксации атмосферного азота, а поскольку клубеньковые бактерии (КБ) рода Rhizobium фиксируют азот в условиях симбиоза с бобовыми растениями, то обмен ПГБ в основном изучали в бактероидах – симбиотической форме этих бактерий, находящейся в клубеньках. Было показано, что в бактероидах Rhizobium содержатся гранулы ПГБ, содержание которой может достигать 50–60% от сухой массы клетки [12, 13]. Накопление ПГБ было показано и для бактероидов КБ, которые теперь относят к роду Bradyrhizobium: B. japonicum и B. elkanii [14]. Бактероиды R. meliloti являются одним из видов, который не накапливает ПГБ во время симбиоза [15].
У многих бактерий ПГБ известен в качестве запасного вещества, активно участвующего в метаболизме углеводов и обмен которого тесно связан с функционированием цикла Кребса [5, 12]. Показано, как ризобиальные штаммы аккумулируют ПГА в качестве аккумуляторов энергии [16]. Накопленный в бактериях ПГА способствуют быстрой колонизации ризосферы, эффективной нодуляции и азотфиксации [17], при этом способность накапливать ПГБ бактероидами в клубеньке прямо коррелирует с типом клубенька: детерминированным или недетерминированным [16].
В Институте биохимии им. А.Н. Баха РАН было показано, что в процессе вегетации бобовых растений скорость распада ПГБ в бактероидах R. lupini (сейчас Bradyrhizobium lupini) наиболее высока при максимальной азотфиксации [18], когда ферменты синтеза и распада ПГБ особенно активны [19]. На основании этих и некоторых других данных можно сделать заключение, что при азотфиксации одновременно происходит и синтез и распад ПГБ, то есть это запасное вещество находится в состоянии активного обмена. ПГБ обеспечивает метаболизм бактероидов в микроаэробных условиях, существующих в центральной зоне клубенька, когда основная часть кислорода задерживается барьером газовой диффузии в коре, а кислород поступает к бактероидам в связанным с легоглобином – симбиотическим гемоглобином бобового растения [20–23].
В то же время работ по изучению ПГБ в клубеньковых бактериях, находящихся в свободноживущем состоянии, крайне мало. Можно отметить работу Стама с соавт. о распаде ПГБ в бактериях рода Rhizobium [24], и статью о функционировании генов, отвечающих за синтез этого полимера в бактериях Rhizobium и Bradyrhizobium [25]. Поскольку в свободноживущем состоянии нитрогеназа в бактериях не экспрессируется, ПГБ работает как “утилизатор” для избытка НАД(Ф)Н при не очень активном цикле Кребса. Регулируя три разных пути окисления НАД(Ф)Н, различные штаммы Rhizobium способны функционировать в разных условиях [26].
Цель работы − изучение влияния условий выращивания на синтез ПГБ различными формами клубеньковыми бактериями R. phaseoli в глубинной культуре.
МЕТОДИКА
Использованные реактивы. В работе использовали среду LB, (NH4)2SO4, PMSF, восстановленный глутатион, глутамат натрия, ксилол − “AppliChem” (Германия); бензилвиологен – Merck” (Германия); Трис – “ICN” (США); пероксид трет-бутила, сафранин, Судан черный B – “Sigma-Aldrich” (США); Нильский красный – “Acros Organics” (Бельгия); пероксид водорода, (NH4)3PO4; MgSO4; NaCl, .HCl, H2SO4, NaNO2, H3PO4, CH3COONa, маннит, уксусная кислота, этанол, хлороформ, этиленгликоль, NaOH, КН2PO4 (Россия). Гороховая мука была приготовлена размолом коммерческих сухих семян гороха посевного лущильного (Pisum sativum L. convar. sativum), выращенного в Ставропольском крае (Россия).
Условия культивирования. В работе использовали клубеньковые бактерии R. phaseoli (эффективный штамм 682) из коллекции ВНИИ сельскохозяйственной биотехнологии (Москва, Россия).
В опытах были использованы питательные среды следующего состава (г/л). Питательная среда № 1: гороховая мука – 10; маннит – 6, (NH4)3PO4 – 2.8; MgSO4 – 0.2; KH2PO4 – 0.5; NaCl – 0.1. Питательная среда № 2: гороховая мука – 10; CH3COONa – 5; глутамат натрия – 1.5; маннит – 15, (NH4)3PO4 – 2.4; MgSO4 – 0.2; KH2PO4 – 0.5; NaCl – 0.1. Соотношение количества C : N составляло: для среды № 1 − 3 : 1; для среды № 2 − 20 : 1. Для поддержания культуры использовали агаризованную (3%) среду № 2. Для выращивания посевного материала смешивали равные объемы среды № 1 и № 2.
Для изучения биосинтеза ПГБ в аэробных условиях бактерии выращивали в колбах Эрленмейера со 150 мл питательной среды на качалке (200 об./мин) при 28°С. Посевную культуру выращивали в течение 24 ч до оптической плотности А600 = 0.2–0.25. Посев проводили смывом со скошенного агара (S-форма) или 2 мл культуры, замороженной в глицерине (R-форма). В вариантах опыта в колбы вносили по 10% посевного материала, затем культивировали в течение 60 ч. При синтезе ПГБ в микроаэрофильных условиях пробки колб со средой № 2 заматывали полиэтиленовой пленкой, предотвращавшей доступ воздуха к культуральной жидкости. Отбор проб в обоих случаях производили каждые 6 ч, в пробах определяли концентрацию биомассы и содержание ПГБ.
Обработка клеток редокс-медиаторами. На 38 ч культивирования в микроаэрофильных условиях (стационарная фаза роста, пик накопления ПГБ) в колбы вносили водный раствор пероксида трет-бутила до конечной концентрации 0.1 мМ или раствор бензилвиологена в этаноле до конечной концентрации 1.0 мМ. После добавления редокс-медиаторов отбор проб производили каждые 2 ч в течение 10 ч, далее – каждые 6 ч, определяли концентрацию биомассы и содержание ПГБ.
Биомассу (С) определяли по оптической плотности культуральной суспензии при λ = 600 нм относительно среды без клеток: C = A600/0.134 мг/мл.
Определение ПГБ. Для определения ПГБ в бактериях применяют различные методы. В работе также использовали несколько методик.
Метод Лоу. Для получения пленок ПГБ и калибровки флуоресцентного метода был использован метод Лоу [27] в предложенной в работе модификации. Бактериальную суспензию 1 мл (если А600 ≥ 0.2) или 2 мл (если А600 < 0.2) помещали в микропробирки, центрифугировали 5 мин при 5 тыс. g. К осадку добавляли 1 мл 2 н HCl и инкубировали 1 ч при 100°С, после чего центрифугировали 5 мин при 5 тыс. g. Осадок подсушивали, добавляли 1 мл хлороформа и интенсивно встряхивали. Микропробирки плотно закупоривали и встряхивали в течении ночи при 200 об./мин и при температуре 28°С. В стеклянный флакон отбирали нижнюю прозрачную хлороформ-содержащую фракцию и высушивали на воздухе. На дне флакона образовывался белый осадок (ПГБ), к которому добавляли 1 мл концентрированной H2SO4 и нагревали при 100°С в течение 1 ч. В результате гидролиза и дегидратации образовывалась кротоновая кислота. Оптическую плотность раствора измеряли при 235 нм (максимум оптической плотности кротоновой кислоты, обусловленный двойной связью), используя в качестве контроля концентрированную серную кислоту. Количество ПГБ рассчитывали по формуле: [ПГБ] (мг) = 0.0056 × А235.
Флуоресценция с Нильским красным. Флуоресцентный метод начали использовать для определения ПГБ в бактериальных клетках достаточно давно и применяют до настоящего времени. Чаще всего в качестве флуоресцентного красителя используют Нильский красный [28–30]. Именно этот краситель ранее был использован для определения ПГБ в бактероидах клубеньков люпина [31]. Данный метод − более быстрый и менее трудоемкий, чем метод Лоу, но он не позволяет получить ПГБ в нативном состоянии. В качестве флуоресцентых красителей для определения ПГБ в ряде работ также использовали Акридиновый оранжевый [32] и липофильный краситель LipidGreen1 (Корея) [33].
В настоящей работе использовали раствор Нильского красного в диметилсульфоксиде – 0.55 мг/мл. Клетки, отобранные на определенной стадии роста, разрушали ультразвуком. Разрушенные клетки центрифугировали и ресуспендировали в воде до А600 = 0.1. К 3 мл суспензии разрушенных клеток добавляли 41 мкл раствора Нильского красного до конечной концентрации 7.5 мкг/мл. Суспензию инкубировали 30 мин в темноте при комнатной температуре. Окрашенные образцы центрифугировали и ресуспендировали в 3 мл воды.
Исследования также проводили и с целыми клетками. В этом случае раствор Нильского красного добавляли к 3 мл стандартизированной суспензии клеток. Дальнейшую процедуру проводили, как описано выше. Окрашенные клетки центрифугировали и ресуспендировали в 3 мл воды.
Для определения ПГБ записывали спектры флуоресценции образцов при λвозб = 550 нм и λисп = 610 нм, при работе с целыми клетками λисп = 630 нм. Количество ПГБ расчитывали по формуле: [ПГБ] (%) = 0.072 × Em, где Em – эмиссия флуоресценции (отн. ед.).
Окрашивание Суданом черным. Метод определения бактериальных жироподобных соединений с красителем Суданом черным был разработан еще в 1940 г. [34], но и в 2015 г. при сравнении различных методов для определения ПГБ в клетках Rhizobium была показана его эффективность [32].
Для работы использовали 0.3%-ный раствор Cудана черного B в этиленгликоле (может быть использован также раствор в этаноле) и 0.5% водный раствор сафранина. Бактериальную пленку фиксировали нагреванием на предметном стекле, погружали в раствор Cудана черного B и окрашивали в течение 15 мин. Краситель сливали, промывали препарат водой и высушивали, после чего промывали предметное стекло поружением в ксилол и высушивали на воздухе. Можно провести дополнительную отмывку в этаноле, в котором судан черный хорошо растворяется. Дополнительно окрашивали препарат водным раствором сафранина в течение 5–10 с. Предметное стекло промывали водой, подсушивали и проводили микроскопию с иммерсионным маслом.
Спектрофотометрические исследования проводили на спектрофотометре Cary 300Bio (“Varian”, США) при комнатной температуре в кварцевых кюветах с длиной оптического пути 1 см при скорости сканирования 600 нм/мин. Спектры флуоресценции записывали на спектрофлуориметре Shimadzu RF-5301 PC (Япония). Для микроскопии использовали микроскоп ЛОМО (Россия), серия XS, объектив 100/1.25 OIL 160.017.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Ранее все клубеньковые бактерии (КБ) относили к одному роду Rhizobium, однако в дальнейшем, с развитием микробиологии и молекулярной генетики, классификация существенно усложнилась, соответственно изменились и названия бактерий. Теперь КБ относят не только к разным родам, на даже к разным семействам протеобактерий. Первыми из рода Rhizobium в 1982 г. был выделен род Bradyrhizobium [35]. При этом реклассификация видов продолжается до настоящего времени. Так бактерия Bradyrhizobium lupini (ранее Rhizobium lupini) – микросимбионт растений люпина, один из основных объектов исследований процесса азотфиксации в Институте биохимии им. А.Н. Баха РАН, была реклассифицирована только в 2015 г. [36]. Бактерия Rhizobium phaseoli – объект данного исследования, микросимбионт растений фасоли, – сохранила свое видовое название. В то же время ко всем клубеньковым бактериям применяют обобщающее название – ризобии.
Известно, что КБ, как и многие другие, могут находиться в различных морфологических формах. Явление диссоциации бактерий на S- (от англ. smooth – гладкий) и R-формы (rough – шероховатый) впервые исследовали Вейль и Феликс в 1917 г. [37], а в 1930 г. это было показано для клубеньковых бактерий [38]. Подробное описание различий между этими формами было приведено в работе Хедли 1927 г. [39], и оно не теряет актуальности до настоящего времени.
Для грамотрицательных (в том числе для клубеньковых) бактерий основной является S-форма. Ее основные признаки: гомогенный рост в бульоне и ограниченный рост на агаре с флуоресцирующими колониями. Колонии гладкие, правильные, выпуклые, могут давать дочерние. Биохимически более активна. Основными признаками R-формы являются агглютинативный рост в бульоне, расползающийся рост на агаре с редко флуоресцирующими колониями. Колонии шероховатые, неправильные, плоские, дочерние колонии дает редко. Биохимически менее активна.
Полиалканоаты обнаруживаются только у S‑форм (с гладкими колониями) большинства грамотрицательных и ряда грамположительных бактерий, что принято считать одним из главных отличий истинной S-культуры от R-формы.
В работе поддержание культуры проводили в S-форме, которая является основной для грамотрицательных бактерий. R-форма была получена при выращивании культуры в неблагоприятных условиях (культивирование на бедной среде с последующим замораживанием при –70°С). Как и можно было предположить, только S-формы клеток исследованного штамма R. phaseoli были способны к синтезу ПГБ.
На рис. 1 показаны клетки R. phaseoli в S-форме на разных стадиях роста, окрашенные красителем Суданом черным. Включения поли-β-оксимасляной кислоты выглядят как черно-синие капельки, в то время как цитоплазма клеток окрашивается в розовый цвет. На фотографиях хорошо видно увеличение количества гранул ПГБ в клетках со временем выращивания.
Рис. 1.
Клетки R. phaseoli (S-форма), окрашенные суданом черным и сафранином, после– 9 (а), 33 (б) и 57 (в) ч роста на среде № 2 в микроаэрофильных условиях. Увеличение ×10000.

Поскольку задачей настоящей работы было изучение накопления ПГБ клетками R. phaseoli, возникла необходимость использовать максимально точные методы для определения полимера. Традиционный метод Лоу [27], основанный на спектрофотометрическом определении кротоновой кислоты, образующейся при гидролизе ПГБ, был модифицирован, что позволило выделять и определять количество полимера непосредственно в биомассе, минуя длительные стадии очистки. Кроме того, метод оказался удобным для расчетов, так как зависимость между количеством ПГБ и оптическим поглощением кротоновой кислоты, в нащем случае была линейной. Кроме того, для определения содержания ПГБ непосредственно в клетке использовали метод, основанный на флуоресценции красителя Нильского красного, связывающегося с ПГБ, также дающий линейную зависимость между количеством полимера, определенного по методу Лоу и интенсивностью флуоресценции Нильского красного в ДМСО.
Изучено накопление ПГБ клетками S- и R‑формы на бедной (С : N = 3 : 1) и богатой (С : N = 20 : 1) по углероду питательных средах соответственно, поскольку известно, что соотношение азота и углерода очень сильно влияет на метаболизм бактерий, а ПГБ является конечным метаболитом обмена углеводов в бактериальной клетке. При выращивании на двух средах выход биомассы различался незначительно, а накопление ПГБ на богатой по углероду среде № 2 происходило ~ на 50% активнее, при этом гранулы полимера были более ярко выражены. В клетках R‑формы ПГБ не накапливался независимо от вида питательной среды, хотя в аэробных условиях биомасса у бактерий этой формы нарастала даже лучше. Различия наглядно видны на графиках (рис. 2). Для накопления ПГБ в клетках необходимо достаточное количество источников углерода, а сам полимер является запасным веществом, накапливающимся при избытке углеродных субстратов.
Рис. 2.
Накопление биомассы (а, б) и ПГБ (в, г) клетками R. phaseoli, выращенными в аэробных условиях на среде № 1 (а) и № 2 (б). 1 – S-, 2 – R-форма.
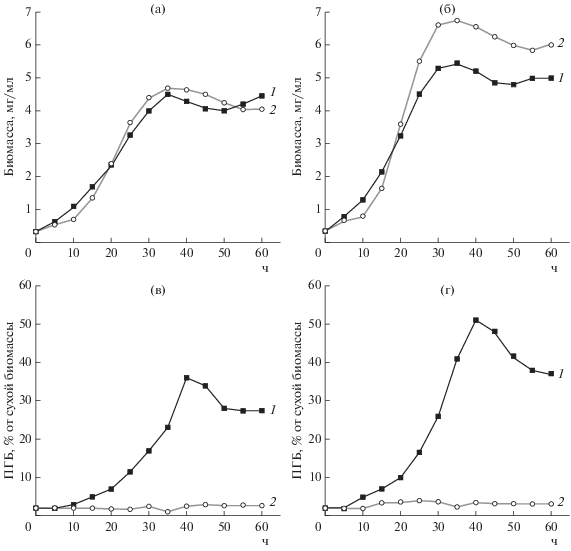
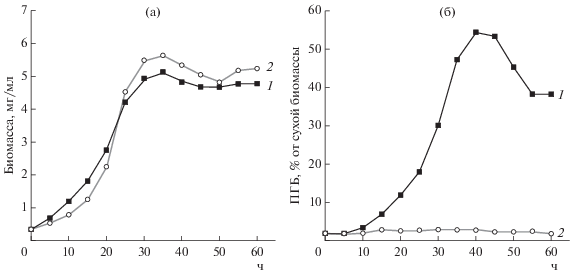
При выращивании бактерий R. phaseoli были использованы аэробные и микроаэрофильные условия. Показано, что в микроаэрофильных условиях синтез ПГБ в клетках R. phaseoli увеличивался ~ на 10% по сравнению с аэробными условиями, а содержание ПГБ могло достигать 54% от сухой биомассы (рис. 3). Во всех исследованных вариантах максимальное количество биомассы и максимум содержания ПГБ в клетках достигались к 35–40 ч роста.
Рис. 3.
Накопления биомассы (а) и ПГБ (б) клетками R. phaseoli, выращенными в микроаэрофильных условиях при культивировании на среде № 2. 1 – S-, 2 – R-форма.
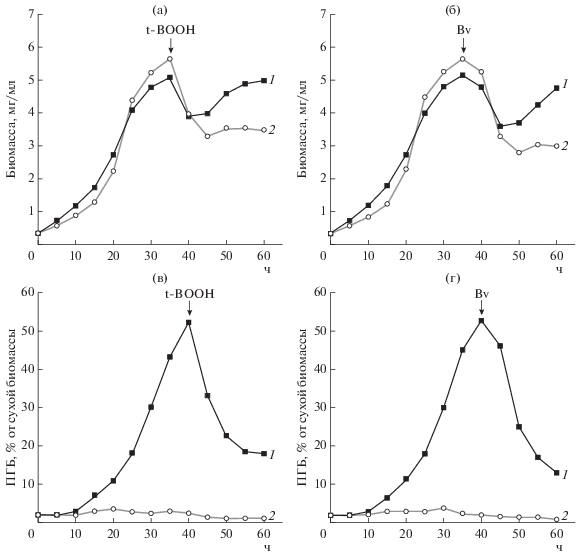
Изучено влияние окислительного стресса на рост бактерий R. phaseoli, синтезирующих ПГБ. В качестве индукторов окислительного стресса (прооксидантов) были использованы пероксид третбутила (t-BOOH) и бензилвиологен (Bv). Оба вещества негативно влияли на рост бактерий, и рост возобновлялся только у S-форм, синтезирующих ПГБ (рис. 4а, 4б) ~ через 6 ч после действия индукторов окислительного стресса. Еще через 10–12 ч биомасса S-формы вновь достигала максимального уровня. Необходимо отметить, что содержание самого полимера в клетках после действия t-BOOH и Bv резко падало и уже больше не восстанавливалось (рис. 4в, 4г). Таким образом, можно сделать вывод, что ПГБ являлся протектором для клубеньковых бактерий при окислительном стрессе.
Рис. 4.
Накопление биомассы (а, б) и ПГБ (в, г) клетками R. phaseoli при культивировании на среде № 2 в микроаэрофильных условиях при действии пероксида трет-бутила (а) и бензилвиологена (б). 1 – S-, 2 – R-форма.
Известно, что при низкой концентрации кислорода и высоком содержании углеводов клетки ризобий могут оказаться в состоянии редуктивного стресса – переполнение НАД(Ф)Н. Для его снижения может происходить активация метаболических путей, потребляющих восстановительные эквиваленты – синтез гликогена или ПГБ. За счет сброса электронов от НАД(Ф)Н на синтез ПГБ регенерируется НАД(Ф)+, и, тем самым, предотвращается ингибирование ферментов цикла Кребса – НАДФ+-зависимой изоцитратдегидрогеназы (КФ 1.1.1.42) и цитратсинтазы (КФ 2.3.3.1) [16]. Другой протекторной функцией ПГБ для бактерий является мобилизация энергетических запасов на случай стрессовой ситуации, в том числе недостатка углеводов. Известно, что ПГБ может защищать клетку и от других стрессовых воздействий: теплового и осмотического шока, УФ-облучения, действия окислителей [12, 40].
ПГБ накапливается в клетках прокариот в условиях несбалансированного роста и выполняет функцию резервного вещества для запасания углерода и энергии, подобно жиру, гликогену и крахмалу у животных и растений. Эти биополимеры обладают рядом специфических свойств, таких, как способность к биодеструкции и совместимость с живой тканью организма, что открывает большие возможности для их использования в практике [41–43]. Конечным продуктом биодеградации ПГБ в окружающей среде является вода и двуокись углерода, а в живом организме – 3‑изомасляная кислота.
ПГБ и другие полигидроксиалканоаты могут найти и уже находят применение в медицине в качестве рассасывающихся шовных нитей, повязок, тампонов, пластин и стержней в ортопедии, а также как полимерная матрица для медикаментов длительного высвобождения [44–46]. Перспективным считается использование ПГА в качестве тары для хранения многих жидких и сыпучих веществ, в частности, одноразовых бутылок, банок, флаконов. Благодаря низкой проницаемости пленки из ПГА для кислорода, она может быть использованы для упаковки пищевых продуктов. Одним из важнейших преимуществ производства биополимеров является возможность использования в качестве сырья постоянно воспроизводимых пищевых ресурсов, таких, как сахар и отходы его производства. Кроме того, захоронение изделий из ПГА после использования обеспечивает их полную биодеградацию и исключает загрязнение окружающей среды. Сам процесс биосинтеза также практически не дает побочных продуктов, производство ПГА является безотходным, поэтому экологический аспект этих разработок также очень важен [17].
Бактериальные ПГА рассматриваются как очень перспективные биоразлагаемые полимеры и изучаются их различные возможные продуценты [17]. В работе [47] в качестве источника мономеров для ПГА были рассмотрены виды еще одного рода клубеньковых бактерий – Mezorhizobium, выделенные из клубеньков Lotus corniculatus, причем синтез мономеров в этом случае являлся штамм-зависимым.
Как было отмечено выше, в наших опытах содержание ПГБ в клетках R. phaseoli в некоторых случаях могло достигать 54% от сухой массы клеток, что превышает максимальную для клубеньковых бактерий рода Mezorhizobium (штамм CSLC10N) величину 44%, как это описано в работе [47]. Такая величина близка значениям, характерным для бактериальных штаммов-продуцентов полимера, использующихся в биотехнологии. Можно сделать заключение, что клубеньковые бактерии, выращенные в глубинной культуре, могут быть потенциальными продуцентами ПГБ и других ПОА.
При проведении исследований использовали оборудование Центра коллективного пользования “Промышленные биотехнологии” Федерального исследовательского центра “Фундаментальные основы биотехнологии” Российской академии наук”.
Список литературы
Meyer A. Praktikum der botanischen bakterienkunde. Jena: G. Fischer, 1903. 157 s.
Lemoigne M. // Bull. Soc. Chim. Biol. 1926. V. 8. P. 770−782.
Macrae R.M., Wilkinson J.R. // J. Gen. Microbiol. 1958. V. 19. P. 210−222.
Schlegel H.G., Gottschalk G., Von Bartha R. // Nature. 1961. V. 191. №. 4787. P. 463−465.
Dawes E.A., Senior P.J. // Adv. Microbiol. Physiol. 1973. V. 10. P. 135−266.
Slater S.C., Voige W.H., Dennis D.E. // J. Bacteriol. 1988. V. 170. №. 10. P. 4431−4436.
Schubert P., Steinbüchel A., Schlegel H.G. // J. Bacteriol. 1988. V. 170. №. 12. P. 5837−5847.
Peoples O.P., Sinskey A.J. // J. Biol. Chem. 1989. V. 264. № 26. P. 15293−15297.
Poirier Y., Erard N., Petetot J.M.C. // FEMS Microbiology Letters. 2002. V. 207. № 1. P. 97−102.
Lossl A., Eibl C., Harloff H.J., Jung C., Koop H.U. // Plant Cell Reports. 2003. V. 21. № 9. P. 891−899.
Forsyth W.G.C., Hayward A.C., Roberts J.B. // Nature. 1958. V. 182. №. 4638. C. 800−801.
Романов В.И. // Успехи биологической химии. 1977. Т. 18. С. 211−230.
Sutton W.D., Pankhurst C.E., Craig A.S. // Intern. Rev. Cytol. 1982. Suppl. 13. P. 149−177.
Lodwig E., Poole P. // Cr. Rev. Plant Sci. 2003. V. 22. P. 37–78.
Cevallos M.A., Encarnacion S., Leija A., Mora Y., Mora J. // J. Bacteriol. 1996. V. 178. P. 1646–1654.
Trainer M.A., Charles T.C. // Appl. Microbiol. Biotechnol. 2006. V. 71. P. 377–386.
Saharan B.S., Grewal A., Kumar P. // Chinese J. Biology. 2014. V. 2014. e802984.
Романов В.В., Юшкова Л. А., Кретович В.Л. // Микробиология. 1975. Т. 44. № 5. С. 820−824.
Федулова Н.Г., Черменская И.Е., Романов В.И., Кретович В.Л. // Физиология растений. 1980. Т. 27. № 4. С. 544−549.
Topunov A.F. // Biochemistry (Moscow). 1995. V. 60. № 1. P. 45−49.
Topunov A.F., Petrova N.E. // Russian J. Plant Physiol. 1997. V. 44. № 5. P. 580−584.
Topunov A.F., Rozov F.N., Petrova N.E. // Russian J. Plant Physiol. 1998. V. 45. № 6. P. 814−819.
Layzell D.B., Atkins C. The Physiology and Biochemistry of Legume N2 Fixation. // Plant Metabolism. /Ed. D.T. Dennis, D.H. Turpin, D.D. Lefebvre, D.B. Layzell. Singapore: Longman Singapore Publishers, 1997. P. 495−505.
Stam H., van Verseveld H.W., de Vries W., Stoutha-mer A.H. // FEMS Microbiology Letters. 1986. V. 35. № 2–3. P. 215–220.
Paganelli F.L., de Macedo Lemos E.L., Carareto Alves L.M. // World J. Microb. Biot. 2011. V. 27. № 4. P. 773–778.
Madison L.L., Huisman G.W. // Microbiol. Mol. Biol. Rev. 1999. V. 63. P. 21–53.
Law J.H., Slepecky R.A. // J. Bacteriol. 1961 V. 82. № 1. P. 33−36.
Spiekermann P., Rehm B.H., Kalscheuer R., Baumeister D., Steinbuchel A. // Arch. Microbiol. 1999. V. 171. № 2. P. 73−80.
Tyo K.E., Zhou H., Stephanopoulos G.N. // Appl. Environ. Microbiol. 2006. V. 72. P. 3412–3417.
Pinzon N.M., Aukema K.G., Gralnick J.A., Wackett L.P. // mBio. 2011. V. 2. № 4. e00109–11.
Romanov V.I., Fedulova N.G., Tchermenskaya I.E., Shramko V.I., Molchanov M.I., Kretovich W.L. // Plant Soil. 1980. V. 56. № 3. P. 379−390.
Manju J, Prabakaran P. // International J. Engineering Science Invention. 2015. V. 4. № 11. P. 23−28.
Ji Eun Choi, Hye Young Na, Taek Ho Yang, Sung-Keun Rhee, Jae Kwang Song. // AMB Express. 2015. V. 5. P. e48.
Hartman L. // Staining Technology. 1940. V. 15. P. 23−28.
Jordan D.C. // Int. J. Syst. Bacteriol. 1982. V. 32. № 1. P. 136−139.
Mateos P.F., Velázquez E., Igual J.M., Martínez-Molina E., Peix A., Trujillo M.E., Ramírez-Bahena M.H., Flores-Félix J.D., Alonso de la Vega P., Rivas R. // Int. J. Syst. Evol. Microbiol. 2015. V. 65. № 4: P. 1213–1219.
Weil E., Felix A. // Wien. Klin. Wochenschr. 1917. B. 30. S. 1509–1511.
Israilski W., Starygin L. // Zbl. Bacter. II. 1930. B. 81. S. 1−11.
Hadley P. // Journal of Infectious Diseases. 1927. V. 40. № 1. P. 1−312.
Kadouri D., Jurkevitch E., Okon Y. // Appl. Environ. Microbiol. 2003. V. 69. P. 3244–3250.
Byrom D. // Trends in Biotechnol. 1987. V. 5. №. 9. P. 246–250.
Piskin E. // J. Biomaterials Science, Polymer Edition. 1995. V. 6. №. 9. P. 775−795.
Alejandra R.C., Margarita C.M., Soledad M.C.M. // Polymer Degradation and Stability. 2012. V. 97. №. 11. P. 2473−2476.
Бонарцев А.П., Иорданский А.Л., Бонарцева Г.А., Босхомджиев А.П., Заиков Г.Е. // Пластические массы. 2010. № 3. С. 6−23.
Бонарцев А.П., Бонарцева Г.А., Воинова В.В., Кирпичников М.П., Шайтан К.В. // Вестник Российского государственного медицинского университета. 2018. № 6. С. 130−134.
Bonartsev A.P., Shaitan K.V., Kirpichnikov M.P., Bonartseva G.A. // Biochemistry (Moscow) Supplement. Series B: Biomedical Chemistry. 2011. V. 5. № 1. P. 10−21.
Marcos–García M., García–Fraile P., Filipová A., Menéndez E., Mateos P.F., Velázquez E., Cajthaml T., Rivas R. // Environmental Science and Pollution Research. 2017. V. 24. № 21. P. 17436–17445.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


