Прикладная биохимия и микробиология, 2020, T. 56, № 1, стр. 35-38
Конформация макромолекул полимера-носителя и активность иммобилизованного фермента
И. Л. Валуев 1, *, Л. В. Ванчугова 1, Л. И. Валуев 1
1 Институт нефтехимического синтеза им. А.В.Топчиева Российской академии наук
119991 Москва, Россия
* E-mail: ivaluev@ips.ac.ru
Поступила в редакцию 27.02.2019
После доработки 22.06.2019
Принята к публикации 30.08.2019
Аннотация
Изучена зависимость активности иммобилизованного трипсина от конформации макромолекулы полимера-носителя. Методом флуоресцентной спектроскопии показано, что иммобилизация фермента на жесткой полимерной глобуле предотвращала ассоциацию его молекул и обеспечивала доступность активных центров даже для высокомолекулярного субстрата.
В современной прикладной биохимии и биотехнологии нашли широкое применение биологически активные соединения, главным образом ферменты, иммобилизованные на природном или синтетическом полимерном носителе [1]. Одним из условий успешного использования таких систем является правильный выбор носителя, при котором удается существенно повысить время активного функционирования ферментов, изменить их каталитическую активность и специфичность действия, а также интенсифицировать технологические процессы с участием этих биологических катализаторов.
В предыдущих работах [2, 3] при изучении модификации белкового ингибитора протеолитических ферментов (ММ 31000 Да) природными и синтетическими полимерами было высказано предположение, что, наряду с химическими свойствами используемого носителя, обеспечивающими его реакцию с белком в мягких условиях, определенный вклад в изменение активности модифицированного белка может вносить и конформация полимерной цепи носителя. Было также предположено, что повышение гибкости цепи увеличивает вероятность внутримолекулярной ассоциции связанных с ней белковых молекул, создавая тем самым стерические препятствия для их реакции с высокомолекулярным субстратом. В качестве белка был использован трипсин (КФ 3.4.21.4), который был одним из первых ферментов, изученных в иммобилизованном состоянии [4]. Выбор полиакриламида и декстрана в качестве носителей обусловлен их достаточно широким применением в медицине, биотехнологии и пищевой промышленности [5–7]. Флуоресцентная спектроскопия была основным методом для изучения ассоциации белковых молекул.
Цель работы – синтезировать производные фермента с двумя полимерами, различающимися конформациями цепи, и найти корреляцию между строением этих производных и каталитической активностью иммобилизованного фермента по отношению к низко- и высокомолекулярным субстратам.
МЕТОДИКА
В работе использовали акриламид, п-нитроанилид N-α-бензоил-D,L-аргинина (БАПА) и декстран с ММ 125000 Да (“Serva”, Германия), трипсин, панкреатический ингибитор трипсина (ПИТ), ингибитор трипсина из сои (СИТ), родамин-В-изотиоцианат и флуоресцеин-изотиоцианат на цеолите (“Sigma”, США), утиный овомукоид (ОМ, ММ 31000 Да) (“Белмедпрепараты”, Беларусь), сефадексы G-25 и G-100 (“Pharmacia”, Швеция). N-aкрилоилгидроксифталимид (АГФИ) синтезировали по методике [8].
Родамин- (РТ) и флуоресцеинмеченный трипсин (ФТ) получали реакцией трипсина с родамин-В- или флуоресцеин-изотиоцианатом на цеолите. Раствор отфильтровывали от цеолита и отделяли от непрореагировавшего красителя на сефадексе G-25.
Спектры флуоресценции регистрировали на спектрофлуориметре F-4000 (“Hitachi”, Япония).
Иммобилизацию трипсина на декстране проводили по методике [9]. При этом для иммобилизации была использована смесь РТ и ФТ (мольное соотношение 2 : 1). Продукты иммобилизации отделяли от непрореагировавших компонентов гель-фильтрацией на сефадексе G-100.
Иммобилизацию аналогичной смеси РТ и ФТ на полиакриламиде осуществляли взаимодействием свободных аминогрупп молекул фермента с предварительно синтезированным активированным сополимером акриламида и АГФИ. Молекулярную массу полимеров оценивали методом визкозиметрии [10].
Амидазную активность нативного и иммобилизованного трипсина определяли, измеряя степень гидролиза БАПА по методу Какадэ [11]. Активность фермента выражали в %, принимая за 100% активность нативного фермента.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Для выяснения роли конформационного состояния макромолекулы полимера-носителя в проявлении активности иммобилизованным ферментом были использованы два полимера: природный полисахарид – декстран, и карбоцепной синтетический полимер – полиакриламид. В растворе макромолекула полиакриламида находится в конформации статистического клубка, в котором внутримолекулярная концентрация собственных звеньев не превышает 1 мас. %. [12]. Макромолекула декстрана имеет более плотную упаковку и форму жесткого клубка [13].
Для иммобилизации на декстране фермент предварительно окисляли перйодатом калия. Продукт окисления содержал 51 ± 6 альдегидных групп, которые определяли спектрофотометрически с помощью 4-амино-3-гидразино-5-меркапто-1,2,4-триазола [14]. Взаимодействием альдегидных групп декстрана с аминогруппами трипсина и восстановлением азометиновой связи боргидридом натрия были получены и выделены производные декстрана, каждая макромолекула которого содержала в среднем от одной до семи молекул трипсина.
Иммобилизацию меченного трипсина на полиакриламиде проводили, используя сополимеры акриламида и АГФИ, имеющие молекулярную массу 104 000–107 000 Да. Изменением концентрации взаимодействующих соединений были получены и выделены производные, каждая молекула которых содержала в среднем от одной до шести молекул фермента.
Результаты изучения активности иммобилизованного трипсина по отношению к низко- и высокомолекулярным субстратам приведены в табл. 1. Из табл. 1 видно, что изменение природы полимерной цепи лишь в незначительной степени влияло на активность иммобилизованного трипсина по отношению к низкомолекулярному субстрату – БАПА. Так, активность трипсина, иммобилизованного на декстране, составляла 69–80% от активности нативного фермента, а трипсина, связанного с полиакриламидом – 66–74%. При этом активность фермента практически не зависела от количества его молекул, связанных с носителем. Следовательно, при иммобилизации трипсина на обоих носителях не создавалось значительных стерических препятствий для взаимодействия активных центров соседних молекул фермента с субстратом.
Таблица 1.
Каталитическая и комплексообразующая активность иммобилизованного трипсина
| Полимер | Иммобилли-зованный трипсин* | Активность по отношению к различным субстратам, % от активности нативного трипсина ** | |||
|---|---|---|---|---|---|
| БАПА | ПИТ | СИТ | ОМ | ||
| Декстран | 1–2 | 72–75 | 66–70 | 58–62 | 47–51 |
| 3–4 | 74–80 | 59–64 | 61–67 | 45–49 | |
| 6–7 | 69–75 | 61–67 | 56–60 | 50–54 | |
| Полиакрил-амид | 1–2 | 67–72 | 62–65 | 52–56 | 45–49 |
| 4–5 | 70–74 | 44–49 | 40–46 | 34–39 | |
| 6–7 | 66–70 | 38–42 | 35–39 | 28–34 | |
Иная картина наблюдалась при изучении активности иммобилизованного трипсина по отношению к высокомолекулярным соединениям. Эту активность оценивали, изучая состав комплексов трипсина с панкреатическим ингибитором (ММ 6500 Да), ингибитором из сои (ММ 21 000 Да) и овомукоидом (ММ 31 000 Да). Все эти ингибиторы подавляли активность трипсина путем образования комплекса с константой связывания порядка 1010 М–1 [15].
Из данных табл. 1 видно, что в этом случае активность иммобилизованного трипсина определялась природой используемого носителя и количеством связанных с ним молекул фермента. Если это количество невелико (1–2 молекулы трипсина на одну макромолекулу носителя), то активность иммобилизованного трипсина практически не зависела от природы носителя и слегка уменьшалась (с 66–70 до 45–51% от активности нативного фермента) с увеличением молекулярной массы ингибитора с 6500 до 31 000 Да.
Конформационное состояние полимера носителя начинало проявляться при увеличении числа связанных с полимером молекул трипсина. Активность иммобилизованного на полиакриламиде трипсина (Т-ПАА) оказалась значительно ниже, чем активность фермента, иммобилизованного на декстране (Т-Д). При этом, чем выше молекулярная масса ингибитора, тем больше была эта разница.
В предыдущих работах [1–3] было высказано предположение, что такое снижение активности может быть обусловлено белок-белковыми взаимодействиями, характерными для поведения белков в растворе, то есть внутримолекулярной ассоцицией связанных с молекулой полимера белковых глобул. Для проверки этого предположения в данной работе был использован метод флуоресцентной спектроскопии (рис. 1).
Рис. 1.
Зависимость интенсивности флуоресценции (отн. ед.) при 518 нм смеси ФТ и РТ (1) и ФТ и РТ, иммобилизованных на декстране (2) и на полиакриламиде (3), от концентрации фермента (соотношение ФТ и РТ – 1 : 2).
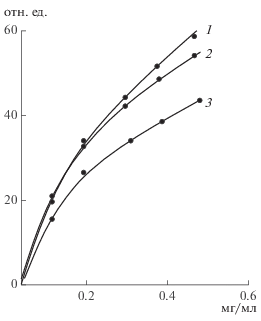
На рис. 1 приведена зависимость интенсивности флуоресценции водных растворов, полученных при смешивании ФТ и РТ (1) и при иммобилизации этой смеси на декстране (2) и полиакриламиде (3), от концентрации фермента. Видно, что интенсивность флуоресценции ФТ, иммобилизованного совместно с РТ на декстране, была несколько ниже, чем раствора смеси ФТ и РТ, то есть происходила передача части энергии с донора (Ф) на акцептор (Р). В существенно большей степени эффект понижения интенсивности флуоресценции был характерен для ФТ, иммобилизованного совместно с РТ на полиакриламиде. Эти результаты свидетельствовали о том, что при иммобилизации образовывались ассоциаты ФТ и РТ, в которых расстояние между метками оказывалось значительно меньше среднего расстояния, рассчитанного для равномерного распределения белковых глобул [16]. В наибольшей степени этот эффект наблюдался для трипсина, иммобилизованного на гибком носителе, полиакриламиде. Жесткая структура глобулы декстрана препятствовала сближению иммобилизованных на ней молекул фермента, что и обеспечивало их доступность даже для относительно высокомолекулярного ингибитора.
Таким образом, на основании полученных результатов можно сделать вывод о том, что конформация макромолекул полимера-носителя является одним из основных факторов, определяющих активность иммобилизованного белка по отношению к высокомолекулярным субстратам. Так, молекулы белка, иммобилизованные на гибком носителе, образовывали ассоциаты, создавая тем самым стерические препятствия для взаимодействия с высокомолекулярным субстратом. Жесткие цепи носителя предотвращали такую ассоциацию, обеспечивая доступность его активных центров для высокомолекулярных субстратов. Для низкомолекулярных субстратов такая ассоциация не являлась определяющей и молекулы белка сохраняли высокую активность после иммобилизации на носителе, как с гибкой, так и жесткой цепью. Полученные результаты открывают еще одну возможность регулирования специфичности действия ферментов путем подбора носителя с разной гибкостью полимерной цепи.
Работа выполнена в рамках Государственного задания ИНХС РАН.
Список литературы
Maiti S., Shklyaev O.E., Balazs A.C., Sen A. // Langmuir. 2019. V. 35. № 10. P. 3724–3732.
Шаназарова И.М., Ванчугова Л.В., Валуев Л.И., Платэ Н.А. // Прикл. биохимия и микробиология. 1992. Т. 28. № 2. С. 292–295.
Валуева Т.А., Валуев И.Л., Обыденнова И.В., Валуев Л.И. // Биоорганическая химия. 2010. Т. 36. № 6. С. 769–773.
Martinek K., Goldmacher V.S., Klibanov A.M., Berezin I.V. // FEBS Lett. 1975. V. 51. № 1. P. 152–155.
Абрамов Л.И., Байдуров Т.А., Григорян Э.П., Зильберман Е.Н., Куренков В.Ф., Мягченков В.А. Полиакриламид, М.: Химия. 1992. 192 с.
Schirmer B., Rezniczek T., Seifert R., Neumann D. // Biochem. Pharmacol. 2015. V. 98. № 1. P. 102–109.
Li J., Yu S., Yao P., Jiang M. // Langmuir. 2008. V. 24. № 7. P. 3486–3492.
Назарова О.В., Соловский М.В., Панарин Е.Ф., Алексеева С.В.// Высокомолекулярные соединения. 1989. Т. 31А. № 2. С. 387–396.
Reiner R.H., Batz H.G. // Macromol. Chem. 1981. V. 182. № 6. P. 1641–1648.
Шур А.М. Высокомолекулярные соединения. М.: Высшая школа. 1981. 657с.
Kakade M.L., Simons N., Liener J.E. // Cereal Chem. 1969. V. 46. № 5. P. 518–526.
Цветков В.Н., Эскин В.Е., Френкель С.Я. Структура макромолекул в растворах. М.: Наука, 1964. 719 с.
Arond L.H., Fran H.P. // J. Phys. Chem. 1954. V. 58. № 11. P. 953–957.
Dickinson R.G., Jacobsen N.W. // J. Soc. Chem. Commun. 1970. V. 64. № 5. P. 1719–1724.
Мосолов В.В. // Протеолитические ферменты. М.: Наука. 1971. 404 с.
Fairclough R.H., Cantor C.R. // Methods Enzymol. 1978. V. 48. P. 347–379.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


