Прикладная биохимия и микробиология, 2020, T. 56, № 3, стр. 223-241
Грибы рода Alternaria как продуценты биологически активных соединений и биогербицидов (обзор)
А. А. Далинова 1, Д. Р. Салимова 1, А. О. Берестецкий 1, *
1 ВНИИ защиты растений
196608 С.-Петербург, Россия
* E-mail: aberestetskiy@vizr.spb.ru
Поступила в редакцию 03.03.2019
После доработки 20.12.2019
Принята к публикации 23.12.2019
Аннотация
За последние несколько десятилетий было описано свыше 300 метаболитов грибов рода Alternaria, многие из которых проявляют биологическую активность по отношению к растениям, бактериям, грибам и простейшим. В обзоре обобщены современные данные о структуре, биологической активности и возможностях практического применения в защите растений, фармакологии и хемосистематике вторичных метаболитов грибов рода Alternaria. Некоторые виды грибов этого рода, поражающие сорные растения, были предложены в качестве продуцентов биогербицидов. Затронуты токсикологические аспекты применения грибов рода Alternaria в качестве биогербицидов.
Анаморфный род грибов Alternaria относится к семейству Pleosporaceae (Pleosporales, Dothideomycetes и Ascomycota). Отличительным признаком грибов этого рода является образование крупных, многоклеточных темноокрашенных конидий с поперечными и продольными перегородками. Систематика грибов рода Alternaria – предмет постоянных научных дискуссий и регулярно пересматривается. В настоящее время род насчитывает более 350 видов. Его делят на две условные группы – мелко- и крупноспоровых видов, которые, в свою очередь, с использованием морфологического и молекулярно-филогенетического подходов разделены на несколько секций [1–3].
Экологическое и практическое значение грибов рода Alternaria очень велико. Многие виды являются сапротрофами и развиваются на разнообразных органических субстратах и наряду с другими микроорганизмами принимают участие в разложении и минерализации растительных остатков. Однако большинство представителей рода Alternaria (A. brassicae, A. brassicicola, A. solani, A. porri и др.) вызывают болезни растений, а для ряда сельскохозяйственных культур являются одними из самых вредоносных. Как правило, грибы этого рода поражают листья, но могут также поражать семена и плоды [4]. Некоторые представители Alternaria spp. охарактеризованы как эндофиты. Ряд видов грибов этого рода, поражающие сорные растения, были предложены в качестве продуцентов биогербицидов [5–8].
За последние несколько десятилетий были описаны свыше 300 вторичных метаболитов грибов рода Alternaria, многие из которых проявляют биологическую активность по отношению к растениям, бактериям, грибам и простейшим. Эти метаболиты относятся ко всем классам природных соединений [9, 10]. Фитопатогенные представители рода Alternaria известны своей способностью продуцировать специфичные и неспецифичные фитотоксины [4]. Вторичные метаболиты микроскопических грибов, в частности, грибов рода Alternaria, могут служить основой для разработки новых пестицидов или лекарственных средств [11]. С другой стороны, грибы рода Alternaria, как сапротрофы, так и патогены сельскохозяйственных культур, продуцируют микотоксины − контаминанты пищевых продуктов [12].
В представленном материале обобщены современные данные о структуре, биологической активности и возможностях практического использования вторичных метаболитов грибов рода Alte-rnaria в защите растений, фармакологии и хемосистематике. Затронуты также токсикологические аспекты применения грибов рода Alternaria в качестве продуцентов биогербицидов.
Микотоксины. Некоторые мелкоспоровые виды рода Alternaria входят в комплексы микромицетов, развивающиеся на сельскохозяйственной продукции при хранении. Со второй половины ХХ в. активно изучается возможное токсическое действие метаболитов альтернариоидных микромицетов на здоровье человека и животных [13, 14]. Из потенциально токсичных метаболитов грибов этого рода наиболее распространенными контаминантами пищевых продуктов являются альтернариол (АОЛ) и его метиловый эфир (АМЭ), тентоксин (ТТ), тенуазоновая кислота (ТеК) и альтертоксины I, II и III (рис. 1) [13, 15, 16]. Производные дибензопиранона – АОЛ и АМЭ – являются наиболее характерными метаболитами грибов рода Alternaria, их образуют как крупноспоровые виды (A. solani, A. porri, A. dauci и др.), так и мелкоспоровые (A. alternata, A. tenuissima, A. arborescens и др.) [16–19]. Производное тетрамовой кислоты, ТеК, и периленхиноновые производные, альтертоксины I, II и III, образуют преимущественно мелкоспоровые виды Alternaria [16].
Рис. 1.
Микотоксины грибов рода Alternaria: 1 – альтернариол, 2 – метиловый эфир альтернариола, 3 – тентоксин, 4 – тенуазоновая кислота, 5 – альтертоксин I, 6 – альтертоксин II.

Современные исследования микотоксинов грибов рода Alternaria охватывают несколько основных направлений, включающих оценку возможных токсических эффектов микотоксинов in vitro и in vivo, разработку чувствительных методик обнаружения микотоксинов (в том числе “замаскированных” – конъюгированных), скрининг различных образцов кормов и пищевых продуктов на содержание основных микотоксинов и их производных, а также изучение стабильности микотоксинов в процессе переработки фруктов, овощей и зерновых продуктов.
Среди основных микотоксинов грибов рода Alternaria только ТеК проявляет выраженную острую токсичность: ЛД50 для куриных эмбрионов составляет 548 мкг/яйцо [20], для крыс – 168 мг/кг, собак – 2.5–10 мг/кг [21]. Токсичность АОЛ и его производных, а также альтертоксинов, по-видимому, заключается в развитии отдаленных эффектов: генотоксичности, канцерогенности и др. [22, 23]. Так, в опытах in vitro показано, что АОЛ и его метиловый эфир способны активировать онкогены в клетках эпителия кишечника человека [24], ингибировать топоизомеразы I и IIα [25, 26], вызывать мутации в клетках фибробластов китайского хомячка V79 [22]. На линиях клеток Caco-2 было показано, что АОЛ в суб-цитотоксичных концентрациях (15–60 мкМ) вызывает нарушения клеточного цикла и изменяет мембранный потенциал митохондрий. Это является, очевидно, следствием генотоксичности микотоксина и приводит к апоптозу и некрозу клеток [27]. АОЛ и АМЕ подавляли индукцию клеточного иммунитета на культурах макрофагов мыши и легочного эпителия человека в концентрации 10 мкМ [28]. В опытах in vitro было показано, что АМЭ и АОЛ в концентрациях 2.5–10 мкМ проявляют микоэстрогенные свойства. АОЛ также ингибировал метаболическую активность и пролиферацию гранулезных клеток свиней, что в совокупности с его микоэстрогенными свойствами может негативно влиять на репродуктивные циклы у свиней и других млекопитающих [29, 30].
Минорные микотоксины грибов рода Alternaria – альтертоксины I, II и III – обладают генотоксическими и мутагенными свойствами [31–34]. Показано, что цитотоксическая активность альтертоксина II на культурах клеток китайского хомячка и человека проявляется при его концентрации 0.1–1.0 мкМ, что на порядок ниже, чем для альтертоксинов I и III [13, 35]. В то же время наибольшую мутагенную активность в тесте Эймса на бактерии Salmonella typhimurium продемонстрировал альтертоксин III: его мутагенный потенциал был всего в 10 раз ниже, чем у афлатоксина В1 [31]. Кратковременное (1 ч) воздействие 10 мкМ альтертоксина II вызывало гибель клеток эпителия кишечника, причем эффект токсина усугублялся при одновременном воздействии на клетки деформации сдвига в качестве стрессового фактора [34].
Содержание микотоксинов грибов рода Alternaria в кормах и продуктах питания не регламентировано нормативными документами, как в России, так и в других странах мира. Так, ПДК для АОЛ, АМЕ и ТеК не установлены [36, 37]. В 2011 г. Европейским агентством по безопасности продуктов питания (EFSA) была предпринята попытка оценить уровень опасности микотоксинов грибов рода Alternaria для здоровья человека и животных на международном уровне [38]. Среднее количество АОЛ и АМЕ, поступающих в организм человека с пищей (зерно, овощи, фрукты и продукты их переработки) составляет около 2.5 нг/кг массы тела в день, ТеК и ТТ – 1.5 нг/кг [38].
Во многом отсутствие нормативных документов, регламентирующих содержание микотоксинов Alternaria spp. в продуктах питания и кормах, связано с недостатком информации о токсичности этих веществ in vivo. В исследовании с участием добровольцев показано, что 90% ТеК выводится из организма с мочой в течение 24 ч [39]. В рамках изучения токсикокинетики АОЛ была показана его способность связываться с сывороточным альбумином [40]. В тестах in vivo на мышах АОЛ практически полностью выводился из организма с фекальными массами и мочой и не проявлял системной генотоксичности [41]. Тем не менее, связь между опухолевыми заболеваниями человека и контаминацией продуктов питания токсинообразующими грибами рода Alternaria может быть прослежена [42].
Мелкоспоровые Alternaria spp. из секции te-nuissima могут одновременно образовывать до 15 микотоксинов, концентрация которых может сильно варьировать. Авторы [43] предположили, что микотоксины могут действовать синергетически. Например, АОЛ in vitro существенно усиливал эстрогенный эффект зеараленона – токсина некоторых видов рода Fusarium. В то же время при изучении комбинированного воздействия АОЛ и альтертоксина II in vitro было показано, что на культурах клеток печени человека HepG2 и аденокарциномы кишечника HT29 АОЛ и альтертоксин II в различных соотношениях проявляют преимущественно аддитивный эффект [44].
Хроматографические методы являются рутинными для количественного определения стандартного набора микотоксинов (АОЛ, АМЭ, ТТ, ТеК и др.) мелкоспоровых альтернарий. В настоящее время разработаны и валидированы высокочувствительные ВЭЖХ-МС методы определения этих и других микотоксинов, включающие простые методики экстракции [45, 46], которые описаны в работах [47, 48] на примере микотоксинов плесневых грибов. Разработана методика определения ТеК в моче при помощи метода разведений растворов стабильного изотопа (SIDA), позволяющая определять микотоксин в диапазоне концентраций 1–100 мкг/л [39].
В последнее время большой интерес вызывают, так называемые, конъюгированные (модифицированные, метаболизированные) микотоксины, включающие гликозиды, серосодержащие и другие их производные. В начале 2000-х годов начаты исследования модифицированных токсинов грибов из родов Aspergillus, Fusarium и Penicillium [49]. Конъюгированные токсины Alternaria spp. изучаются недавно. Однако обнаружено, что они образуются в чистой культуре, в организме животных и в растениях. Так, АОЛ-3-сульфат и АМЕ-3-сульфат были найдены в коммерческих образцах томатов [50], в моче и кале крыс [51].
Микотоксины Alternaria spp. обнаруживаются в большинстве образцов различных сельскохозяйственных культур (томатах, яблоках, пшенице, овсе и др.) и продуктах их переработки (пюре, кетчупе, вине, подсолнечном масле и кормовых ингредиентах) [36, 52–55]. В образцах кормов и кормового сырья российского производства, проанализированных в 2014–2016 гг., доминировали такие токсины грибов рода Alternaria, как ТеК (41% от общего числа образцов), ТТ (30%), АОЛ (16%) и АМЭ (10%) [56]. Обнаружено накопление ТеК в плодах винограда в зависимости от его сорта на уровне от 0 до 780 мкг/кг [57]. В работе [58] после анализа 129 образцов фруктовых и овощных соков, а также продуктов переработки томатов было сделано заключение, что ТеК не представляет такой большой опасности для здоровья человека, как АОЛ и АМЕ, обнаруженные в 100% образцов. Содержание АОЛ, АМЕ, альтенуена и ТеК в пшенице может достигать уровня 6, 17, 3 и 0.8 мг/кг зерна соответственно [59]. При помощи метода ВЭЖХ/МС-МС с применением изотопно-меченого внутреннего стандарта изучено накопление микотоксинов в продуктах для детского питания. Наиболее часто в крупах и томатном соке встречалась ТеК. При этом в ряде образцов томатного сока содержание этого токсина было около 0.5 мг/кг [37]. В интактных плодах томатов альтертоксин II быстро метаболизируется растительными ферментами, в то время как в томатной пасте его разрушение идет более медленно (в течение 1 сут выявляется около 50% от внесенного вещества), которое, однако, ускоряется при термальной обработке (выход около 2–4% через 24 ч после обработки) [60].
К микотоксинам можно отнести и другие малоизученные метаболиты Alternaria spp. Так, A. oxytropis – эндофит бобовых из родов Astragalus и Oxytropis – продуцирует алкалоид сваинсонин, который отвечает за токсикозы домашних животных, питающихся пораженными растениями. Этот токсин обнаружен также у энтомопатогенного гриба Metarhizium anisopliae, его молекулярной мишенью является маннозидаза [61]. Токсикологические свойства большинства метаболитов видов рода Alternaria изучены слабо. В частности, к микотоксинам потенциально могут быть отнесены дикетопиперазины (например, рассмотренный ниже макулозин), обнаруженные у Alternaria spp., поскольку многие известные представители этого класса природных соединений проявляют токсигенные свойства [62].
Фитотоксины. Грибы рода Alternaria, вызывающие болезни растений, по типу питания, как правило, являются некротрофными патогенами, для которых характерно образование фитотоксинов (ФТ) в области инфекции. Исследования их химической структуры, функций, молекулярных мишеней и особенностей образования in vitro и in vivo могут способствовать лучшему пониманию инфекционного процесса и, следовательно, разработке рациональных способов борьбы с альтернариозами.
Большинство ФТ грибов рода Alternaria являются неспецифичными (неселективными), поскольку к ним чувствителен широкий круг растений из различных семейств [63]. Более того, многие из ФТ демонстрируют и другие типы биологической активности, в том числе, антимикробную, инсектицидную и цитотоксическую [9]. Образование таких ФТ не является необходимым условием для успешной колонизации растения-хозяина, но в то же время усиливает проявление симптомов заражения [64] и, возможно, повышает шансы на выживание в конкурентной борьбе за субстрат с другими микро- и макроорганизмами [65]. Хозяин-специфичные ФТ (ХСТ), к которым высоко чувствительны только определенные генотипы культурных или сорных растений, известны пока только для некоторых патотипов A. alternata [66, 67]. Как правило ХСТ являются факторами патогенности, их образование является необходимым условием для успешной колонизации хозяина [68–70].
ХСТ A. alternata разнообразны по структуре. Так, АМ-токсин патотипа A. alternata, вызывающего пятнистость листьев яблони (рис. 2, 1), представляет собой циклический нерибосомальный тетрапептид [71]. Токсины патотипов A. alternata, поражающих грушу, землянику и мандарин (АК-, AF- и АСТ-токсины соответственно), имеют в своей структуре один и тот же фрагмент – эпокси-декатриеновую кислоту (рис. 2, 2–4) [72–74]. ACRL-токсин патотипа A. alternata, поражающего лимон, является поликетидом (рис. 2.5 ) и содержит в своей структуре многоатомный спирт и дигидропироновое кольцо [75]. AAL-токсины патогена томата A. alternata f. sp. lycopersici представляют собой эфиры аминопентола и являются структурными аналогами сфинганина и сфингозина (рис. 2, 6) [76].
Рис. 2.
Хозяиноспецифичные фитотоксины грибов рода Alternaria: 1 – АМ-токсин, 2 – АК-токсин, 3 – AF-токсин, 4 – АСТ-токсин, 5 – АСRL-токсин, 6 – AAL-токсин.

В настоящее время для большинства ХСТ известны клеточные мишени. Структурно схожие АК-, AF- и ACT-токсины вызывают дисфункцию мембран, которая приводит к утечке электролитов, в первую очередь ионов K+, уже в первые минуты после обработки этими токсинами [74]. В результате воздействия ACR-токсина в клетках чувствительных сортов растений, происходит окислительное фосфорилирование, потеря мембранного потенциала митохондрий и утечка кофактора NAD+. Чувствительность определенных сортов лимона к действию ACR-токсина обусловлена посттранскрипционной модификацией митохондриального гена тРНК-Ала, которая в растительных клетках приводит к синтезу предположительно порообразующего олигомерного белка [77].
Гены биосинтеза большинства ХСТ A. alternata находятся на дополнительных хромосомах, наличие которых в геноме не является необходимым для нормальной жизнедеятельности гриба. Межвидовая передача таких хромосом может осуществляться в процессе парасексуального цикла через анастомозы [67]. “Возникновение” патотипов A. alternata, вероятно, обусловлено внедрением сортов растений, обладающих молекулярной мишенью для конститутивных или индуцибельных метаболитов этого гриба или изолятов, несущих указанные выше хромосомы. Однако данных по встречаемости ХСТ-образующих альтернарий недостаточно, чтобы определить степень опасности этих ФТ.
В России был отмечен альтернариоз листьев яблони, однако выявить штаммы A. alternata (или A. mali), образующие АМ-токсин, не удалось [78]. ВЭЖХ/МС-МС анализ ряда ХСТ (ACTG-C, D, E и F, AK-токсин II) в изолятах возбудителей альтернариоза листьев цитрусовых Бразилии (тангора и лайма) позволил выявить ХСТ-образующие A. alternata. При этом они образовывали АОЛ, АМЭ, альтенузин, альтенуен и альтертоксин I [79]. При анализе метаболитов A. alternata, выделенных из цитрусовых, собранных в Италии и Испании, были обнаружены типичные токсины этого гриба (АОЛ, АМЭ, альтенуен и ТеК). У наиболее патогенных изолятов выявили наличие гена, отвечающего за биосинтез ХСТ ACT-токсина [80].
Подробную информацию о ХСТ A. alternata можно найти в специально посвященных им обзорах [67, 81]. Свойства некоторых других ХСТ (макулозина и AAL-токсина) будут рассмотрены ниже. В качестве примеров неспецифических ФТ будут приведены некоторые метаболиты возбудителей альтернариозов пасленовых и крестоцветных культур.
Крупноспоровый вид A. solani является возбудителем сухой пятнистости листьев картофеля и томатов. Из культур этого гриба было выделено несколько неселективных ФТ. Так, из фильтрата культуральной жидкости A. solani, выращенной на среде Чапека-Докса, была выделена альтернариевая кислота (АК) (рис. 3, 1) [82]. Ее фитотоксическое действие на отсеченных побегах картофеля и томата выражалось в некротических повреждениях стебля и листьев, схожих по внешнему виду с симптомами заражения A. solani в природе. В биотесте на отсеченных побегах фитотоксическое действие проявлялось по отношению к растениям различных семейств – томату, гороху, свекле, редису, горчице, капусте и моркови [82]. В тесте на надколотых листовых дисках чувствительными к АК оказались только растения семейства пасленовых – томат, картофель и табак [83]. АК образуется как на искусственных питательных средах, так и в пораженных плодах томата, причем не только в очаге поражения грибом, но и в “отдаленных” их участках [84]. Обработка АК в концентрации 50–200 мкМ срезов клубней картофеля, устойчивого к фитофторозу, вызывала задержку в проявлении иммунной реакции при заражении Phytophthora infestans. Таким образом, АК может играть роль иммуносупрессора в патогенезе A. solani и других грибов [85]. На это также указывает тот факт, что заражение листьев томатов A. solani благоприятствует их заселению слабопатогенными мелкоспоровыми альтернариями [86].
Рис. 3.
Неспецифичные фитотоксины грибов рода Alternaria: 1 – альтернариевая кислота, 2 – альтерсоланол А, 3 – соланапирон А, 4 – бициклоальтернарен 1, 5 – деструксин В, 6 – брассициколин А.

Из культуральной жидкости A. solani был выделен антрахиноновый пигмент, альтерсоланол А (рис. 3, 2) [87]. Этот ФТ и его аналоги были найдены и у других грибов, в частности, A. porri, Dactylaria lutea и Phomopsis juniperovora. Альтерсоланол А ингибировал рост проростков салата и лука-батуна (Allium fistulosum). Механизм его действия заключается в ингибировании клеточного дыхания [88]. При культивировании на картофельно-глюкозной среде A. solani продуцировал соланапироны A-Е (рис. 3, 3) [89]. Эти соединения были обнаружены также у патогена нута Ascochyta rabiei и ряда других грибов, причем предполагали, что образование соланапиронов является фактором вирулентности у A. rabiei. Однако эти токсины не детектировались в пораженных тканях нута [90]. Мутантные штаммы A. rabiei и A. solani, неспособные к биосинтезу соланапиронов, не демонстрируют снижения вирулентности на растениях-хозяевах. Таким образом, образование соланапиронов, по-видимому, не является обязательным фактором для успешной колонизации их продуцентами растений-хозяев [91].
У различных возбудителей альтернариозов крестоцветных известны ФТ различной химической природы. Из культурального фильтрата патогена китайской капусты A. alternata, полученного на модифицированной среде Ричарда с добавлением картофельного крахмала, было выделено 11 соединений терпеноидной природы – би- и трициклоальтернаренов (рис. 3, 4). Следует отметить, что среди них два соединения оказались идентичны известным ранее ACTG-токсинам, выделенным из патотипа A. alternata, поражающего лимон (рис. 3, 4). Таким образом, ACTG-токсины можно считать скорее селективными, чем строго специфичными [92]. Бициклоальтернарен II в концентрации 0.1 мМ подавлял рост ряски многокоренника [93].
При культивировании на среде V8 патоген рапса A. brassicae продуцировал несколько фитотоксичных циклодепсипептидов, среди которых основным фитотоксичным компонентом был деструксин В (ДБ) (рис. 3, 5). Этот ФТ в концентрации 50–100 мкг/мл вызывает хлорозы на листьях рапса, а у растений других семейств – в концентрации 250–500 мкг/мл [94, 95]. Среди деструксинов наибольшую фитотоксичность проявлял гомодеструксин В [96]. Следует отметить, что деструксины, включая ДБ, также являются метаболитами некоторых хорошо известных энтомопатогенных грибов Metarhizium anisopliae и Lecanicillium longisporum [97, 98]. ДБ обнаруживается как в прорастающих конидиях A. brassicae, так и в растениях, зараженных грибом. Этот ФТ активно метаболизируется в листьях крестоцветных растений, а также индуцирует в них образование антимикробных метаболитов [99]. Совместная обработка растений ДБ и конидиями сапротрофного изолята A. alternata не приводила к возникновению заболевания, как это происходило при комбинации этого гриба с некоторыми другими ХСТ [95]. Таким образом, роль ДБ в заражении растений его продуцентом остается неясной.
Основной низкомолекулярный ФТ A. brassicicola, брассициколин А, который образуется при культивировании гриба на различных жидких питательных средах, но лучше всего – на картофельно-декстрозной жидкой среде и на средах, бедных азотом (рис. 3, 6). Этот ФТ содержит в структуре редкую для природных соединений изоцианидную группу и проявляет в концентрации 5 мМ фитотоксическую активность на листьях растений рода Brassica, стимулирует образование фитоалексинов растениями, а также обладает антимикробными свойствами [100–102].
Необходимо также отметить фитотоксические свойства часто встречающихся микотоксинов. Уже упомянутые микотоксины грибов рода Alternaria, ТеК, АОЛ и АМЭ, проявляют неспецифические фитотоксические свойства [103]. Высказано предположение, что АОЛ, а также его производные могут играть роль в патогенности грибов рода Alternaria, хотя они обладают более низкой фитотоксичностью, чем ТеК. Мутанты по гену поликетидсинтазы pksI, неспособные к синтезу пула пиронов (АОЛ, АМЭ, альтенузина и альтенуена), обладали пониженной патогенностью по сравнению со штаммами дикого типа. При гетерологичной экспрессии гена pksI в Aspergillus oryzae образовывалось достаточное количество АОЛ [104]. Биосинтез ТеК осуществлялся из изолейцина и ацетил-КоА при действии TeA-синтетазы1 [105]. Возможно, получение ТеК–-мутантов позволит определить роль и этого токсина в развитии мелкоспоровых альтернарий на растениях.
Фитотоксины Alternaria spp. могут быть использованы в качестве селективного фактора для отбора нечувствительных к ним генотипов культурных растений [106–108]. Так, в патенте РФ № 2066347 [109] был описан способ получения токсинов гриба A. solani для применения в качестве компонента селективных сред в селекции устойчивых к альтернариозу сортов томата и картофеля. Клеточные линии генотипа моркови, устойчивого к альтернариозу (возбудитель A. dauci), оказались менее чувствительны по отношению к недавно выделенному фитотоксину, адулактону, чем клеточные линии, полученные из восприимчивого к заболеванию генотипа [110]. ТТ нашел применение в биотехнологии растений для определения жизнеспособности и функционирования хлоропластов у гибридов Nicotiana spp. [111].
Продуценты микогербицидов. Фитопатогенные микроорганизмы, поражающие сорные растения, могут быть использованы в качестве биогербицидов. Они должны отвечать следующим основным требованиям: эффективность в полевых условиях, технологичность и безопасность, как для защищаемых культур, так и для полезных организмов и человека. Внесение фитопатогенов в агрофитоценоз проводится той же аппаратурой, что используется и для применения химических гербицидов. При благоприятных условиях это приводит к развитию сильной локальной эпифитотии в популяции сорного растения в течение одного сезона вегетации [112]. Грибы рода Alternaria, вызывающие заболевания сорных растений, часто рассматривались или были запатентованы в качестве основы для биогербицидов. Их примеры приведены в таблице 1. Некоторые из них были зарегистрированы для применения в США (Casst™ и Smolder™), а препарат Мусо-herb® на основе A. chlamidosporiformans (Lewia chlamidosporiformans) проходил предрегистрационные испытания в Бразилии. Однако внедрения их в практику не произошло [113]. Причины этого могут быть различные. Прежде всего, нестабильная эффективность в полевых условиях, а также возможные проблемы с получением больших объемов инокулюма при помощи твердофазной ферментации и высушивания конидий Alternaria spp., что является стандартным процессом стабилизации инокулюма грибов-продуцентов биопестицидов [114].
Таблица 1.
Виды рода Alternaria, перспективные для разработки биогербицидов
| Вид | Целевой объект | Источник |
|---|---|---|
| Alternaria sp. | Чертополох мелкоголовчатый (Carduus pycnocephalus) | [115] |
| A. alternata | Щирица запрокинутая (Amaranthus retroflexus) | [116] |
| A. alternata | Лантана сводчатая (Lantana camara) | [117] |
| A. alternata | Ежовник (Echinochloa spp.) | [118] |
| A. alternata | Водный гиацинт (Eichhornia crassipes) | [119] |
| A. alternata f. sp. sphenocleae | Сфеноклея цейлонская (Sphenoclea zeylanica) | [120] |
| A. cassiae | Сенна туполистная (Cassia obtusifolia), сенна западная (Cassia occidentalis), кроталярия нарядная (Crotalaria spectabilis) | [5] |
| A. cirsinoxia | Бодяк полевой (Cirsium arvense) | [7, 121, 122] |
| A. destruens | Повилика (Cuscuta spp.) | [123] |
| A.euphorbiicola | Молочай разнолистный (Euphorbia heterophylla) | [124] |
| A.eichhorniae | Водный гиацинт (Eichhornia crassipes) | [6] |
| A. macrospora | Партениум позднеплодный (Parthenium hysterophorus) | [8] |
| A. macrospora | Анода гребенчатая (Anoda cristata) | [125] |
| A. sonchi | Осот полевой (Sonchus arvensis) | [126] |
| A. zinniae | Чертополох (Carduus pycnocephalus) | [127] |
Препарат Casst на основе конидий A. cassia для борьбы с сенной туполистной (Senna obtusifolia) и кроталярией нарядной (Crotalaria spectabilis) был зарегистрирован в 1980 гг. [5]. Описана биогербицидная композиция на основе нефитотоксичного растительного масла, прилипателя и конидий этого гриба, которую можно использовать при помощи стандартного распылительного оборудования [128]. Для повышения эффективности биогербицида на основе A. cassia были разработаны способы совместного применения конидий гриба с такими химическими гербицидами, как глифосат, 2,4-Д и лактофен [129].
Разработан состав микогербицида против повилики (Cuscuta spp.) на основе смеси конидий Alternaria sp. и Fusarium tricinctum в 0.05%-м растворе Твин-20. Испытания этой композиции были проведены на плантациях клюквы с высокой естественной засоренностью повиликой. Препарат снизил численность повилики на 90% через 24 сут после обработки [130]. Эффективность A. destruens против повилики, паразитирующей на цитрусовых, удалось повысить за счет совместного применения композиции, состоящей из конидий гриба (18 млрд конидий/л), растительного масла (7.5%), фитотоксичного прилипателя сульфата аммония (0.125%) и гербицида глифосата (20 г действующего вещества/л). Эта смесь была эффективной в полевых условиях, вызывая гибель паразитического растения через 5 нед. после обработки и не затрагивая лимонные деревья [123].
Некоторые виды Alternaria spp. вирулентны при заражении растений мицелием или его видоизменениями, что важно при плохой споруляции. Так, для A. chlamidosporiformans – продуцента микогербицида против молочая разнолистного (Euphorbium heterophylla) были подобраны условия получения хламидоспор на жидкой питательной среде, содержавшей 30 г сахарозы, 20 г дрожжевого экстракта и 4 мл Твин-80. Среда имела pH 6.9–7.0, а температура инкубации составляла 25–30°C и скорость перемешивания 150 об./мин. Замена сахарозы на коричневый сахар позволила снизить расход дрожжевого экстракта в 2 раза без потери выхода продукта [124].
Из культур ряда возбудителей альтернариозов сорных растений выделены и охарактеризованы фитотоксины, которые могут быть использованы для создания гербицидных композиций или как маркеры для селекции высокопатогенных штаммов. Например, фитотоксичный периленхинон альтейхин выделен у патогена водного гиацинта A. eichhorniae [131]. У другого патогена этого растения (A. crassipies) неидентифицированный фитотоксин предложен в качестве одного из компонентов микогербицида [132]. Фильтрат культуральной жидкости A. alternata LC# 508, основным компонентом которого является ТеК, может быть дополнительным в составе микогербицида для борьбы с лантаной сводчатой [133]. Из культуральной жидкости патогена бодяка полевого A. cirsinoxia, полученного на глюкозно-аспарагиновой среде, был выделен цинниол – известный фитотоксин грибов рода Alternaria (A. tagetica, A. zinniae, A. porri и др.) [134]. Недавно в твердофазной культуре патогена осота полевого A. sonchi были обнаружены фитотоксичные хлоромонилиниковые кислоты B–D, известные у фитопатогенных грибов Monilinia fructicola и Cochliobolus australiensis [10, 135, 136]. Из культуры возбудителя пятнистости молочая разнолистного A. euphorbiicola выделены ангидромевалонолактон, тирозол и циклоглицилпролин, обладающие фитотоксическими свойствами [137]. Однако роль этих и многих других фитотоксинов в патогенезе еще не изучена.
При разработке биогербицидов на основе грибов рода Alternaria необходимо учитывать и риски их применения – токсигенные и аллергенные свойства грибов этого рода. Известно, например, что гриб A. alternata накапливает АОЛ в конидиях [138], в их оболочке обнаружены аллергенные белки Alt a1-а15 с молекулярной массой от 11 до 58 кДа [139]. Однако информация о токсигенных и аллергенных свойствах большинства возбудителей альтернариозов культурных и сорных растений практически отсутствует. В связи с этим для продуцентов биогербицидов, включая возбудителей альтернариозов, предложено: 1) разрабатывать методики определения остаточных количеств токсичных и гербицидных метаболитов, 2) подбирать такие способы применения биогербицидов, которые исключают попадание токсинов в корма и продукты питания, 3) вести отбор штаммов, не продуцирующих микотоксины [140]. Для достижения этой цели безусловно будут полезны вышеописанные разработки для анализа микотоксинов и ХСТ мелкоспоровых Alternaria spp.
Прообразы действующих веществ химических пестицидов. Природные биологически активные соединения, включая вторичные метаболиты грибов, широко используются в качестве прообразов действующих веществ пестицидов. Так, в 2016 г. продажи инсектицидов на основе природных соединений или их синтетических аналогов составляли 73%, фунгицидов – 61%, гербицидов – 39% от общего числа средств защиты растений. Многие природные соединения обладают оригинальными механизмами действия и благодаря этому могут быть использованы для борьбы с популяциями вредных организмов (фитофагов, фитопатогенов, сорных растений), резистентных к традиционным химическим пестицидам [141–143].
ТеК и ее синтетические производные рассматривались как потенциальные инсектицидные соединения. ТеК проявила ларвицидную активность по отношению к гусеницам первого возраста Lucilia sericata (ЛД50 120 мкг/мл), но не была активна по отношению к другим тестируемым насекомым из различных отрядов: Drosophila melanogaster, Sitophilus granarius, Aphis fabae и Tetranychus urticae. Некоторые производные ТеК (с двумя фенильными группами и хлором при 4-м атоме углерода) проявили повышенную активность по отношению к некоторым упомянутым членистоногим, например, L. sericata (ЛД50 50 мкг/мл) и S. granarius (ЛД50 23 мкг/мл) [144]. Обработка листьев розы Rosa chinensis нефитотоксичными дозами ТеК (0.06 мкг/мл) приводила к стимуляции выработки защитных метаболитов растения и к гибели тли Macrosiphum rosivorum на уровне 80% по сравнению с контролем [145].
Некоторые альтернарии способны образовывать ингибиторы различных холинэстераз и могут быть использованы в создании инсектицидных препаратов, многие из которых действуют на холиновые рецепторы насекомых [146]. Так, из культуры A. alternata был выделен альтенуен (рис. 4, 1), соединение, обладающее высокой ацетилхолинэстераза-ингибирующей активностью, который при добавлении в корм на уровне 50 мг/мл вызывал гибель более чем 70% гусениц Spodoptera litura [147]. Деструксин В продемонстрировал более высокую цитотоксическую активность по отношению к клеточной линии Sf9 из Spodoptera frugiperda по сравнению с другими деструксинами и их синтетическими производными [148].
Рис. 4.
Вторичные метаболиты грибов рода Alternaria как прообразы действующих веществ химических пестицидов: 1 – альтенуен, 2 – цикло (L-фенилаланин-транс-4-гидрокси-L-пролин), 3 – цикло (L-лейцин-транс-4-гидрокси-L-пролин), 4 – цикло (L-аланин-транс-4-гидрокси-L-пролин), 5 – радицинин, 6 – макулозин.

Из культуры эндофита виноградной лозы, идентифицированного как A. alternata, были выделены три соединения из группы дикетопиперазинов (рис. 4, 2–4). Соединения ингибировали спороношение возбудителя ложной мучнистой росы винограда Plasmopara viticola и не оказывали фитотоксическое действие на его листья [149]. Продуцирующий эти дикетопиперазины штамм A. alternata и его метаболиты были запатентованы как основа для фунгицидного препарата [150]. Радицинин (рис. 4.5 ), известный у A. radicina [151], A. helianthi [152], A. chrysanthemi [153] и Cochliobolus australiensis [154], обладает заметной ингибирующей активностью (в концентрации 50 мкг/диск) по отношению к бактерии Xylella fastidiosa, крайне опасного карантинного патогена виноградной лозы в Европе. Предполагают, что этот метаболит подавляет протеазу этой фитопатогенной бактерии [155].
Большинство изученных Alternaria spp. способны к образованию фитотоксинов. Некоторые из них обладают гербицидным потенциалом: высокой фитотоксической активностью, определенной селективностью и новыми механизмами действия на растения. В настоящее время ощущается острая нехватка гербицидов с такими свойствами [11, 156, 157]. В разное время среди фитотоксинов грибов рода Alternaria в качестве прообразов химических гербицидов рассматривались AAL-токсин, ТТ, макулозин, ТеК и многие другие.
AAL-токсин был выделен и охарактеризован в конце 1970-х гг. как ХСТ специализированной формы A. alternata, вызывающей рак стеблей томатов [77]. Информации о встречаемости этого токсина до сих пор мало, поскольку в чистой культуре он образуется более чем через 1 мес культивирования при 30°С [158]. AAL-токсин (рис. 2, 6) рассматривался как перспективная основа для разработки гербицида против ряда сорных растений, таких как щирица запрокинутая, дурман обыкновенный, эшиномене виргинская, сесбания возвышенная и др. [159, 160]. Механизм фитотоксического действия этого соединения заключается в ингибировании церамидсинтазы. Однако AAL-токсин проявляет токсичность по отношению к млекопитающим, что ограничивает его перспективность в качестве химического гербицида [161]. Попытки получить синтетические аналоги этого ФТ, обладающие высокой фитотоксической активностью и в то же время низкой токсичностью для млекопитающих, не увенчались успехом [162]. Структура AAL-токсина имеет высокую степень сходства с фумонизинами – канцерогенными микотоксинами некоторых грибов рода Fusarium [163]. Фумонизины проявляли более слабую биологическую активность на листьях томата, чем AAL-токсин. Однако совместная обработка восприимчивого сорта томата конидиями непатогенного штамма A. alternata и фумонизином приводила к такому же образованию некротических пятен, как и в результате инокуляции конидиями патогенного штамма A. alternata f. sp. lycopersici [160].
Циклический тетрапептид тентоксин (ТТ) (рис. 1, 3) образуют многие виды рода Alternaria: (например, A. alternata, A. linicola и A. porri), а также некоторые представители других родов грибов [16]. Его роль в патогенности альтернарий еще не доказана, однако, ТТ–-мутанты Cochliobolus miyabeanus были менее патогенны на листьях риса, чем штамм дикого типа. Отмечена положительная связь между образованием ТТ у различных изолятов гриба и его патогенностью [164]. ТТ проявляет широкий спектр фитотоксической активности в микромолярных концентрациях и обладает качествами, необходимыми для потенциально нового химического гербицида [11]. Фитотоксическое действие ТТ проявляется в виде хлорозов. Его механизм действия специфичен для растений. ТТ является ингибитором АТФазы хлоропластов [165]. Некоторые его синтетические производные связывались с этим ферментом менее эффективно чем ТТ [166]. Сложность разработки нового гербицида на основе ТТ заключается, как в низком выходе из культуры гриба-продуцента A. alternata (макс. 90 мг/л), так и многостадийном химическом синтезе [165–167]. Эта задача сможет быть решена в будущем при помощи оптимизации состава питательной среды и условий культивирования продуцентов ТТ, либо при помощи подходов метаболической инженерии. Так, идентифицированы два гена, кодирующих предполагаемую нерибосомальную пептид-синтетазу TES и цитохром 450-белок TES1, которые необходимы для биосинтеза ТТ у A. alternata ZJ33 [168]. Подана заявка на получение патента, где идентифицирован ген, отвечающий за синтез ТТ и его прекурсора, а также приведена методика получения ТТ гетерологичной экспрессией [169].
Из культуры гриба A. alternata, поражающего василек пятнистый (Centaurea maculosa), который является проблемным инвазивным растением в Северной Америке, был выделен селективный фитотоксин макулозин (рис. 4, 6). Структура макулозина представляет собой дикетопиперазин цикло-(L-Pro-L-Tyr). При оценке активности макулозина по отношению к 19 видам растений его фитотоксическое действие было обнаружено только по отношению к растению-хозяину. Так, наиболее чувствительными к макулозину оказались растения василька, собранные в том же районе, в котором были собраны пораженные образцы. На листовых дисках этих растений макулозин был токсичен при микромолярной концентрации. Растения, собранные в отдаленных районах, оказались менее чувствительными к нему. Можно предположить, что макулозин является специфичным по отношению к определенным генотипам C. maculosa [170]. При этом он оказался неэффективен при обработке целых растений василька. Минорный метаболит A. alternata, цикло(L-Pro-L-Phe), проявлял активность, как на надколотых листовых дисках, так и на целых растениях [171], и может быть использован как гербицид [172].
Упомянутый выше радицинин оценивается в качестве гербицидного соединения для борьбы с буфельской травой (Cenchrus ciliaris) – инвазивным сорным растением в Северной Америке. Он проявлял активность при концентрации 1 мM, однако испытанные нативные растения были менее чувствительными к этому ФТ. У радицинина не обнаружены токсигенные свойства. Так, при концентрации 40 мкМ он не действовал на развитие эмбриона рыбы Brachydanio rerio [154]. Синтетический (±)-3-деоксирадицинин проявил схожий с природным ФТ уровень фитотоксической активности [173]. Радицинин и его производные можно получать биотехнологическими методами. Так, его выход в твердофазной культуре некоторых изолятов A. radicina на субстрате из рисовой крупы превышал 3 г/кг субстрата [174].
Среди фитотоксинов грибов рода Alternaria наиболее активно в настоящее время изучается гербицидная активность ТеК. Тенуазоновая и изо-тенуазоновая кислоты были запатентованы в качестве природных неселективных гербицидов [175]. В чувствительных растениях ТеК ингибирует транспорт электронов в фотосистеме II путем связывания с D1-белком, который является молекулярной мишенью многих коммерческих гербицидов. Однако механизм связывания ТеК с мишенью оригинален. По классификации токсичности пестицидов ТеК относится к среднетоксичным и может использоваться в качестве послевсходового гербицида [176]. Период полураспада ТеК в почве составляет около 3 сут, а его остаточные количества обнаруживаются в течение 20 сут [177]. В полевых испытаниях синтетическая ТеК уничтожала свыше 90% молодых растений агератины железистой (Ageratina adenophora) при норме расхода 600 г/га. В посевах хлопка ТеК с добавлением в качестве адъюванта полиоксиэтиленовых эфиров жирных спиртов и лаурокапрама успешно уничтожал два вида экономически значимых сорных растений Digitaria sanguinalis и Amaranthus retroflexus при норме расхода 1125 г/га [178].
Прообразы лекарственных средств. Вторичные метаболиты микроорганизмов представляют собой источник базовых структур для разработки новых лекарственных препаратов, в том числе и для лечения трудноизлечимых заболеваний человека [179, 180]. Многие метаболиты грибов рода Alternaria проявили биологическую активность, перспективную с точки зрения медицинской химии – цитотоксическую (альтерпорриолы и депудецин), антибактериальную (альтенузин и брассициколин), противопаразитарную (депудецин и альтенузин), противовирусную и др. Некоторые из них будут рассмотрены ниже.
Производные антрахинона, образуемые видами A. porri и A. solani, проявляют цитотоксическую активность по отношению к различным клеточным линиям. Альтерпорриол F (рис. 5, 1), выделенный из A. porri, обладал цитотоксической активностью по отношению к клеткам карциномы шейки матки (линия HeLa) и плоскоклеточного рака кожи (линия КВ), величина концентрации полумаксимального ингибирования (ИК50) составила 6.5 и 7.0 мкг/мл соответственно [17]. Альтерпорриол L (рис. 5, 2), выделенный из Alternaria sp. ZJ9-6B, показал перспективную цитотоксическую активность по отношению к клеткам рака молочной железы на уровне ИК50 20 мкМ. Он ингибировал рост и пролиферацию опухолевых клеток, а также вызывал их некроз и апоптоз [181]. Известно, что альтерсоланол А в микромолярных концентрациях обладает цитотоксической активностью по отношению к клеткам миелогенной лейкемии (линия K562) и карциномы легкого (линия А549). Альтерсоланол А при концентрации 25 мкМ индуцировал апоптоз в раковых клетках, и при этом в меньшей степени затрагивалась жизнеспособность клеток без раковых изменений (мононуклеарные клетки периферической крови) [182].
Рис. 5.
Биологически активные вещества грибов рода Alternaria как прообразы лекарственных средств для медицины и ветеринарии: 1 – альтерпорриол F, 2 – альтерпорриол L, 3 – депудецин, 4 – альтейхин, 5 – альтенузин, 6 – тетрагидроальтерсоланол С, 7 – альтерпорриол Q.
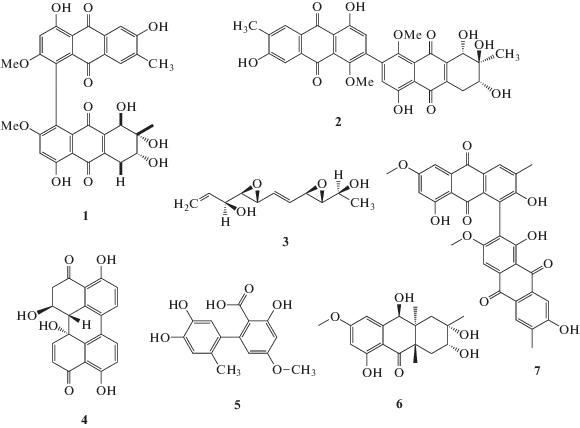
Деструксины и, в частности, деструксин В (ДБ) (рис. 3, 5) интересны как цитотоксические и противоопухолевые соединения, и их биотехнологический потенциал активно изучается [183]. Так, ДБ ингибирует рост различных линий опухолевых клеток человека (Sk-Hep1, Hep G2, Mahlavu, Huh7, HepJ5, HT29, HCT116 и SW480) с ИК50 от 2 до 6 мкМ. В предклинических испытаниях ДБ ингибировал опухолеобразование у HT29-ксенотрансплантатных мышей. В образцах опухолевой ткани было отмечено ингибирование β-катенина, циклина D1, сурвивина и эндотелиального маркера CD31 и, наоборот, повышенная экспрессия каспазы-3. В целом, это демонстрирует, что ДБ является ингибитором Wnt/β-катенин/Tcf-сигнального пути, и в сочетании с другими химиотерапевтическими средствами может быть полезен для лечения колоректального рака [184, 185]. ДБ вызывает апоптоз клеток лимфомы человека (линия Toledo) с ИК50 1.9 мкМ, что включает изменения мембранного потенциала [186]. На вариантах линии клеток карциномы кишечника (линия HCT116), устойчивых к действию деструксинов, был изучен молекулярный механизм резистентности. В устойчивых клетках наблюдались изменения в биохимических свойствах мембран и повышение содержания холестерина, что, по-видимому, приводило к снижению их проницаемости для деструксинов [187].
Метаболит A. brassicicola, депудецин (рис. 5, 3), способен в микромолярных концентрациях индуцировать дифференцировку опухолевых клеток. Предполагаемый механизм действия депудецина заключается в ингибировании деацетилаз гистоновых белков (HDAC). Значение ИК50 для депудецина в опытах по ингибированию HDAC in vitro (4.7 мкМ) сравнимы с ИК50 в биотесте на обратную трансформацию опухолевых клеток (4.7–47 мкМ) [188].
Альтейхин из A. eichorniae (рис. 5, 4) ингибирует со значением ИК50 30 мкМ активность теломеразы, которая является перспективной мишенью для терапии онкологических заболеваний, не действуя при этом на вирусную обратную транскриптазу [189]. Альтертоксин VII проявил цитотоксическую активность по отношению к клеткам миелогенной лейкемии (линия К562), аденокарциномы шейки матки (линия SGC-7901) и карциномы печени человека (линия BEL-7402) со значениями ИК50 26.6, 8.8 и 13.1 мкг/мл соответственно [190].
Ряд соединений, описанных у Alternaria spp., проявляют антимикробную активность. Так, производное дифенила альтенузин (рис. 5, 5), обнаруженный у нескольких видов Alternaria, подавляет рост клинических штаммов Paracoccidioides brasiliensis, вызывающих системные микозы человека. Минимальные действующие концентрации альтенузина для различных штаммов P. brasiliensis составили 2 – 31 мкМ [191]. Брассициколин А (рис. 3, 6) из A. brassicicola проявляет антимикробную активность против S. aureus и B. subtilis со значениями минимальной ингибирующей концентрации 1.5 и 8.0 мкг/мл соответственно [100]. Из твердофазной культуры A. sonchi был выделен антибиотик хлоромонилицин, активный в концентрации 0.5 мкг/диск по отношению к E. coli, P. fluorescens, B. subtilis и Candida tropicalis. Хлоромонилицин в концентрации 10 мкг/мл подавлял также прорастание конидий фитопатогенных грибов F. culmorum, Bipolaris sorokiniana и C. gloeosporioides [192].
Депудецин и альтенузин могут быть использованы для борьбы с паразитарными заболеваниями животных и человека. В концентрации 0.5 мкг/мл депудецин значительно снижал внутриклеточное размножение возбудителя неоспороза кокцидии Neospora caninum, но не проявлял цитотоксичности в отношении клеток-хозяев [193]. Альтенузин являлся ингибитором трипанотион-редуктазы in vitro, значение ИК50 составило 4.3 мкМ. Альтенузин был предложен для борьбы с такими паразитарными заболеваниями, как трипаносомоз и лейшманиоз [194].
Известны противовирусные метаболиты Alternaria spp. Альтертоксин V в концентрации 0.5 мкМ подавлял репликацию ВИЧ [195]. Тетрагидроальтерсоланол С и альтерпорриол Q (рис. 5, 6 и 7, соответственно) из Alternaria sp. ZJ-2008003 проявили противовирусную активность по отношению к вирусу репродуктивно-респираторного синдрома свиней [196].
Альтенузин представляет интерес как ингибитор агрегации тау-белка, одного из ключевых этапов развития болезни Альцгеймера. В опытах in vitro на клетках нейробластомы человека (линия SH-SY5Y) альтенузин в концентрациях 5–10 мкМ индуцировал образование олигомерных и глобулярных структур тау-белка, в то время как особую опасность при развитии болезни Альцгеймера представляют фибриллярные структуры [197]. В КНР альтенузин был запатентован в качестве компонента лекарственных средств, воздействующих на фарнезоидный Х-рецептор (FXR), играющий значительную роль в развитии цирроза печени, ожирения, диабета 2-го типа и дислипидемии [198, 199].
Для наработки наиболее перспективных БАВ альтернарий, в частности депудецина и альтенузина, в качестве альтернативы биотехнологическому методу получения предложены эффективные схемы химического синтеза [200, 201]. Таким образом, грибы рода Alternaria могут служить как источником новых БАВ с перспективной фармакологической активностью, так и выступать в качестве продуцентов уже хорошо известных биологически активных соединений.
Метаболиты грибов рода Alternaria в качестве хемотаксономических маркеров. Хемосистематика широко используется для характеристики и дифференциации различных таксонов грибов, в частности, токсигенных видов Aspergillus, Fusarium и Penicillium [202]. Важно отметить, что в отличие от молекулярно-генетических методов, основанных на анализе последовательностей генов ITS, TEF и GPD, анализ метаболома Alternaria spp. в определенной степени отражает их функции и, соответственно, потенциальную токсигенность [203]. В настоящее время для хемотаксономических исследований грибов рода Alternaria используется стандартный и простой протокол культивирования грибов и экстракции их метаболитов. Из нескольких двухнедельных колоний, полученных на стандартной агаризованной среде (например, DRYES), вырезают несколько блоков, из которых грибные метаболиты экстрагируют при помощи ультразвука подкисленным этилацетатом. После удаления растворителя сухой остаток перерастворяют в метаноле, и его состав анализируют различными методами хроматографии. При таком подходе за несколько суток можно проанализировать десятки образцов [204–206]. Для более полного определения биосинтетического потенциала грибов их культивируют на различных жидких и твердых питательных субстратах [10]. Тем не менее, использовать хемотаксономический подход нужно с осторожностью в рамках полифазного подхода, учитывая, что состав питательных субстратов, длительность и условия культивирования могут оказать существенное влияние на образование анализируемых метаболитов грибов [202].
Составы ВЭЖХ-УФ профилей экстрактов A. infectoria существенно отличаются от других представителей рода Alternaria наличием уникальных метаболитов [207]. Так, хроматографический и спектральный анализ при использовании ВЭЖХ/МС-МС и ВЭЖХ/МСВР состава метаболитов в экстрактах из 14 сут твердофазных культур (на рисовой крупе) мелкоспоровых Alternaria spp., собранных в Германии и России, позволил четко разделить представителей секций tenuissima и infectoria. Однако внутри секции tenuissima существенные различия по количественному и качественному составу метаболитов (проанализировано наличие 15 микотоксинов) среди видов A. alternata, A. tenuissima и A. arborescens не были обнаружены [208]. Аналогичные результаты получены при анализе экстрактов аргентинских изолятов мелкоспоровых альтернарий, выделенных из различных сельскохозяйственных культур и выращенных на агаризованной среде DRYES в течение 2 нед. [206].
Для A. infectoria предложено несколько хемотаксономических маркеров (например, инфектопирон) (рис. 6, 1) [209]. Из 153 изученных штаммов представителей рода Alternaria у 33 был обнаружен инфектопирон и все они относились комплексу ‘A. infectoria’. Инфектопирон был также обнаружен у видов Stemphylium sarciniforme, S. vesicarium и Ulocladium consortiale [210]. У других видов комплекса ‘A. infectoria’ (A. ethzedia, A. graminicola, A. infectoria, A. metachromatica и др.) метаболиты изучены недостаточно. Столь существенная филогенетическая и метаболомная дифференциация грибов группы infectoria от других мелкоспоровых грибов рода Alternaria может быть основанием для вывода их в отдельный род [211].
Рис. 6.
Хемотаксономические маркеры различных видов Alternaria 1 – инфектопирон (комплекс видов A. infectoria), 2 – макроспорин (секция Porri).

При помощи ВЭЖХ/УФ и факторного анализа изучен набор вторичных метаболитов некоторых крупноспоровых видов альтенарий (A. dauci, A. porri, A. solani и A. tomatophila), который показал, что у изучаемых микромицетов присутствует ряд общих метаболитов: антрахиноновые пигменты – макроспорин (рис. 6, 2) и альтерсоланол А (рис. 3, 2), а также альтернариол. Альтертоксин I был характерен, как для A. solani, так и A. tomatophila, а у A. dauci и A. porri он не был выявлен. В составе экстрактов обнаружены также и неизвестные метаболиты, специфичные для A. dauci, A. solani и A. tomatophila. Кластерный анализ позволил дифференцировать эти три вида, в то время как различные изоляты A. porri не удалось сгруппировать [212]. Сравнением протеома упомянутых крупноспоровых видов методом MALDI-TOF не были разделены виды A. solani и A. tomatophila, однако различными молекулярно-генетическими методами они отлично дифференцируются [213, 214].
Таким образом, грибы рода Alternaria способны синтезировать широкий набор биологически активных веществ, относящихся ко всем группам природных соединений, которые могут быть использованы как прообразы лекарственных средств и пестицидов. Известно более 350 видов грибов этого рода, однако вторичные метаболиты изучены лишь у небольшого числа видов, главным образом, экономически значимых патогенов сельскохозяйственных культур и токсигенных видов. Очевидно, что потенциал грибов этого рода в качестве продуцентов биологически активных соединений остается очень высоким. Дальнейший прогресс в изучении биологически активных соединений грибов рода Alternaria будет связан c углубленной токсикологической оценкой уже известных и новых метаболитов, определением роли фитотоксинов этих грибов в патогенезе заболеваний растений и изучением биосинтеза и механизмов действия наиболее перспективных из них. Разработки методов количественного определения токсинов альтернариодных микромицетов в различных матрицах могут быть полезны для оценки безопасности как биогербицидов на основе Alternaria spp., так и их метаболитов, предложенных для борьбы с сорными растениями. Сравнительный анализ профилей вторичных метаболитов может быть использован как дополнительный инструмент для дифференциации видов альтернариоидных грибов.
Работа выполнена при финансовой поддержке Российского Научного Фонда (проект № 16-16-00085).
Список литературы
Lawrence D., Rotondo F., Gannibal P. // Mycol. Prog. 2016. V. 15. № 3. P. 1–22.
Woudenberg J.H.C., Seidl M.F., Groenewald J.Z., de Vries M., Stielow J.B., Thomma B.P.H.J., Crous P.W. // Stud. Mycol. 2015. V. 82. P. 1–21.
Gannibal Ph.B. // Mycotaxon. 2018. V. 133. № 1. P. 37–43.
Thomma H. J. // Mol. Plant Pathol. 2003. V. 4. № 2. P. 225–236.
Bannon J.S. // Am. J. Alternative Agr. 1988. V. 3. № 2–3. P. 73–76.
Shabana Y.M., Charudattan R., Elwakil M.A. // Biol. Control. 1995. V. 5. № 2. P. 136–144.
Green S., Bailey K.L. // Biol. Control. 2000. V. 19. № 2. P. 167–174.
Kaur J., Aggarwal N.K. // Crop Prot. 2015. V. 4. P. 719–726.
Lou J., Peng Y., Fu L., Zhou L. // Molecules. 2013. V. 18. № 5. P. 5891–5935.
Берестецкий А.О., Далинова А.А., Волосатова Н.С. // Прикл. биохимия и микробиология. 2019. Т. 55. № 3. С. 271–281.
Duke S.O., Owens D.K., Dayan F.E. Weed Control: Sustainability, Hazards, and Risks in Cropping Systems Worldwide / Eds. N.E. Korres, N.R. Burgos, S.O. Duke. Boca Raton: CRC Press, 2019. 663 p.
Streit E., Schwab C., Sulyok M., Naehrer K., Krska R., Schatzmayr G. // Toxins. 2013. V. 5. № 3. P. 504–523.
Pero R.W., Posner H., Blois M., Harvan D., Spalding J.W. // Environ. Health Perspect. 1973. V. 4. P. 87–94.
Ostry V. // World Mycotoxin J. 2008. V. 1. № 2. P. 175–188.
Meronuck R.A., Steele J.A., Mirocha C.J., Christensen C.M. // Appl. Microbiol. 1972. V. 23. № 3. P. 613–617.
Pinto V.E.F., Patriarca A. Mycotoxigenic Fungi: Methods and Protocols / Eds. A. Moretti, A. Susca. NY: Springer Science+Business Media LLC, 2017. 379 p.
Phuwapraisirisan P., Rangsan J., Siripong P., Tip-pyang S. // Nat. Prod. Res. 2009. V. 23. № 12. P. 1063–1071.
Vaquera S., Patriarca A., Pinto V.F. // Int. J. Food Microbiol. 2016. V. 219. P. 44–49.
Tian J., Fu L., Zhang Z., Dong X., Xu D., Mao Z. et al. // Nat. Prod. Res. 2016. V. 31. № 4. P. 387-396.
Griffin G.F., Chu F.S. // Appl. Environ. Microbiol. 1983. V. 46. № 6. P. 1420–1422.
Bottalico A., Logrieco A. Mycotoxins in Agriculture and Food Safety / Eds. K.K. Sinha, D. Bhatnagar. NY: Marcel Dekker Inc., 1998. P. 65–108.
Brugger E-M., Wagner J., Schumacher D.M., Koch K., Podlech J., Metzler M., Lehmann L. // Toxicol. Lett. 2006. V. 164. № 3. P. 221–230.
Solhaug A., Eriksen G. S., Holme J. A. // Basic Clin. Pharmacol. Toxicol. 2016. V. 119. № 6. P. 533–539.
Liu G.T., Qian Y.Z., Zhang P., Dong W.H., Qi Y.M., Guo H.T. // Chin. Med. J. 1992. V. 105. № 5. P. 394–400.
Bensassi F., Gallerne C., Sharaf El Dein O. // Toxicol In Vitro. 2012. V. 26. № 6. P. 915–923.
Fehr M., Pahlke G., Fritz J., Christensen M.O., Boege F., Altemoller M., Podlech J., Marko D. // Mol. Nutr. Food Res. 2009. V. 53. № 4. P. 441–451.
Fernández-Blanco C., Juan-García A., Juan C., Font G., Ruiz M.-J. // Food Chem. Toxicol. 2016. V. 88. P. 32–39.
Grover S., Lawrence C.B. // Int. J. Mol. Sci. 2017. V. 18. № 7. P. 1577. https://doi.org/10.3390/ijms18071577
Tiemann U., Tomek W., Schneider F., Müller M., Pöhland R., Vanselow J. // Toxicol. Lett. 2009. V. 86. P. 139–145.
Dellafiora L., Warth B., Schmidt V., Del Favero G., Mikula H., Fröhlich J., Marko D. // Food Chem. 2018. V. 248. P. 253–261.
Stack M.E., Prival M.J. // Appl. Environ. Microbiol. 1986. V. 52. № 4. P. 718–722.
Fleck S.C., Burkhardt B., Pfeiffer E., Metzler M. // Toxicol. Lett. 2012. V. 214. № 1. P. 27– 32.
Schwarz C., Tiessen C., Kreutzer M., Stark T., Hofmann T., Marko D. // Arch. Toxicol. 2012. V. 86. № 12. P. 1911–1925.
Del Favero G., Zaharescu R., Marko D. // Arch. Toxicol. 2018. V. 92. № 12. P. 3535–3547.
Boutin B., Peeler J., Twedt R. // J. Toxicol. Environ. Health. Part A. 1989. V. 26. № 1. P. 75–81.
Седова И.Б., Киселева М.Г., Чалый З.А., Аксенов И.В., Захарова Л.П. // Усп. Мед. Микол. 2018. Т. 19. С. 329–330.
Gotthardt M., Asam S., Gunkel K., Moghaddam A.F., Baumann E., Kietz R., Rychlik M. // Front. Microbiol. 2019. V. 10. P. 109. https://doi.org/10.3389/fmicb.2019.00109
European Food Safety Authority (EFSA) // EFSA J. 2016. V. 14. № 12. P.e04643. https://doi.org/10.2903/j.efsa.2016.4643
Asam S., Habler K., Rychlik M. // Anal. Bioanal. Chem. 2013. V. 405. № 12. P. 4149–4158.
Fliszár-Nyúl E., Lemli B., Kunsági-Máté S., Dellafiora L., Dall’Asta C., Cruciani G., Poór M. // Int. J. Mol. Sci. 2019. V. 20. № 9. P. 2352. https://doi.org/10.3390/ijms20092352
Schuchardt S., Ziemann C., Hansen T. // EFSA supporting publication. 2014. V. 11. № 11. P. 679E. https://doi.org/10.2903/sp.efsa.2014.EN-679
Zwickel T., Kahl, S., Klaffke H., Rychlik M., Müller M. // Toxins. 2016. V. 8. № 11. P. 344. https://doi.org/10.1002/ejoc.201300879
Vejdovszky K., Schmidt V., Warth B., Marko D. // Mol. Nutr. Food Res. 2016. V. 61. № 3. 1600526. https://doi.org/10.1002/mnfr.201600526
Vejdovszky K., Sack M., Jarolim K., Aichinger G., Somoza M. M., Marko D. // Toxicol. Lett. 2017. V. 267. P. 45–52.
Escrivá L., Oueslati S., Font G., Manyes L. // J. Food Qual. 2017. P. 1–20. https://doi.org/10.1155/2017/1569748
Puntscher H., Kütt M.-L., Skrinjar P., Mikula H., Podlech J., Fröhlich J., Warth B. // Anal. Bioanal. Chem. 2018. V. 410. № 18. P. 4481–4494.
Myresiotis C.K., Testempasis S., Vryzas Z., Karaoglanidis G.S., Papadopoulou-Mourkidou E. // Food Chem. 2015. V. 182. P. 81–88.
Амелин В.Г., Карасева Н.М., Третьяков А.В. // Журн. аналит. химии. 2013. Т. 68. № 3. С. 212–223.
Berthiller F., Crews C., Dall’Asta C., Saeger S. D., Haesaert G., Karlovsky P., Stroka J. // Mol. Nutr. Food Res. 2012. V. 57. № 1. P. 165–186.
Puntscher H., Cobankovic I., Marko D., Warth B. // Food Control. 2019. V. 102. P. 157-165.
Puntscher H., Hankele S., Tillmann K., Attakpah E., Braun D., Kütt M.L., Del Favero G., Aichinger G., Pahlke G., Höger H., Marko D., Warth B. // Toxicol. Lett. 2019. V. 301. P. 168-178.
Lee H.B., Patriarca A., Magan N. // Mycobiology. 2015. V. 43. № 2. P. 93–106.
Noser J., Schneider P., Rother M., Schmutz H. // Mycotoxin Res. 2011. V. 27. № 4. P. 265–271.
Буркин А.А., Кононенко Г.П. // Прикл. биохимия и микробиология. 2011. Т. 47. № 1. С. 79–83.
Джатдоева А.А., Селимов Р.Н., Грачева Т.С., Метальников П.С., Комаров А.А. // Усп. Мед. Микол. 2018. Т. 19. С. 297–298.
Селимов Р.Н., Джатдоева А.А., Метальников П.С., Комаров А.А. // Ветеринария. 2017. № 12. С. 53–57.
Prendes L.P., Fontana A.R., Merín M.G., D´ Amario Fernández A., Bottini R., Ramirez M.L., Morata de Ambrosini V. I. // Food Sci. Nutr. 2018. V. 6. № 3. P. 523–531.
Walravens J., Mikula H., Rychlik M., Asam S., Devos T., Njumbe Ediage E., De Saeger S. // J. Agr. Food Chem. 2016. V. 64. № 24. P. 5101–5109.
Ramires F., Masiello M., Somma S., Villani A., Susca A., Logrieco A., Moretti A. // Toxins. 2018. V. 10. № 11. P. 472. https://doi.org/10.3390/toxins10110472
Puntscher H., Marko D., Warth B. // Front. Nutrit. 2019. V. 6. P. 92. https://doi.org/10.3389/fnut.2019.00092
Tan X., Zhang X., Yu M., Yu Y., Guo Z., Gong T., Ding G. // Phytochemistry. 2019. V. 164. P. 154–161.
Brase S., Glaser F., Kramer C.S., Linder S., Linsenmeier A.M., Masters K.S., Meister A.C., Ruff B.M., Zhong S. // Prog. Chem. Org. Nat. Prod. 2013. V. 97. P. 1–300.
Möbius N., Hertweck C. // Curr. Opin. Plant Biol. 2009. V. 12. № 4. P. 390–398.
Mitchell R.E. // Annu. Rev. Phytopalhol. 1984. V. 22. P. 215–245.
Берестецкий А.О., Чистый Л.С., Мироненко Н.В. // Микология и фитопатология. 2018. Т. 52. № 3. С. 196–207.
Akimitsu K., Tsuge T., Kodama M., Yamamoto M., Otani H. // J. Gen. Plant. Pathol. 2014. V. 80. № 2. P. 109–122.
Tsuge T., Harimoto Y., Akimitsu K., Ohtani K., Kodama M., Akagi Y., Egusa M., Yamamoto M., Otani H. // FEMS Microbiol. Rev. 2013. V. 37. № 1. P. 44–66.
Park P., Nishimura S., Kohmoto K., Otani, H., Tsujimoto K. // Can. J. Bot. 1981. V. 59. № 3. P. 301–310.
Yamagishi D., Akamatsu H., Otani H., Kodama M. // J. Gen. Plant. Pathol. 2006. V. 72. № 5. P. 323–327.
Friesen T. L., Faris J. D., Solomon P. S., Oliver R. P. // Cell. Microbiol. 2008. V. 10. № 7. P. 1421–1428.
Ueno T., Nakashima T., Hayashi Y., Fukami H. // Agr. Biol. Chem. 1975. V. 39. № 5. P. 1115–1122.
Nakashima T., Ueno T., Fukami H., Taga T., Masuda H., Osaki K., Otani H., Kohmoto K., Nishimura S. // Agr. Biol. Chem. 1985. V. 49. № 3. P. 807–815.
Nakatsuka S., Ueda K., Goto T., Yamamoto M., Nishimura S., Kohmoto K. // Tetrahedron Lett. 1986. V. 27. № 24. P. 2753–2756.
Itoh Y., Kohmoto K., Shimomura N., Otani H., Kodama M., Nakatsuka S. A. // Ann. Phytopath. Soc. Japan. 1993. V. 59. № 4. P. 416–427.
Gardner J.M., Konoa Y., Tatumb J.H., Suzukia Y., Takeuchia S. // Phytochemistry. 1985. V. 24. № 12. P. 2861–2867.
Clouse S.D., Martensen A. N., Gilchrist D. G. // J. Chromatog. 1985. V. 350. P. 255–263.
Ohtani K., Yamamoto H., Akimitsu K. // Proc. Natl. Acad. Sci. U.S.A. 2002. V. 99. № 4. P. 2439–2444.
Ганнибал Ф.Б., Бильдер И.В., Ули-Маттила Т. // Микология и фитопатология. 2008. Т. 42. № 1. С. 18–25.
Prieto K.R., Medeiros L.S. de, Isidoro M.M., Toffano L., Silva M.F.G.F. da, Fernandes J.B., Machado M.A. // J. Braz. Chem. Soc. 2016. V. 27. № 8. P. 1493–1505.
Garganese F., Schena L., Siciliano I., Prigigallo M.I., Spadaro D., De Grassi A., Sanzani S.M. // PLOS ONE. 2016. V. 11. № 9. e0163255. https://doi.org/10.1371/journal.pone.0163255
Meena M., Samal S. // Toxicol. Rep. 2019. V. 6. P. 745–758.
Brian P.W., Curtis P.J., Hemming H.G., Unwin C.H., Wright G.M. // Nature. 1949. V. 164. № 4169. P. 534. https://doi.org/10.1038/164534a0
Langsdorf G., Fururchi N., Doke N., Nishimura S. // J. Phytopathol. 1990. V. 128. № 4. P. 271–282.
Brian P.W., Elson G.W., Hemming H.G., Wright J.M. // Ann. Appl. Biol. 1952. V. 39. № 3. P. 308–321.
Furuichi N., Nishimura S., Langsdorf G. // Ann. Phytopath. Soc. Japan. 1992. V. 58. P. 1–7.
Bessadat N., Berruyer R., Hamon B., Bataille-Simoneau N., Benichou S., Kihal M., Simoneau P. // Eur. J. Plant Pathol. 2016. V. 148. № 1. P. 181–197.
Stoessl A. // Chem. Comm. 1967. № 7. P. 307–308.
Haraguchi H., Abo T., Fukuda A., Okamura N., Yagi A. // Phytochemistry. 1996. V. 43. № 5. P. 989–992.
Ichihara A., Tazaki H., Sakamura S. // Tetrahedron Lett. 1983. V. 24. № 48. P. 5373–5376.
Hohl B., Weidemann C., Hohl U., Barz W. // J. Phytopathol. 1991. V. 132. № 3. P. 193–206.
Kim W., Park C.-M., Park J.-J., Akamatsu H.O., Peever T.L., Xian M., Gang D.R., Vandemark G., Chen W. // MPMI. 2015. V. 28. № 4. P. 482–496.
Liebermann B., Ellinger R., Ihn W. // J. Phytopathol. 1994. V. 140. P. 385–388.
Liebermann B., Nussbaum R.-P., Gunther W. // Phytochemistry. 2000. V. 55. № 8. P. 987–992.
Ayer W.A., Pena-Rodriguez L.M. // J. Nat. Prod. 1987. V. 50. № 3. P. 400–407.
Parada R. Y., Oka K., Yamagishi D., Kodama M., Otani H. // Physiol. Mol. Plant P. 2007. V. 71. № 1-3. P. 48–54.
Pedras M.S., Biesenthal C.J., Zaharia I.L. // Plant Sci. 2000. V. 156. № 2. P. 185–192.
Ibrahim A.A., Asker M.S. // Aust. J. Basic Appl. Sci. 2012. V. 6. № 5. P. 284–288.
Butt T.M., Hadj N.B.E., Skrobek A., Ravensberg W.J., Wang C., Lange C.M., Dudley E. // Rapid Commun. Mass Spectrom. 2009. V. 23. № 10. P. 1426–1434.
Pedras M.S., Khallaf I. // Phytochemistry. 2012. V. 77. P. 129–139.
Gloer J.B., Poch G.K., Short D.M., McCloskey D. V. // J. Org. Chem. 1988. V. 53. № 16. P. 3758–3761.
Pedras M.S.C., Chumala P.B., Jin W., Islam M.S., Hauck D.W. // Phytochemistry. 2009. V. 70. № 3. P. 394–402.
Pedras M.S., Park M.R. // Mycologia. 2015. V. 107. № 6. P. 1138–1150.
Meena M., Swapnil P., Upadhyay R.S. // Sci. Rep. 2017. V. 7. № 1. P. 8777.
Wenderoth M., Garganese F., Schmidt-Heydt M., Tobias S. S., Ippolito A., Sanzani S. M., Fischer R. // Mol. Microbiol. 2019. V. 112. № 1. P. 131–146.
Yun C.-S., Motoyama T., Osada H. // Nat. Commun. 2015. V. 6. № 1. P. 8758.
Аврова А.О., Тютерев С.Л., Евстигнеева Т.А., Козырева О.Г. // Микология и фитопатология. 1993. Т. 27. № 6. С. 52–56.
Svavov S. // Biotechnol. Biotechnol. Equip. 2009. V. 23. № SE. P.881–884. https://doi.org/10.1080/13102818.2009.10818563
Tan K-C., Phan H.T.T., Rybak K., John E., Chooi Y.H., Solomon P.S., Oliver R.P. // Front. Plant Sci. 2015. V. 6. № 501. P. 1–9.
Пaтeнт PФ. 1996. № 2066347.
Courtial J., Hamama L., Helesbeux J.-J., Lecomte M., Renaux Y., Guichard E., Voisine L., Yovanopoulos C., Hamon B., Ogé L., Richomme P., Briard M., Boureau T., Gagné S., Poupard P., Berruyer R. // Front. Plant Sci. 2018. V. 9. P. 502. https://doi.org/10.3389/fpls.2018.00502
Lal R., Lai S. Crop Improvement Utilizing Biotechnology / Eds. R. Lal, S. Lai. Boca Raton: CRC Press, 2018. 363 p.
Берестецкий А. О. // Вестник защиты растений. 2017. Т. 91. № 1. С. 5-12.
Watson A.K. Weed Control: Sustainability, Hazards, and Risks in Cropping Systems Worldwide / Eds. N.E. Korres, N.R. Burgos, S.O. Duke. Boca Raton: CRC Press, 2019. 664 p.
Berestetskiy A, Sokornova S. Biological Approaches for Controlling Weeds / Ed. R. Radhakrishnan. London: IntechOpen, 2018. 463 p.
Andersen G.L., Lindow S.E. Biological control of Carduus pycnocephalus with Alternaria sp.// Proc. VI Int. Symp. Biol. Contr. Weeds. Vancouver, Canada: E. S. (ed.). Agri-c. Can. 1985. P. 593–600.
Lawrie J., Down V.M., Greaves M.P. // Biocontrol. Sci. Techn. 2000. V. 10. № 1. P. 81–87.
Singh J., Majumdar D., Pandey A., Pandey A.K. // Recent Res. Sci. Technol. 2010. V. 2. № 9. P. 22–27.
Motlagh M.R.S. // Afr. J. Microbiol. Res. 2012. V. 6. № 21. P. 4481–4488.
Aneja K.R., Kumar P., Sharma C. // J. Innov. Biol. 2014. V. 1. № 2. P. 117–121.
Mabbayad M.O., Watson A.K. // J. Crop Prot. 1995. V. 14. № 5. P. 429–433.
Green S., Bailey K. L., Tewari J. P. // Mycol. Res. 2001. V. 105. № 3. P. 344–351.
Ганнибал Ф.Б., Берестецкий А.О. // Микология и фитопатология. 2008. Т. 42. № 2. С. 110–118.
Cook J.C., Charudattan R., Zimmerman T.W., Rosskopf E.N., Stall W.M., MacDonald G.E. // Weed Technol. 2009. V. 23. № 4. P. 550–555.
Vieira B.S., Barreto R.W. // Australas. Plant Pathol. 2010. V. 39. № 2. P. 154–160.
Walker H.L., Sciumbato G.L. // Weed Sci. 1979. V. 27. № 6. P. 612–614.
Пaтeнт PФ. 2019. № 2701957.
Патент США. 1984. № 4636386.
Патент США. 1986. № 4755207.
Патент США. 1988. № 4776873.
Патент США. 1990. № 4915726.
Robeson D., Strobel G., Matusumoto G.K., Fisher E.L., Chen M.H., Clardy J. // Experientia. 1984. V. 40. № 11. P. 1248–1250.
Патент КНР. 2008. № 101508959 A.
Sanodiya B.S., Thakur G.S., Baghel R.K., Pandey A.K., Prasad G.B.K.S, Bisen P.S. // J. Plant Prot. Res. 2010. V. 50. № 2. P. 133–139.
Берестецкий А.О., Юзихин О.С., Каткова А.С., Добродумов А.В., Сивогривов Д.Е., Коломбет Л.В. // Прикл. биохимия и микробиология. 2010. Т. 46. № 1. С. 84–88.
Sassa T., Horiguchi K., Suzuki Y. // Agric. Biol. Chem. 1989. V. 53. № 5. P. 1337–1341.
Masi M., Meyer S., Clement S., Pescitelli G., Cimmino A., Cristofaro M., Evidente A. // J. Nat. Prod. 2017. V. 80. № 10. P. 2771–2777.
Varejão E.V.V., Demuner A.J., Barbosa L.C. de A., Barreto R.W. // Quim. Nova. 2013. V. 36. № 7. P. 1004–1007.
Haggblom P. // Microbiology. 1987. V. 133. № 12. P. 3527–3529.
Kustrzeba-Wójcicka I., Siwak E., Terlecki G., Wolań-czyk-Mędrala A., Mędrala W. // Clin. Rev. Allergy Immunol. 2014. V. 47. № 3. P. 354–365.
Hoagland R.E., Boyette C.D., Weaver M.A., Abbas H.K. // Toxin Rev. 2007. V. 26. № 4. P. 313–342.
Pickett J.A. // Resistance’91: Achievements and Developments in Combating Pesticide Resistance. Dordrecht: Springer, 1992. P. 354–365.
Shcherbakova L.A. Natural Products in Plant Pest Management / Ed. N.K. Dubey. Wallingford: CABI International, 2011. P. 109‒133.
Lorsbach B.A., Sparks T.C., Cicchillo R.M., Garizi N.V., Hahn D.R., Meyer K.G. // Pest Manag. Sci. 2019. V. 75. P. 2301–2309.
La Croix E.A.S., Mhasalkar S.E., Mamalis P., Harrington F.P. // Pesticide Science. 1975. V. 6. № 5. P. 491–496.
Yang F., Yang B., Li B., Xiao C. // J. Zhejiang Univ. Sci. B. 2015. V. 16. № 4. P. 264–274.
Singh B., Bhagat J., Chadha B., Kaur A. // Biologia. 2014. V. 69. № 1. P. 10-14.
Bhagat J., Kaur A., Kaur R., Yadav A. K., Sharma V., Chadha B. S. // J. Appl. Microbiol. 2016. V. 121. № 4. P. 1015–1025.
Male K.B., Tzeng Y.-M., Montes J., Liu B.-L., Liao W.-C., Kamen A., Luong J. H. T. // Analyst. 2009. V. 134. № 7. P. 1447–1452.
Musetti R., Polizzotto R., Vecchione A., Borselli S., Zulini L., D’Ambrosio M., L. Sanita` di Toppi L., Pertot I. // Micron. 2007. V. 38. № 6. P. 643–650.
Патент США. 2009. № 20090257984 А1.
Solfrizzo M., Vitti C., De Girolamo A., Visconti A., Logrieco A., Fanizzi F. P. // J. Ag. Food Chem. 2004. V. 52. № 11. P. 3655–3660.
Tal B., Robeson J.D., Burke A.B., Aasen J.A. // Phytochemistry. 1985. V. 24. № 4. P. 729–731.
Robeson D.J., Gray G.R., Strobel G.A. // Phytochemistry. 1982. V. 21. № 9. P. 2359–2362.
Masi M., Meyer S., Clement S., Cimmino A., Evidente A. // Nat. Prod. Res. 2019. V. 5. P.1–9.
Aldrich T.J., Rolshausen P.E., Roper M.C., Reader J.M., Steinhaus M.J., Rapicavoli J., Maloney K.N. // Phytochemistry. 2015. V. 116. P. 130–137.
Harding D.P., Raizada M.N. // Front. Plant Sci. 2015. V. 6. P. 659. https://doi.org/10.3389/fpls.2015.00659
Heap I. // Pest Manag. Sci. 2014. V.70. № 9. P. 1306–1315.
Vaquera S., A. Patriarca G. Cabrera V.F. // Eur. J. Plant Pathol. 2017. V.148. № 4. P. 1003–1009.
Патент США. 1993. № 5256628.
Abbas H.K., Vesonderr F., Boyette C.D., Peterson S.W. // Can. J. Bot. 1993. V. 71. № 1. P. 155–160.
Abbas H.K., Egley G.H., Paul R.N. // Phytopathol. 1995. V. 85. № 6. P. 677–682.
Abbas H. // Phytochemistry. 1995. V. 40. № 6. P. 1681–1689.
Chen J., Mirocha C.J., Xie W., Hogge L., Olson D. // Appl. Environ. Microbiol. 1992. V. 58. № 12. P. 3928–3931.
De Bruyne L., Van Poucke C., Di Mavungu D.J., Zainudin N.A.I.M., Vanhaecke L., De Vleesschauwer D., Höfte M. // Mol. Plant Pathol. 2015. V. 17. № 6. P. 805–817.
Lax A.R., Shepherd H.S., Edwards J.V. // Weed Technol. 1988. V. 2. № 4. P. 540–544.
Cavelier F., Verducci J., André F., Haraux F., Sigalat C., Traris M., Vey A. // Pestic. Sci. 1998. V. 52. № 1. P. 81–89.
Loiseau N., Cavelier F., Noel J.-P., Gomis J.-M. // J. Pept. Sci. 2002. V. 8. № 7. P. 335–346.
Li, Y.-H., Han, W.-J., Gui, X.-W., Wei, T., Tang, S.-Y., Jin, J.-M. // Toxins 2016. V. 8. № 8. P. 234. https://doi.org/10.3390/toxins8080234
Пaтeнт WIPO. 2017. № 159795A1.
Stierle A.S., Cardellina J.H., Strobel G.A. // Proc. Natl. Acad. Sci. U.S.A. 1988. V. 85. № 21. P. 8008–8011.
Bobylev M.M., Bobyleva L.I., Strobel G.A. // J. Agric. Food Chem. 1996. V. 44. № 12. P. 3960–3964.
Патент США. 1990. № 4929270.
Marsico G., Ciccone M.S., Masi M., Freda F., Cristofaro M., Evidente A., Scafato P. // Molecules. 2019. V. 24. № 17. P. 3193. https://doi.org/10.3390/molecules24173193
Solfrizzo M., Girolamo A.D., Vitti C., Tylkowska K., Grabarkiewicz-Szczęsna J., Szopińska D., Dorna H. // Food Addit. Contam. Part A Chem. Anal. Control Expo. Risk Assess. 2005. V. 22. № 4. P. 302–308.
Европейский патент. 2005. № 1849361 A1.
Chen S., Qiang S. // Pestic. Biochem. Phys. 2017. V. 143. P. 252–257.
Qiang S., Zhou B. // Am. Eurasian J. Environ. Agric. Sci. 2007. V. 26. P. 572–576.
Zhou B., Wang H., Meng B., Wei R., Wang L., An C., Chen S., Yang C., Qiang S. // Pest Manag. Sci. 2019. V. 75. P. 2482–2489.
Sharma S., Hameed S., Fatima Z. // Recent Pat. Biotechnol. 2016. V. 10. № 2. P. 167–174.
Dinic J., Podolski-Renic A., Stankovic T., Bankovic J., Pesic M. // Curr. Pharm. Des. 2015. V. 21. № 38. P. 5589–5604.
Huang C., Jin H., Song B., Zhu X., Zhao H., Cai J., Lin Y. // Appl. Microbiol. Biotechnol. 2011. V. 93. № 2. P. 777–785.
Teiten M.H., Mack F., Debbab A., Aly A.H., Dicato M., Proksch P., Diederich M. // Bioorg. Med. Chem. 2013. V. 21. № 13. P. 3850–3858.
Liu B.-L., Tzeng Y.-M. // Biotechnol. Adv. 2012. V. 30. № 6. P. 1242–1254.
Yeh C.-T., Rao Y.K., Ye M., Wu W.-S., Chang T.-C., Wang L.-S., Tzeng Y.-M. // Toxicol. Appl. Pharm. 2012. V. 261. № 1. P. 31–41.
Huynh T.-T., Rao Y. K., Lee W.-H., Chen H.-A., Le T. D.-Q., Tzeng D.T.W., Yeh C.-T. // Toxicol. in Vitro. 2014. V. 28. № 4. P. 552–561.
Chao P.-Z., Chin Y.-P., Hsu I.-U., Liu C.-M., Yu Y.-C., Leung T.-K., Lin Y.-F. // Toxicol. in Vitro. 2013. V. 27. № 6. P. 1870–1876.
Heilos D., Röhrl C., Pirker C., Englinger B., Baier D., Mohr T. et al. // Oncotarget. 2018. V. 9. № 39. P. 25661–25680.
Kwon H.J., Owa T., Hassig C.A. // Proc. Natl. Acad. Sci. 1998. V. 95. № 7. P. 3356–3361.
Togashi K., Kakeya H., Morishita M., Song Y.X., Osada H. // Oncol. Res. 1998. V.10. № 9. P. 449–453.
Pang X., Lin X., Wang P., Zhou X., Yang B., Wang J., Liu Y. // Mar. Drugs. 2018. V. 16. № 8. P. 280. https://doi.org/10.3390/md16080280
Johann S., Rosa L.H., Rosa C.A. Perez P., Cisalpino P.S., Zani C.L., Cota B.B. // Rev. Iberoam. Micol. 2012. V. 29. № 4. P. 205–209.
Cimmino A., Pescitelli G., Berestetskiy A., Dalinova A., Krivorotov D., Tuzi A., Evidente A. // J. Antibiot. 2015. V. 69. № 1. P. 9–14.
Kwon H. J., Kim J.-H., Kim M., Lee J.-K., Hwang W.-S., Kim D.-Y. // Vet. Parasitol. 2003. V. 112. № 4. P. 269–276.
Cota B.B., Rosa L.H., Caligiorne R.B., Rabello A.L.T., Alves T.M.A., Rosa C.A., Zani C.L. // FEMS Microbiol. Lett. 2008. V. 285. № 2. P. 177–182.
Bashyal B.P., Wellensiek B.P., Ramakrishnan R., Faeth S.H., Ahmad N., Gunatilaka A.A.L. // Bioorg. Med. Chem. 2014. V 22. № 21. P. 6112–6116.
Zheng C.-J., Shao C.-L., Guo Z.-Y., Chen J.-F., Deng D.-S., Yang K.-L., Wang C.-Y. // J. Nat. Prod. 2012. V. 75. № 2. P. 189–197.
Chua S.W., Cornejo A., van Eersel J., Stevens C.H., Vaca I., Cueto M., Ittner L.M. // ACS Chem. Neurosci. 2017. V. 8. № 4. P. 743–751.
Zheng Z., Zhao Z., Li S., Lu X., Jiang M., Lin J., Xie W. // Mol. Pharm. 2017. V. 92. № 4. P. 425–436.
Патент КНР. 2012. №103054843B.
García-Ruiz C., Cheng-Sánchez I., Sarabia F. // Org. Lett. 2015. V. 17. № 22. P. 5558–5561.
Podlech J., Cudaj J. // Synlett. 2012. V. 23. № 3. P. 371–374.
Frisvad J.C. // Front. Microbiol. 2015. V. 5. P. 773. https://doi.org/10.3389/fmicb.2014.00773
Andersen B., Sørensen J.L., Nielsen K.F., van den Ende B.G., de Hoog S. // Fungal Genet. Biol. 2009. V. 46. № 9. P. 642–656.
Andersen B., Hansen M. E., Smedsgaard J. // Phytopathology. 2005. V. 95. № 9. P. 1021–1029.
Lakshmi M.J., Chowdappa P., Mahmood R. // Indian Phytopath. 2014. V. 67. № 4. P. 374–382.
Patriarca A., da Cruz Cabral L., Pavicich M.A., Nielsen K.F., Andersen B. // Int. J. Food Microbiol. 2019. V. 291. P. 135–143.
Andersen B., Thrane U. // Mycotoxin Res. 1996. V. 12. № 2. P. 54–60.
Zwickel T., Kahl S.M., Rychlik M., Müller M.E.H. // Front. Microbiol. 2018. V. 9. P. 1368. https://doi.org/10.3389/fmicb.2018.01368
Larsen T.O., Perry N.B., Andersen B. // Tetrahedron Lett. 2003. V. 44. № 24. P. 4511–4513.
Andersen B., Kroger E., Roberts R.G. // Mycol. Res. 2002. V. 106. № 2. P. 170–182.
Somma S., Amatulli M.T., Masiello M., Moretti A., Logrieco A.F. // Int. J. Food Microbiol. 2019. V. 293. P. 34–43.
Andersen B., Dongo A., Pryor B.M. // Mycol. Res. 2008. V. 112. № 2. P. 241–250.
Brun S., Madrid H., Gerrits Van Den Ende B., Andersen B., Marinach-Patrice C., Mazier D., De Hoog G.S. // Fungal Biol. 2013. V. 117. № 1. P. 32–40.
Орина А.С., Ганнибал Ф.Б., Мироненко Н.В., Левитин М.М. // Микология и фитопатология. 2014. Т. 48. № 1. С. 53–62.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


