Прикладная биохимия и микробиология, 2020, T. 56, № 3, стр. 242-249
Эффект фотодинамической инактивации в отношении покоящихся и активно растущих форм Mycobacterium smegmatis
М. О. Шлеева 1, *, А. П. Савицкий 1, В. Д. Никитушкин 1, И. Д. Соловьёв 1, К. А. Трутнева 1, Я. С. Керученько 1, А. С. Капрельянц 1
1 Институт биохимии им. А.Н. Баха, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Россия
* E-mail: margoshleeva@gmail.com
Поступила в редакцию 04.12.2019
После доработки 17.12.2019
Принята к публикации 23.12.2019
Аннотация
Исследована возможность уничтожения покоящихся микобактерий Mycobacterium smegmatis (Msm) с помощью фотодинамической инактивации (ФДИ), используя их способность запасать эндогенные порфирины в период перехода в состояние покоя. Покоящиеся клетки Msm получали при постепенном закислении среды роста в стационарной фазе в течение 14 сут при разных концентрациях ионов железа в среде, а также в присутствии 5-аминолевулиновой кислоты в среде роста. Клетки подвергали воздействию света с длиной волны 532 нм, испускаемой лазером LLD10 в течение 5–60 мин. Показано, что увеличение концентрации копропорфирина у M. smegmatis через 6 суток роста при оптимальной концентрации ионов железа 0.5 г/л коррелировало с началом снижения метаболической активности и образованием овоидных покоящихся форм. Покоящиеся бактерии были чувствительны к ФДИ и погибали через 15–30 мин освещения, в отличие от активных клеток. В присутствии 5-аминолевулиновой кислоты происходило усиление продукции уропорфирина как в активных, так и в покоящихся микобактериях, что сопровождалось повышением чувствительности к действию ФДИ. Полученные результаты выявляют перспективу использования ФДИ для борьбы с покоящимися формами возбудителя ТБ и латентной формой заболевания.
Туберкулез (ТБ) является одной из 10 основных причин смерти в мире. По данным ВОЗ в 2018 г. туберкулезом заболели 10 млн чел. в мире, и 1.5 млн чел. (в том числе 0.251 млн чел. с ВИЧ) умерли от этой болезни. Туберкулез с множественной лекарственной устойчивостью (МЛУ-ТБ) по-прежнему представляет серьезную проблему для здравоохранения. По оценкам ВОЗ, в 2018 г. в мире выявлено 484 000 заболевших туберкулезом, возбудитель которого обладал устойчивостью к рифампицину – самому эффективному препарату первой линии. Среди вновь выявленных больных ТБ в 2018 г. в 78% диагностировали МЛУ-ТБ. Около одной четверти населения мира имеют латентный туберкулез. Риск того, что инфицированные туберкулезными бактериями заболеют туберкулезом, составляет 5–15%. Однако люди с ослабленной иммунной системой, такие как ВИЧ-инфицированные, а также неполноценно питающиеся или курящие подвергаются гораздо более высокому риску заболевания. Без надлежащего лечения в среднем 45% ВИЧ-негативных людей с туберкулезом и почти все ВИЧ-позитивные люди с туберкулезом погибают.
Возбудитель ТБ – Mycobacterium tuberculosis (Mtb) способен в неблагоприятных условиях образовывать покоящиеся формы, которые не только приобретают устойчивость ко всем известным антибактериальным препаратам, но и способны десятилетиями сохранять жизнеспособность в организме человека и переходить в активное состояние, вызывая возобновление болезни. Несмотря на недавние многочисленные исследования молекулярных механизмов, лежащих в основе перехода активных микобактерий в состояние покоя, мало известно об особенностях метаболических процессов, протекающих в покоящихся микобактериях. Исходя из того, что в состоянии покоя в бактериях происходит торможение метаболизма, включающее ингибирование многих ферментов и биохимических путей, можно ожидать внутриклеточного накопления некоторых промежуточных метаболитов, таких как метаболиты немевалонатного пути биосинтеза терпеноидов [1]. В недавней работе [2] было показано накопление в значительных количествах промежуточных продуктов биосинтеза протопорфиринов – ключевых молекул гем-содержащих ферментов. Быстрорастущий родственник возбудителя ТБ – Mycobacterium smegmatis (Msm) способен накапливать эндогенно свободные порфирины, такие как копропорфирин III и уропорфирин III, а также их метиловые эфиры [2] во время перехода в покоящееся состояние. В протеомном профиле покоящихся клеток Msm обнаружено увеличение количества ферментов синтеза порфирина: порфибилиногендеаминаза, дегидратаза дельта-аминолевулиновой кислоты, декарбоксилаза уропорфириногена, в отличие от активных микобактерий [3].
Это необычное явление требует дальнейшего исследования для установления особенностей структуры накопленных порфиринов, характеристики ферментов, участвующих в их синтезе и причин этого явления. С другой стороны, возможное накопление порфиринов в условиях покоя Mtb может быть использовано для фотодинамической инактивации (ФДИ) таких форм и лечения латентного ТБ. До настоящего времени накопление покоящимися микобактериями порфиринов до сих пор не было исследовано.
Цель работы − изучение накопления порфиринов при переходе активных Msm в покоящееся состояние, а также оценка эффективности фотодинамической инактивации покоящихся микобактерий.
МЕТОДИКА
Образование покоящихся форм M. smegmatis. Клетки M. smegmatis штамма mc2155 выращивали в питательном бульоне (NB) (“Himedia”, Индия) при 37°C в течение 24 ч при перемешивании (200 об./мин). Инокулят (1 мл) добавляли к 100 мл среды Сатона, следующего состава (г/л): K2HPO4 − 0.5; MgSO4 ⋅ 7H2O − 1.4; L-аспарагин − 4.0; цитрат аммония трехвалентного железа − 0.05; цитрат Na − 2.0; ZnSO4 − 0.01 (“Sigma Aldrich”, США) и глицерин (“Panreac”, Испания) − 60 мл, рН 6.0, вместо обычного для этой среды рН 7.0. Для предотвращения агрегации клеток добавляли Твин 80 (конечная концентрация 0.05%). Культуру выращивали при 37°С на качалке (200 об./мин) в течение 13–16 сут, пока не установится значение рН среды ~ 6.0 [4].
Оценка жизнеспособности по КОЕ. Бактериальные суспензии покоящихся, активных и освещенных микобактерий серийно разводили в свежей среде Сатона, и затем по три пробы 10 мкл из каждого разведения наносили на агаризированную среду NB (“Himedia”, India). Чашки Петри инкубировали при 37°С в течение 5 сут, затем подсчитывали количество колониеобразующих единиц (КОЕ). Предел обнаружения составил 10 КОЕ/мл.
Определение метаболической активности клеток методом мониторинга включения 3Н-урацила. Культуры активных и покоящихся клеток М. smegmatis (1 мл) инкубировали с 1 мкл [5.6-3H] урацила (конечная молярная активность – 1 мкКи/0.02 мкмоль) в течение 4 ч при 37°С на шейкере (45–60 об./мин). Клетки собирали на GFC-фильтрах из стекловолокна (“Whatman”, Англия), промывали 3 мл 7%-ной трихлоруксусной кислоты, а затем 3 мл абсолютного этанола. Высушенные на воздухе фильтры помещали в сцинтилляционную жидкость, радиоактивность измеряли на сцинтилляционном счетчике LS6500 (“Beckman”, США).
Экстракция пигмента из клеток. Пигмент экстрагировали из биомассы бактерий по методу Блая и Дайера [5]. К влажной биомассе (0.8 г) добавляли 1.0 мл хлороформа и 2.0 мл метанола, клетки перемешивали в течение 2 ч, затем центрифугировали при 2500 g в течение 20 мин и к надосадочной жидкости добавляли 1.0 мл воды и 1.0 мл хлороформа (для разделения фаз). Слой хлороформа трижды промывали 0.1 М NaCl и затем анализировали методом ВЭЖХ (Аквилон, “Стайер”, Россия).
Определение порфирина методом ВЭЖХ. Хлороформные экстракт, содержащий порфирины, анализировали методом ВЭЖХ; использовали колонку размером 4.6 × 250 мм с сорбентом Kromasil 100-5 С18 (“Akzo Nobel”, Швеция); в градиентном режиме с буфером A (30%-ный водный CH3CN) и буфером B (100% CH3CN); скорость потока, 1 мл/мин, объем образца 50 мкл. Копропорфирин III и протопорфирин IX (Calbiochem, США) были использованы в качестве стандартов. Длина волны регистрации − 400 нм.
Фотодинамическая инактивация. Для экспериментов по инактивации светом использовали суспензии покоящихся или активных клеток Msm с ОП = 0.1, что соответствовало ~107 бактерий в мл. В лунки 96-луночного планшета Nunc (“ThermoFisher Scientific”, США) вносили по 100 мкл суспензий бактерий. Образцы освещали с помощью лазера LLD10 (“ATC Semiconductor Devices”, Россия) при 532 нм. Плотность мощности света определяли с помощью измерителя мощности 2936-c (“Newport”, США). Световой пучок коллимировали до диаметра 5 мм, что соответствовало диаметру лунок 96-луночного планшета. Освещали в течение 5, 15, 30 или 60 мин. Температурный контроль осуществлялся с помощью мультиметрического термопарного датчика 80BK типа K (“Fluke”, Германия) непосредственно в микроячейке до и после освещения, а также в присутствии и без суспензии M. smegmatis с точностью ±0.2°C. Температура была ниже 40°С в лунках в течение всех экспериментов. После освещения образцов десятикратные разведения (от 10–1 до 10–7) высевали на чашки с агаризованным МПБ для определения КОЕ. Инкубацию проводили при 37°C в течение 5 сут.
Микроскопия. Фазово-контрастную эпифлуоресцентную микроскопию осуществляли с использованием микроскопа Eclipse Ni-U (“Nikon”, Япония) при увеличении ×1500. Эпифлуоресцентную микроскопию проводили в “канале TRITC” (Ex = 540/25; DM = 565; BA = 605/55). Фотографии были сделаны с помощью камеры DS Qi2 (“Nikon”, Япония). Конечная концентрация добавленного к клеткам йодида пропидия (PI) 1 мкг на мл.
Проточная цитометрия. Для количественной оценки бактериальных клеток, окрашенных PI (пропидий йодид) использовали проточный цитометер FACSCalibur (“Becton Dickinson”, США). Анализировали распределение клеток в координатах SSC-H ~ FL3 (регистрировалось 10 000 клеток со скоростью записи 1000 клеток/с). Анализ данных проводился с использованием программного обеспечения FlowJo LLC (“Орегон”, США).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В экспериментальных моделях образования покоящихся форм микобактерий in vitro показано, что такие клетки обладают низкой активностью метаболизма и устойчивостью к известным противотуберкулезным препаратам [6]. Действие многих антибиотиков основано на ингибировании таких основных биосинтетических путей, как синтезы белка, нуклеиновых кислот или полимеров клеточной стенки, что в конечном счете приводит к гибели бактерий. Покоящиеся бактерии с незначительной метаболической активностью могут избежать действия таких “биохимических блокаторов” несмотря на то, что они все еще содержат подходящую мишень. Можно предположить, что эффект полного подавления жизнеспособности покоящихся “некультивируемых” микобактерий может быть обеспечен другим типом противомикробных препаратов, вызывающих прямое вредное воздействие на бактериальную клетку [6]. Такие соединения могут модифицировать внутриклеточные компоненты путем алкилирования, гидролиза, восстановления/окисления и т.д. Так, 2-тиопиридины способствуют транспорту Cu++ и накоплению этого иона в токсичных концентрациях в клетке путем формирования стабильного заряженного комплекса [7], что приводит к стерилизующему эффекту в отношении покоящихся форм Mtb. Подобный эффект наблюдался в отношении покоящихся микобактерий при использовании полидиаллиламинов, вызывающих деструкцию клеточной стенки [8].
Обнаруженное ранее явление накопления свободных и метилированных порфиринов в покоящихся микобактериях [2] может быть использовано для проведения их фотодинамической инактивации. Среди имеющихся в настоящий момент фотосенсибилизаторов (ФС) у порфирина и его аналогов имеются следующие преимущества: 1) многие из них являются эффективными продуцентами синглетного кислорода; 2) они обычно не генерируют синглентный кислород в отсутствие света; 3) имеют заметное поглощение в красной области оптического спектра; 4) они относительно стабильны. В настоящей работе была проведена экспериментальная проверка влияния фотодинамической инактивации на жизнеспособность покоящихся форм Msm.
Бактерии M. smegmatis, выращенные в среде Сатона, в условиях постепенного подкисления среды роста, образовали покоящиеся клетки овоидной формы после 14 сут культивирования. Появление овоидных клеток в популяции сопровождалось снижением метаболической активности, о чем свидетельствует уменьшение включения H3-урацила, в то время как КОЕ в культуре оставалась почти постоянным в течение 30 сут. Также такие формы микобактерий имели низкую дыхательную активность и были значительно менее чувствительны к ингибированию синтеза РНК (рифампицин) и белка (гигромицин) или H+АТФазы (бедаквилин) (табл. 1). В таких покоящихся клетках Msm было обнаружено накопление значительного количества уропорфирина/копропорфирина и их метильных производных [2]. Поскольку порфирины являются предшественниками гема, для синтеза которого также требуются ионы железа, можно предположить, что концентрация железа внутри клетки может влиять на скорость синтеза предшественников гема. Была проанализирована динамика внутриклеточного накопления порфиринов при переходе микобактерий в состояние покоя в среде Сатона, содержащей разные количества ионов Fe3+ в диапазоне от 0 до 3.2 г/л цитрата железа (III)-аммония ((NH4)5[Fe(C6H4O7)2]), остальные компоненты среды добавляли в неизменной концентрации. В норме количество цитрата железа (III)-аммония составляло 0.05 г/л среды. Наибольшая интенсивность накопления веществ порфириновой структуры (до 1.2 мкМ против 0.4 мкМ при стандартной концентрации железа) была обнаружена при концентрации цитрата железа (III)-аммония, соответствующей 0.5 г/л (рис. 1). При отсутствии железа микобактерии не переходят в покоящуюся форму (рис. 2). Микроскопические исследования показали, что при отсутствии железа овоидные формы микобактерий не образуются, клетки продолжали делиться и были представлены тонкими длинными палочками (рис. 2). При этом закисления внешней среды в стационарной фазе роста культуры не наблюдалось. При концентрации цитрата железа (III) аммония 0.05 и 0.5 г/л появлялись типичные овоидные формы клеток, которые ассоциированы с состоянием покоя у микобактерий, в этих случаях происходило самозакисление окружающей среды до значений 5.6–6.2. При концентрации цитрата аммонийного железа (III) 1.3 и 3.2 г/л наблюдалось сильно выраженная гетерогенность клеток в культуре, при которой наряду с овоидными клетками присутствовали и короткие палочки. Увеличение концентрации копропорфирина в стационарной фазе (после 6 сут роста) коррелировало с постепенным подкислением культуры, началом снижения метаболической активности и образованием овоидных покоящихся форм (табл. 2).
Таблица 1.
Свойства активных и покоящихся клеток M. smegmatis
| Параметр | Активные клетки | Покоящиеся клетки |
|---|---|---|
| Размер клетки, длина/ширина, мкм | 3.43 ± 1.05/0.61 ± 0.06 | 1.42 ± 0.35/0.55 ± 0.08 |
| Скорость включения H3-урацила при 37°C, CPM/мг влажного веса клеток | 21 383 ± 3401 | 646 ± 13 |
| Скорость включения H3-урацила при 25°C, CPM/мг влажного веса клеток | 6036 ± 793 | 30 ± 5 |
| Активность дыхания: | ||
| Активность ДФИ-редуктазы, ОП600 /мин–1 мг–1 | 0.18 ± 0.01 | 0.01 ± 0.005 |
| Потребление кислорода, нмоль O2 мин–1 мг–1 | 20 ± 4.5 | 2.5 ± .075 |
| АТФ, пкмоль × влажного веса клеток–1 | 82 ± 13 | 10 ± 2 |
| Устойчивость к рифампицину, %* | 0.02 ± 0.007 | 62.5 ± 17.8 |
| Устойчивость к гигромицину, %* | 0.0001 ± 0.00005 | 10 ± 2 |
| Устойчивость к бедаквилину, %* | 1.4 ± 0.5 | 30.8 ± 9.2 |
Рис. 1.
Влияние концентрации железа на продукцию порфиринов в процессе образования покоящихся микобактерий. На оси абсцисс – концентрация железа в (г/л). На оси ординат – концентрация экстрагированных из клеток M. smegmatis порфиринов в (мкМ).

Рис. 2.
Изменение значений рН и морфологии бактерий в процессе перехода в состояние покоя клеток Msm при разных концентрациях железа в среде роста.
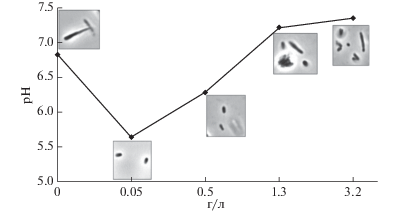
Таблица 2.
Концентрации порфиринов в клетках M. smegmatis при переходе в состояние покоя
| Время, сут | pH | Тетраметил-копропорфирин в CHCl3, ммоль/г влажного веса клеток | Копропорфирин в CH3OH, ммоль/г влажного веса клеток |
|---|---|---|---|
| 2 | 6.65 | 24.32 ± 4.5 | 0.16 ± 0.01 |
| 3 | 7.27 | 34.61 ± 5.0 | 0.93 ± 0.1 |
| 4 | 7.58 | 67.55 ± 5.5 | 0.57 ± 0.04 |
| 5 | 7.64 | 76.11 ± 4.2 | 1.05 ± 0.08 |
| 6 | 7.47 | 200.43 ± 7.5 | 1.14 ± 0.1 |
| 7 | 7.15 | 194.5 ± 14.6 | 1.23 ± 0.11 |
| 8 | 7.03 | 272.74 ± 8.5 | 0.53 ± 0.06 |
| 9 | 6.6 | 312.93 ± 10.5 | 0.48 ± 0.03 |
| 10 | 6.3 | 307.03 ± 6.5 | 0.35 ± 0.03 |
| 11 | 6.18 | 286.07 ± 10.2 | 0 |
| 12 | 6.23 | 402.64 ± 7.5 | 0 |
Для увеличения внутриклеточной концентрации порфиринов в микобактериях была использована 5-аминолевулиновая кислота (АЛК), которую добавляли в среду выращивания. В этом случае наблюдалось увеличение внутриклеточной концентрации неметилированных порфиринов (уропорфирина) в бактериях стационарной фазы развития культуры и в покоящихся микобактериях (табл. 3), но не в клетках логарифмической фазы роста (не показано). Анализ экстрагированных порфиринов из активных и покоящихся клеток, выращенных в присутствии АЛК, методом ВЭЖХ показал, что в присутствии избытка АЛК в среде наблюдалось уменьшение продукции метилированной формы копропорфирина и увеличение количества уропорфирина (табл. 3).
Таблица 3.
Содержание порфиринов в активных и покоящихся клетках M. smegmatis, выращенных в присутствии 5-аминолевулиновой кислоты и без нее
| Вариант опыта | Метилированный копропорфирин (экстракция ацетоном и аммиаком), мкг/мг влажного веса клеток |
Уропорфирин (экстракция хлороформом и метанолом с водой), мкг/мг влажного веса клеток |
|---|---|---|
| Покоящиеся Msm | 0.575 ± 0.08 | 0.00345 ± 0.0001 |
| Покоящиеся Msm + АЛК | 0.305 ± 0.008 | 0.14 ± 0.014 |
| Активные Msm | 0.04667 ± 0.006 | 0.02233 ± 0.002 |
| Актвные Msm + АЛК | 0.07667 ± 0.006 | 0.11767 ± 0.011 |
Было изучено влияние света с длиной волны 532 нм (совпадает с максимумом поглощения порфиринов в видимой области [2]) на жизнеспособность активных и покоящихся форм микобактерий, выращенных в присутствии 3.0 мМ АЛК и без нее (рис. 3). Наибольшее снижение выживаемости микобактерий наблюдалась при воздействии света на покоящиеся микобактерии, выращенные в присутствии АЛК (снижение показателя в 1000 раз при 30 мин освещения), в случае воздействия света на покоящиеся микобактерии, выращенные без добавления АЛК также отмечалось значительное снижение выживаемости клеток в 100 раз (рис. 3а), что косвенно подтвердило накопление порфиринов в покоящихся клетках Msm. В дальнейшем изучали влияние времени воздействия света с λ 532 нм на жизнеспособность клеток Msm трех типов: 1) клетки логарифмической фазы роста, выращенные в присутствии 3.0 мМ АЛК в течение 18 ч; 2) клетки ранней стационарной фазы роста (27 ч); 3) клетки ранней стационарной фазы роста, выращенные в течение 27 ч в присутствии АЛК (рис. 3б). При облучении лазером с λ 532 нм в течение 15 мин активные бактерии ранней стационарной фазы роста, выращенные в присутствии АЛК, быстро погибали, при этом КОЕ с 107 уменьшалось до 2 × 104, в отличие от двух других вариантов культур; продолжение освещения не приводило к дальнейшему снижению КОЕ (рис. 3б).
Рис. 3.
Влияние света λ – 532 нм на выживаемость клеток покоящихся (а) и активных (б) клеток Msm, выращенные с добавлением АЛК (2) и без нее (1). б − 1, 2 – выращивание 18 ч, 3 – 27 ч.

ВЭЖХ-анализ порфиринов, экстрагированных из освещенных покоящихся микобактерий, выявил выраженное уменьшение пика (20 мин), соответствующего копропорфиринам, и появление дополнительного пика (23.5 мин, не показано), что, очевидно, связано с накоплением фотомодифицированной формы порфиринов.
Чтобы проанализировать возможное разрушение клеток после светового воздействия, накопление поврежденных клеток оценивали методом проточной цитометрии с помощью окрашивания иодидом пропидия, который формирует флуоресцентный комплекс с ДНК при повреждении барьера проницаемости клеток бактерий. Типичная картина распределения неокрашенной пробы клеток микобактерий, включающая в себя популяцию живых и мертвых клеток продемонстрирована на рис. 4 (проба без красителя). Однако, если к этой пробе добавить ДНК-связывающийся краситель PI, который связывается с исключительно поврежденными (мертвыми) бактериальными клетками, интенсивность сигнала FL3 (красная флуоресценция) значительно возрастала, особенно для образца, предварительно освещенного лазером. Наложение точечных диаграмм окрашенных и неокрашенных клеток позволило выявить клетки с красной флуоресценцией, а следовательно, установить процент поврежденных клеток. Цитометрия неосвещенных клеток в присутствии иодида пропидия выявила некоторое количество поврежденных бактерий (33.3 ± 3.3%) (рис. 4), которые отражают существование нежизнеспособных клеток даже в неэкспонированной культуре. На рис. 4б показано увеличение количества поврежденных клеток сразу же после воздействия света по сравнению с неосвещенными клетками. По данным проточной цитометрии, после 30 мин воздействия света около 60 процентов (58.73 ± 4.9%) клеток были повреждены.
Рис. 4.
Анализ количества поврежденных клеток M. smegmatis после освещения лазером с длиной волны 532 нм методом проточной цитометрии. I – контроль (неосвещенные клетки); II – освещенные клетки. Диаграммы распределения построены в координатах: по оси абсцисс SSC-H (боковое рассеяние света), по оси ординат FL3 (красная флуоресценция). На диаграммах распределения полигоном отмечена популяция клеток, окрашиваемых по PI, которая соответствует доли поврежденных клеток.

Таким образом, в данном исследовании выявлено, что освещение бактерий лазерным светом приводило к инактивации микобактерий, находящихся в стадии покоя, в противоположность активным бактериям логарифмической фазы роста (рис. 3). Очевидно, что снижение выживаемости бактерий под действием света действительно связано с накоплением порфиринов, поскольку введение АЛК в среду роста стимулировало выработку порфиринов (табл. 3) и повышало чувствительность клеток к освещению (рис. 3). Ранее стимуляция синтеза порфиринов под действием АЛК была описана для культур Mycobacterium phlei и M. smegmatis [9], но фотодинамическое действие эндогенных порфиринов в отношении микобактерий не оценивалось.
Хотя большинство клеток (около 99%) в исследованных популяциях были высокочувствительными к освещению, менее 1.0% клеток были либо устойчивы к освещению при 532 нм, либо значительно менее чувствительны к нему (рис. 3). Одной из причин возникновения остаточной устойчивости клеток к освещению может быть “эффект фильтра”, когда свет рассеивается клетками в суспензии, что приводит к снижению световой дозы в глубоких слоях образца. Гетерогенность клеток в популяции, содержащих различное количество порфиринов, также может объяснять этот эффект. Интересно, что оценка количества поврежденных и, очевидно, нежизнеспособных клеток сразу же после освещения методом проточной цитометрии (рис. 4) выявляет значительную часть популяции как неповрежденную (около 40%). Последнее означает, что в популяции действительно присутствуют высокочувствительные к освещению клетки и менее чувствительные. Однако последние также содержат определенные повреждения, которые приводят в конечном итоге к гибели около 99% клеток.
Полученные нами результаты согласуются с исследованиями, в которых описывается возможность фотодинамической инактивации микобактерий в основном при помощи экзогенно добавленных ФС. Так, Санг с соавт. продемонстрировали возможность фотоинактивации штаммов Mtb с множественной лекарственной устойчивостью с применением экзогенно введенного фотосенсибилизатора радахлорина in vitro [10]. Ранее было показано, что Mycobacterium bovis BCG [11], M. marinum [12], M. fortutinum [13] могут быть инактивированы путем фотодинамического воздействия с применением экзогенно добавленных порфиринов, как in vitro, так и in vivo. Применение катионных ФС порфириновой природы приводило к значительному снижению числа жизнеспособных клеток M. smegmatis при ФДИ белым светом в экспериментах in vitro [14]. Иногда в качестве таких экзогенно добавленных фотосенсибилизаторов используют вещества порфириновой структуры. Так, для фотодинамической инактивации золотистого стафилококка применяли порфирины, связанные с циклодекстрином [15].
Работы, в которых использовались эндогенные ФС для инактивации клеток бактерий, находящихся в состоянии покоя, ранее не проводились. Обнаруженный нами факт накопления эндогенных порфиринов в процессе перехода микобактерий в состояние покоя является уникальным и расширяет горизонты для использования фотодинамической терапии в отношении возбудителя туберкулеза.
В настоящем исследовании впервые показана возможность фотоинактивации in vitro активных и покоящихся форм микобактерий на примере быстрорастущего родственного возбудителю туберкулеза Msm штамма. Таким образом, настоящее исследование выявляет перспективу использования ФДИ для борьбы с покоящимися формами возбудителя ТБ и латентной формой заболевания.
Эксперименты по проведению фотодинамической инактивации микобактерий были проведены при поддержке гранта РНФ № 19-15-00324. Характеристика покоящихся микобактерий проведена при поддержке гранта РНФ № 16-15-00245.
При проведении исследований использовалось оборудование Центра коллективного пользования “Промышленные биотехнологии” Федерального государственного учреждения “Федеральный исследовательский центр "Фундаментальные основы биотехнологии” Российской академии наук”.
Список литературы
Trutko S.M., Shcherbakova V.A., Ivanova I.V., Lysanskaya V.Ya., Arkhipova O.V., Chuvil’skaya N.A., Baskunov B.P., Ostrovskii D.N., Akimenko V.K. // Microbiology. 2008. V. 77. № 3. P. 261–267.
Nikitushkin V.D., Shleeva M.O., Zinin A.I., Trutneva K.A., Ostrovsky D.N., Kaprelyants A.S. // FEMS Microbiol. Lett. 2016. V. 363. № 19. P. 1–8.
Trutneva K., Shleeva M., Nikitushkin V., Demina G., Kaprelyants A. // Front. Microbiol. 2018. V. 9. P. 2083.
Кудыкина Ю.К., Шлеева М.О., Арцатбанов В.Ю., Сузина Н.Е., Капрельянц А.С. // Микробиология. 2011. Т. 80. № 5. С. 625–636.
Bligh E., Dyer W.J. // Can. J. Biochem. Physiol. 1959. V. 37. № 8. P. 911–917.
Kaprelyants A., Salina E., Makarov V. // Int. J. Mycobacteriology. 2018. V. 7. P. 399–400.
Salina E.G., Huszár S., Zemanová J., Keruchenko J., Riabova O., Kazakova E., Grigorov A., Azhikina T., Kaprelyants A., Mikušová K., Makarov V. // Metallomics. 2018. V. 10. № 7. P. 992–1002.
Timofeeva L.M., Kleshcheva N.A., Shleeva M.O., Filatova M.P., Simonova Y.A., Ermakov Y.A., Kaprelyants A.S. // Appl. Microbiol. Biotechnol. 2015. V. 99. № 6. P. 2557–2571.
Bruce-Micah R., Hüttenberger D., Freitag L., Cullum J., Foth H.J. // J. Photochem. Photobiol. B Biol. 2009. V. 97. № 1. P. 1–7.
Sung N., Back S., Jung J., Kim K.H., Kim J.K., Lee J.H., Ra Y., Yang H.C., Lim C., Cho S., Kim K., Jheon S. // Photodiagnosis Photodyn. Ther. 2013. V. 10. № 4. P. 694–702.
O'Riordan K., Sharlin D.S., Gross J., Chang S., Errabelli D., Akilov O.E., Kosaka S., Nau G.J., Hasan T. // Antimicrob. Agents Chemother. 2006. V. 50. № 5. P. 1828–1834.
Wiegell S.R., Kongshoj B., Wulf H.C. // Arch. Dermatol. 2006. V. 142. № 9. P. 1241–1242.
Shih M.H., Huang F.C. // Investig. Ophthalmol. Vis. Sci. 2011. V. 52. № 1. P. 223–229.
Feese E., Ghiladi R.A. // J. Antimicrob. Chemother. 2009. V. 64. № 4. P. 782–785.
Hanakova A., Bogdanova K., Tomankova K., Pizova K., Malohlava J., Binder S., Bajgar R., Langova K., Kolar M., Mosinger J., Kolarova H. // Microbiol. Res. 2014. V. 169. № 2–3. P. 163–170.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


