Прикладная биохимия и микробиология, 2020, T. 56, № 3, стр. 257-265
Оценка биотехнологического потенциала новых штаммов-деструкторов фенола
В. Н. Поливцева 1, Т. О. Анохина 1, Л. Р. Иминова 2, О. В. Борзова 2, Т. З. Есикова 1, И. П. Соляникова 1, 2, *
1 Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина РАН, Федеральный исследовательский центр “Пущинский научный центр биологических исследований РАН”
142290 Московская обл., Пущино, Россия
2 Пущинский государственный естественно-научный институт
142290 Московская обл., Пущино, Россия
* E-mail: innas@IBPM.Pushchino.ru
Поступила в редакцию 29.11.2019
После доработки 13.12.2019
Принята к публикации 23.12.2019
Аннотация
Из чистых почв и почв, загрязненных полициклическими ароматическими углеводородами, выделены бактерии, в том числе ризосферные, способные в различной степени трансформировать алифатические и ароматические соединения. Отобрано 7 бактерий, способных разлагать фенол в концентрации не менее 500 мг/л. Идентификация по гену 16S рРНК показала, что они относятся к родам Rhodococcus, Pseudomonas, Stenotrophomonas, Lysinibacillus и Isoptericola. Определение активности ферментов деструкции фенола у всех этих культур показало отсутствие мета-пути расщепления пирокатехина при деградации фенола. В бесклеточных экстрактах обнаружены активности пирокатехин-1,2-диоксигеназы и протокатехоат-3,4-диоксигеназы, активность последнего фермента была до 15 раз выше, чем пирокатехин-1,2-диоксигеназы, что для представителей рода Isoptericola описано впервые. Штаммы, выделенные из ризосферы растений, растущих на загрязненной почве, были способны к деструкции до 15 индивидуальных поллютантов, таких как алифатические углеводороды, хлорфенолы, 2,4,5-трихлорфеноксиуксусная кислота и капролактам. С применением биохимических тест-систем для представителей родов Stenotrophomonas и Isoptericola было показано наличие активности таких ферментов как β-галактозидаза и лизин-декарбоксилаза. Выделенные бактерии могут быть использованы как для создания препаратов для биомередиации, так и штаммов-продуцентов целевых ферментов.
Ароматические соединения и их производные широко распространены в природе и приводят к значительному загрязнению окружающей среды. Фенол – это один из широко распространённых промышленных загрязнителей, его источниками являются нефтехимические предприятия. Часть фенола поступает в окружающую среду в результате разложения растительных и животных остатков. Фенол и особенно его производные (крезолы, ксиленолы, нафтолы гидрохинон, резорцин, пирогаллол, нитро- и хлорфенолы и др.), используемые в различных отраслях производства, токсичны для животных, человека, микроорганизмов, поэтому промышленные сточные воды с высоким содержанием фенола плохо поддаются биологической очистке. Фенол и его производные как естественного, так и антропогенного происхождения, классифицированы Агентством по токсическим субстанциям и регистрации заболеваний (ATSDR), как приоритетные опасные вещества в силу их потенциального токсического, мутагенного, канцерогенного и тератогенного эффектов.
Биологические способы очистки, в частности микробная биодеградация, имеют огромный потенциал и конкурентные преимущества, связанные прежде всего с их экологической безопасностью и более низкой стоимостью [1]. Многие бактерии способны к деструкции фенола, среди них грамотрицательные бактерии родов Pseudomonas, Sphingomonas, Burkholderia, Alcaligenes, Acinetobacter, Flavobacterium, и представители грамположительных бактерий родов Arthrobacter, Nocardia, Rhodococcus и Bacillus [2–6]. Микроорганизмы разлагают токсичные ароматические соединения до безопасных для живых организмов и легко утилизируемых субстратов, поэтому выделение и характеристика новых штаммов-деструкторов является перспективным направлением исследований для создания эффективных биопрепаратов, пригодных для биоремедиации.
Цель работы − характеристика новых почвенных микроорганизмов, способных к деградации ароматических соединений, выделенных из различных источников: загрязненных и незагрязненных почв России и Казахстана.
МЕТОДИКА
Организмы, методы культивирования. Микроорганизмы были выделены из почвы, отобранной в окрестностях г. Пущино Московской обл. (Россия), из ризосферной незагрязненной и загрязненной почвы г. Саратова (Саратовский нефтеперерабатывающий завод, Россия) и Казахстана. Отбор проб проводили с глубины 5–10 см. Для выделения микроорганизмов использовали почву после перемешивания отобранных образцов. Образцы почвы (5 г) вносили в колбы Эрленмеера со 100 мл минеральной среды следующего состава (г/л): Na2HPO4 − 0.7; KH2PO4 − 0.5; NH4NO3 − 0.75; MgSO4 ⋅ 7H2O − 0.2; MnSO4 − 0.001; FeSO4 − 0.02, NaHCO3 − 0.25, содержащей 100 мг/л бензоата. Культивирование образцов проводили на качалке (180 об./мин) при 28°С в течение 7 сут. Клетки высевали на агаризованную богатую среду Luria Bertani (LB) после разведения до 10–6–10–8. Отдельные колонии, отличающиеся по морфотипу, высевали на богатую среду для дальнейшей работы.
Для получения биомассы штаммы культивировали на минеральной среде. Культуры засевали в колбы объемом 750 мл, содержащие по 200 мл минеральной среды с 0.2 г/л фенола в качестве единственного источника углерода и энергии. Бактерии выращивали на качалке при 220 об/мин при температуре 28°C до оптической плотности (ОП) 0.7–0.8 ед., далее повторно вносили 0.2 г/л фенола по мере его потребления культурой. Рост культуры оценивали спектрофотометрически по ОП при длине волны 590 нм, присутствие фенола определяли по спектру поглощения в области 220–350 нм на спектрофотометре UV-1800 (“Shimadzu”, Япония).
Идентификацию бактерий. Определение штаммов проводили на основе анализа генов 16S рРНК. Геномную ДНК выделяли с помощью набора Zymo Reseacher Quick-DNA Fungal/Bacterial Miniprep Kit (“Zymo Reseach”, США) в соответствии с рекомендацией производителя. Ген 16S рРНК амплифицировали в ПЦР, используя универсальные для 16S рРНК прокариот праймеры: 27f (5'-AGAGTTTGATCCTGGCTCAG-3') и 1525r (5'-AAGGAGGTGATCCAGCC-3') [7]. ПЦР осуществляли на приборах My-Cycler, Tetrad 2 (“Bio-Rad Laboratories”, США).
Филогенетический анализ. Первичный филогенетический скрининг полученных последовательностей проводили с помощью программы BLAST [http://www.ncbi.nlm.nih.gov/blast] и базы данных EzBioCloud (www.ezbiocloud.net). Для филогенетического анализа были использованы последовательности гена 16S рРНК, взятые из базы данных GenBank (www.ncbi.nlm.nih.gov). Полученные нуклеотидные последовательности гена 16S рРНК выравнивали вручную c последовательностями референтных штаммов ближайших микроорганизмов с помощью программы CLUSTAL W [8].
Проверка деградативной активности бактерий по отношению к фенолу. Штаммы культивировали в минеральной среде с фенолом (начальная концентрация 100 мг/л) в качестве источника углерода и энергии. За ростом культур следили, определяя ОП при 590 нм, присутствие фенола контролировали, снимая спектры в диапазоне 220–350 нм. рН среды поддерживали в диапазоне значении 7.0–7.2 путем внесения NaOH. Культуры, утилизирующие фенол в концентрации 100 мг/л, пересевали в свежую минеральную среду, концентрацию фенола увеличивали до 300 мг/л. Культуры, способные расти в минеральной среде с фенолом при его концентрации 300 мг/л, пересевали в свежую среду с фенолом с концентрацией 500 мг/л.
Определение способности бактерий утилизировать различные поллютанты. Отобранные культуры бактерий проверяли на способность утилизировать различные ароматические, алифатические и хлорсодержащие соединения, которые добавляли в минеральную среду в качестве единственного источника углерода и энергии. Субстраты использовали в следующих концентрациях: фенантрен, антрацен, флюорен, аценафтен, фенол, капролактам – 0.2–1.0 г/л; салицилат, гентизат, протокатехоат, о-фталат, 2-гидроксикоричная кислота, пирокатехин, фенол, бензоат, хлорбензоаты (2-, 3-, 4-хлорбензоат, 3,5-дихлорбензоат), 2,4,5-трихлорфеноксиуксусная кислота – 0.2 г/л; хлорфенолы (2-, 3-хлорфенол, 2,3-, 2,4-, 2,5-, 2,6-, 3,4-дихлорфенол, 2,3,4-, 2,4,5-, 2,4,6-трихлорфенол, пентахлорфенол) – 0.1 г/л. При выращивании штаммов на агаризованной среде летучие ароматические и алифатические соединения: нафталин, бензол, толуол, этилбензол, гексан, октан, нонан, декан, ундекан, додекан, гексадекан, дизельное топливо, камфора, кумарин наносили на крышку перевернутой чашки Петри.
Микроскопические методы исследования. Микроскопические исследования штаммов проводили с использованием микроскопов Nikon Eclipse Ci microscope (“Nikon”, Япония) с камерой ProgRes SpeedXT (“Jenoptic”, Германия).
Определение спектра утилизируемых субстратов бактериальных изолятов. Использовали тесты API 20 E и CH 50 (“bioMerieux”, Франция), согласно инструкциям производителя.
Приготовление бесклеточных экстрактов. Клетки разрушали экструзионной дезинтеграцией на прессе типа Хьюза (“ИБФМ-пресс”, Россия) с рабочим давлением 3200 кГ/см2. После дезинтеграции клеточный дебрис удаляли центрифугированием при 10 000 g (4°С, 30 мин) в присутствии следовых количеств ДНК-азы. Супернатант использовали в качестве бесклеточного экстракта для определения активностей ферментов. В 1.0 мл реакционной смеси вносили 5–50 мкл экстракта. Определение активностей проводили при 25°С, реакцию начинали внесением бесклеточного экстракта, ОП определяли на спектрофотометре UV-1800 (“Shimadzu”, Япония).
Определение активности ферментов. Активность пирокатехин-2,3-диоксигеназы определяли по скорости образования 2-гидроксимуконового полуальдегида в реакционной смеси, содержащей 0.25 мМ пирокатехин, бесклеточный экстракт и 50 мМ Tрис-НСl буфер (рН 7.5) (λ = = 375 нм, ε = 33400 М–1 см–1) [9].
Активность пирокатехин-1,2-диоксигеназы определяли по скорости образования цис,цис-муконата в реакционной смеси, содержащей 5.0 мМ Nа ЭДТА, 0.25 мМ пирокатехин, бесклеточный экстракт, 50 мМ фосфатный буфер (рН 7.0) (λ = 260 нм, ε = 16900 М–1 см–1) [9].
Активность гентизат-1,2-диоксигеназы определяли по скорости образования малеилпирувата в реакционной смеси, содержащей 0.1 мМ гентизата, бесклеточный экстракт и 100 мМ калий-фосфатный буфер (рН 7.4) (λ = 330 нм, ε = = 10 800 М–1 см–1) [10].
Активность протокатехоат-3,4-диоксигеназы определяли по убыли протокатехоата в реакционной смеси, содержащей 0.25 мМ протокатехоата, бесклеточный экстракт в трис-ацетатном буфере (рН 7.5) (λ = 290 нм, ε = 2870 М–1 см–1) [11].
За единицу активности принимали количество фермента, катализирующее превращение 1 мкмоль субстрата или образование 1 мкмоль продукта за 1 мин в расчете на 1 мг клеточного белка. Концентрацию белка определяли спектрофотометрически по модифицированному методу Бредфорда [12].
Статистическая обработка. Средние значения и стандартные ошибки среднего арифметического были получены по данным из трех независимых экспериментов с использованием программы Microsoft Excel 2007.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Выделение штаммов. С применением метода накопительного культивирования из образцов различных почв была создана коллекция штаммов-деструкторов ароматических соединений. На первом этапе были выделены штаммы, способные расти в минеральной среде с бензоатом, так как это соединение менее токсично, по сравнению с фенолом, а полная деструкция и бензоата и фенола предполагает образование на первом этапе пирокатехина, дальнейшую трансформацию которого осуществляют изофункциональные ферменты [13]. Таким способом было отобрано порядка 80 штаммов. В дальнейшем отобранные штаммы исследовали на способность утилизировать фенол в качестве единственного источника углерода при его содержании в среде от 100 до 500 мг/л. Выделенные из различных загрязненных и незагрязненных почв штаммы, были разделены на 3 группы.
Первая группа состояла из 8 штаммов, выделенных из ризосферы растений, растущих в незагрязненной почве, эти штаммы были обозначены − Fch 1–8. Они разлагали фенол в концентрации 100 мг/л. Все штаммы этой группы были пересеяны на минеральную среду с увеличенной до 300 мг/л концентрацией фенола. Штаммы (Fch №№ 4–8), способные разлагать фенол в концентрации 300 мг/л, были пересеяны на минеральную среду, содержащую фенол в концентрации 500 мг/л. Из них наиболее активными оказались 3 штамма − Fch 5, 7, 8.
Из штаммов, выделенных из ризосферы растений, растущих в загрязненной почве, по такому же алгоритму из 6 штаммов (штаммы Fg 1, 3–7), был отобран один штамм Fg 1, способный разлагать фенол в концентрации 500 мг/л.
В третью группу микроорганизмов входило 17 штаммов, выделенных из загрязненной почвы (г. Саратов, “Саратовский нефтеперерабатывающий завод”, Россия). Из этой группы в жидкой среде, содержащей 500 мг/л фенола, росли 3 штамма (8BN, 7B, 13BN).
Рис. 1.
Изменение ОП клеток (1) и концентрации фенола (2) при выращивании штаммов Stenotrophomonas sp. Fch 8 (а), Pseudomonas sp. 13BN (б), Isoptericola sp. 8BN (в), Rhodococcus sp. 7B (г) на минеральной среде с фенолом (концентрация фенола 300 мг/л (а) и 500 мг/л (б–г)).
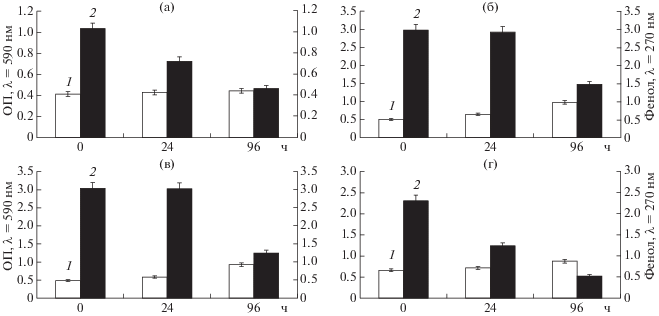
Таким образом, из 81 выделенного штамма было отобрано 7, способных разлагать фенол в концентрации 500 мг/л (рис. 1).
Систематика. Анализ гена 16S рРНК показал, что отобранные культуры можно отнести к следующим филогенетическим группам: штамм 7B – к роду Rhodococcus, штамм 13BN – к роду Pseudomonas, штаммы Fch 5, 7 и 8 – к роду Stenotrophomonas, штамм Fg 1 к роду Lysinibacillus sp. и штамм 8BN к роду Isoptericola.
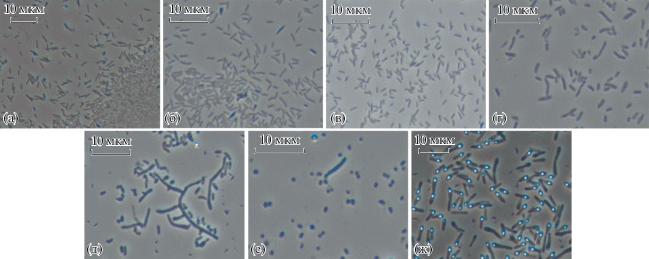
Морфология клеток. Проведенные микроскопические исследования позволили определить характерные морфологические особенности клеток штаммов (рис. 2). Клетки культуры 7B, выделенной из незагрязненной почвы, представлены длинными ветвящимися неподвижными палочками, характерными для родококов. Клетки штамма 13BN представлены средними палочками длиной 2–3 нм, отличительной особенностью роста культуры является формирование так называемых “газовых пузырей” на поверхности роста колоний, что было выявлено нами с применением фазово-контрастной микроскопии и требует дальнейшего изучения. Штаммы Fch 5, 7 и 8 − тонкие палочки длинной 1–2 нм, штамм 8BN − мелкие кокки, имеющие в одной из фаз своего развития форму длинных палочек (длиной 3–4 нм), которые способны дробится с образованием мелких кокков. Клетки Fg 1 − бациллярной формы, образуют терминально расположенные споры, при этом формируя “булавообразную” форму клетки (рис. 2).
Рис. 2.
Фазово-контрастная микроскопия выделенных штаммов: Stenotrophomonas sp. Fch 5 (а), Stenotrophomonas sp. Fch 7 (б), Stenotrophomonas sp. Fch 8 (в), Pseudomonas sp. 13BN (г), Rhodococcus sp. 7B (д), Isoptericola sp. 8BN (е), Lysinibacillus sp. Fg 1 (ж).
Биохимические свойства. Для определения физиолого-биохимических особенностей культур использовали тесты API 32E и 50CH (“bioMerieux”, Франция). Проведенные исследования отобранных штаммов позволили выявить следующие особенности (табл. 1).
Таблица 1.
Биохимические свойства исследуемых штаммов
| Показатель* | Штаммы | ||||||
|---|---|---|---|---|---|---|---|
| 7B | 8BN | 13BN | Fch 7 | Fch 8 | Fg 1 | Fch 5 | |
| Активность фермента | |||||||
| β-галактозидаза | – | + | – | + | + | – | + |
| Аргинингидролаза | – | – | + | – | - | – | – |
| Лизиндекарбоксилаза | – | – | – | – | + | – | + |
| Уреаза | + | – | – | – | – | – | + |
| Утилизация цитрата | + | – | + | + | + | – | + |
| Разжижение желатина | – | – | – | – | + | – | + |
| Восстановление N2 | – | – | – | + | + | + | + |
| Утилизация субстратов** | |||||||
| L-арабиноза | – | + | + | – | – | – | – |
| D-ксилоза | – | + | + | – | – | – | – |
| D-галактоза | – | + | + | – | – | – | – |
| D-глюкоза | – | + | – | – | – | – | – |
| D-фруктоза | + | + | – | – | – | – | – |
| D-манноза | – | + | + | – | + | – | – |
| Инозит | + | – | – | – | – | – | – |
| D-маннит | + | – | – | – | – | – | – |
| D-сорбит | + | – | – | – | – | – | – |
| Эскулин | + | + | – | + | + | – | + |
| N-ацетилглюкозоамин | – | + | – | – | – | + | – |
| Амигдалин | – | + | – | – | – | – | – |
| Арубутин | – | + | – | – | – | – | – |
| Салицин | – | + | – | – | – | – | – |
| D-целлобиоза | – | + | – | – | – | – | – |
| D-мальтоза | – | + | – | + | + | – | + |
| D-лактоза | – | + | – | – | – | – | – |
| D-мелибиоза | – | + | – | – | – | – | – |
| D-сахароза | – | + | – | – | – | – | – |
| D-трегалоза | – | + | + | – | – | – | – |
| D-мелецитоза | – | + | – | – | – | – | – |
| D-раффиноза | – | + | – | – | – | – | – |
| Амидон (крахмал) | – | + | – | – | – | – | – |
| Гликоген | – | – | – | – | – | – | – |
| Гентиобиоза | – | + | – | – | – | – | – |
| D-тураноза | – | + | – | – | – | – | – |
| D-тагатоза | – | – | + | – | – | – | – |
| D-арабит | + | – | – | – | – | – | – |
* − отрицательная реакция; + − положительная реакция. ** Все исследованные штаммы показали отрицательную реакцию на образование H2S и индола, реакцию Фогес-Проскауэра, утилизацию глицерина, эритритола, D-арабинозы, D-рибозы, D-ксилозы, D-адонитола, метил-β D-ксилопиранозида, L-сорбозы, L-рамнозы, дульцитола, метил-α D-маннопиранозида, метил-α D-глюкопиранозида, инулина, ксилита, D-ликсозы, D-фукозы, L-арабита, 2-кетоглюконата, 5-кетоглюконата.
Практически все исследуемые штаммы утилизировали несколько органических соединений. Исключение составил штамм Isoptericola sp. 8BN, который был способен утилизировать многие из исследуемых субстратов, в том числе, N-ацетилглюкозамин – основной компонент клеточной стенки бактерий. Таким же свойством обладал штамм Lysinibacillus sp. Fg 1, который рос только на среде с N-ацетилглюкозамином. Этот факт указывает на потенциальную антимикробную активность данных штаммов.
Штаммы рода Stenotrophomonas Fch 5, 7, 8 и штамм Isoptericola sp. 8BN синтезировали β-галактозидазу, два из них, Fch 5 и 8, проявили также лизин-декарбоксилазную активность, а штамм Pseudomonas sp. 13BN активность аргинингидролазы.
Деградативный потенциал выделенных культур. Изучение характеристик отобранных штаммов показало, что в большей степени ими утилизировались такие субстраты, как бензоат, фенол, нафталин и н-алканы (количество атомов углерода С6–С16) (табл. 2). Более половины из них росли на этих соединениях.
Таблица 2.
Рост выделенных штаммов на целевых субстратах
| Штамм | Источник выделения | Субстрат для роста |
|---|---|---|
| Stenotrophomonas sp. Fch 5 | Ризосфера растений незагрязненных почв | Капролактам, фенол, бензоат, салицилат, гентизиновая кислота, октан, нонан, декан, гексадекан, додекан, ундекан, 2-хлорфенол, 2,4-дихлорфенол, 2,6-дихлорфенол, 2,4,6-трихлорфенол |
| Stenotrophomonas sp. Fch 7 | Ризосфера растений незагрязненных почв | Фенол, 2-хлорфенол |
| Stenotrophomonas sp. Fch 8 | Ризосфера растений незагрязненных почв | Фенол, пентахлорфенол, 2,5-дихлорфенол |
| Lysinibacillus sp. Fg 1 |
Ризосфера растений загрязненных почв | Капролактам, фенол, бензоат, октан, нонан, декан, гексадекан, додекан, ундекан, 2-хлорфенол, 3-хлорфенол, пентахлорфенол, 2,5-дихлорфенол, 2,6-дихлорфенол, 2,4,5-трихлорфеноксиуксусная кислота, 2,4,6-трихлорфенол, протокатеховая кислота |
| Pseudomonas sp. 13BN | Загрязненная почва (Саратовский нефтеперерабатывающий завод, Россия) | Фенол, декан, ундекан |
| Isoptericola sp. 8BN | Загрязненная почва (Саратовский нефтеперерабатывающий завод, Россия) | Фенол |
| Rhodococcus sp. 7B | Незагрязненная почва | Капролактам, фенол, бензоат, октан, нонан, декан, гексадекан, додекан, ундекан |
Значительно меньшее количество штаммов могли утилизировать бензол и его производные – толуол и этилбензол, а также хлорсодержащие фенолы и бензоаты. Большинство штаммов не использовали эти субстраты. Штаммы, обозначенные как Fch 8 и Fg 1, росли на пентахлорфеноле, соединении, которое Стокгольмской конвенцией включено в список стойких органических загрязнителей (СОЗ). С другой стороны, штаммы Fch 5 и Fg1, выделенные из ризосферы растений, растущих в чистой и загрязненной почве, показали способность к деструкции более чем 15 соединений, в том числе относящихся к СОЗ (штамм Fg 1).
Активности ферментов деградации фенола. В клетках четырех наиболее активно растущих на феноле культур (Fch 8, 13BN, 8BN и 7B) определяли активность ферментов, участвующих в разложении фенола: пирокатехин-1,2-диоксигеназы (ПК-1,2-ДО), пирокатехин-2,3-диоксигеназы (МПК), протокатехоат-3,4-диоксигеназы (ПКК-3,4-ДО), муконатциклоизомеразы (МЦИ) и гентизат-1,2-диоксигеназы (ГДО) (табл. 3).
Таблица 3.
Активность (ед./мг белка) ферментов деградации ароматических соединений
| Штамм | ПК-1,2-ДО | ПК-2,3-ДО | ПКК-3,4-ДО | МЦИ | ГДО |
|---|---|---|---|---|---|
| Stenotrophomonas sp. Fch 8 | 0.086 ± 0.009 | 0.001 ± 0.001 | <0.001 | 0.006 ± 0.002 | ≤0.001 |
| Pseudomonas sp. 13BN | 0.089 ± 0.011 | 0.002 ± 0.001 | 1.355 ± 0.121 | 0.079 ± 0.016 | ≤0.001 |
| Isoptericola sp. 8BN | 0.159 ± 0.028 | 0.009 ± 0.002 | 1.098 ± 0.025 | 0.097 ± 0.049 | ≤0.001 |
| Rhodococcus sp. 7B | 0.122 ± 0.029 | <0.001 | 2.014 ± 0.185 | 0.046 ± 0.02 | ≤0.001 |
Обнаружено, что все исследуемые штаммы проявляли активность ПК-1,2-ДО составившую 0.08–0.16 ед./мг белка, в то же время активность ПКК-3,4-ДО в бесклеточных экстрактах штаммов 13BN, 8BN и 7B была выше почти в 15 раз по сравнению с активностью ПК-1,2-ДО. У штамма Fch 8 активность ПКК-3,4-ДО не была обнаружена. Активность МЦИ была также обнаружена только в бесклеточных экстрактах штаммов 13BN, 8BN и 7B и составляла в среднем 0.07 ед./мг белка. Активности ферментов МПК и ГДО не были обнаружены в бесклеточных экстрактах всех исследуемых штаммов. В клеточных гомогенатах не обнаружены также активности орнитин-декарбоксилазы и триптофандеаминазы.
Из коллекции штаммов-деструкторов бензоата нами было отобрано 7 штаммов, способных утилизировать фенол в концентрации до 500 мг/л. Фенол был выбран для создания коллекции деструкторов, так как он является широко распространенным токсичным соединением, содержание которого в питьевой воде и воздухе должно строго контролироваться [14, 15]. Выделенные нами бактериальные штаммы, способные к деградации фенола в концентрациях выше 500 мг/л, представляют значительный биотехнологический интерес.
Также нами была определена способность отобранных штаммов к утилизации ряда токсичных органических соединений и показано, что два ризосферных штамма Fch 5 и Fg 1 способны расти на более чем 15 субстратах, при этом один из штаммов выделен из незагрязненной почвы (Fch 5). Исследуемые штаммы относятся к различным филогенетическим группам: грамотрицательные – Stenotrophomonas sp. Fch 5, Fch 7, Fch 8, Pseudomonas 13BN и грамположительные – Rhodococcus sp. 7B, Lysinibacillus sp. Fg 1 и Isoptericola sp. 8BN. Представители последних двух родов мало описаны в литературе как деструкторы токсичных ароматических соединений. Так, в 2018 г. для бактерии Isoptericola chiayiensis описана способность к росту на сырой нефти в качестве единственного источника углерода и энергии [16]. Сравнение субстратного профиля описанных ранее и выделенного нами штамма показало их сходство, но в отличие от ранее выделенных штаммов 8BN проявлял β-галактозидазную активность и способность к утилизации N-ацетилглюкозамина [17–19].
Определение активности основных ферментов деградации фенола показало, что исследуемые штаммы проявляли активность ПК-1,2-ДО, при этом у штаммов 13BN, 8BN и 7B в бесклеточном экстракте определена активность ПКК‑3,4-ДО, которая была в 15 раз выше, чем активность ПК‑1,2-ДО. Одновременное присутствие ПК‑1,2-ДО и ПКК-3,4-ДО описано у бактерий разных родов, например, в клетках бактерий Pseudomonas putida KT2440, выращенных на бензоате, была обнаружена высокая активность ПК-1,2-ДО и следы ПКК-3,4-ДО [20], в клетках Acinetobacter baumanii DU202, выращенных на пара-Гидроксибензойной кислоте [21], у некоторых представителей Amycolatopsis и Streptomyces при утилизации бензоата [22]. У штамма Rhodococcus sp. RHA1 ПК-1,2-ДО и ПКК-3,4-ДО обнаруживались одновременно как при росте на бензоате, так и фталате [23], но для представителей рода Isoptericola это было описано впервые. Высокая активность фермента ПКК-3,4-ДО может свидетельствовать о том, что процесс деградации фенола идет преимущественно через образование протокатехоата, не характерном для бактерий. Другое возможное объяснение – множественность путей деградации ароматических соединений у бактерий, которые не были адаптированы к росту на целевых субстратах в течение длительного времени.
С применением биохимических тест систем для представителей родов Stenotrophomonas и Isoptericola качественно было показано наличие активности таких ферментов как бета-галактозидаза и лизиндекарбоксилаза. Эти ферменты получают в промышленности в том числе с помощью микроорганизмов, поэтому исследуемые штаммы могут быть использованы не только для биоремедиации, но и как источник этих ферментов.
Штамм Lysinibacillus sp. Fg 1 способен к утилизации N-ацетилглюкозамина – основного компонента бактериальной клеточной стенки. Анализ данных по субстратным профилям описанных ранее в литературе штаммов рода Lysinibacillus показал, что эта особенность ранее не была показана и является отличительной характеристикой выделенного штамма [24, 25]. В литературе описаны примеры антимикробной и антигрибной активности штаммов этого рода, в том числе против паразитических грибов растений [26], поэтому дальнейшее его изучение позволит выявить его биотехнологический потенциал. Следует подчеркнуть, что, являясь спорообразующей бактерией, штамм Fg 1 способен к выживанию в неблагоприятных условиях, сохраняясь в виде спор, он может быть транспортирован в сухом виде, поэтому является перспективным при создании биопрепаратов для очистки территорий, удаленных от мест его производства.
Проблема утилизации соединений, относящихся к стойким органическим загрязнителям, является актуальной. К первичному списку, определенному Стокгольмской конвенцией в 2001 г., постепенно добавляются новые соединения. Штаммы Fch 8 и Fg 1, способные утилизировать пентахлорфенол – соединение, относящегося к СОЗ, являются потенциально значимыми для создания биопрепаратов для очистки территорий, подвергшийся воздействию СОЗ.
В целом можно говорить, что выделенные штаммы являются ценными для применения в различных отраслях биотехнологии и необходимо их дальнейшее изучение, направленное на более глубокую характеристику уже изученных свойств и выявление новых особенностей.
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 18-34-00964.
Список литературы
Wang Q., Zhang S., Li Y., Klassen W. // J. Environ. Protect. 2011. № 2. P. 47–55.
Nešvera J., Rucká L., Pátek M. // Advances in Applied Microbiology. 2015. V. 93. P. 107–160. https://doi.org/10.1016/bs.aambs.2015.06.002
Geng A., Soh A. E.W., Lim C.J., Loke L.C.T. // Appl. Microbiol. Biotechnol. 2006. V. 71. № 5. P. 728–735. https://doi.org/10.1007/s00253-005-0199-z
Szőköl J., Rucká L., Šimčíková M., Halada P., Nešvera J., Pátek M. // Appl. Microbiol. Biotechnol. 2014. V. 98. № 19. P. 8267–8279. https://doi.org/10.1007/s00253-014-5881-5886
Ahmad S., Syed M., Arif N., Shukor M., Shamaan N. // Aust. J. Basic Appl. Sci. 2011. V. 5. № 8. P. 1035–1045.
Zhai Z., Wang H. Yan S., Yao J. // J. Chem. Technol. Biotechnol. 2012. V. 87. № 1. P. 105–111.
Weisburg W.G, Barns S.M, Pelletier D.A, Lane D.J. // J. Bacteriol. 1991. V. 173. № 2. P. 697–703.
Thompson J.D., Higgins D.G., Gibson T.J. // Nucleic Acid-s Res. 1994. V. 22. № 22. P. 4673–4680.
Hegeman G.D. // J. Bacteriol. 1966. V. 91. № 3. P. 1140–1154.
Crawford R.L., Hutton S.W., Chapman P.J. // J. Bacteriol. 1975. V. 121. № 3. P. 794–799.
Fujisawa H., Hayaishi O. // J. Biol. Chem. 1968. V. 243. № 10. P. 2673–2681.
Schlömann M., Schmidt E., Knackmuss H.-J. // J. Bacteriol. 1990. V. 172. № 9. P. 5112–5118.
Mazzoli R., Pessione E.,Giuffrida M.G., Fattori P., Barello C., Giunta C., Lindley N.D. // Arch. Microbiol. 2007. V. 188. № 1. P. 55–68. https://doi.org/10.1007/s00203-007-0223-z
Liu Y., Wang W., Shah S.B., Zanaroli G., Xu P., Tang H. // Appl. Microbiol. Biotechnol. 2019. https://doi.org/10.1007/s00253-019-10271-w
Li H., Meng F., Duan W., Lin Y., Zheng Y. // Ecotoxicol. Environ. Saf. 2019. V. 184. Article 109658. https://doi.org/10.1016/j.ecoenv.2019.109658
Lee D.W., Lee H., Kwon B.O., Khim J.S., Yim U.H., Kim B.S., Kim J.J. // Environ. Pollut. 2018. V. 241. P. 254–264.
Bakalidou A., Kämpfer P., Berchtold M., Kuhnigk T., Wenzel M., König H. // Int. J. Syst. Evol. Microbiol. 2002. V. 52. Pt. 4. P. 1185–1192.
Stackebrandt E., Schumann P., Cui X.-L. // International J. Syst. Evol. Microbiol. 2004. V. 54. Pt. 3. P. 685–688.
Kaur N., Rajendran M.K., Kaur G., Shanmugam M. // Antonie Van Leeuwenhoek. 2014. V. 106. № 2. P. 301–307.
Kim Y.H., Cho K., Yun S.-H., Kim J.Y., Kwon K.-H., Yoo J.S., Kim S.I. // Proteomics. 2006. V. 6. № 4. P. 1301–1318.
Park S.H., Kim J.W., Yun S.H., Leem S.H., Kahng H.Y., Kim S.I. // J. Microbiol. 2006. V. 44. № 6. P. 632–640.
Grund E., Knorr C., Eichenlaub R. // Appl. Environ. Microbiol. 1990. V. 56. № 5. P. 1459–1464.
Patrauchan M.A., Florizone C., Dosanjh M., Mohn W.W., Davies J., Eltis L.D. // J. Bacteriol. 2005. V. 187. № 12. P. 4050–4063.
Lee C.S., Jung Y.-T., Park S., Oh T.-K., Yoon J.-H. // Int. J. Syst. Evol. Microbiol. 2010. V. 60. Pt. 2. P. 281–286.
Begum M.A., Rahul K., Sasikala C., Ramana C.V. // Arch. Microbiol. 2016. V. 198. № 4. P. 325–332. https://doi.org/10.1007/s00203-016-1194-8
Ahmad V., Iqbal A.N., Haseeb M., Khan M.S. // Anaerobe. 2014. V. 27. № 1. P. 87–95. https://doi.org/10.1016/j.anaerobe.2014.04.001
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


