Прикладная биохимия и микробиология, 2020, T. 56, № 3, стр. 250-256
Антимикробная активность липопептида – эмерициллипсина А, выделенного из Emericellopsis alkalina, в отношении биопленкообразующих бактерий
В. С. Садыкова 1, 2, *, И. А. Гаврюшина 1, 2, А. Е. Куварина 1, 2, Н. Н. Маркелова 3, 4, Н. Г. Седых 4, М. Л. Георгиева 1, 5, А. С. Барашкова 2, Е. А. Рогожин 1, 2, 6
1 Научно-исследовательский институт по изысканию новых антибиотиков им. Г.Ф. Гаузе
119021 Москва, Россия
2 Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН
117997 Москва, Россия
3 Российский научный центр рентгенорадиологии Минздрава России
117997 Москва, Россия
4 Центральный научно-исследовательский институт эпидемиологии Роспотребнадзора
111123 Москва, Россия
5 Московский государственный университет им. М.В. Ломоносова
119234 Москва, Россия
6 Тюменский государственный университет
625003 Тюмень, Россия
* E-mail: sadykova_09@mail.ru
Поступила в редакцию 12.11.2019
После доработки 20.12.2019
Принята к публикации 23.12.2019
Аннотация
Изучена антимикробная активность нового нерибосомального пептида эмерициллипсина А в отношении биопленкообразующих патогенных грамположительных и грамотрицательных клинических бактерий. Впервые показана для пептидов из группы пептаиболов способность к ингибированию патогенных бактерий, образующих биопленки. Наиболее выраженный эффект был продемонстрирован в отношении грамположительных форм, что определяет специфичность антибактериального действия данного пептида.
Во всем мире серьезную угрозу здоровью населения представляют инфекционные заболевания, микроорганизмы-возбудители которых способны к образованию биопленок, являющихся одновременно фактором патогенности и резистентности бактерий. Необходимо отметить, что такие бактерии составляют ~80% всех патогенных видов [1]. Инфекции, при которых образуются биопленки, с трудом поддаются лечению, поскольку обладают высокой устойчивостью ко многим антибиотикам и антимикробным препаратам, применяемым в клинической медицине, а также способностью преодолевать защитные механизмы макроорганизмов [1, 2]. Установлено, что резистентность возбудителей в составе биопленки возрастает во много раз по сравнению с планктонными микроорганизмами, поскольку за счет ее матрикса фактически создается так называемый защитный барьер, препятствующий эффективному контакту действующего вещества с клетками-мишенями [3]. В последнее время активно разрабатываются новые подходы к выявлению и изучению биопленок, меняется тактика антибиотикотерапии, а также ведется поиск новых антибиотиков, ингибиторов межклеточной сигнализации, ферментов и других методов разрушения уже сформировавшихся биопленок. В число наиболее опасных инфекционных биопленкообразующих бактерий – возбудителей инфекционных заболеваний включены грамположительные бактерии Staphylococcus aureus и Enterococcus spp. с множественной лекарственной устойчивостью. Среди грамотрицательных бактерий – возбудителей госпитальных инфекций наибольшую опасность представляют Acinetobacter baumannii и Klebsiella pneumoniae.
Эти патогенные микроорганизмы преимущественно обнаруживаются в больничной среде и демонстрируют режим выживания с множественной лекарственной устойчивостью, который усложняет антимикробную терапию с использованием конвенциальных антибиотиков [4, 5].
Антимикробные пептиды (АМП) в последнее десятилетие вызывают наибольший интерес и являются основными кандидатами в области поиска и разработки, альтернативных традиционным, лекарственных средств для борьбы с микроорганизмами – возбудителями инфекционных заболеваний, в том числе вызываемых штаммами бактерий, образующими биопленки. На сегодняшний день все зарегистрированные природные и синтетические АМП собраны в различных базах данных, например, в хранилище данных антимикробных пептидов (DRAMP), которое содержит более 4500 последовательностей [6]. АМП, выделенные из различных источников, активно изучаются, в том числе, как соединения, действующие на биопленки патогенных бактерий. В течение последнего десятилетия ряд АМП, выделенных из животных, показал антибиопленочную активность по отношению к патогенным видам бактерий, приводящую либо к ингибированию формирования, либо к разрушению уже образовавшейся биопленки. Одним из первых пептидов, обладающих антибиопленочной активностью, был кателицидин человека LL-37 [7]. Этот линейный пептид является одним из наиболее изученных, в субингибирующих концентрациях проявляющих антибиопленочную активность по отношению к планктонному виду Pseudomonas aeruginosa [8]. Примечательно, что данный пептид практически не обладает ингибирующей активностью в отношении планктонных бактерий, но проявляет специфическое антибиопленочное действие. Был проведен ряд исследований, показавших, что обработка стафилококков антимикробными тромбоцитарными пептидами способствует изменению их физико-химических свойств (гидрофилизация поверхности и повышение электрокинетического потенциала) и снижению биопленкообразования [9]. Так, врожденный защитный регуляторный пептид IDR-1018, выделенный из сыворотки крови крупного рогатого скота, показал широкий спектр действия в отношении грамположительных и грамотрицательных патогенов, образующих биопленки [10].
Следует отметить, что АМП природного происхождения, выделенные из грибов, являются одними из важнейших, активно изучаемых источников новых эффективных антибиотиков. Им свойственны широкий спектр действия в отношении условно-патогенных и патогенных бактерий, дрожжей и мицелиальных грибов, как правило, низкая токсичность, к ним не формируется резистентность. При этом они обладают способностью ингибировать рост микроорганизмов, во многих случаях посредством механизмов, отличных от большинства традиционных антибиотиков [6]. Однако до настоящего времени в литературе нет сведений о влиянии АМП грибного происхождения на бактерии, образующие биопленки. Выделение и описание нового алкалофильного таксона грибов Emericellopsis alkalina Bilanenko & Georgieva из засоленных почв [11] показало широкие перспективы для поиска новых пептидных антибиотиков. Проведенный скрининг различных изолятов данного вида на способность к синтезу антибиотических веществ, позволил выявить перспективный с биотехнологической точки зрения штамм ВКПМ F-1428, характеризующийся уникальным комплексом пептидов с антимикробной активностью в отношении грибов и бактерий. Приоритетным результатом проведенной работы стало выделение и структурно-функциональная характеристика нового, ранее не описанного, секретируемого антимикробного пептида – эмерициллипсина А, являющегося продуктом нерибосомального синтеза и относящегося к группе пептаиболов [2, 12]. Эмерициллипсин А обладает противогрибковой активностью in vitro в отношении клинических изолятов патогенных видов дрожжей и грибов – возбудителей аспергиллеза и кандидоза у больных туберкулезом и СПИД, при этом, согласно проведенным экспериментам, обладает относительно низкой цитотоксичностью по отношению к культуре соматических эукариотических клеток млекопитающих [13, 14].
Цель работы – оценка потенциальной антибактериальной активности эмерициллипсина А в отношении клинических биопленкообразующих бактерий – основных возбудителей госпитальных инфекций, в том числе влияние данного пептида на формирование и разрушение биопленок.
МЕТОДИКА
Культивирование штамма – продуцента. Штамм Emericellopsis alkalinа ВКПМ F-1428 (Hypocreales, Ascomycota) депонирован в ВКПМ, коллекции “Грибы экстремальных местообитаний” кафедры микологии и альгологии биологического факультета МГУ им. М.В. Ломоносова и коллекции продуцентов Научно-исследовательского института по изысканию новых антибиотиков имени Г.Ф. Гаузе, как продуцент комплекса антимикробных пептидов. Штамм E. alkalinа синтезирует комплекс липофильных соединений пептидной природы, преобладающим среди которых является липопептаибол эмерициллипсин А, обладающий антимикробным действием в отношении широкого спектра дрожжевых и мицелиальных грибов, а также грамположительных бактерий [15].
Культивирование штамма для накопления эмерициллипсина А осуществляли в стационарных условиях в течении 14 сут в колбах Эрленмейера на специализированной жидкой щелочной среде, подобранной ранее [2]. В качестве посевного материала использовали 5-суточную культуру гриба, выращенную на агаризованной щелочной среде [2]. Мицелий и споры отделяли от культуральной жидкости центрифугированием.
Выделение эмерициллипсина А. Эмерициллипсин А выделяли из культуральной жидкости по ранее разработанной схеме выделения, описанной в работах [2, 12]. Разделение активных фракций, выделение и очистку пептида проводили последовательно методами экстракции, прямо-фазной и гидрофобной хроматографии, как описано ранее. Для выделения индивидуального компонента использовали аналитическую обращено-фазовую ВЭЖХ. Обогащенный концентрат, полученный после растворения упаренного этилацетатного концентрата культуральной жидкости, наносили на колонку XBridge BEH 4.6 × 250 мм (“Waters”, Ирландия) с неподвижной фазой С18 и осуществляли фракционирование в градиенте повышения концентрации ацетонитрила в воде с добавлением 0.1% трифторуксусной кислоты: 16–28% – за 12 мин; 28–55% – за 27 мин; 55–75% – за 20 мин и 75–85% – за 10 мин, с последующим изократическим элюированием в течение 25 мин. Детектирование поглощения разделяемых веществ осуществляли при трех длинах волн (214, 247 и 280 нм). Эмерициллипсин А детектировали по поглощению при длине волны 214 нм и времени удержания согласно протоколу, описанному в работе [12].
Тест-микроорганизмы. Клинические изоляты бактерий Staphylococcus aureus (4 изолята), Enterococcus faecalis (4 изолята), E. faecium (1 изолят), Acinetobacter baumannii (2 изолята), Klebsiela pneumoniae (1 изолят), выделенные из клинического материала различных пациентов, были взяты из коллекции культур лаборатории инфекций, связанных с оказанием медицинской помощи, ЦНИИ эпидемиологии (Москва, Россия). Стафилококки характеризовались чувствительностью к аминогликозидам, фторхинолонам, гликопептидам и β-лактамам, за исключением пенициллинов; энтерококки – к ампициллину, ванкомицину, линезолиду, нитрофурантоину (за исключением резистентности E. faecium к ампициллину); K. pneumoniae – к цефалоспоринам, карбапенемам, аминогликозидам, фторхинолонам. Изоляты A. baumannii с множественной лекарственной устойчивостью сохраняли чувствительность только к колистину. Тест-культуры клинических изолятов Bacillus cereus, Escherichia coli, Pseudomonas aeruginosa, Listeria monocytogenes и Candida albicans, выделенные из биологических жидкостей особей крупного рогатого скота, были взяты из коллекции кафедры микробиологии и заразных болезней Оренбургского государственного аграрного университета.
Формирование in vitro биопленок. Тестируемые бактерии выращивали на плотной питательной среде 18 ч при температуре 37°С. Из выросших культур готовили бактериальную суспензию плотностью 0.5 мкФ в бульоне Мюллер-Хинтона, которую затем разбавляли до концентрации 105 КОЕ/мл. Приготовленный инокулят тестируемых бактерий добавляли по 150 мкл в лунки 96-луночного планшета, в которые помещали стерильные тефлоновые кубики размером 4 × 4 мм для формирования на их поверхности биопленок. Инкубировали в течение 20 ч на орбитальном шейкере при скорости вращения 110 об./мин и температуре 35°С [15, 16].
Антимикробная активность, ассоциированная с разрушением сформированных биопленок (антибиопленочная активность). Кубики, содержащие биопленки, переносили в лунки 96-луночного микротитровального планшета с 200 мкл серийных двукратных разведений АМП и инкубировали в течение 18 ч при 37°С. Для определения минимальной биоцидной концентрации пептида (МБК) в отношении дисперсных клеток биопленки оценивали самую низкую его концентрацию, которая обеспечивала выживаемость субкультуры <0.1%. С этой целью отбирали аликвоты по 10 мкл из лунок без видимого роста, проводили посев на плотные питательные среды и инкубировали в течение 20 ч при 37°C. Тефлоновые кубики промывали для удаления неприкрепленных бактериальных клеток, а затем механически разрушали биопленки на поверхности кубиков. Для определения минимальной биоцидной концентрации АМП, уничтожающей биопленку (МБКб), разрушенные биопленки рекультивировали в бульоне Мюллера-Хинтона и определяли возобновление роста бактерий [16].
Антимикробная активность in vitro, ассоциированная с подавлением формирования биопленок. Изоляты бактерий инкубировали при 37°C, 24 ч в присутствии различных концентраций эмерициллипсина A в 96-луночных планшетах, в лунки которого помещали тефлоновые кубики. Каждая лунка планшета с кубиком содержала 200 мкл инокулята плотностью 105 КОЕ/мл. После инкубации отработанную среду аспирировали, а кубики промывали раствором для удаления неприкрепленных бактерий и высушивали на воздухе. Образование связанной с поверхностью кубиков биопленки анализировали путем их окрашивания 0.1% водным раствором кристаллического фиолетового в течение 5 мин и дальнейшим экстрагированием кристаллического фиолетового этанолом. Затем измеряли оптическую плотность полученных растворов при 595 нм (ОП595). При обработке результатов оптическая плотность, полученная в результате окрашивания кубиков без биопленки, не учитывалась [16, 17].
Статистический анализ. Результаты анализа ингибирования образования биопленки представлены в виде средних значений ± стандартные отклонения. Для сравнения различий между контрольными и обработанными антимикробными биопленками использовался однофакторный дисперсионный анализ с помощью множественного сравнительного теста Бонферрони. Значение p < < 0.005 считалось статистически значимым [18].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Антибактериальная активность эмерициллипсина А. Как было отмечено ранее [12] эмерициллипсин А представляет собой пептидный антибиотик, обладающий разнонаправленным спектром антимикробного действия. Фунгицидная активность выражается в неспецифическом действии на эукариотические патогенные дрожжевые и мицелиальные виды грибов, обладающие высоким уровнем резистентности к традиционным противогрибковым препаратам группы азолов и макроциклов с клеточной мембраной. Антибактериальный эффект антибиотика менее выражен, чем антифунгальный, и имеет явно выраженную специфичность. Стоит отметить, что ингибирующее действие данного вещества направлено преимущественно на грамположительные бактерии: так, активность по отношению к S. aureus и B. cereus (4 и 16 мкг/мл соответственно) сопоставима с эффектом, достигаемым при применении ванкомицина (3 и 12 мкг/мл, соответственно) [12], тогда как клинические изоляты E. fecalis подавлялись на уровне МБК лишь при 40 мкг/мл. Характерно, что антимикробная активность эмерициллипсина А против грамотрицательных форм была гораздо менее выражена и МБК превышала 300 мкг/мл. По отношению к таким бактериям характер действия изучаемого пептидного токсина можно классифицировать как бактериостатический, не ассоциированный непосредственно с взаимодействием с клеточной оболочкой.
Влияние эмерициллипсина А на разрушение биопленок, сформированных бактериями. С целью исследования возможного механизма антибактериального действия эмерициллипсина А была проверена его активность в отношении планктонных и прикрепленных клеток у культур грамположительных и грамотрицательных микроорганизмов и образованных ими биопленок (табл. 1).
Таблица 1.
Значение МБК (для планктонных (МБКп) и прикрепленных (МБКпр) клеток) и МБКб эмерициллипсина A в отношении клинических изолятов бактерий
| Изоляты бактерий | МБКп | МКБпр | МБКб |
|---|---|---|---|
| мкг/мл | |||
| S. aureus 1 | 12.5 | 25 | 100.0 |
| S. aureus 2 | 12.5 | 25 | 50.0 |
| S. aureus 3 | 25.0 | 100 | 100.0 |
| S. aureus 4 | 12.5 | 25 | 100.0 |
| E. faecium 5 | 25.0 | 100 | 200.0 |
| E. faecalis 6 | 50.0 | 100 | 200.0 |
| E. faecalis 7 | 50.0 | 100 | 200.0 |
| E. faecalis 8 | 25.0 | 100 | 200.0 |
| E. faecalis 9 | 25.0 | 100 | 200.0 |
| A. baumannii 10 | 50.0 | >200 | >200.0 |
| A. baumannii 11 | 25.0 | 200 | >200.0 |
| K. pneumoniae 12 | 25.0 | 200 | >200.0 |
Планктонные клетки тестируемых клинических бактерий показали различную чувствительность к пептиду, значения составили МБК от 12.5 до 50.0 мкг/мл, что в отдельных случаях не превышало концентрации клинически эффективных антибиотиков, за пределами которых определяется устойчивость бактерий, и рекомендованных EUCAST (European Committee on Antimicrobial Susceptibility Testing): амикацина (R > 16 мкг/мл), фосфомицина (R > 32 мкг/мл) в отношении стафилококков; нитрофурантоина (R > 64 мкг/мл) в отношении E. faecalis.
Антибиопленочная активность пептида находилась в диапазоне от 50 до 200 мкг/мл для грамположительных бактерий (S. aureus, E. faecium, E. faecalis) и превышала 200 мкг/мл – для грамотрицательных (A. baumannii, K. pneumoniae), что свидетельствовало о слабом действии эмерициллипсина A на предварительно сформированные биопленки клинических грамотрицательных бактерий. Наблюдаемое повышение устойчивости бактериальных биопленок к эмерициллипсину A, по сравнению с планктонными культурами, согласуется со многими данными по резистентности биопленок к любым антимикробным агентам [15, 16]. Исследуемый антибиотик не обладал способностью к активному взаимодействию с экзополисахаридным матриксом, составляющим основу бактериальных биопленок, что, по-видимому, определяется, в первую очередь, отсутствием функциональных групп на его поверхности.
Влияние эмерициллипсина А на формирование биопленок клиническими изолятами бактерий. Установлено, что эмерициллипсин A ингибировал образование биопленок клиническими изолятами S. aureus (рис. 1). Максимальный эффект наблюдался при концентрациях пептида, соответствующих 1/2 МБК и составил от 73.2 до 97.8%, в зависимости от изолята. При концентрации 1.5 мкг/мл образование биопленки достоверно уменьшилось на 53.0, 56.0, 53.1% соответственно S. aureus 1, 2, 3. В отношении E. faecalis 6, 7, 8, 9 ингибирующий эффект наблюдался при 1/2 МБК и составил 87.6, 94.8, 69.3, 98.2% соответственно (рис. 2). Концентрации пептида в 8 раз ниже МБК способствовали уменьшению образования биопленки E. faecalis 6, 7, 8, 9 на 56.8, 68.0, 30.0, 51.4% соответственно. Для клинического изолята E. faecium и грамотрицательных бактерий A. baumannii 11, K. pneumoniae 12 достоверное ингибирование образования биопленок наблюдалось только при 1/2 МБК и составило 39.0, 53.2, 57.1% соответственно.
Рис. 1.
Анализ образования биопленки (ОП595) штаммами S. aureus при различных концентрациях эмерициллипсина А (мкг/мл): а – S. aureus 1; б – S. aureus 2; в – S. aureus 3; г – S. aureus 4. ** Концентрации пептида, при которых наблюдались статистически значимые различия между контрольными биопленками и биопленками, образующимися в присутствии пептида (p < 0.005).

Рис. 2.
Анализ образования биопленки (ОП595) штаммами E. faecalis при различных концентрациях эмерициллипсина А (мкг/мл): а – E. faecalis 6; б – E. faecalis 7; в – E. faecalis 8; г – E. faecalis 9. ** Концентрации пептида, при которых наблюдались статистически значимые различия между контрольными биопленками и биопленками, образующимися в присутствии пептида (p < 0.005).
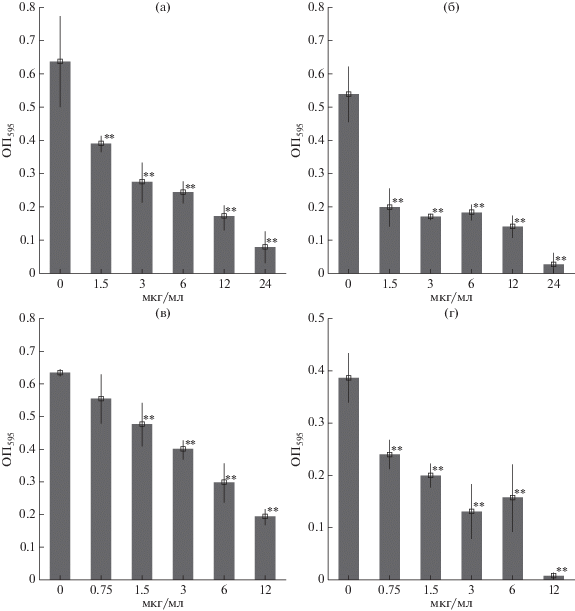
Таким образом, субингибирующие концентрации эмерициллипсина А предотвращали образование бактериальных биопленок in vitro в отношении грамположительных бактерий наиболее эффективно, чем в отношении грамотрицательных, при этом наблюдалось достоверное различие как между клиническими изолятами одного вида бактерий, так и между изолятами различной видовой принадлежности.
В работе впервые показано влияние антимикробных метаболитов грибов из группы пептаиболов на способность к ингибированию патогенных форм бактерий через воздействие на образование биопленок, что является одним из ключевых факторов антибиотикорезистентности. При этом, как было отмечено ранее, наиболее выраженный эффект был продемонстрирован в отношении грамположительных форм, что определяет специфичность антибактериального действия данного пептида. Полученные результаты расширяют понимание механизмов антимикробной активности секретируемых мицелиальными грибами метаболитов и их селективное воздействие на сопутствующую микробиоту при конкурентных взаимоотношениях в сообществах.
Авторы выражают благодарность сотрудникам кафедры микробиологии и заразных болезней Оренбургского государственного аграрного университета и лично Сычевой М.В. за помощь в исследовании антимикробных свойств эмерициллипсина А.
Работа по выделению и накоплению эмерициллипсина А для биологических испытаний выполнена при финансовой поддержке Российского научного фонда (грант № 18-74-10073), работа по культивированию продуцента при финансовой поддержке РФФИ в рамках научного проекта № 19-34-90088.
Список литературы
Yazici A., Ortucu S., Taskin M., Marinelli L. // Current Topics in Medicinal Chemistry. 2018. V. 18. № 24. P. 1–6.
Do T., Devine D., Marsh P.D. // Clin. Cosmet. Investig. Dent. 2013. V. 5. № 6 P. 11–19.
Baranova A.A., Georgieva M.L., Bilanenko E.N., Andreev Y.A., Rogozhin E.A., Sadykova V.S. // Appl. Biochem. Microbiol. 2017. V. 53. № 6. P. 703–710.
Athina A., Molchanova N., Jenssen H. // Biomolecules. 2018. V. 8. № 2. № 27. P. 1–29.
Costerton W., Veeh R., Shirtliff M., Pasmore M., Post C., Ehrlich G. // J. Clin. Investig. 2003. V. 112. № 10. P. 1466–1477.
Fan L., Sun J., Zhou M., Zhou J., Lao X., Zheng H., Xu H. // Sci. Rep. 2016. V. 6. № 24482.
Jacobsen A.S., Jenssen H. // Future Med. Chem. 2012. № 4. P. 1587–1599.
Overhage J., Campisano A., Bains M., Torfs E.C.W., Rehm B.H.A., Hancock R.E.W. // Infect. Immun. 2008. V. 76. № 9. P. 4176–4182.
Журлов О.С. // Успехи современного естествознания. 2015. № 9 Т. 1. С. 107–109.
Mansour S.C., de la Fuente-Núñez C., Hancock R.E.W. // J. Pept. Sci. 2015. V. 21. P. 323–329.
Grum-Grzhimaylo A.A., Georgieva M.L., Debets A.J.M., Bilanenko E.N. // IMA Fungus. 2013. V. 4. № 2. P. 213–228.
Rogozhin E.A., Sadykova V.S., Baranova A.A., Vasilchenko A.S., Lushpa V.A., Mineev K.S., Georgieva M.L., Kul’ko A.B., Krasheninnikov M.E., Lyundup A.V., Vasilchenko A.V., Andreev Y.A. // Molecules. 2018. V. 23. № 11. № 2785.
Rogozhin E., Sadykova V.A. // Proceedlings. 2019. V. 22. E. 4. P. 1–12.
Baranova A.A., Rogozhin E.A., Georgieva M.L., Bilanenko E.N., Kul’ko A.B., Yakushev A.V., Alferova V.A., Sadykova V.S. // Applied Biochemistry and Microbiology. 2019. V. 55. № 2. P. 145–151.
Садыкова В.С., Рогожин Е.А., Баранова А.А., Георгиева М.Л., Биланенко Е.Н., Васильченко А.С. Патент РФ № 2704421, 2019.
Plakunov V.K., Martyanov S.V., Teteneva N.A., Zhurina M.V. // Microbiology. 2016. V. 85. № 4. P. 509–513.
MBEC™ Assay For High-Throughput Antimicrobial Susceptibility Testing of Biofilms Procedural manual. Version 1.1 For High-Throughput Antimicrobial Susceptibility Testing of Biofilms. Date of Issue: 17 November 2015. ©Innovotech, Inc.
O’Toole G.A. // J. Visualized Experiments. 2011. V. 47. P. e2437. https://doi.org/10.3791/2437
Трухачева Н.В. Математическая статистика в медико-биологических исследованиях с применением пакета Statistica. ГЭОТАР-Медиа, 2012. 384 с.
Pfalzgraff A., Brandenburg K., Weindl G. // Front Pharmacol. 2018. V. 28. № 9. P. 281. https://doi.org/10.3389/fphar.2018.00281
Khan F., Nguyen P.D.T., Oloketuyi S.F., Kim Y.M. // Curr. Pharm. Biotechnol. 2019. V. 30 P. 345–360. https://doi.org/10.2174/1389201020666191112155905
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


