Прикладная биохимия и микробиология, 2020, T. 56, № 3, стр. 292-300
Ароматические карбоновые кислоты корневых экссудатов ячменя и их влияние на рост Fusarium culmorum и Pseudomonas fluorescens
А. И. Шапошников 1, В. Ю. Шахназарова 1, 2, Н. А. Вишневская 1, Е. В. Бородина 1, О. К. Струнникова 1, *
1 Всероссийский научно-исследовательский институт сельскохозяйственной микробиологии
196608 г. Санкт-Петербург, Россия
2 Санкт-Петербургский Государственный Университет
199034 г. Санкт-Петербург, Россия
* E-mail: olgastrunnikova@rambler.ru
Поступила в редакцию 10.07.2019
После доработки 17.12.2019
Принята к публикации 23.12.2019
Аннотация
В корневых экссудатах стерильного ячменя, колонизированного фитопатогенным грибом Fusarium culmorum и антагонистической бактерией Pseudomonas fluorescens, методом ультраэффективной жидкостной хроматографии установлено наличие семи ароматических карбоновых кислот, известных как антимикробные вещества. В ответ на колонизацию P. fluorescens ячмень в экссудатах продуцировал меньшее количество антимикробных компонентов, чем при колонизации F. culmorum. Все продуцируемые ароматические карбоновые кислоты подавляли рост F. culmorum, но только две из них в самой высокой концентрации ингибировали рост P. fluorescens. Полученные данные свидетельствовали о способности растения, посредством корневых экссудатов создавать в ризосфере благоприятные условия для развития полезных бактерий и неблагоприятные для роста фитопатогенного гриба. Это открывает перспективы возможного отбора сортов зерновых культур, содержащих определенный состав антимикробных компонентов в корневых экссудатах.
Факультативный фитопатогенный гриб Fusarium culmorum (W. G. Sm.) Sacc. поражает широкий набор сельскохозяйственных культур и особенно вредоносен для зерновых, приводя к недобору урожая и загрязнению зерна микотоксинами [1, 2]. Влияние хозяйского растения на колонизирующую способность F. culmorum и его развитие в ризосфере изучено очень слабо. Между тем известно, что растения, помимо источников питания, формирующих прикорневое микробное сообщество, выделяют в ризосферу вещества, обладающие антимикробными свойствами [3]. Так, экссудация антимикробных веществ корнями Arabidopsis thaliana обеспечивала устойчивость растений к нескольким не хозяйским бактериальным патогенам. Однако хозяйский штамм Pseudomonas syringae, патогенный для A. thaliana, был устойчив к антимикробным компонентам экссудатов [4]. Кофейная кислота экссудатов томата подавляла рост патогенной бактерии Ralstonia solanacearum [5]. Антимикробное вещество скополетин, входящее в состав корневых экссудатов A. thaliana, ингибировало рост фитопатогенных грибов F. oxysporum и Verticillium dahliae, обитающих в почве, в то время как ризобактерия P. simiae WCS417 была устойчива к нему [6]. Содержащиеся в корневых экссудатах ячменя ароматические карбоновые кислоты (пара-кумаровая, ванилиновая, 4-гидроксифенилуксусная, феруловая, транс-коричная, бензойная и сиреневая) ингибировали рост фитопатогенного гриба F. graminearum [7]. В настоящее время присутствие антимикробных компонентов в корневых экссудатах рассматривают как одну из стратегий защиты против фитопатогенных микроорганизмов, созданную растением. Было установлено, что антимикробные компоненты экссудатов, выделяемые растением в ризосферу, способны оказывать не только прямое воздействие на фитопатогены, подавляя их рост, но и опосредованное через влияние на прикорневое микробное сообщество, изменение в составе которого становится благоприятным для развития полезных для растений микроорганизмов [5, 6, 8].
В данной работе было оценено влияние ароматических карбоновых кислот на рост патогена ячменя F. culmorum и антагонистической бактерии P. fluorescens. В предыдущей работе [9] было показано, что бактерия подавляла рост гриба в почве. При этом оказалось, что на корнях ячменя плотность грибного мицелия в присутствии бактерии была снижена не во всех случаях, но, несмотря на это, внесение P. fluorescens 2137 совместно с F. culmorum в почву или в вермикулит всегда приводило к снижению интенсивности корневой гнили ячменя [10–12]. Выяснение характера ответной реакции растения на колонизацию фитопатогенным грибом и его антагонистом позволит получить новые данные о роли самого растения в защите от инфицирования фитопатогенным грибом и в регуляции взаимоотношений в ризосфере и ризоплане ячменя.
Цель работы – определение количественного состава ароматических карбоновых кислот (антимикробных веществ) в корневых экссудатах ячменя в ответ на его колонизацию F. culmorum и P. fluorescens, и оценка воздействия антимикробных веществ на рост этих микроорганизмов.
МЕТОДИКА
Объекты исследования. В работе был использован восприимчивый к фузариозной корневой гнили ячмень Hordeum vulgare L. сорта Белогорский из коллекции Всероссийского института растениеводства им. Н.И. Вавилова.
F. culmorum штамм 30 был выделен из пораженных корней ячменя. Изолят был идентифицирован по морфологическим признакам [13]. Использование видо-специфичных праймеров OPT18 F/R подтвердило принадлежность изолята к виду F. culmorum [14]. Гриб выращивали на агаризованной среде Чапека в течение 14 сут. Макроконидии смывали стерильной водой, осаждали центрифугированием (2000 g, 10 мин) и доводили до нужной концентрации после учета количества конидий в камере Горяева.
P. fluorescens 2137 был выделен из почвы и идентифицирован методом BIOLOG [15]. Видовая идентификация штамма была подтверждена методом секвенирования гена 16S рибосомальной РНК с помощью автоматического секвенатора CEQТМ-8000 (“Beckman”, США) по стандартным методикам, применяемым в ФГБНУ ВНИИСХМ. Штамм P. fluorescens 2137 выращивали в течение сут на МПА. Клетки суспендировали в стерильной дистиллированной воде и осаждали центрифугированием (8000 g, 10 мин). Концентрацию бактериальных клеток определяли по оптической плотности при 600 нм (ОD600) на спектрофотометре Ultrospec II (“LKB biochrom”, Швеция). Окончательное количество жизнеспособных клеток было определено посевом бактериальной суспензии на МПА.
Получение корневых экссудатов ячменя. Эксперимент проводили в стерильном вермикулите в герметичных стеклянных сосудах емкостью 0.5 л, содержащих по 24 г сухого вермикулита, в который в одном случае внесили суспензию макроконидий гриба (2 × 105), в другом – суспензию клеток бактерии (1.5 × 107), а в третьем – совместно клетки гриба и бактерии в тех же концентрациях. В контрольных сосудах в вермикулит внесили только воду. Общее количество воды, включая суспензии микроорганизмов, составило 250 мл на каждые 100 г сухого вермикулита. Повторность сосудов шестикратная, при совместном внесении в вермикулит гриба и бактерии количество сосудов удваивали. Семена ячменя стерилизовали в 96%-ном этиловом спирте в течение 30 сек, трижды промыли стерильной водой, а затем инкубировали в 1%-ном растворе AgNO3 в течение 30 мин. После удаления азотнокислого серебра семена промывали 1%-ным раствором NaCl один раз и пять раз стерильной водой, а затем переносили в стерильные чашки Петри на влажную фильтровальную бумагу и выдерживали в течение 30 ч. Проклюнувшиеся семена ячменя переносили в подготовленные сосуды с вермикулитом в количестве 10 штук/сосуд. Ячмень выращивали в течение 36 ч, затем растения аккуратно извлекали, излишки вермикулита удаляли, а корни промывали стерильной водой. Далее растения переносили в заранее подготовленные герметичные сосуды со стерильной деионизированной водой, которая должна была покрывать только корни ячменя, и выдерживали 4 сут при естественном освещении. По истечении указанных сроков раствор корневых экссудатов центрифугировали при 15 000 g в течение 15 мин. Супернатант хранили в морозильной камере при –20°С до определения состава корневых экссудатов. Корни растений оценивали на наличие симптомов гнили и определяли их сырую массу. Количество гриба и бактерии в корнях, а также в культуральных жидкостях после их роста в деионизированной воде, определяли посевом на среду Чапека и МПА соответственно.
Определение количественного состава ароматических карбоновых кислот в экссудатах ячменя. Растворы корневых экссудатов фильтровали под вакуумом через нейлоновые фильтры Magna nylon с порами 0.45 мкм (“GE Water & Process Technologies BVBA”, Бельгия) и концентрировали досуха на роторном вакуумном испарителе Heidolph Hei-VAP Precision (“Heidolph Instruments GMBH & CO KG”, Германия) при 45°С. Остаток растворяли в 0.5 мл деионизированной воды (качества Milli-Q) и хранили при –20°С. Перед хроматографическим анализом растворы фильтровали центрифугированием в микропробирках с мембранными нейлоновыми фильтрами с порами 0.2 мкм Costar® Spin-X® (“Sigma-Aldrich Int. GMBH”).
Ароматические карбоновые кислоты (АКК) в корневых экссудатах ячменя определяли ультраэффективной жидкостной хроматографией (УЭЖХ) в системе Waters ACQUITY UPLC H-class (“Waters”, США). Для анализа использовали обращенно-фазовую колонку Waters Symmetry C18 (3.5 мкм, 4.6 × 75 мм) (“Waters”, США). В качестве подвижной фазы использовали смесь деионизированной воды (качества Milli-Q) и ацетонитрила (LiChrosolv, HPLC grade), в которую добавляли муравьиную кислоту до концентрации 0.1%. Хроматографическое разделение осуществляли в смеси, содержавшей 95% воды в течение 1.38 мин, после чего использовали линейный градиент содержания воды от 95 до 40% в течение 8.62 мин, а затем проводили промывку колонки смесью, содержавшей 95% ацетонитрила в течение 2 мин. Колонку уравновешивали смесью, содержавшую 95% воды, в течение 3.5 мин. Скорость потока – 1.36 мл/мин при температуре колонки 25°С. Обнаружение ароматических карбоновых кислот осуществляли с использованием диодноматричного ультрафиолетового детектора Waters eλPDA при 276 нм.
Ароматические карбоновые кислоты идентифицировали и определяли их концентрации по времени выхода пиков стандартной смеси АКК с известной концентрацией, и пиков проб корневых экссудатов, а также по совпадению их УФ-спектров (в диапазоне 210–400 нм). Запись УФ-спектров проводили на детекторе Waters eλPDA в процессе хроматографического разделения. В качестве стандартов служили растворы (0.01 мг/мл в метаноле) каждого из соответствующих химически чистых соединений (“Sigma-Aldrich Int. GMBH”, США). Обработку полученных хроматограмм и спектральных данных осуществляли с помощью программного пакета Empowerтм 3 (“Waters”, США).
Ароматические карбоновые кислоты в метаболитах микроорганизмов определяли с помощью системы УЭЖХ аналогично методике анализа образцов корневых экссудатов. Для анализа использовали культуральные жидкости гриба и бактерии после их роста в деионизированной воде в течение 1 и 4 сут.
Для оценки влияния ароматических карбоновых кислот на рост гриба и бактерии, а также для проверки способности микроорганизмов к их утилизации использовали соответствующие химически чистые АКК (“Sigma-Aldrich Int. GMBH”, США).
Способность гриба и бактерии утилизировать ароматические карбоновые кислоты была проверена при росте микроорганизмов в питательной среде (г/л: глюкоза – 1, KH2PO4 – 0.4, K2HPO4 – 0.1, MgSO4 ∙ 7H2O – 0.1, NH4NO3 – 0.2), содержавшей АКК в подобранных концентрациях (таблица). Готовили 500-кратный раствор каждой кислоты и общей смеси кислот в метаноле и вносили 200 мкл в 100 мл питательной среды. Растворы инокулировали макроконидиями гриба до конечной концентрации 1.5 × 104 и клетками бактерии до оптической плотности 0.04, после чего инкубировали в течение 3 сут. Остаточное количество каждой АКК определяли в культуральной жидкости гриба и бактерии с помощью системы УЭЖХ.
Для оценки влияния ароматических карбоновых кислот на рост гриба и бактерии использовали растворенные в метаноле АКК и их смесь в исходных концентрациях (табл. 1), а также в превышающих ее в 10 и 100 раз. Для оценки влияния АКК на рост бактерии каждое из антимикробных веществ, растворенное в метаноле, и их смесь вносили в количестве 10 мкл на 5 мл среды в питательный раствор следующего состава (г/л): глюкоза –1, KH2PO4 – 0.4, K2HPO4 – 0.1, MgSO4 ∙ 7H2O – 0.1, NH4NO3 – 0.2. Растворы инокулировали смытыми с МПА клетками бактерии до начальной оптической плотности 0.04 и инкубировали в течение 2 сут. Рост бактериального штамма оценивали по оптической плотности культуры при 600 нм (ОD600).
Таблица 1.
Утилизация ароматических карбоновых кислот F. culmorum и P. fluorescens
| Ароматическая карбоновая кислот | Исходное количество, нг/мл | Количество оставшейся кислоты после 3-суточной инкубации, нг/мл | |
|---|---|---|---|
| F. culmorum | P. fluorescens | ||
| Транс-коричная | 20 | 5.02 ± 0.45 | 10.73 ± 1,15 |
| Бензойная | 250 | 130.73 ± 11.23 | 70.28 ± 6.55 |
| Феруловая | 50 | 0.10 ± 0.01 | 0.13 ± 0,02 |
| Пара-кумаровая | 50 | 0.05 ± 0.01 | 1.03 ± 0.09 |
| Сиреневая | 20 | 9.81 ± 0.85 | 5.16 ± 0.51 |
| Ванилиновая | 20 | 0 | 0.52 ± 0.05 |
| 4-Гидроксифенилуксусная | 500 | 742.14 ± 70.28 | 214.15 ± 22.31 |
Для оценки влияния ароматических карбоновых кислот на рост гриба по 200 мкл растворов приготовленных кислот в трех, указанных выше, концентрациях вносили в 100 мл теплой агаризованной среды Чапека. После застывания среды в центр чашки помещали мицелием вниз блок диаметром 10 мм, вырезанный из 12-сут колонии F. сulmorum. Измерение радиуса растущих колоний проводили на 2-е и 4-е сут.
Статистическая обработка полученных результатов проведена с помощью программы Microsoft Office Excel 2007. Эксперименты проводили в 3–6 биологических и аналитических повторностях. В качестве доверительного интервала приведены значения стандартной ошибки среднего при уровне значимости 0.05. За значимые принимали различия при значении p < 0.05 (на рисунках отмечены звездочкой).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Сравнительный анализ стерильных и колонизированных микроорганизмами корней не выявил симптомов гнили на тех, которые были заселены фитопатогенным грибом (данные не приведены).
В 4-суточных экссудатах ячменя было идентифицировано семь ароматических карбоновых кислот (рис. 1). Наибольшее их количество содержалось в экссудатах стерильных (контрольных) растений ячменя и колонизированных фитопатогенным грибом. Среди них доминировала 4-гидроксифенилуксусная кислота (4-ГФУ). В экссудатах ячменя, колонизированных бактерией, отсутствовала сиреневая кислота, а количество 4-ГФУ было незначительным (рис. 1).
Рис. 1.
Количественный состав АКК: транс-коричной (1), бензойной (2), феруловой (3), пара-кумаровой (4), сиреневой (5), ванилиновой (6) и 4-гидроксифенилуксусной (7), в 4-суточных экссудатах стерильного ячменя (I), колонизированного F. culmorum (II), P. fluorescens (III) и совместно F. сulmorum и P. fluorescens (IV).

Колонизация ячменя фитопатогенным грибом F. culmorum не привела к увеличению количества антимикробных компонентов в экссудатах по сравнению со стерильным ячменем. Эти данные не совпадали с данными других исследователей, которые установили увеличение по сравнению со стерильным ячменем количества антимикробных компонентов в экссудатах в ответ на колонизацию ячменя F. graminearum [7]. В цитируемой работе максимальное количество антимикробных веществ в экссудатах было отмечено на 7 сут после инфицирования ячменя F. graminearum и к этому же времени наблюдалось появление некрозов на корнях [7]. Следует отметить, что в нашем эксперименте не наблюдалось явных признаков гнили на корнях. Можно предположить, что отсутствие ответной реакции ячменя на колонизацию F. culmorum было связано с тем, что в заданных условиях гриб не проявлял фитопатогенную активность. Однако, количество антимикробных компонентов в экссудатах ячменя в ответ на колонизацию фитопатогенным грибом F. culmorum было выше, чем при колонизации антагонистической ризобактерией P. fluorescens 2137 (рис. 1).
Учитывая, что в растворе экссудатов ячменя, колонизированных F. culmorum и P. fluorescens, могут содержаться и метаболиты этих микроорганизмов, было оценено присутствие АКК в метаболитах гриба и бактерии после их 1 и 4 сут роста в деионизированной воде (рис. 2). Проведенный анализ показал, что количество АКК в метаболитах микроорганизмов оказалось существенно ниже, чем в растворах экссудатов ячменя (рис. 1).
Рис. 2.
Количество АКК: транс-коричной (1), бензойной (2), феруловой (3), пара-кумаровой (4), сиреневой (5), в культуральной жидкости F. culmorum (I), P. fluorescens (II) при их раздельном и совместном (III) выращивании в деионизированной воде в течение 1 (а) и 4 сут (б).
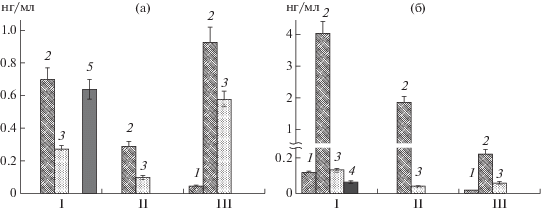
Незначительное количество АКК, обнаруженное в метаболитах гриба и бактерии (рис. 2), не могло сильно повлиять на общее их количество в экссудатах, тем более что в метаболитах доминировала бензойная кислота, а в растворе экссудатов – 4-ГФУ. Полученные данные подтверждали предположение о том, что значительная часть антимикробных веществ продуцировалась растением, тем более что самое большое количество АКК было обнаружено в корневых экссудатах стерильных растений ячменя, не колонизированных микроорганизмами (рис. 1).
В метаболитах микроорганизмов АКК появились уже на 1 сут (рис. 2а). При этом в метаболитах гриба их количество оказалось выше, чем в метаболитах бактерии (рис. 2а, 2б). К 4 сут в метаболитах гриба и бактерии, растущих раздельно, существенно увеличивалось количество бензойной кислоты, в то время как при их совместном росте общее количество АКК в метаболитах значительно снижалось по сравнению с 1 сут и прежде всего за счет бензойной и феруловой кислот. Снижение количества АКК на 4 сут в метаболитах гриба и бактерий при их совместной инкубации не могло быть связано с отсутствием роста этих микроорганизмов. Как показал проведенный анализ, количество гриба на 4 сут при совместной инкубации с бактерией оказалось даже выше, чем при культивировании гриба без бактерии (рис. 3а). Количество же бактерии при совместном росте с грибом не было ниже, чем при инкубации только бактериального штамма (рис. 3б). Снижение количества ароматических карбоновых кислот в метаболитах при совместном выращивании гриба и бактерии в воде могло быть следствием использования этих веществ микроорганизмами в качестве источника питания. Результаты определения содержания ароматических карбоновых кислот в метаболитах F. culmorum и P. fluorescens после инкубации в течение 3 сут и их исходное количество приведены в таблице. Определение остаточных количеств АКК после выращивания в их растворах гриба и бактерии свидетельствовало, что эти микроорганизмы способны утилизировать значительную часть ароматических карбоновых кислот (табл. 1).
Рис. 3.
Количество (КОЕ) F. culmorum (а) и P. fluorescens (б) при их раздельном (1) и совместном (2) росте в деионизированной воде в течение 4 сут.

Способность бактерий рода Pseudomonas деградировать ароматические соединения хорошо известна [16–19], именно на этом основано использование псевдомонад в технологиях биоремедиации. Согласно полученным данным и фитопатогенный гриб F. culmorum в условиях голодания также способен использовать АКК как источник углерода для своего роста. Только 4-ГФУ не утилизировалась грибом, а ее количество в культуральной жидкости даже увеличивалось. Такое увеличение количества 4-ГФУ при утилизации грибом антимикробных веществ (табл. 1) связано, вероятнее всего, с присутствием этой кислоты в метаболитах гриба (рис. 2а). Наличие АКК в культуральной жидкости было оценено после роста гриба в воде, в то время как эксперимент по утилизации проводился в среде, содержавшей необходимые для роста гриба элементы питания, что привело к увеличению плотности гриба и, соответственно, количества выделяемых им метаболитов.
Ароматические карбоновые кислоты, внесенные в питательный раствор, в той или иной степени и в разных концентрациях, оказывали влияние на рост гриба и бактерии (рис. 4). Количество используемых в данных экспериментах АКК было подобрано на основании данных по 4-суточной экссудации растений в деионизированную воду, и результатов, полученных ранее при анализе корневых экссудатов ячменя [7]. Радиальный рост гриба на среде Чапека на 4 сут подавлялся всеми исследуемыми антимикробными веществами. Наименьшее воздействие оказывали бензойная кислота, 4-ГФУ и смесь кислот, которые подавляли рост гриба только в повышенных концентрациях (рис. 4а).
Рис. 4.
Влияние метанола (2) и АКК транс-коричной (3), бензойной (4), феруловой (5), пара-кумаровой (6), сиреневой (7), ванилиновой (8), 4-гидроксифенилуксусной (9) и смеси кислот (10), на рост гриба F. culmorum на среде Чапека (1): а – радиус 4-суточных колоний, мм; б – ОП600 2-суточной суспензии P. fluorescens (1) при выращивании в жидкой питательной среде с АКК при концентрациях: I – исходная (табл. 1), II – в 10 и III – в 100 раз превышающих исходную (существенные отличия от контроля отмечены звездочкой).
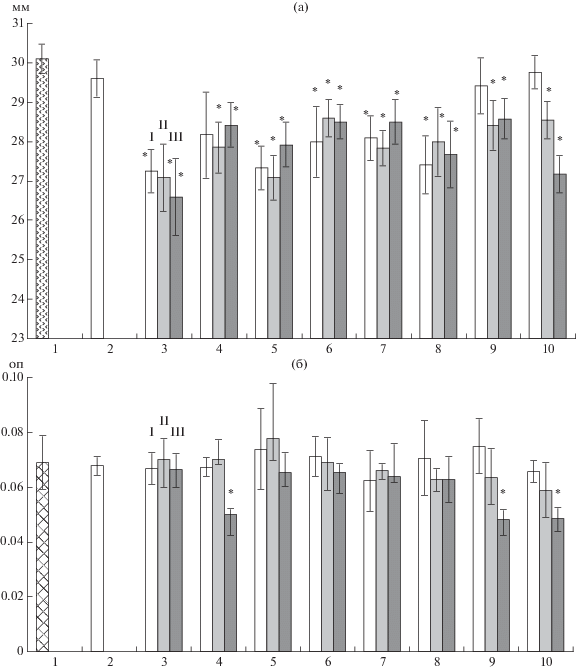
На рост бактерии ароматические карбоновые кислоты оказали меньшее ингибирующее воздействие, чем на гриб (рис. 4б). Ко 2 сут рост бактериального штамма был подавлен в среде с добавлением повышенных концентраций бензойной, 4-ГФУ и смеси кислот (рис. 4б). Для проверки влияния АКК на рост гриба и бактерии использовали такое их количество, которое было обнаружено в растворе экссудатов. Однако реальное количество ароматических карбоновых кислот в близости к корню могло быть существенно выше, чем в растворе экссудатов.
Таким образом, проведенный хроматографический анализ показал, что в экссудатах ячменя количество ароматических карбоновых кислот, относящихся к антимикробным веществам, изменяется в зависимости от микроорганизма, колонизирующего корни. Так, колонизация ячменя антагонистической ризобактерией сопровождалась выделением в экссудатах меньшего количества антимикробных веществ, чем колонизация фитопатогенным грибом (рис. 1). Низкое количество АКК в экссудатах ячменя, колонизированного бактерией, было обусловлено незначительным содержанием 4-ГФУ (рис. 1). Бактериальный штамм в отличие от грибного был способен утилизировать данную кислоту (табл. 1). Однако снижение количества 4-ГФУ в экссудатах ячменя могло объясняться не только утилизацией этого вещества бактерией во время ее роста на корнях. Как показали результаты эксперимента, бактерия примерно вдвое снижала количество 4-ГФУ, присутствующей в среде (таблица), тогда как в растворе корневых экссудатов ячменя, колонизированного бактерией, ее количество было снижено в 17 раз по сравнению с количеством в экссудатах стерильного ячменя (рис. 1). Таким образом, изменение количественного состава АКК в корневых экссудатах ячменя, колонизированного бактерий, связано не столько с утилизацией этих веществ данным бактериальным штаммом, сколько с ответной реакцией самого растения.
Исходя из полученных результатов, можно сделать заключение, что P. fluorescens 2137 обладал бóльшей адаптационной способностью к существованию в ризосфере и ризоплане ячменя, чем F. culmorum. В ответ на колонизацию ризобактерией ячмень отвечал меньшим количеством антимикробных компонентов в экссудатах, чем на колонизацию фитопатогенным грибом. Бактериальный штамм оказался и более устойчивым к антимикробным веществам экссудатов, чем фитопатогенный гриб. Полученные данные свидетельствовали о том, что растение ячменя, выделяя антимикробные вещества в ризосферу, создавало более благоприятные условия для развития P. fluorescens и менее благоприятные – для развития F. culmorum. Можно предположить, что снижение плотности гриба на корнях в присутствии бактерии, описанное в предыдущих работах [10–12], могло быть связано не только с прямым действием бактерии, но и с влиянием растения.
Таким образом, в перспективе возможен отбор сортов зерновых культур с определенным составом антимикробных компонентов в корневых экссудатах. Возделывание таких сортов позволит улучшить фитосанитарное состояние почв путем регуляции состава прикорневой микрофлоры.
Для выполнения работы использовали оборудование центра коллективного пользования “Геномные технологии, протеомика и клеточная биология” Всероссийского научно-исследовательского института сельскохозяйственной микробиологии (ЦКП ГТПиКБ ФГБНУ ВНИИСХМ).
Работа выполнена при финансовой поддержке Российского Фонда Фундаментальных Исследований (проект № 18-016-00111-а). Хроматографический анализ ароматических карбоновых кислот выполнен при финансовой поддержке Российского Научного Фонда (проект № 19-16-00097).
Список литературы
Parry D.W., Jenkinson P., McLeod L. // Plant Pathol. 1995. V. 44. № 2. P. 207–238.
Clear R., Patrick S. Fusarium Head Blight in Western Canada https://www.grainscanada.gc.ca/en/grain-research/scientific-reports/fhb-western/fhb-1.html; (Revised), 2010.
Bais H.P., Weir T.L., Perry L.G., Gilroy S., Vivanco J.M. // Annu. Rev. Plant Biol. 2006. V. 57. № 3. P. 233–266.
Bais H.P., Prithiviraj B., Jha A.K., Ausubel F.M., Vivanco J.M. // Nature. 2005. V. 434. № 7030. P. 217–221. https://doi.org/10.1038/nature03356
Gu Y., Wei Z., Wang X., Friman V-P., Huang J., Wang X., Mei X., Xu Y., Shen Q., Jousset A. // Biol. Fertil. Soils. 2016. V. 52. № 7. P. 997–1005. https://doi.org/10.1007/s00374-016-1136-2
Stringlis I.A., Yu K., Feussner K., de Jonge R., Van Bentum S., Van Verk M.C., Berendsen R.L., Bakker P.A.H.M., Feussner I., Pieterse C.M.J. // Proc. Natl. Acad. Sci. USA. 2018. V. 115. № 22. P. E5213–E5222. doi.org/https://doi.org/10.1073/pnas.1722335115
Lanoue A., Burlat V., Henkes G.J., Koch I., Schurr U., Rose U.S.R. // New Phytologist. 2010. V. 185. № 2. P. 577–588. https://doi.org/10.1111/j.1469-8137.2009.03066.x
Stringlis I.A., de Jonge R., Pieterse C.M.J. // Plant Cell Physiol. 2019. V. 60. № 7. P. 1405–1419. https://doi.org/10.1093/pcp/pcz076
Струнникова О.К., Шахназарова В.Ю., Вишневская Н.А., Чеботарь В.К., Тихонович И.А. // Микробиология. 2007. Т. 76. № 5. С. 675–681.
Струнникова O.K., Шахназарова В.Ю., Вишневская Н.А., Чеботарь В.К., Тихонович И.А. // Микология и фитопатология. 2008. Т. 42. № 1. С. 68–77.
Струнникова О.К., Феоктистова А.С., Вишневская Н.А., Чеботарь В.К. // Микология и фитопатология. 2010. Т. 44. № 2. С. 160–168.
Strunnikova O.K., Vishnevskaya N.A., Ruchiy A.S., Shakhnazarova V.Yu., Vorobyov N.I., Chebotar V.K. // Plant Soil. 2015. V. 389. № 2. P. 131–144. https://doi.org/10.1007/s11104-014-2351-y
Gerlach W., Nirenberg H. The Genus Fusarium – a Pictorial atlas. Mitt Berlin-Dahlem: Biol. Bundesanst Land U Forstwirtsch, 1982. 40 p.
Шахназарова В.Ю., Феоктистова А.С., Чижевская Е.П., Вишневская Н.А., Струнникова О.К. // Микология и фитопатология. 2012. Т. 46. № 4. С. 287–292.
Кравченко Л.В., Макарова Н.М., Азарова Т.С., Проворов Н.А., Тихонович И.А. // Микробиология. 2002. Т. 71. № 4. С. 521–525.
Huang Z., Dostal L., Rosazza J.P.N. // J. Bacteriol. 1994. V. 176. № 19. P. 5912–5918.
Muller C., Petruschka L., Cuypers H., Burchhardt G, Herrmann H. // J. Bacteriol. 1996. V. 178. № 7. P. 2030–2036.
Shrivastava R., Purohit H., Phale P.S. // J. Bioremed. Biodegrad. 2011. V. 2. № 2. P. 120. https://doi.org/10.4172/2155-6199.1000120
Karishma M., Trivedi V.D., Choudhary A., Mhatre A., Kambli P., Desai J., Phale P.S. // FEMS Microbiol. Letters. 2015. V. 362. № 20. P. 1–7. https://doi.org/10.1093/femsle/fnv139
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


