Прикладная биохимия и микробиология, 2021, T. 57, № 5, стр. 485-495
Эффективность деполимерицации хитозана микробными хитиназами и хитозаназами с точки зрения антимикробной активности образуемых хитоолигомеров
В. Р. Сафина 1, А. И. Мелентьев 1, Н. Ф. Галимзянова 1, Е. А. Гильванова 1, Л. Ю. Кузьмина 1, С. А. Лопатин 2, В. П. Варламов 2, Андр. Х. Баймиев 3, Г. Э. Актуганов 1, *
1 Уфимский Институт биологии Уфимского федерального исследовательского центра РАН
450054 Уфа, Россия
2 Институт биоинженерии ФИЦ “Фундаментальные основы биотехнологии” РАН
117312 Москва, Россия
3 Институт биохимии и генетики Уфимского федерального исследовательского центра РАН
450054 Уфа, Россия
* E-mail: gleakt@anrb.ru
Поступила в редакцию 17.03.2021
После доработки 15.04.2021
Принята к публикации 23.04.2021
Аннотация
Изучены особенности ферментативной деструкции хитозана со степенью деацетилирования (СД) 85 и 50% препаратами микробных хитиназ и хитозаназ по показателям глубины гидролиза, молекулярно-массового распределения (ММР) и антимикробной активности образуемых продуктов реакции. Ферментный комплекс штамма Bacillus thuringiensis B-387, характеризующегося высоким уровнем продукции хитозаназ (>4.5 ед/мл), осуществлял деструкцию полимера до низкомолекулярных хитоолигосахаридов (Mw ≤ 2 кДа) при низком выходе (~5%) олигохитозанов (Mw 2–16 кДа). Препараты штаммов Bacillus atrophaeus IB-33-1 и Cohnella sp. IB-P192, характеризующиеся активностью преимущественно хитиназы (0.3–0.5 ед./мл), показали наиболее низкие скорость и глубину гидролиза хитозана с СД 85%. Подбор соотношения фермент : субстрат в интервале 2–5 ед./г (по хитозаназе) позволил снизить глубину гидролиза исходного полимера и повысить выход олигохитозанов с Mw ~ 15–17 кДа до 30% при деполимеризации хитозана (СД 85%) ферментным комплексом B. thuringiensis B-387. При гидролизе хитозана различной степени деацетилирования (СД 85% и 50%) ферментными комплексами с высокой активностью хитозаназы бактерицидный и фунгицидный эффект образуемых олигомеров снижался, как правило, более заметно, чем при использовании хитиназ. Однако в некоторых случаях имело место как неспецифическое, так и специфическое усиление антимикробного действия продуктов ферментолиза по сравнению с исходным полимером, что определялось индивидуальной чувствительностью штаммов бактерий и микромицетов.
Хитозан – уникальный по физико-химическим свойствам и разнообразию биологической активности аминополисахарид, получаемый щелочным деацетилированием хитина из панциря морских ракообразных [1]. Объемы промышленно производимого хитозана существенно превышают известные в настоящее время потенциально значимые естественные источники этого биополимера, относящиеся в основном к грибам класса Zygomycetes, например, Absidia caurulea [2, 3]. Неотъемлемыми биологическими свойствами хитозана являются антибактериальная и фунгицидная активности, обусловленные, в известной степени, его поликатионной природой [1, 4, 5]. Вне зависимости от источника хитозана, его антимикробная активность в значительной мере определяется такими характеристиками как молекулярная масса (Mw) и степень деацетилирования (СД) [4, 6, 7]. Олигомеры хитозана, включая хитоолигосахариды (ХОС) со степенью полимеризации n = 4–10 и низкомолекулярный хитозан с Mw ~ 4–20 кДа, представляют собой более функциональные соединения по сравнению с исходным полимером в силу их растворимости в воде при нейтральных значениях рН и низкой вязкости [8–10]. По различным данным, наиболее высокой бактерицидной и фунгицидной активностью обладают хитоолигомеры с Mw ~ 5–10 кДа, тогда как другие виды биологической/физиологической активности значительно варьируют по своему уровню среди олигомеров с Mw ~ 1.5–20 кДа и более [6, 9, 11–13]. Особенности структуры исходного полимера и способ его деструкции могут оказывать существенное влияние на спектр образуемых олигомеров и их биологическую активность [14]. Преимущества ферментативной деструкции хитозана заключаются в безопасности этого процесса для окружающей среды (по сравнению с химическими методами) и отсутствии побочных продуктов, а также возможности контроля протекающей реакции и глубины гидролиза субстрата [10, 15, 16]. Хитозан может быть гидролизован различными гидролазами, в том числе некоторыми целлюлазами, протеазами, пектиназами и др. [15]. Однако, в отличие от неспецифических ферментов, ограниченная деструкция полимера хитозаназами (КФ 3.2.1.132) может протекать при существенно меньшем соотношении фермент-субстрат и требует меньшего времени инкубации. Сравнительная оценка потенциала микробных хитозаназ и хитиназ представляет значительный интерес с точки зрения образования и выхода водорастворимых хитоолигомеров.
Цель настоящей работы – сравнительное изучение эффективности ферментативного гидролиза хитозана до олигомеров, обладающих антимикробной активностью, под действием хитиназ и хитозаназ бактериального и грибного происхождения, различающихся по специфичности и каталитическим свойствам.
МЕТОДИКА
Основными объектами исследования являлись штаммы хитинолитических бактерий и микромицетов из коллекции Уфимского института биологии (УИБ УФИЦ РАН) и Всероссийской коллекции микроорганизмов (ВКМ), в том числе, Bacillus atrophaeus IB-33-1, B. licheniformis IB-A41.4.2, B. licheniformis IB-P141 B21-1, B. mannanilyticus IB‑OR17 B1 (штамм депонирован в ВКМ под номером В-2715D), B. thuringiensis var. dendrolimus ВКМ В-387, Cohnella sp. IB-P192, Paenibacillus ehimensis IB-739 (депонирован в ВКМ под номером B-2680D), P. illinoisensis IB-1087, а также хитозанолитический штамм Penicillium sp. IB-37-2A (депонирован в ВКМ под номером F-4780). Культуры поддерживали на агаризованных средах, описанных в работе [17], а также на агаризованной среде LB и картофельно-глюкозном агаре (КГА). В качестве тест-объектов для оценки антибактериальной и фунгицидной активности хитозана и его олигомеров использовали коллекционные и собственные (коллекции УИБ и ИБГ УФИЦ РАН) штаммы условно патогенных бактерий Bacillus cereus ВКМ В-688, Enterobacter cloaceae IB-34 4 CPA, Escherichia coli IBG-9 и Pseudomonas aeruginosa IB-39D, а также фитопатогенных микромицетов Bipolaris sorokiniana(Sacc.) Shoemaker ИБ Г-12, Fusarium culmorum (Wm.G.Sm.) Sacc. ВКМ F-844, F. oxysporum (Schlecht.) Snyd. et Hans. ВКМ F-137 и Rhizoctonia solani J.G. Kühn ВКМ F-895.
В работе использовали хитозан с СД ~ 85% (ЗАО “Биопрогресс”, Россия), а также частично N-ацетилированный хитозан (СД ~ 50%), любезно предоставленный лабораторией инженерии биополимеров (Институт биоинженерии ФИЦ Биотехнологии РАН).
Хитозан (СД 85%) растворяли в 100 мл 0.2 М уксусной кислоты (х. ч.) при 40○С и постоянном перемешивании. Полученный раствор затем титровали 0.2 М NaOH до рН 6.0, после чего доводили до объема 200 мл деионизированной водой и хранили при 5°С. В дальнейшей работе приготовленный раствор хитозана разбавляли деионизированной водой до необходимых концентраций. Аналогичным способом готовили раствор хитозана (СД 50%).
Активность хитозаназы и хитиназы препаратов, а также содержание в них белка определяли, как описано ранее в работе [18].
Деполимеризацию хитозана СД 85 и 50% ферментными препаратами оценивали по снижению кинематической вязкости его растворов, которую измеряли с помощью капиллярного стеклянного вискозиметра ВПЖ-4 (“Экохим”, Россия) с диаметром капилляра 0.82 мм. Концентрацию субстрата подбирали в интервале 1–1.35% в соответствии с рекомендациями по рабочему диапазону времени истечения. В расходный резервуар вискозиметра вносили около 6 мл раствора хитозана, к которому добавляли от 0.01 до 0.1 мл раствора ферментного препарата. Реакционную смесь тщательно перемешивали и инкубировали при 50°С в течение 60 мин. Вязкость раствора субстрата измеряли через 2, 5, 10, 20, 40 и 60 мин от начала реакции. Кинематическую вязкость реакционной смеси рассчитывали по формуле:
где g – ускорение свободного падения в месте измерения, Т – время истечения, K – постоянная вискозиметра, равная 0.03 мм2/с2 для вискозиметра ВПЖ-4.Степень гидролиза хитозана с СД 85% оценивали после 1 ч обработки при 50°С ферментными препаратами штаммов B. atrophaeus IB-33-1, B. thuringiensis В-387, Cohnella sp. IB-P192, P. ehimensis IB-739 и Penicillium sp. IB-37-2A. Остаточное содержание хитозана определяли следующим образом. Частично гидролизованный полисахарид осаждали добавлением в реакционную смесь 0.5 М NaOH в соотношении 1 : 3 (об./об.), центрифугировали, промывали деионизированной водой и высушивали при 45°С до постоянного веса и взвешивали на аналитических весах Leki B2104 (Финляндия) с погрешностью ±0.1 мг. Глубину гидролиза субстрата определяли по формуле [(C0–C1)/C1] × 100 (%), где С0 – начальная, а С1 – остаточная концентрация хитозана (мг/мл) в реакционной смеси после инкубации в присутствии ферментных препаратов.
Средневесовую (Mw), среднечисловую (Mn) молекулярную массу, а также индекс полидисперсности (Mw/Mn) образцов низкомолекулярного хитозана определяли с помощью высокоэффективной жидкостной эксклюзионной хроматографии (HP-SEC) на жидкостном хроматографе S-2100 (“Sykam”, Германия). Ферментные препараты добавляли к 2%-ному раствору хитозана (СД 85%) в 50 мМ Na-ацетатном буфере (pH 6.0) в различных объемных соотношениях и инкубировали в течение 60 мин при 50°C. Образовавшиеся олигохитозаны осаждали добавлением 2.0 М раствора NaOH (1 : 1, об./об.), центрифугировали, промывали деионизированной водой до нейтральной реакции и перерастворяли в 50 мМ Na-ацетатном буфере (pH 6.0). Полученные растворы лиофильно высушивали на установке Иней 6 (ИБП РАН, Пущино, Россия) и после повторного растворения в деионизированной воде фракционировали на колонке PolySep-GFC-P 4000 (“Phenomenex”, США) 7.8 × 300 мм с предколонкой 5.0 × 2 мм. В качестве элюента использовали 50 мМ уксусную кислоту – 150 мМ ацетат натрия, рН 5.0, при скорости потока 0.5 мл/мин, температуре 30°C и давлении 2 MPa. Колонку калибровали декстрановыми стандартами с молекулярной массой 1.08, 4.44, 9.89, 43.5, 66.7, 123.6 и 196.3 кДа (“Sigma”, США). Анализ хроматограмм проводили с помощью программы Chrom&Spec v. 1.6 (“Ampersand”, Россия).
Анализ антибактериальной и фунгицидной активности ферментативных гидролизатов образцов хитозана со СД 85 и 50% проводили в стандартных 96-луночных полистирольных культуральных планшетах (“Corning”, США). Образцы хитозана после ферментолиза подвергали термообработке в водной бане (10 мин при 100°С) для инактивации ферментов и затем стерилизовали пропусканием через бактериальные шприцевые фильтры с размером пор 0.20 мкм (“GVS”, США) или 0.45 мкм (“Sartorius”, Германия). Тест-штаммы бактерий предварительно выращивали в течение ночи в бульоне LB при 220 об./мин и 36.5°С для бацилл и 30°С – для других бактерий.
Инокуляты готовили разведением свежей культуры бактерий в стерильной среде LB до значений оптической плотности 0.05–0.10 ед. и вносили в лунки в объеме 0.1 мл. К инокулятам добавляли стерильные растворы ферментативных гидролизатов хитозана в различном соотношении и доводили общий объем среды до 0.2 мл. Смеси инкубировали от 24 до 48 ч при 30°С, после чего измеряли их оптическую плотность при 600 нм на планшетном спектрофотометре EnSpier (“Perkin-Elmer”, США). В качестве контроля использовали образцы питательной среды, не содержащей олигомеров хитозана, а также среду с хитозаном без ферментативной обработки. Степень ингибирования (СИ, %) тест-штаммов бактерий рассчитывали с помощью стандартной формулы СИ = ((ОПк – ОПэ)/ОПк) × 100, где ОПк и ОПэ – оптическая плотность среды в контрольных и экспериментальных вариантах соответственно. Минимальную ингибирующую концентрацию (мкг/мл) рассчитывали по количеству хитозана и хитоолигосахаридов, вызывающее снижение оптической плотности тест-культур не менее, чем на 50%. Значения представляли как средние трех независимых экспериментов.
Фунгицидную активность хитоолигосахаридов оценивали аналогичным способом, используя в качестве питательной среды картофельно-глюкозный бульон. Инокуляты готовили на основе свежей (5–6 сут) культуры микромицетов; в качестве посевного материала использовали суспензию спор концентрацией около 105 спор/мл питательной среды. Среднее количество грибных спор/конидий в инокуляте рассчитывали с помощью камеры Горяева. После засева планшеты инкубировали при 28°С в течение 3–4 сут.
Фунгицидную активность некоторых гидролизатов хитозана количественно определяли также по подавлению радиального роста колоний фитопатогенного гриба B. sorokiniana IB Г-12 при культивировании на КГА. Предварительный гидролиз 1%-ных растворов хитозана (СД 85% и СД 50%, рН 6.0) проводили в течение 1 ч при 50°С концентрированными ферментными препаратами штаммов B. atrophaeus IB-33-1 (ХОС 1), B. thuringiensis B-387 (ХОС 2) и Penicillium sp. IB-37-2A (ХОС 3) в соотношении от 1 : 60 до 1 : 120 (о/о). Затем реакционную смесь инкубировали 10 мин при 100°С, остужали, центрифугировали и пропускали через бактериальные фильтры с размером пор 0.20 мкм (“GVS”, США). Полученные растворы вносили в расплавленный и охлажденный перед застыванием КГА в соотношениях 1 : 15 и 1 : 30 (об./об.), после чего агар разливали по 15 мл в чашки Петри. В застывшем КГА вырезали лунки диаметром 9 мм, в которые вставляли агаровые блоки того же диаметра стерильно вырезанные из свежей (5–7 сут) культуры тест-гриба. Чашки инкубировали в течение 7 сут при 28°С, после чего измеряли диаметр выросших колоний гриба. Размер колоний, выросших на КГА в отсутствии гидролизатов хитозана, принимали в качестве негативного контроля. В качестве положительного контроля принимали размеры колоний, выросших в присутствии исходных растворов 1%-ного (в/о) хитозана (СД 85% и СД 50%), внесенных в среду в том же объемном отношении (1 : 30), что и полученные из них гидролизаты. Степень подавления роста гриба рассчитывали в % по стандартной формуле (см. выше), используя в качестве переменных значения площади (мм2) колоний гриба в контрольном и опытном вариантах. Значения представляли как средние арифметические данных трех независимых экспериментов, со стандартным отклонением в качестве доверительного интервала.
Статистическую обработку результатов осуществляли с помощью программы OriginPro 2018 (версия b9.5.0.193), “OriginLab Corp.”). Коэффициенты корреляции по Пирсону и линейную регрессию оценивали, используя пакет анализа MS Office Excel 2007 (12.0.6611.1000).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Понятие “эффективности” гидролиза хитозана ферментными препаратами может интерпретироваться по-разному в зависимости от целей, однако ключевым критерием при этом является соблюдение баланса между достигаемым повышением растворимости продуктов частичной деструкции полимера в водных растворах и их биологической, в данном контексте, антимикробной активностью. Важным фактором, оказывающим влияние на эффективность процесса деполимеризации, является степень деацетилирования исходного полимера. Как известно, некоторые бактериальные экзохитиназы семейства GH18, в отличие от эндохитиназ GH19, эффективно расщепляют хитозан со степенью деацетилирования (СД) 35–50% [16, 19]. По мере увеличения СД до 68–87% размер молекул олигомерных продуктов ферментолиза возрастает, при этом хитиназы, такие как ChiB, сохраняют эффективность в отношении хитозана [16]. Поскольку последовательности, кодирующие консервативные участки каталитических доменов хитиназ ChiA и ChiB, широко распространены среди почвенных бактерий, на предварительном этапе работы нами была оценена активность гидролиза хитозана (в отношении хитозана со СД 85%) комплексом ферментов бактерий порядка Bacillales – продуцентов внеклеточных хитиназ. Тестировали девять коллекционных штаммов различной таксономической принадлежности. Для сравнения в работе использовали также штамм микромицета Penicillium sp. IB-37-2A [20]. Сравнительный групповой анализ показал отсутствие прямой корреляции (RX,Y = –0.39) и плохую взаимосвязь (r2 < 0.5) между значениями хитиназной и хитозаназной активности у исследуемых штаммов (табл. 1). Данный факт свидетельствует о том, что при групповой характеристике бактерий уровень их хитинолитической активности не может адекватно характеризовать их способность к гидролизу хитозана. Основную роль в гидролизе высокодеацетилированного хитозана могут играть хитозаназы (КФ 3.2.1.132), распространенные у бацилл и актинобактерий [21], однако на уровне отдельных штаммов хитозанолитическая активность может складываться из эффекта разных групп ферментов, в том числе, неспецифических. Объективным показателем способности хитинолитических штаммов к продукции хитозаназ, по-видимому, может служить значение индекса (IChoA) соотношения хитозаназной и хитиназной активности у изучаемой культуры (табл. 1). Так, при IChoA$ \gg $ 1 можно говорить о хорошей способности бактериальных штаммов к продукции хитозаназ, тогда как значения IChoA ~ ~ 1.1–1.9 могут косвенно свидетельствовать о синтезе неспецифических гидролаз, участвующих в деградации хитозана.
Таблица 1.
Cредняя продуктивность и индекс хитозаназной активности штаммов бактерий и микромицетов, способных к гидролизу хитина и хитозана
| № | Штамм | Средняя продуктивность штамма (ферментативная активность в СН КЖ), ед./мл |
IChoA1 | |
|---|---|---|---|---|
| хитиназа | хитозаназа2 | |||
| 1 | Bacillus atrophaeus IB-33-1 | 0.407 ± 0.027 | 0.107 ± 0.014 | 0.26 |
| 2 | B. licheniformis IB-A41.4.2 | 0.220 ± 0.024 | 0.281 ± 0.024 | 1.28 |
| 3 | B. licheniformis IB-P141 B21-1 | 0.265 ± 0.027 | 0.285 ± 0.027 | 1.08 |
| 4 | B. mannanilyticus IB-OR17 B1 | 0.318 ± 0.047 | 0.038 ± 0.005 | 0.12 |
| 5 | B. thuringiensis ВКМ В-387 | 0.457 ± 0.0383 | 4.609 ± 0.1254 | 10.09 (32)5 |
| 6 | Cohnella sp. IB-P192 | 0.240 ± 0.017 | 0.303 ± 0.010 | 1.26 |
| 7 | Paenibacillus ehimensis IB-739 | 0.217 ± 0.016 | 0.328 ± 0.020 | 1.51 |
| 8 | P. illinoisensis IB-1087 | 0.366 ± 0.024 | 0.528 ± 0.032 | 1.44 |
| 9 | Penicillium sp. IB-37-2A | 0.095 ± 0.007 | 2.486 ± 0.644 | 26.17 |
| Коэффициент корреляции по Пирсону между показателями активности | 0.32332 | – | ||
| Коэффициент корреляции обеих активностей по Пирсону (с показателем IChiA) | –0.38531 | 0.6558 | ||
| Коэффициент детерминации r2 Y-пересечение |
0.148467 10.046 |
0.430109 0.8960 |
||
1 IChoA – относительный индекс хитозанолитической активности; 2 оценка по скорости гидролиза растворимого/коллоидного хитозана с СД 85%; 3 индукция 0.25–1.0%-ным коллоидным хитином; 4 базовый уровень конститутивного синтеза в среде LB; 5 значение в скобках указано для соотношения уровня хитозаназной активности, индуцируемой в тех же условиях, что и аналогичная хитиназная активность.
Для сравнительной оценки деполимеризации хитозана под действием различных ферментных систем, нами были отобраны штаммы, способные к одновременной продукции хитиназ и хитозаназ, с высоким и умеренным индексом хитозаназной активности – B. thuringiensis B-387, Penicillium sp. IB-37-2A и P. ehimensis IB-739, а также культуры, синтезирующие преимущественно хитиназы – B. atrophaeus IB-33-1, Cohnella sp. IB-P192. Из перечисленных культур штамм P. ehimensis IB-739 рассматривался ранее как потенциальный продуцент ферментного комплекса для получения низкомолекулярного хитозана [22]. Другими исследователями показана возможность применения хитозаназы штамма P. ehimensis B-23118 для деструкции хитозана до функциональных хитоолигосахаридов со степенью полимеризации от 2 до 6 [23]. Количественный анализ удельной ферментативной активности отобранных штаммов на основе оценки скорости накопления восстанавливающих сахаров, образуемых при гидролизе коллоидного хитина и растворимого хитозана со СД 85%, показал довольно сходный интервал значений продукции хитиназ, при наличии резко выделяющейся хитозаназной активности у штаммов B. thuringiensis B-387 и Penicillium sp. IB-37-2 (рис. 1). Уровень деструкции хитозана СД 85% ферментными комплексами исследуемых штаммов по данным вискозиметрического анализа в целом коррелировал с показателями динамики освобождения продуктов гидролиза, за исключением штамма Penicillium sp. IB-37-2A, который при более высокой “сахаробразующей” активности, чем у ферментного комплекса P. ehimensis IB-739, характеризовался сравнительно медленной динамикой снижения вязкости субстрата (рис. 2а). Проявление такой диспропорции типично для действия ферментов экзо-типа, которым является хитозаназа Penicillium sp. IB-37-2A [20]. Следует отметить сходный характер воздействия на хитозан с СД ~ ~ 50%, все ферментные препараты быстрее снижали вязкость его раствора по сравнению с хитозаном СД 85% (рис. 2б), что может быть связано с повышением активности хитиназ в отношении N-ацетилированных остатков.
Рис. 1.
Удельная хитиназная (а) и хитозаназная (б) активности (ед./мг белка) штаммов хитинолитических бактерий (1–4) и Penicillium sp. IB-37-2A (5) при глубинном культивировании в среде с 0.5% коллоидного хитина (штаммы 1, 3–5) и среде LB (штамм 2). 1 – B. atrophaeus IB-33-1; 2 – B. thuringiensis B-387; 3 – Cohnella sp. IB-P192; 4 – P. ehimensis IB-739.
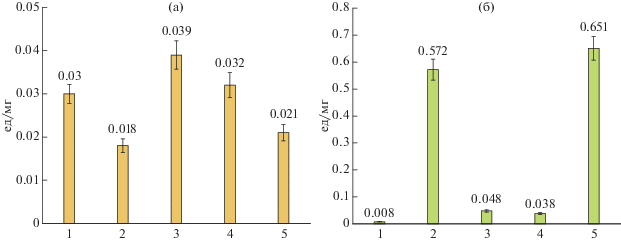
Рис. 2.
Динамика снижения кинематической вязкости (V) 1.3%-ных растворов хитозана с СД 85% (a) и 50% (б) под действием препаратов КЖ штаммов: 1 – B. thuringiensis B-387 (ед./мг); 2 – P. ehimensis IB-739 (ед./мг); 3 – Cohnella sp. IB-P192 (ед./мг); 4 – Penicillium sp. IB-37-2A (ед./мг); 5 – B. atrophaeus IB-33-1 (ед./мг). Объемное соотношение (об./об.) растворов фермента и субстрата – 1 : 60, 50°С, 50 мМ Na-ацетатный буфер, рН 6.0.

Глубина конверсии хитозана СД 85% до низкомолекулярных водорастворимых хитоолигосахаридов напрямую определялась уровнем хитозаназной активности ферментных препаратов (RX,Y = = 0.83; r2 ~ 0.68), тогда как значения их хитиназной активности не оказывали существенного влияния на степень гидролиза данного полисахарида (RX,Y = –0.04; r2 ~ 0.001) (табл. 2). Из табл. 3 видно, что при одинаковых объемных соотношениях (1 : 60) ферментных препаратов и раствора субстрата, показатели их индивидуального фермент-субстратного соотношения по хитозаназе могли различаться в 40 и более раз. Ферментный препарат B. thuringiensis B-387 осуществлял наиболее глубокий гидролиз хитозана СД 85% (95–97%) в течение 1 ч инкубации (50°С) при минимальной степени загрязнения реакционной смеси микробным белком (табл. 2). Высокую степень конверсии полимера (80–85%) показывал также ферментный комплекс Penicillium sp. IB-37-2A после 4-часовой обработки (данные не показаны). Как известно, продукты глубокого гидролиза хитозана, включая мономер и димер, не проявляют антибактериальной активности, а хитоолигосахариды со степенью полимеризации n = 3–6 показывают существенно меньший антимикробный эффект по сравнению с низкомолекулярным хитозаном [24]. С точки зрения выхода низкомолекулярного хитозана, эффективность конверсии исходного полисахарида показывала обратную зависимость от уровня хитозаназной активности проверенных ферментных препаратов). Так, олигохитозан, осаждаемый 0.5 М раствором NaOH, практически отсутствовал при гидролизе хитозана (СД 85%) высокоактивным ферментным комплексом B. thuringiensis B-387 (табл. 2) в течение 1 ч (табл. 2).
Таблица 2.
Степень деструкции высокомолекулярного хитозана (СД 85%) и выход частично гидролизованных олигохитозанов при действии концентрированных ферментных препаратов различных штаммов (50°С, рН 5.5)
| Фермент-субстратное соотношение, ед./г хитозана | Концентрация микробного белка в реакционной смеси, мг/мл | Степень конверсии хитозана за 1 ч, % * | Средний выход олигомерных продуктов, %** | ||
|---|---|---|---|---|---|
| об./об. | хитиназа | хитозаназа | |||
| Штамм B. atrophaeus IB-33-1 | |||||
| 1 : 120 | 3.2 | 0.5 | 0.44 ± 0.05 | 9.1 ± 1.1 | 91 |
| 1 : 60 | 6.4 | 1.1 | 0.89 ± 0.10 | 16.3 ± 1.5 | 84 |
| Штамм B. thuringiensis В-387 | |||||
| 1 : 240 | 0.3 | 10.2 | 0.06 ± 0.005 | 95.3 ± 3.2 | 5 |
| 1 : 120 | 0.6 | 20.3 | 0.12 ± 0.010 | 97.3 ± 2.8 | 3 |
| 1 : 60 | 1.2 | 40.5 | 0.25 ± 0.018 | 97.6 ± 1.7 | 2 |
| Штамм Cohnella sp. IB-P192 | |||||
| 1 : 60 | 1.6 | 0.2 | 0.28 ± 0.025 | 22 ± 2.1 | 78 |
| Штамм P. ehimensis IB-739 | |||||
| 1 : 60 | 2.5 | 3 | 0.34 ± 0.027 | 31.2 ± 2.8 | 68 |
| Штамм Penicillium sp. IB-37-2A | |||||
| 1 : 120 | 1.7 | 19 | 0.11 ± 0.014 | 37.2 ± 2.9 | 63 |
| 1 : 60 | 3.5 | 38 | 0.21 ± 0.016 | 51.2 ± 4.4 | 49 |
Таблица 3.
Молекулярно-массовые характеристики и относительный выход олигохитозанов, образуемых под действием ферментных комплексов исследуемых штаммов после 1 ч гидролиза хитозана (20 мг/мл, СД ~ 85%) при различной температуре и соотношении фермент : субстрат
| Фермент-субстратное соотношение, ед./г хитозана | Mn1, кДа | Mw2, кДа | Mw/Mn3 | Выход, % | ||
|---|---|---|---|---|---|---|
| об./об. | хитиназа | хитозаназа | ||||
| Штамм B. thuringiensis В-387 | ||||||
| 1 : 6004 | 0.02 | 0.5 | 22.7 | 46.2 | 2.03 | 44.2 |
| 1 : 1206 | 0.1 | 2.3 | 9.2 | 14.8 | 1.62 | 29.2 |
| 1 : 604 | 0.2 | 4.6 | 10.7 | 16.7 | 1.55 | 30.0 |
| Штамм Cohnella sp. IB-P192 | ||||||
| 1 : 604 | 1.3 | 0.2 | 30.5 | 70.6 | 2.32 | 58.3 |
| Штамм P. ehimensis IB-739 | ||||||
| 1 : 6004 | 0.2 | 0.2 | 35.9 | 90.1 | 2.51 | 70 |
| 1 : 1204 | 1 | 1.2 | 25.8 | 67.8 | 2.63 | 45.8 |
| 1 : 604 | 1.9 | 2.3 | 15.2 | 27.1 | 1.79 | 55.0 |
| Штамм Penicillium sp. IB-37-2A | ||||||
| 1 : 2404 | 0.03 | 0.8 | 57.8 | 127.9 | 2.21 | 50.0 |
| 1 : 605 | 0.1 | 3.1 | 41.2 | 97.1 | 2.36 | 61.7 |
Молекулярная масса (Mw) олигомерного хитозана является важным показателем эффективности ограниченного ферментативного гидролиза, определяющего ключевые функциональные характеристики продуктов реакции, такие как растворимость и антибактериальная и фунгицидная активность. Следует отметить, что по этому критерию, комплексы гидролаз большинства исследуемых штаммов, при низком соотношении фермент : субстрат, показывали относительно слабую степень конверсии исходного полимера, образуя продукты в интервале молекулярных масс 67–128 кДа и индексов полидисперсности 2.2–2.6 (по данным ВЭЖХ, табл. 3). Олигомерные продукты гидролиза хитозана (СД 85%) ферментным комплексом штамма B. atrophaeus IB-33-1 не были нами исследованы в силу того, что он показывал наименьшую хитозан-деградирующую активность среди всех исследуемых культур. Высокоактивный комплекс B. thuringiensis B-387 при использовании более низких рабочих концентраций хитозаназы (2–5 ед./г субстрата) демонстрировал максимальную эффективность среди всех штаммов по показателям средневесовой молекулярной массы образуемых олигомеров (Mw ~ 15–17 кДа) при сравнительно невысоком выходе ~ 30% (табл. 3). Олигохитозаны с Mw 5–15 кДа являются наиболее функциональными водорастворимыми олигомерами хитозана в аспекте проявления антимикробной активности [1, 6, 12]. Всесторонний анализ влияния ключевых параметров ферментативной реакции (фермент-субстратное соотношение, температура, время, рН, ионная сила и т.д.) на показатели молекулярно-массового распределения продуктов гидролиза хитозана позволит в дальнейшем более детально оценить потенциал ферментных препаратов исследуемых штаммов при получении функциональных хитоолигомеров с Mw 5–15 кДа. Предварительные данные показывают, что увеличение температуры инкубации с 50 до 70°С обеспечивало сходную эффективность конверсии хитозана (по показателям выхода и молекулярно-массового распределения) ферментным комплексом B. thuringiensis B-387 в условиях 2-кратного снижения его концентрации (табл. 3).
Проведена сравнительная оценка бактерицидной и фунгицидной активности суммарных гидролизатов 1%-ного хитозана, полученных при действии концентрированных ферментных комплексов (см. табл. 2). Активность олигомерных продуктов гидролиза в отношении штамма B. cereus B-688 заметно снижалась по сравнению с исходным полимером (табл. 4), при этом показатели минимальной ингибирующей концентрации суммарных гидролизатов коррелировали с глубиной гидролиза хитозана в незначительной степени (rx,y ~ 0.34). Рост остальных штаммов бактерий, напротив, в целом более сильно подавлялся олигомерами, чем хитозаном (табл. 4). Если в отношении E. coli гидролизаты, полученные с помощью ферментных препаратов большинства тестированных штаммов (B. atrophaeus IB-33-1, B. thuringiensis B-387, P. ehimensis IB-739 и Penicillium sp. IB-37-2A) показывали примерно одинаковую активность, то против B. cereus и P. aeruginosa наиболее эффективны были продукты ферментных комплексов Penicillium sp. IB-37-2A и P. ehimensis IB-739 соответственно (табл. 4). Фунгицидная активность ферментативных гидролизатов хитозана в значительной степени зависела от видовой принадлежности тестируемых штаммов микромицетов, степени деацетилирования исходного полисахарида и метода оценки. При проведении эксперимента в планшетах, в интервале концентраций 25–150 мкг/мл, олигомерные продукты всех ферментных препаратов демонстрировали примерно одинаковую активность против фитопатогенных грибов F. culmorum и R. solani, тогда как подавление роста F. oxysporum заметно снижалось (на 30–40%) только у гидролизата B. thuringiensis B-387, что обусловлено, по-видимому, более глубокой деструкцией хитозана (СД 85%) ферментным комплексом этого штамма (табл. 5). При деполимеризации хитозана (СД 50%) фунгицидная активность уменьшалась у гидролизатов P. ehimensis IB-739, B. thuringiensis B-387 и Cohnella sp. IB-P192, что также может быть связано с более глубоким гидролизом ими N-ацетилированного хитозана за счет совместного действия хитиназ и хитозаназ (табл. 5).
Таблица 4.
Минимальная ингибирующая концентрация хитозана (СД 85%) и олигомерных продуктов его гидролиза ферментными комплексами исследуемых штаммов (1 ч, 50°С)
| Штамм-продуцент (соотношение фермент : субстрат) |
МИК, мкг/мл | |||
|---|---|---|---|---|
| Bacillus cereus B-688 |
Escherichia coli IBG-9 | Pseudomonas aeruginosa IB-39D |
Enterobacter cloaceae IB-34 4CPA |
|
| Хитозан СД 85% | 225 ± 35 | 45 ± 7 | 1250 ± 71 | 40 ± 7 |
| Ферментативные гидролизаты 1%-ного хитозана (СД 85%) | ||||
| B. atrophaeus IB-33-1 (1 : 60) | 425 ± 35 | 28 ± 4 | 900 ± 141 | НД* |
| B. thuringiensis B-387 (1 : 240) | 475 ± 35 | 28 ± 4 | 1250 ± 71 | НД* |
| Cohnella sp. IB-P192 (1 : 60) | 550 ± 71 | НД1 | 900 ± 141 | НД* |
| P. ehimensis IB-739 (1 : 60) | 900 ± 141 | 23 ± 4 | 425 ± 35 | 28 ± 4 |
| Penicillium sp. IB-37-2A (1 : 120) | 325 ± 35 | 28 ± 4 | 1000 ± 71 | НД* |
| Коэффициент корреляции между значениями МИК и глубиной гидролиза хитозана, rx, y | 0.34 | 0.27 | 0.61 | – |
Таблица 5.
Сравнительная степень подавления роста (72 ч, 28°С) штаммов фитопатогенных микромицетов одинаковыми концентрациями (150 мкг/мл) хитозанов со СД 85 и 50% и продуктов их ферментативного гидролиза (1 ч, 50°С) различными препаратами хитиназ/хитозаназ
| Хитозаны и олигомерные продукты их гидролиза ферментными комплексами | Степень ингибирования роста тест-грибов, % | ||
|---|---|---|---|
| Fusarium culmorum F-844 | Fusarium oxysporum F-137 |
Rhizoctonia solani F-895 | |
| Хитозан СД 85% | 77 ± 6 | 79 ± 4 | 90 ± 5 |
| Ферментативные гидролизаты 1%-ного хитозана (СД 85%) | |||
| B. atrophaeus IB-33-1 (1 : 60)* | 85 ± 4 | 80 ± 10 | 89 ± 4 |
| B. thuringiensis B-387 (1 : 240)* | 81 ± 6 | 56 ± 8 | 87 ± 7 |
| Cohnella sp. IB-P192 (1 : 60)* | 84 ± 6 | 70 ± 6 | 93 ± 2 |
| P. ehimensis IB-739 (1 : 60)* | 82 ± 6 | 76 ± 8 | 73 ± 7 |
| Penicillium sp. IB-37-2A (1 : 120) * | 87 ± 4 | 77 ± 4 | 91 ± 5 |
| Хитозан СД 50% | 61 ± 6 | 71 ± 6 | 82 ± 4 |
| Ферментативные гидролизаты 1%-ного хитозана (СД 50%) | |||
| B. atrophaeus IB-33-1 (1 : 60)* | 81 ± 7 | 78 ± 8 | 90 ± 9 |
| B. thuringiensis B-387 (1 : 240)* | 80 ± 5 | 54 ± 7 | 90 ± 10 |
| Cohnella sp. IB-P192 (1 : 60)* | 88 ± 4 | 60 ± 4 | 93 ± 2 |
| P. ehimensis IB-739 (1 : 60)* | 76 ± 5 | 52 ± 7 | 91 ± 9 |
| Penicillium sp. IB-37-2A (1 : 120)* | 80 ± 5 | 71 ± 6 | 92 ± 9 |
При оценке фунгицидной активности хитозана (СД 85%) и ХОС в агаризованной среде в отношении фитопатогена B. sorokiniana резкое снижение степени подавления роста гриба отмечалось у 1-часовых гидролизатов, полученных при действии препаратов с высокой активностью хитозаназ (штаммы B. thuringiensis B-387 и Penicillium sp. IB-37-2A) (рис. 3). В то же время, деструкция (1 ч) хитозана (СД 50%) комплексом B. thuringiensis B-387 с преимущественно эндо-хитозаназной активностью, в отличие от ферментных препаратов B. atrophaeus IB-33-1 и Penicillium sp. IB-37-2A, приводила к возрастанию фунгицидной активности олигомерных продуктов примерно на 30% по сравнению с исходным полисахаридом (рис. 3).
Рис. 3.
Степень подавления радиального роста (%) микромицета Bipolaris sorokiniana в агаре (КГА, 28°С, 7 сут) в присутствии одинаковых концентраций (275 ± 35 мкг/мл) хитозанов с СД 85% (1) и СД 50% (2) и их гидролизатов, полученных при действии ферментных комплексов B. atrophaeus IB-33-1 (ХОС 1), B. thuringiensis B-387 (ХОС 2) и Penicillium sp. IB-37-2A (ХОС 3).

Полученные результаты свидетельствуют о том, что ферментные комплексы высокоактивных культур (B. thuringiensis B-387 и Penicillium sp. IB-37-2A), продуцирующих хитозаназы, более эффективно гидролизуют хитозан с СД 85 и 50%, по времени и глубине гидролиза, а также высокой растворимости олигомерных продуктов и меньшей степени загрязнения реакционной смеси микробными белками и метаболитами (табл. 2). Вместе с тем, ферментные препараты штаммов, синтезирующих преимущественно хитиназу (B. atrophaeus IB-33-1, Cohnella sp. IB-P192), либо незначительное количество эндохитозаназ (P. ehimensis IB-739), при сходных условиях реакции характеризуются более высокими показателями выхода и значений Mw олигомерных продуктов. В целом, суммарные смеси хитоолигосахаридов, полученные с помощью последних, демонстрируют более стабильную антибактериальную и фунгицидную активность по сравнению c олигомерами, образующимися под действием высокоактивных деградирующих хитозан комплексов. Глубокий ферментативный гидролиз хитозанов приводит, как правило, к заметному снижению их антимикробной активности. Однако, в отношении некоторых штаммов грамотрицательных бактерий (Escherichia coli, Enterobacter cloaceae) ферментативные гидролизаты хитозана показывают более высокую антибактериальную активность по сравнению с исходным хитозаном (СД 85%), что может быть связано с их специфической восприимчивостью к смесям хитоолигомеров. Отмечено заметное повышение фунгистатической активности по сравнению с исходным хитозаном (СД 50%) смеси его олигомеров, полученных под действием пяти ферментных препаратов (табл. 5) против некоторых штаммов микромицетов (Fusarium culmorum, Rhizoctonia solani). В то же время, в отношении гриба Bipolaris sorokiniana данный эффект отмечался только у продуктов гидролиза хитозана (СД 50%) ферментным комплексом B. thuringiensis B-387, что также может быть обусловлено специфической чувствительностью этого гриба к низкомолекулярным хитоолигосахаридам со значительным содержанием ацетилированных остатков. Оптимизация процесса ферментативной деструкции хитозана по ключевым параметрам (соотношение фермент:субстрат, время, температура и т.п.) позволит более эффективно регулировать получение целевых продуктов, в том числе, повысить выход олигомеров, демонстрирующих оптимальное соотношение таких характеристик, как растворимость и биологическая активность. С практической точки зрения наиболее перспективно применение высокоактивных комплексов хитозанолитических ферментов (например, B. thuringiensis B-387), поскольку эффективность гидролиза хитозана должна оцениваться на основе интегрального показателя, включающего не только выход целевых олигомеров и уровень их биологической активности, но и скорость реакции (длительность процесса), расход ферментного препарата, растворимость олигомеров, а также степень загрязнения продуктов микробным белком. С другой стороны, принимая во внимание постоянное расширение сведений о биологической активности хитоолигомеров, можно предположить, что в ближайшем будущем возникнет необходимость комбинированного применения ферментов, различающихся по специфичности и удельной активности, для направленного получения конкретного олигомера (или смеси олигомеров), обладающего определенными функциональными характеристиками.
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 19-34-90119, а также в рамках государственного задания Минобрнауки России № 075-00326-19-00 по теме № АААА-А18-118022190098-9.
При проведении исследований использовали оборудование ЦКП “Агидель” УФИЦ РАН.
Список литературы
Варламов В.П., Ильина АВ., Шагдарова Б.Ц., Луньков А.П., Мысякина И.С. // Успехи биологической химии. 2020. Т. 60. С. 317–368.
Hamed I., Özogul F., Regenstein J.M. // Trends Food Sci. Technol. 2016. V. 48. P. 40–50. https://doi.org/10.1016/j.tifs.2015.11.007
Ghormade M., Pathan E.K., Deshpande M.V. // Int. J. Biol. Macromol. 2017. V. 104(B). P. 1415–1421. https://doi.org/10.1016/j.ijbiomac.2017.01.112
Куликов С.Н., Тюрин Ю.А., Фассахов Р.С., Варламов В.П. // ЖМЭИ. 2009. № 5. С. 91–97.
Yilmaz Atay H.Y. Functional Chitosan. / Ed. S. Jana, J. Subrata. Syngapore: Springer Nature, 2019. P. 457–489. https://doi.org/10.1007/978-981-15-0263-7_15
Герасименко Д.В., Авдиенко И.Д., Банникова Г.Е., Зуева О.Ю., Варламов В.П. // Прикл. биохимия и микробиология. 2004. Т. 40. № 3. С. 301–306.
Hosseinejad M., Jafari S.M. // Int. J. Biol. Macromol. 2016. V. 85. P. 467–475. https://doi.org/10.1016/j.ijbiomac.2016.01.022
Ilyina A.V., Tikhonov V.E., Albulov A.I., Varlamov V.P. // Process Biochem. 2000. V. 35. № 6. P. 563–568. https://doi.org/10.1016/S0032-9592(99)00104-1
Liaqat F., Eltem R. // Carbohydr. Polym. 2018. V. 184. № 15. P. 243–259. https://doi.org/10.1016/j.carbpol.2017.12.067
Liang S., Sun Y., Dai X. // Int. J. Mol. Sci. 2018. V. 19. № 8. 2197. P. 1–19. https://doi.org/10.3390/ijms19082197
Tokura S., Ueno K., Miyazaki S., Nishi N. // Macromol. Symp. 1997. V. 120. № 1. P. 1–9. https://doi.org/10.1002/masy.19971200103
Park Y., Kim M.H., Park S.C., Cheong H., Jang M.K., Nah J.W., Hahm K.S. // J. Microbiol. Biotechnol. 2008. V. 18. № 10. P. 1729–1734.
Lin S.-B., Lin Y.-C., Chen H.-H. // Food Chem. 2009. V. 116. № 1. P. 47–53. https://doi.org/10.1016/j.foodchem.2009.02.002
Sánchez Á., Mengíbar M., Rivera-Rodríguez G., Moerchbacher B., Acosta N., Heras A. // Carbohydr. Polym. 2017. V. 157. P. 251–257.
Jung W.-J., Park R.-D. // Mar. Drugs. 2014. V. 12. № 11. P. 5328–5356. https://doi.org/10.3390/md12115328
Aam B., Heggset E., Norberg A., Sǿrlie M., Vårum K., Ejsink V. // Mar. Drugs. 2010. V. 8. № 5. P. 1482–1517. https://doi.org/10.3390/md8051482
Актуганов Г.Э., Сафина В.Р., Галимзянова Н.Ф., Кузьмина Л.Ю., Гильванова Е.А., Бойко Т.Ф., Мелентьев А.И. // Микробиология. 2018. Т. 87. № 5. С. 599–609. https://doi.org/10.1134/S0026365618050026
Актуганов Г.Э., Галимзянова Н.Ф., Терегулова Г.А., Мелентьев А.И. // Прикл. биохимия и микробиология. 2016. Т. 52. № 5. С. 520–526. https://doi.org/10.7868/S0555109916050020
Sørlie M., Horn S.J., Vaaje-Kolstad G., Eijsink V.G.H. // React. Funct. Polym. 2020. V. 148. 104488. https://doi.org/10.1016/j.reactfunctpolym.2020.104488
Aktuganov G.E., Galimzianova N.F., Gilvanova E.A., Pudova E.A., Kuzmina L.Yu., Melentiev A.I., Safina V.R. // World J. Microbiol. Biotechnol. 2019. V. 35. № 2. 18. P. 1–13. https://doi.org/10.007/s11274-019-2590-4
Viens P., Lacombe-Harvey M.-E., Brzezinski R. // Mar. Drugs. 2015. V. 13. № 11. P. 6566–6587. https://doi.org/10.3390/md13116566
Ильина А.В., Варламов В.П., Мелентьев А.И., Актуганов Г.Э. // Прикл. биохимия и микробиология. 2001. Т. 37. № 2. С. 160–163. https://doi.org/10.1023/A:1002867412442
Pagnocelli M.G.B., De Araujo N.K., Da Silva N.M.P., De Assis C.F., Rodrigues S., De Macedo G.R. // Bras. Arch. Biol. Technol. 2010. V. 53. № 6. P. 1461–1468. https://doi.org/10.1590/S1516-89132010000600023
Hadwiger L.A., Ogawa T., Kuyama H. // MPMI. 1994. V. 7. № 4. P. 531–533. https://doi.org/10.1094/mpmi-7-0531
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


