Прикладная биохимия и микробиология, 2021, T. 57, № 5, стр. 441-449
Фотоокисление тетрагидробиоптерина – ключевой процесс фототерапии витилиго
Т. А. Телегина 1, 2, *, Ю. Л. Вечтомова 1, М. С. Крицкий 1, Э. И. Мадиров 2, 3, А. С. Низамутдинов 3, Ю. Н. Обухов 1, 2, А. А. Буглак 2
1 Институт биохимии им. А.Н. Баха, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Россия
2 Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Россия
3 Казанский федеральный университет
420008 Казань, Россия
* E-mail: telegina@inbi.ras.ru
Поступила в редакцию 02.04.2021
После доработки 12.04.2021
Принята к публикации 23.04.2021
Аннотация
В контексте патологии и терапии витилиго исследованы процессы автоокисления и фотоокисления тетрагидробиоптерина (Н4Бип) – кофермента, присутствующего в 3–5-кратном избытке при витилиго. Изучение кинетики автоокисления Н4Бип и ВЭЖХ анализ продуктов реакции показали, что автоокисление проходило интенсивно с константой скорости 1 × 10–3 с–1 с образованием дигидробиоптерина, дигидроптерина и их окисленных производных. Анализ данных по автоокислению привел к новому выводу о том, что окисление избытка Н4Бип в меланоцитах, очевидно, запускает автокаталитический цикл синтеза избытка пероксида водорода (Н2О2), который в свою очередь активирует интерферон-индуцибельную ГТФ-циклогидролазу, синтезирующую избыток Н4Бип. Автокаталитический цикл избыточного синтеза Н2О2, по-видимому, лежит в основе патологии витилиго. Избыток Н2О2 также частично расходуется для активации иммунной системы. Разорвать автокаталитический цикл можно путем перевода Н4Бип в димеры дигидроптерина при его УФ-фотоокислении. Исследована кинетика фотоокисления Н4Бип, идентифицированы продукты реакции и рассчитаны квантовые выходы образования димеров дигидроптерина. На основании данных по квантовым выходам построен спектр действия УФ-излучения, демонстрирующий, что диапазон 300–325 нм является эффективным для фототерапии витилиго.
Витилиго – это дерматологическое заболевание, характеризующееся образованием депигментированных пятен вследствие нарушения биосинтеза меланина [1–3]. Заболеваемость витилиго по странам колеблется от 0.1 до 4.0% [4–7]. Наблюдается рост заболеваемости этой болезнью, что определяет актуальность данного исследования. Витилиго является иммуноопосредованным, многофакторным заболеванием, в патоэтиологии которого важна генетическая предрасположенность, а также факторы внутренней и внешней среды. Первоначальный взгляд на витилиго как на аутоиммунное заболевание уступает место пониманию того, что иммунной атаке на меланоциты предшествуют внутренние процессы в самих пигмент-синтезирующих клетках.
Пусковой момент нарушений меланогенеза в меланоцитах, по-видимому, связан с функционированием тетрагидробиоптерина (Н4Бип) – кофермента фенилаланингидроксилазы (фенилаланин-4-монооксигеназа, КФ 1.14.16.1). В меланоцитах тирозин образуется при гидроксилировании фенилаланина с участием кофермента Н4Бип, далее тирозин с помощью медь-зависимой тирозиназы (КФ 1.14.18.1) преобразуется в диоксифенилаланин (ДОФА), и далее на пути к меланину образуется ДОФА-хром. При витилиго в меланоцитах фиксируется 3–5 кратный избыток Н4Бип, который ингибирует тирозиназу – ключевой фермент в синтезе меланина [2, 8–11].
Важным является то, что, будучи восстановленным соединением Н4Бип легко окисляется кислородом воздуха (автоокисление), как in vitro, так и in vivo [12]. Образование окисленных производных сопровождается образованием пероксида водорода (Н2О2). При витилиго в коже больных идентифицирован Н2О2 в миллимолярных концентрациях [11], т.е. имеет место окислительный стресс. В работе [13] было показано, что УФ облучение определенных диапазонов длин волн усиливает автоокисление за счет возбуждения самого Н4Бип (λmaxвозб. 298 нм), но в основном за счет возбуждения окисленного биоптерина, запускающего процесс фотосенсибилизированного окисления Н4Бип при облучении в области поглощения окисленного биоптерина (350 нм). Такое фотоокисление Н4Бип может приводить к накоплению Н2О2 и этим пролонгировать витилиго [13–15].
Метод УФВ-фототерапии, использующий средневолновый УФ (308 и 311нм) для лечения витилиго [11, 16], является наиболее успешным методом лечения витилиго, но механизм терапевтического эффекта долго оставался невыясненным. Предложена гипотеза и приведены аргументы в ее пользу, согласно которой главной мишенью УФВ-излучения является Н4Бип [17]. Впервые было показано образование димеров азоциклобутанового типа при УФВ-фотоокислении Н4Бип. Доказано фотообразование из Н4Бип димеров дигидроптерина ((Н2Птр)2).
Выяснение роли Н4Бип в патогенезе и фототерапии витилиго проведено далеко не в полном объеме и требует дальнейших исследований. Цель настоящей работы – изучение механизма фотоокисления Н4Бип: идентификация продуктов реакции и нахождение максимума в спектре действия УФ-излучения с целью оптимизации УФB-фототерапии витилиго.
МЕТОДИКА
Реактивы. 5,6,7,8-тетрагидро-L-биоптерин (Н4Бип), 7,8-дигидро-L-биоптерин (Н2Бип), дигидроксантоптерин (Н2Ксп), L-биоптерин (Бип), ксантоптерин (Ксп) и птерин (Птр) фирмы “Schirks Laboratories” (Швейцария). Остальные реактивы, использованные в работе, были получены от “Sigma-Aldrich” (США).
Приготовление образцов. В работе использовали растворы Н4Бип в 0.1 М Трис-HCl буфере, рН 7.2. Растворы готовили растворением сухого препарата Н4Бип непосредственно перед проведением эксперимента, концентрацию образцов определяли по молярному коэффициенту экстинкции (ε297 = 10200 М–1 см–1 для рН 7.0).
УФ-облучение. Свежеприготовленные растворы Н4Бип облучали при постоянном перемешивании на воздухе в 1 см кварцевой кювете, используя в качестве источника УФ-света спектрофлуориметр FluoroMax 4 (“Horiba Scientific”, Япония) или в кварцевой кювете 0.3 см, используя в качестве источника перестраиваемый УФ-лазер на активной среде LiLu0.7Y0.3F4:Ce + Yb.
Облучение на спектрофлуориметре проводили при длинах волн 300, 305, 308, 311, 315, 320, 325, 330, 335, 340 и 350 нм со спектральной шириной щели 20 нм в течение различных промежутков времени (1 или 2 мин). Темновые интервалы, в течение которых производили запись спектров облученных образцов, составляли 2 мин. Темновые контроли к опытам по облучению ставили параллельно к каждому опыту. В темновых контролях протекал только процесс автоокисления Н4Бип.
В работе использовался перестраиваемый УФ-лазер на основе кристалла LiLu0.7Y0.3F4, активированного ионами Ce3+ и Yb3+. В качестве источника накачки применялся лазер на кристалле LiCaAlF6, активированном ионами Ce3+ (290 нм), источником возбуждения для которого в свою очередь служило 266 нм излучение 4-ой гармоники лазера YAG:Nd (LQ529B) “SolarLS” (Беларусь). Образец облучался лазером на длинах волн 290, 300, 308, 310, 312, 325 и 330 нм. Условия проведения эксперимента аналогичны облучению на спектрофлуориметре.
Концентрация димеров дигидроптерина определялась по изменению в поглощении полосы в области 245 нм и рассчитывалась с учетом коэффициента экстинкции (ε245 = 37000 М–1 см–1 для рН 7).
Методы исследования. Запись спектров поглощения темновых контролей и облучаемых образцов проводили на спектрофотометре Shimadzu UV-1601 (Япония) или Cary 300 Bio (“Varian”, США) в Центре коллективного пользования ФИЦ “Биотехнологии” РАН. Плотность мощности (Вт · м–2) излучения, поглощаемого образцом, измеряли радиометром Аргус-04 (“ВНИИОФИ”, Россия).
ВЭЖХ анализ продуктов реакции проводили на катионообменной колонке Luna 5u SCX 100A (“Phenomenex”, США). Подвижная фаза содержала 0.1 М Na-цитратный буфер рН 2.7, предварительно дегазированый, продуваемый аргоном во время проведения хроматографии. Скорость потока 0.4 мл · мин–1, время анализа 40 мин. Время выхода веществ устанавливали по времени выхода свидетелей – препаратов Н4Бип и его окисленных производных. Свидетеля – дигидроптерина не было, так как это соединение неустойчиво и не производится ни одной фирмой. Детекцию продуктов реакции проводили с помощью трех детекторов подключенных последовательно: спектрофотометрического (267 нм), флуориметрического (λвозб 330 нм, λфлуор 440 нм) и электрохимического (+0.7 В). Такое подключение детекторов позволяло наиболее точно установить продукты реакции, поскольку все они имели разную степень окисления и флуоресцентные свойства.
Для проведения анализа аликвота образца смешивалась в соотношении 1 : 1 с раствором 0.1 М цитрата натрия рН 2.4, результирующее рН 2.7 соответствовало рН подвижной фазы на колонке. Далее раствор хранился при температуре 4°С до проведения анализа. В кислой среде все продукты реакции переходят в катионную форму, которая является более устойчивой к окислению, что позволяло разделять продукты реакции на катионобменной колонке и избежать дальнейшего окисления продуктов реакции.
Расчет квантового выхода фотореакции. Квантовый выход образования димера дигидроптерина (Н2Птр)2 рассчитывали по формуле:
где ∆A – изменение концентрации облучаемого раствора при 245 нм в единицах оптической плотности;V – объем облучаемого раствора в литрах;
Na – число Авогадро, моль–1;
τ – время облучения, с;
l – толщина поглощающего слоя, см;
In – интенсивность поглощаемого света, квант/с;
ΔЕ – разность молярных коэффициентов экстинкции димера дигидроптерина и Н4Бип при 245 нм.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Автоокисление тетрагидробиоптерина. Н4Бип является высокоактивным восстановленным соединением, которое подвержено спонтанному автоокислению молекулярным кислородом как in vivo, так и in vitro в водных растворах [12]. Как видно из рис. 1 первым продуктом автоокисления является неустойчивый 6,7-хиноноидный дигидробиоптерин (qН2Бип) со временем жизни 1.5 мин. Затем он изомеризуется в более стабильный Н2Бип или трансформируется в Н2Птр с отрывом бокового радикала-дигидроксипропила. Далее Н2Бип переходит в полностью окисленную форму – биоптерин, а неустойчивый дигидроптерин (Н2Птр) окисляется кислородом до птерина или до Н2Ксп.
Рис. 1.
Схема автоокисления Н4Бип. В скобках указаны длинноволновые максимумы в спектрах поглощения [17].

В зависимости от рН среды, температуры и природы буфера будет преобладать Н2Бип или Н2Птр и их полностью окисленные формы. В серии экспериментов по исследованию темновых процессов автоокисления спектрофотометрически показано, что по мере протекания процесса убывает полоса поглощения Н4Бип (297 нм) и нарастает поглощение в области 275–280 нм и в области 325–340 нм, которые характеризуют накопление Н2Бип, Н2Птр, Бип и Птр (рис. 2). Изучение кинетики автоокисления показало, что процесс идет довольно интенсивно с константой скорости 1 × 10–3 с–1. Уточнение характера окисления Н4Бип в условиях эксперимента и количественное определение продуктов темнового автоокисления было проведено методом ВЭЖХ (рис. 3). Как видно из рис. 3 в результате ВЭЖХ анализа установили образование Н2Бип, Бип и Птр при проведении автоокисления Н4Бип в течение 30 мин. Полученные результаты говорят о том, что за столь короткий промежуток времени может протекать довольно глубокое автоокисление Н4Бип с образованием дигидро- и полностью окисленных птериновых производных. Об образовании неустойчивого Н2Птр при окислении Н4Бип свидетельствует идентифицированный на хроматограмме продукт его дальнейшего спонтанного окисления – Птр.
При этом на всех этапах окисления идет образование Н2О2. Благодаря процессам автоокисления 3–5-кратного избытка Н4Бип, имеющего место при витилиго, в коже накапливается Н2О2 в миллимолярных концентрациях, ведущих к окислительному стрессу. Н2О2 при посредстве цитокинов, в частности γ-интерферона, может активировать ГТФ-циклогидролазу (КФ 3.5.4.16), синтезирующую избыточное количество Н4Бип, который неизбежно будет автоокисляться с образованием Н2О2. Можно предположить, что, таким образом, может запускаться автокаталитический цикл избыточного синтеза Н2О2 при витилиго. Известно, что одной из функций активных форм кислорода, в частности Н2О2, является индукция иммунной системы. Действительно при витилиго активируются системы гуморального и клеточного иммунитета, ведущие к уменьшению количества меланоцитов, продуцирующих меланин.
Рис. 2.
Изменение во времени спектров поглощения раствора 1.42 × 10–4 М Н4Бип в 0.1 М Трис-HCl буфере рН 7.2 в присутствии кислорода воздуха. 1 – исходный раствор, 2 – через 15 мин, 3 – через 30 мин. На врезке разностные спектры (время в темноте – 0 мин).
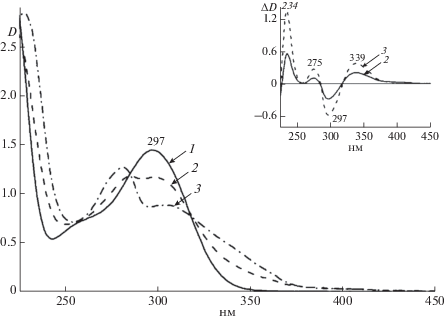
Рис. 3.
ВЭЖХ-анализ продуктов окисления 1.42 × × 10–4 М Н4Бип (0.1 М Трис-НCl буфер, рН 7.2) через 30 мин в темноте. 1 – спектрофотометрический детектор (267 нм); 2 – электрохимический детектор (+0.7 В); 3 – флуориметрический детектор (λвозб. 330 нм, λфлуор. 440 нм).

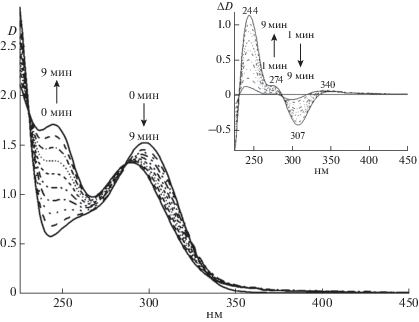
Фотоокисление Н4Бип. Было проведено несколько серий опытов по фотоокислению Н4Бип, в которых изменяли длину волны возбуждающего света. В сериях опытов, в которых изменяющейся величиной была длина волны УФ, раствор Н4Бип облучали ультрафиолетовым излучением с различными длинами волн в интервале 300–350 нм. Каждая отдельно взятая длина волны имела разброс в 10 нм, который обеспечивался спектральной шириной щели в 20 нм в спектрофлуориметре, используемом нами в качестве источника УФ-света. На рис. 4 приведены результаты опыта по облучению раствора 1.46 × 10–4 М Н4Бип в Трис-HCl (рН 7.2) излучением с длиной волны 325 ± 10 нм, при этом интервал облучения составлял 1 мин, а темновой интервал между облучениями составлял 2 мин. На разностном спектре поглощения (рис. 4, врезка) можно видеть, что по мере облучения убывало соединение с максимумом длинноволнового поглощения при 307 нм и нарастало поглощение в области 245 нм, а также перегиб в области 275 нм. Это может указывать на убыль промежуточного межмолекулярного комплекса хиноноидный дигидроптерин-дигидроптерин (qН2Птр-Н2Птр) и нарастание количества образующегося (Н2Птр)2. Промежуточный межмолекулярный комплекс может образовываться при донорно-акцепторных взаимодействиях бензоидной формы дигидроптеринов (Н2Птр или Н2Бип) с хиноноидной формой дигидроптеринов (qН2Птр или qН2Бип). Образующийся межмолекулярный комплекс имеет, очевидно, поглощение с максимумом при 307 нм, что выявлено по появлению полосы при 307 нм в спектре четвертой производной спектра поглощения исходного Н4Бип. Именно полоса поглощения с максимумом 307 нм убывала при проведении фотоокисления Н4Бип при всех исследуемых длинах волн в интервале 300–350 нм.
Рис. 4.
Изменение спектров поглощения раствора 1.46 × 10–4 М Н4Бип в 0.1М Трис-HCl буфере рН 7.2 при ступенчатом облучении 325 ± 10 нм на флуориметре в присутствии кислорода воздуха. На врезке – разностные спектры (время облучения – 0 мин).
В качестве примера опытов по облучению с помощью перестраиваемого УФ-лазера растворов 1.07 × 10–4 М Н4Бип в Трис-HCl буфере рН 7.2 (световые интервалы 2 мин и темновые интервалы по 2 мин) приведены результаты опыта, когда облучение проводили при длине волны 325 нм (рис. 5). На рис. 5 можно видеть, что по мере облучения также падает поглощение в области 306 нм и возрастает поглощение в области 245 и 274 нм, что свидетельствует об образовании (Н2Птр)2 из промежуточного межмолекулярного комплекса. Смещение максимума при 245 нм в сторону 239 нм на разностном спектре (рис. 5, врезка) говорит о том, что в растворе по мере облучения накапливались также продукты темнового окисления Н4Бип. ВЭЖХ анализ продуктов фотореакции показал, что действительно в системе образовывались (Н2Птр)2 и продукты окисления. Это можно объяснить тем, что при проведении опытов по облучению лазером не использовалась мешалка и, по-видимому, не весь объем раствора попадал под облучение. В целом полученные данные также свидетельствовали об образовании промежуточного межмолекулярного комплекса qН2Птр-Н2Птр (λmax 307 нм), в котором при облучении поглощала молекула хиноноидной формы дигидроптерина и молекула Н2Птр (λmax 325 нм) с преобладанием поглощения УФ-излучения хиноноидной или бензоидной формой Н2Птр в зависимости от длины волны света, используемого для инициирования фотопроцесса.
Рис. 5.
Изменение спектров поглощения раствора 1.07 × 10–4 М Н4Бип в 0.1 М Трис-HCl буфере рН 7.2 при ступенчатом облучении 325 на перестраиваемом лазере в присутствии кислорода воздуха: 1 – 0 мин; 2 – 2 мин; 3 – 4 мин; 4 – 6 мин; 5 – 8 мин; 6 – 10 мин; 7 – 12 мин. На врезке – разностный спектр (время облучения – 0 мин).

При витилиго в меланоцитах накапливается 3–5-кратный избыток Н4Бип. Проводя УФ облучение депигментированных участков кожи можно добиться удаления избытка Н4Бип и этим разорвать автокаталитический цикл синтеза избытка Н2О2 и способствовать предотвращению дальнейшего развития патологического процесса.
ВЭЖХ анализ продуктов фотоокисления. Разработан метод ВЭЖХ анализа для разделения и идентификации продуктов автоокисления и фотоокисления Н4Бип с использованием катионообменной колонки Luna 5u SCX после перевода неустойчивых продуктов реакции и исходного Н4Бип в более устойчивые катионные формы. На рис. 6 представлена типичная хроматограмма образца, полученного после облучения 1.4 × 10–4 М Н4Бип излучением 320 ± 10 нм в течение 16 мин. Можно видеть, что среди продуктов преобладал (порядка 90%) димер дигидроптерина, который в отличие от других продуктов реакции не флуоресцирует и не дает сигнала на электрохимическом детекторе в данных условиях. Среди других продуктов реакции можно видеть небольшое количество продуктов окисления Н4Бип: Н2Бип, Бип, Птр и Ксп.
Рис. 6.
ВЭЖХ анализ продуктов фотоокисления 1.4 × × 10–4 М Н4Бип (0.1М Трис-НCl буфер, рН 7.2) при облучении 320 ± 10 нм в течение 16 мин. 1 – спектрофотометрический детектор (267 нм); 2 – флуориметрический детектор (λвозб 330 нм, λфлуор 440 нм); 3 – электрохимический детектор (+0.7 В).

Расчет квантовых выходов образования димера дигидроптерина. Поскольку квантовый выход характеризует эффективность фотопроцесса, рассчитывали квантовые выходы образования (Н2Птр)2 при фотоокислении Н4Бип. В табл. 1 приведены результаты расчета квантовых выходов для серии опытов, в которой для возбуждения использовали излучение с длинами волн 308 ± 10, 320 ± 10, 330 ± 10 и 350 ± 10 нм. Из полученных результатов можно заключить, что эффективность фотохимического процесса в случае применения излучения с длиной волны 308 нм было максимальным. Квантовый выход при длине волны 308 нм, практически в 6 раз выше квантового выхода продукта реакции – (Н2Птр)2, образующегося при использовании для фотовозбуждения света с длиной волны 350 нм. Полученные результаты можно объяснить тем, что использованная нами длина волны 308 нм совпадала с максимумом спектра поглощения (307 нм) промежуточного молекулярного комплекса (qН2Птр-Н2Птр). При этом при 308 нм поглощал как хиноноидный дигидроптерин, имеющий очень широкий спектр с λмах 301 нм, так и дигидроптерин (λмах 325 нм при ширине спектра около 50 нм на полувысоте), внося некоторую прибавку в суммарный квантовый выход с учетом молярного коэффициента экстинкции. При длине волны 350 нм в составе молекулярного комплекса дигидроптерин поглощал на уровне полувысоты своего спектра, а хиноноидный дигидроптерин ниже полувысоты и этим объясняется значительное снижение квантового выхода.
Таблица 1.
Квантовый выход образования димеров дигидроптерина
| Длина волны, нм | Интенсивность поглощаемого света, Вт/м2 | ∆A245, ед. оптич. плотности за 6 мин облучения | Квантовый выход (Φ), молекул/квант |
|---|---|---|---|
| 308 | 41.4 | 1.7043 | 2.33 × 10–2 |
| 320 | 62.4 | 1.5075 | 1.32 × 10–2 |
| 330 | 85.0 | 1.6187 | 1.02 × 10–2 |
| 350 | 162.0 | 1.3526 | 4.10 × 10–3 |
Построение спектра действия. Для построения спектра действия УФ излучения в реакции образования димеров дигидроптерина использовали данные по квантовым выходам продукта реакции при действии УФ излучения в диапазоне 300–335 нм. На рис. 7 приведена зависимость квантового выхода от длины волны УФ излучения, используемого для проведения процесса фотоокисления Н4Бип. Можно видеть, что квантовый выход образования димеров падает по мере возрастания длины волны возбуждающего излучения и при этом падение не гладкое, а имеется два перегиба. Первый перегиб наблюдается в области 308 нм и второй перегиб в области 320–325 нм. Можно сделать вывод, что излучение в этих областях длин волн сильнее инициирует процесс фотообразования димеров в сравнении с излучением соседних длин волн. Полученный спектр действия показывает, что максимальная эффективность фотоокисления Н4Бип с образованием димеров (Н2Птр)2 достигается при облучении в области максимального поглощения qН2Бип (λmax 301 нм), имеющего довольно высокий молярный коэффициент поглощения (ε301 = 8700) [18]. Перегибы на спектре действия отражают вклад в эффективность фотопроцесса за счет поглощения света обеими частями межмолекулярного комплекса (qН2Птр-Н2Птр) (λmax 307 нм) и вклад за счет поглощения Н2Птр в области максимума поглощения (λmax 325 нм). Облучение Н4Бип с использованием лазера, имеющего спектральную ширину излучения 1 нм, подтвердило полученный спектр действия и показало, что квантовый выход образования (Н2Птр)2 при облучении длиной волны 290 нм ниже квантового выхода при 300 нм. Полученный спектр действия указывает диапазон длин УФ излучения, который может быть наиболее эффективным для использования в фототерапии витилиго. Различие в квантовых выходах менее чем в 2 раза в диапазоне длин волн 300–325 нм указывает на применимость этих длин волн для инициирования фотоокисления Н4Бип и это позволяет расширить арсенал источников УФ для фототерапии витилиго. В настоящее время для фототерапии витилиго используется УФВ излучение эксимерного лазера (308 нм) и излучение 311 нм эмиссионного спектра паров ртути в специальных лампах. Оба эти устройства генерируют УФВ излучение в области первого перегиба на кривой спектра действия и, по-видимому, этим можно объяснить эффективность УФВ фототерапии витилиго.
Рис. 7.
Зависимость квантового выхода образования димеров дигидроптерина от длины волны УФ излучения, используемого для проведения процесса фотоокисления Н4Бип.

В целом, полученные экспериментальные данные по изучению процесса автоокисления Н4Бип и данные литературы по его избыточному синтезу при витилиго позволяют заключить, что в основе патологии витилиго лежит формирование автокаталитического цикла избыточного синтеза Н2О2. Очевидно, что при УФВ-фототерапии витилиго будет разрываться автокаталитический цикл избыточного синтеза Н2О2 за счет удаления избыточного количества Н4Бип в виде (Н2Птр)2. Следовательно, такая УФВ-терапия будет способствовать восстановлению процесса меланогенеза. Условием успешного восстановления процесса меланогенеза является удаление избытка Н2О2, образующегося в миллимолярных концентрациях в меланоцитах при витилиго, создающего условия окислительного стресса и активирующего иммунную систему. В условиях окислительного стресса Н2О2 может запускать автокаталитический цикл через цитокины, в частности интерферон, который активирует интерферон-индуцибельный фермент – ГТФ-циклогидролазу, синтезирующую избыток Н4Бип. Таким образом, может замыкаться автокаталитический цикл. В связи с этим лучшие результаты терапии витилиго могут быть получены, когда одновременно с УФВ-терапией применяют антиоксидантную терапию для удаления Н2О2 и предотвращения его накопления в меланоцитах. Так, например, хорошие результаты комплексной терапии достигают при применении УФВ-терапии и псевдокаталазы, разлагающей Н2О2 [11, 16]. Дальнейшее развитие работ в этом направлении необходимо как для совершенствования методов терапии витилиго, так и для получения фундаментальных знаний об аутоиммунном ответе при витилиго, когда избыток Н2О2 активирует иммунную систему организма.
Работа поддержана грантом РНФ № 20-73-10029.
Список литературы
Schallreuter K.U., Wood J.M., Pittelkow M.R., Gutlich M., Lemke K.R., Rödl W., Swanson N.N., Hitzemann K., Ziegler I. // Science. 1994. V. 263. № 5152. P. 1444–1446.
Schallreuter K.U., Moore J., Wood J.M., Beazley W.D., Peters E.M., Marles L.K., Behrens-Williams S.C., Dummer R., Blau N., Thony B. // J. Invest. Dermatol. 2001. V. 116. № 1. P. 167–174.
Bidaki R., Majidi N., Moghadam Ahmadi A., Bakhshi H., Sadr Mohammadi R., Mostafavi S.A., Kazemi Arababadi M., Hadavi M., Mirzaei A. // Clin. Cosmet. Investig. Dermatol. 2018. V. 11. P. 383–386.
Cho H.K., Eun L.Y., Song J.S., Kang W.H., Ro B.I. // Ann. Dermatol. 2009. V. 21. № 1. P. 75–77.
Park J.M., Kim H.J., Bae B.G., Park Y.K. // Ann. Dermatol. 2009. V. 21. № 3 P. 330–333.
Hedayat K., Karbakhsh M., Ghiasi M., Goodarzi A., Fakour Y., Akbari Z., Ghayoumi A., Ghandi N. // Health Qual. Life Outcomes. 2016. V. 14. № 86. https://doi.org/10.1186/s12955-016-0490-y
Morales-Sánchez M.A., Vargas-Salinas M., Peralta-Pedrero M.L., Olguín-García M.G., Jurado-Santa Cruz F. // 2017. V. 108. № 7. P. 637–642.
Hasse S., Gibbons N.C., Rokos H., Marles L.K., Schallreuter K.U. // J. Invest. Dermatol. 2004. V. 122. № 2. P. 307–313.
Eskandani M., Golchai J., Pirooznia N., Hasannia S. // Indian J. Dermatol. 2010. V. 55. № 1. P. 15–19.
Spencer J.D., Gibbons N.C., Rokos H., Peters E.M., Wood J.M., Schallreuter K.U. // J. Invest. Dermatol. 2007. V. 127. № 2. P. 411–420.
Schallreuter K.U., Salem M.A., Holtz S., Panske A. // FASEB J. 2013. V. 27. № 8. P. 3113–3122.
Kaufman S. // Proc. Natl. Acad. Sci. USA 1963. V. 50. № 6. P. 1085–1093.
Buglak A.A., Telegina T.A., Lyudnikova T.A., Vechtomova Y.L., Kritsky M.S. // Photochem. Photobiol. 2014. V. 90. № 5. P. 1017–10126.1.
Buglak A.A., Telegina T.A., Kritsky M.S. // Photochem. Photobiol. Sci. 2016. V. 15. № 6. P. 801–811.
Buglak A.A., Telegina T.A. Vorotelyak E.A., Kononov A.I. // J. Photochem. Photobiol. A. 2019. V. 372. P. 254–259.
Gawkrodger D.J. // Br. J. Dermatol. 2009. V. 161. № 4. P. 721–722.
Telegina T.A., Lyudnikova T.A., Buglak A.A., Vechtomova Y.L., Biryukov M.V., Demin V.V., Kritsky M.S. // J. Photochem. Photobiol. A. 2018. V. 354. P. 155–162.
Davis M.D., Kaufman S. // J. Biol. Chem. 1989. V. 264. № 15. P. 8585–8596.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


