Прикладная биохимия и микробиология, 2022, T. 58, № 3, стр. 264-272
Продукция диадиноксантина в интенсивной культуре диатомовой водоросли Cylindrotheca closterium (Ehrenb.) Reimann et Lewin. и его проапоптотическая активность
Р. Г. Геворгиз 1, *, М. А. Гуреев 2, **, С. Н. Железнова 1, Е. В. Гуреева 1, М. В. Нехорошев 1
1 Федеральный исследовательский центр “Институт биологии южных морей
им. А.О. Ковалевского” РАН
299011 Севастополь, Россия
2 Первый Московский Государственный Медицинский Университет им. И.М. Сеченова,
Центр цифрового биодизайна и персонализированной медицины
119991 Москва, Россия
* E-mail: r-gevorgiz@yandex.ru
** E-mail: max_technik@mail.ru
Поступила в редакцию 29.04.2021
После доработки 29.08.2021
Принята к публикации 02.09.2021
- EDN: QPYCFU
- DOI: 10.31857/S0555109922010032
Аннотация
Изучена продукция диадиноксантина в интенсивной культуре Cylindrotheca closterium, а также его цитостатическая активность методами молекулярного моделирования и исследованиями на культурах опухолевых клеток человека: OVCAR5, OVCAR8, KURAMOCHI и OVSAHO. По результатам как вычислительного эксперимента, так и эксперимента с культурами клеток диадиноксантин демонстрирует более низкую активность по сравнению с фукоксантином (более чем в 4 раза). Величина IC50 диадиноксантина достигалась при >100 мкМ, в то время как фукоксантин проявлял цитостатическое действие в пределах 18.75 мкМ. В проточной культуре Cylindrotheca closterium продукция диадиноксантина может превышать продукцию фукоксантина в 14 раз, что может сделать технологию его получения менее затратной и существенно снизить себестоимость лечебно-профилактических препаратов на основе микроводорослей.
Морская диатомовая водоросль Cylindrotheca closterium является источником целого ряда биологически активных веществ, которые представляют большой интерес для современной медицины и биотехнологии [1–3]. Особый интерес представляют каротиноиды морского генезиса, поскольку их биологическая активность позволяет создавать высокоэффективные препараты для профилактики и лечения тяжелых заболеваний. Например, фукоксантин (Fx), доля которого в биомассе C. closterium достигает 2% от сухой массы, являясь уникальным каротиноидом с алленовой связью проявляет высокую противоопухолевую активность [3, 4], а также цитотоксическую активность по отношению к клеткам рака простаты PC-3, DU145 и LNCap [5, 6], индуцирует апоптоз лейкозных клеток HL-60 и клеток рака толстой кишки Caco-2, HT-29 и DLD-1 [5–7], останавливая клеточный цикл в клетках GOTO нейробластомы и др.
Технология получения Fx в интенсивной культуре микроводорослей, как правило, основана на двухстадийном накопительном культивировании [8, 9]: на первом этапе культивирования (экспоненциальная фаза роста) происходит накопление биомассы, а на втором (стационарная фаза роста) – биосинтез Fx. Накопление Fx наблюдается в условиях стресса, например при лимитировании роста биогенными элементами, поэтому именно условия второго этапа культивирования определяют количество синтезируемого Fx в клетках. Однако существенным недостатком двухстадийного накопительного культивирования является гибель немалой части клеток микроводорослей в условиях стресса, поскольку в клетках микроводорослей происходят множество неустойчивых и неуправляемых деструктивных процессов, что в значительной мере снижает предсказуемость накопления Fx в технологическом процессе и эффективность технологии получения целевого продукта в целом.
Известно, что Fx является побочным продуктом диадиноксантинового цикла у диатомовых водорослей [10, 11]. Именно при неблагоприятных условиях окружающей среды из диадиноксантина (Ddx) синтезируется Fx, что обуславливает накопление Ddx в экспоненциальной фазе, а Fx в стационарной фазе роста. Такая физиологическая особенность диатомовых водорослей дает возможность при разработке промышленной технологии получения Ddx этап создания стрессовых условий исключить, что в значительной мере ее упрощает и удешевляет, а также повышает эффективность процесса.
Несмотря на достаточно большое количество публикаций, посвященных исследованию проапоптотической активности каротиноидов морских организмов [12–16], данные об активности Ddx в литературе до сих пор отсутствуют.
Цель работы – изучение продукции Ddx в интенсивной культуре диатомовой водоросли C. closterium и оценка цитостатического эффекта Ddx методами молекулярного моделирования, а также на культурах опухолевых клеток человека.
МЕТОДИКА
Условия культивирования. C. closterium, полученную из коллекции культур ФИЦ Институт биологии южных морей РАН выращивали в фотобиореакторах плоскопараллельного типа с рабочим объемом 3 л и толщиной рабочего слоя 5 см, при температуре 20 ± 1○С, при круглосуточном освещении белыми люминесцентными лампами CЄPIL1LF36W/54-765-2450 lm, которые на рабочей поверхности давали 150 мкмоль квантов/(м2 · с) (33 Вт/м2). Культуру выращивали в накопительном режиме на питательной среде RS, приготовленную на стерильной черноморской воде, следующего состава (г/л): NaNO3 – 0.75, NaH2PO4·2H2O – 0.0641, Na2SiO3·9H20 – 0.386, Na2ЭДТА – 0.0872, FeSO4·7H2O – 0.05, CuSO4·5H2O – 0.2 × 10–3, ZnSO4·7H2O – 0.44 × 10–3, CoCl2·6H2O – 0.2 × 10–3, MnCl2·4H2O – 0.36 × 10–3, NaMoO4·H2O – 0.12 × × 10–3 [17]. В процессе выращивания культуру барботировали воздухом (1.5 л воздуха на литр культуры в минуту).
Измерение плотности культуры микроводорослей приводили путем взвешивания сырой массы C. сlosterium в полипропиленовых пробирках с погрешностью 0.1 мг после осаждения клеток центрифугированием при 1600 g в течение 2 мин. Для пересчета полученных данных на сухую массу использовали коэффициент связи между сухой и сырой массой (k = 0.1) [18].
Fx и Ddx в биомассе C. сlosterium определяли по разработанной нами ранее методике [19]. Коэффициент экстинкции $\left( {{\text{E}}_{{{\text{1cm}}}}^{{{\text{1}}\% }}} \right)$ для Ddx в ацетоне принимали равным 2230 мл/(мг · см) при 448 нм [20], а для фукоксантина в спирте – 1280 мл/(мг · см) при 448 нм [21].
Выделение каротиноидов. Для получения Fx и Ddx в кристаллической форме предварительно проводили трехкратную экстракцию липидов смесью Фолча из 30 г сырой массы C. closterium (3 г сухой массы) с концентрацией Fx и Ddx 7 и 1.5 мг/г сухой массы соответственно. При первой экстракции использовали 100 мл смеси Фолча в соотношении спирт-хлороформ 1 : 1. Две последующих экстракции проводили смесью Фолча объемом по 50 мл в соотношении спирт-хлороформ 1 : 2 до полного обесцвечивания биомассы.
Все экстракты объединяли и трехкратно промывали дистиллированной водой в соотношении 1 : 3 для удаления нелипидных примесей. Хлороформную фракцию упаривали на роторном испарителе при температуре 30°С. Концентрат липидов хроматографировали на колонке (диаметр 1.5 см, высота 22 см). В качестве носителя использовали силикагель марки Lachema 100/250 мкм. Элюировали смесью гексан–ацетон в соотношении 7 : 3. Полученную фракцию Fx и Ddx в дальнейшем перекристаллизовывали из смеси диэтилового эфира-гексана или хлористого метилена-гексана. Выделившиеся кристаллы Fx и Ddx промывали гексаном и высушивали в потоке аргона. Было получено 13 мг кристаллического Fx и 2.5 мг кристаллического Ddx, при этом потери Fx при кристаллизации составили 38.1%, а Ddx – 45.5%.
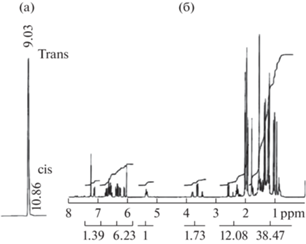
Каротиноиды идентифицировали по известным величинам Rf и спектральным (UV-Vis) характеристикам [20, 22, 23]. Отношение полос поглощения (III/II) для Ddx составляло 90% и совпадало с данными литературы [20]. Кристаллический Fx был также охарактеризован методами ВЭЖХ, масс- и ЯМР-спектроскопии. Изомеры Fx разделяли на жидкостном хроматографе высокого давления Shimadzu LC–6АD (Shimadzu, Япония), снабженного колонкой длиной 250 мм. Внутренний диаметр колонки 4.6 мм, неподвижная фаза − силикагель, растворитель ацетон-гексан (3 : 7), скорость подачи элюанта 1 мл/мин, регистрация при 450 нм. Спектры протонного магнитного резонанса (HNMR, 500 МГц) снимали на Varian UNITY INOVA 500 (Varian, США) в дейтерохлороформе, в качестве внутреннего стандарта использовали тетраметилсилан (TMS). Масс-спектры (Fast Atom Bombardment MS) получены на спектрометре JEOL JMS HX 110 Å (JEOL, Япония) на матрице из мета-нитробензилового спирта. На рис. 1а представлены данные препаративного разделения изомеров кристаллического Fx. После перекристаллизации Fx из хлористого метилена-гексана соотношение изомеров составило 99:0.5. Спектр протонного магнитного резонанса кристаллического Fx (рис. 1б) соответствует all-trans Fx, который был описан ранее [24]. Основные пики масс-спектра: m/z 681.4078 [M + Na]+m/z 659.4272 [M + H]+m/z 641.4172 [MH-18]+ идентичны для Fx. Спектры в ультрафиолетовой и видимой областях (UV-VIS) в метаноле соответствовали all-trans Fx и совпадали с литературными данными [25].
Рис. 1.
ВЭЖХ изомеров кристаллического фукоксантина после перекристаллизации фукоксантина из хлористого метилена–гексана (а), спектр протонного магнитного резонанса (´HNMR) кристаллического фукоксантина (б).
Молекулярный докинг. Молекулярный докинг проводили в программе Glide [26]. Структура белка HER2 загружена из базы данных RCSB Protein DataBank [27] (номер структуры: 3RCD). Перед проведением расчетов модель белка прошла проверку на наличие ошибок и дефектов с применением модуля Protein PrepWizard [28]. Для исследуемых малых молекул проведена генерация трехмерных координат в силовом поле OPLS3e с использованием модуля LigPrep [28].
Область докинга малых молекул построена на основе центроида координат лиганда в модели белка HER2. Ввиду больших размеров исследуемых лигандов, размер грани кубической области докинга составил 23 ангстрем. Процедура молекулярного докинга проводилась без каких-либо позиционных ограничений. Для каждого лиганда отобраны 20 решений докинга (укладок). Релевантность метода докинга проверена путем повторного докинга контрольного лиганда (представлен в рассматриваемой модели белка HER2) в активную полость. Среднеквадратичное отклонение (RMSD) лучшей расчетной укладки от данных рентгеноструктурного анализа составило 0.23. Оценка результатов молекулярного докинга проводилась путем сравнения показателей скоринг-функции GlideScore и Emodel.
Клеточные линии. Для экспериментов использованы следующие клеточные линии опухолевых клеток (рак яичников человека): OVCAR5 (CVCL_1628), OVCAR8 (CVCL_1629), KURAMOCHI (CVCL_1345) и OVSAHO (CVCL_3114) [https:// web.expasy.org/cellosaurus/]. Образцы клеточных линий получены из банка клеток American Type Culture Collection (ATCC), культивировали при 37°C в атмосфере с 5% CO2 в увлажненном инкубаторе в соответствии с инструкциями поставщика. Культуры клеток выращивали с избытком, с целью оценки уровня заражения микоплазмой с использованием специализированного ПЦР-теста. Используемая среда для культивирования – RPMI (“Lonza”, Швейцария).
Исследование выживаемости. Исследуемые соединения (Fx, Ddx) приготовлены в виде растворов с шестью разными концентрациями: 5, 10, 15, 50, 100 мкМ/л. Каждая концентрация в четырех повторностях. Растворы размещены в 384-луночных планшетах (“Corning”, США) с использованием жидкостного автодозатора Echo 550 (“Labcyte”, США). В качестве негативного контроля использован 0.1% раствор ДМСО и 100 мкМ/л раствор бензетония хлорида соответственно. В ячейки планшета с растворами Fx и Ddx добавлено по 50 мкл суспензии клеток, что соответствовало плотности 1000 кл. на ячейку. После 72 ч инкубирования проведен анализ выживаемости клеток и цитотоксичности. Реагент CellTiter-Glo (“Promega”, Германия) добавляли по 25 мкл в каждую лунку, люминесценцию регистрировали после 10-минутной выдержки при комнатной температуре с помощью ридера PheraStar (“BMG Labtech”, Германия). Выживаемость клеток рассчитывали путем нормализации позитивного и негативного контролей по следующей формуле:
(1)
${\text{Выживаемость}} = \frac{{{\text{CT}}{{{\text{G}}}_{{{\text{drug}}}}} - {\text{CT}}{{{\text{G}}}_{{{\text{benz}}}}}}}{{{\text{CT}}{{{\text{G}}}_{{{\text{DMSO}}}}} - {\text{CT}}{{{\text{G}}}_{{{\text{benz}}}}}}},$Все измерения проводили в четырех аналитических повторностях. На рисунках приведены средние значения и среднеквадратическое отклонение. Для расчета доверительных интервалов использовали t-критерий Стьюдента для 95% вероятности.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В эксперименте накопительная культура C. closterium характеризовалась достаточно высокими продукционными показателями. Лаг-фаза практически отсутствовала, экспоненциальная фаза роста длилась 5 сут, стационарная фаза роста – с 5 по 11 сут, после чего культура переходила в фазу отмирания (рис. 2а). В экспоненциальной фазе роста в биомассе C. closterium наблюдалось накопление преимущественно Ddx, к концу стационарной фазы роста накапливался Fx (рис. 2б). Средняя скорость биосинтеза Ddx в экспоненциальной фазе роста составила 1.22 мг/(л·сут). За все время накопительного культивирования средняя скорость биосинтеза Fx составила 0.636 мг/(л · сут). Таким образом, очевидно, что получение Ddx на основе накопительной культуры C. closterium занимает вдвое меньше времени, чем Fx. Кроме того, поскольку накопление Ddx наблюдалось именно в активно растущей культуре, еще больший выход в единицу времени возможен в проточной культуре, например, хемостате.
Рис. 2.
Динамика плотности накопительной культуры C. closterium в эксперименте (а) (линией отмечена аппроксимация данных уравнением (2) в экспоненциальной фазе роста); (б) – концентрация диадиноксантина (1) и фукоксантина (2) в экспоненциальной и стационарной фазах роста.

Для предельной оценки продуктивности C. closterium и скорости биосинтеза Ddx в хемостате аппроксимировали экспериментальные данные методом наименьших квадратов и рассчитали величину удельной скорости роста (μ) в экспоненциальной фазе роста (рис. 2a):
(2)
$B\left( t \right) = {{B}_{0}} \cdot {{e}^{{\mu \cdot t}}};\,\,\,B\left( t \right) = 0.3 \cdot {{e}^{{0.5t}}}.$Продуктивность (P) проточной культуры равна:
где ω – скорость разбавления культуры (удельная скорость протока), 1/сут; B – текущая плотность культуры, которая в свою очередь определяется выражением:(4)
$B\left( t \right) = {{B}_{{\text{н}}}} \cdot {{e}^{{\left( {\mu - \omega } \right)\left( {t - {{t}_{{\text{н}}}}} \right)}}},$Из формулы (3) ясно, что продуктивность культуры в хемостате будет тем больше, чем больше величины удельной скорости протока и текущей плотности культуры. Однако эти величины ограничены рабочей областью хемостата: 0 < ω ≤ μ и B0 < < Bн < Bmax, где Bmax – плотность культуры в стационарной фазе роста.
Подставляя (4) в (3), получим:
(5)
$P = \omega \cdot {{B}_{н}} \cdot {{e}^{{\left( {\mu - \omega } \right)\left( {t - {{t}_{н}}} \right)}}}.$Из последнего выражения следует, что в рабочей области хемостата максимальная продуктивность будет достигаться в условиях стационарного динамического равновесия при ω = μ и Bн → Bmax,
Поскольку в условиях стационарного динамического равновесия рост культуры микроводорослей характеризуется неизменностью биохимического состава биомассы, используя выражение (5), скорость биосинтеза Ddx в хемостате (Pddx) можно представить как:
(6)
${{P}_{{{\text{Ddx}}}}} = \omega \cdot {{\delta }_{{{\text{Ddx}}}}} \cdot {{B}_{{\text{н}}}} \cdot {{e}^{{\left( {\mu - \omega } \right)\left( {t - {{t}_{{\text{н}}}}} \right)}}},$Подставив в (6) данные эксперимента (ω = = 0.5 1/сут, δDdx = 0.0061, Bн = 3 г/л), получим предельное значение продуктивности Ddx в хемостате для установившегося процесса:
Таким образом, можно видеть, что в проточной культуре скорость биосинтеза Ddx превышает среднюю скорость биосинтеза Ddx в накопительной культуре в 7.5 раз, а Fx – в 14 раз.
В дальнейшем была проведена оценка проапоптической активности Ddx и Fx. Эксперименты на клетках, а также анализ тематических публикаций показал наличие проапоптотических процессов, индуцируемых Fx и его метаболитами [12–16]. В табл. 1 приведены наиболее значимые мишени, связанные с развитием проапоптотических процессов.
Таблица 1.
Основные мишени, рассматриваемые в контексте развития низкомолекулярных индукторов апоптоза
С целью более точного определения потенциальной мишени для исследуемых активных веществ был изучен генетический профиль клеточной культуры OVCAR4 (рак яичников человека https://web.expasy.org/cellosaurus/CVCL_1628). Анализ генома клеточных культур нормальных клеток яичников и рака яичников проведен с помощью инструмента BioGPS [29], а также базы данных KEGG [30]. Список генов, задействованных в процессе канцерогенеза: 1. BRCA1 (germline mutation/deletion) [HSA:672] [KO:K10605]; 2. BRCA2 (germline mutation/deletion) [HSA:675] [KO:K08775]; 3. MSH2 (germline mutation) [HSA:4436] [KO:K08735]; 4. MLH1 (germline mutation) [HSA:4292] [KO:K08734]; 5. ERBB2 (amplification/overexpression) [HSA:2064] [KO:K05083]; 6. K-ras (mutation) [HSA:3845] [KO:K07827]; 7. AKT2 (amplification) [HSA:208] [KO:K04456]. 8. PIK3CA (amplification) [HSA:5290] [KO:K00922]; 9. c-MYC (overexpression) [HSA:4609] [KO:K04377]; 10. p53 (mutation / deletion, overexpression) [HSA:7157] [KO:K04451].
Ранее упомянутые мишени, к которым селективен Fx и его производные, в данном генетическом профиле отсутствуют. Однако проапоптотический эффект есть. Среди перечисленных генов, стоит обратить внимание на ERBB2, кодирующий белок HER2, который наиболее часто связан с развитием рака яичников у человека.
HER2 (англ. human epidermal growth factor receptor 2; рецептор эпидермального фактора роста, тип 2) — трансмембранный белок, тирозиновая протеинкиназа, относящаяся к семейству рецепторов эпидермального фактора роста (EGFR/ErbB). Амплификация или повышенная экспрессия гена данного белка играет важную роль в патогенезе и прогрессировании определенных агрессивных типов злокачественных новообразований, являясь важным биомаркером и терапевтической мишенью.
Анализ структуры белка HER2, имеющейся в базе данных RCSB Protein Data Bank, показал наличие работ, демонстрирующих возможность негативной модуляции активности данного белка с помощью низкомолекулярных агентов [31, 32]. В частности, при рассмотрении трехмерной модели белка HER2 в комплексе с селективным ингибитором TAK-285 (модель 3RCD в Protein Data Bank), нами установлен линейный характер структуры низкомолекулярного ингибитора. В связи с этим, был проведен вычислительный эксперимент по симуляции процесса взаимодействия Ddx и Fx с активной полостью белка HER2.
Оценка сродства малых молекул проведена с помощью метода молекулярного докинга. Рассчитана область потенциального взаимодействия. При этом, размер области связывания выбран в соответствии с геометрией исследуемых лигандов, так как они значительно больше лиганда в активной полости TAK-285. В итоге, получены результаты, которые представлены в табл. 2.
Таблица 2.
Показатели расчeтного сродства исследуемых соединений в отношении белка HER2
| Структура | GlideScore (ккал/моль) | Emodel (ккал/моль) | IC50 (мкмоль) |
|---|---|---|---|
| Фукоксантин | –7.18 | –44.72 | 18.75 |
| Диадиноксантин | –6.61 | –44.61 | >100 |
| Контроль (в модели белка HER2) | –9.72 | –102.4 | 0.017 |
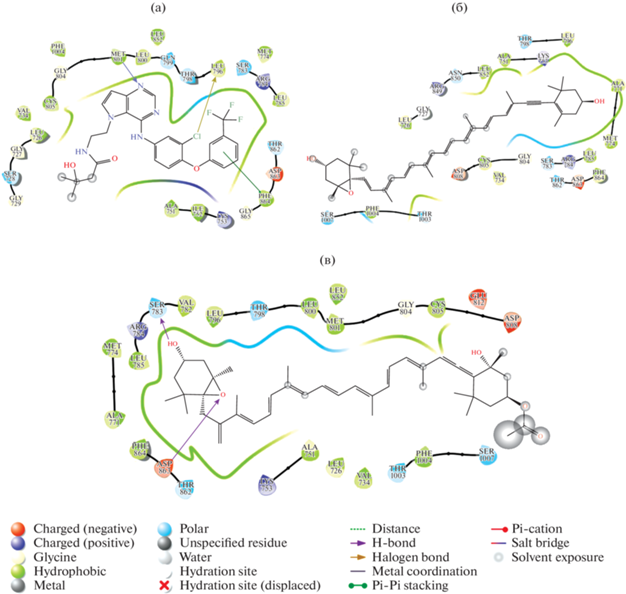
Проведенные расчеты показали, что Ddx парциально имитирует гидрофобное взаимодействие с аминокислотами активной полости белка HER2. Отсутствие ароматического скаффолда в случае рассматриваемого каротиноида приводит к значительной потере гидрофобных контактов. Однако, если обратиться к рис. 4 б, то можно увидеть, что основные гидрофобные/полярные/электростатические контакты реализованы аналогично контрольному лиганду. Данный факт позволяет говорить о потенциальной реализуемости специфического взаимодействия с белком HER2. К тому же, расчеты показывают достаточно высокий уровень кластеризации решений докинга, что также косвенно говорит о потенциальной сайтоспецифичности взаимодействия (рис. 3б). Аналогично и со структурой Fx. Соединение за счет линейной структуры с сопряженными двойными связями обладает весьма высоким потенциалом гидрофобного взаимодействия, за счет чего довольно эффективно оккупирует активную полость HER2. Тем не менее, отсутствие ароматических мотивов в структуре снижает сайтоспецифичность взаимодействия (рис. 4 ).
Рис. 3.
Укладка исследуемых соединений в активной полости белка HER2: контрольный лиганд TAK-285 (a), диадиноксантин (б), фукоксантин (в).

Рис. 4.
Диаграмма лиганд-белковых взаимодействий исследуемых соединений с белком HER2: референсный лиганд TAK-285 (а), диадиноксантин (б), фукоксантин (в).
Результаты расчетов показали, что в сравнении с референсной структурой TAK-285 Fx и Ddx обладают более низкими показателями активности. Рассматривая величину GlideScore как аналог свободной энергии Гиббса (ΔG) можно утверждать, что расчетная константа ингибирования различается примерно на три порядка (1000х). Данные результаты согласуются с экспериментальным уровнем активности: ΔGlideScore (Ddx) = = 3.11; IC50 Ddx/реф = 5882.35; ΔGlideScore (Fx) = = 2.54, IC50 Fx/реф = 1102.94.
Проведенный нами эксперимент по изучению цитостатического эффекта Ddx и Fx с культурами клеток OVCAR5, OVCAR8, KURAMOCHI и OVSAHO (Серозная аденокарцинома яичников с вариантами мутаций в ERBB2/p53/KRAS) показал, что для соединения Ddx величина IC50 достигалась при концентрации >100 мкМ (рис. 5 а).
Рис. 5.
Цитостатический эффект диадиноксантина (а) и фукоксантина (б) на клеточных линиях: 1 – KURAMOCHI; 2 – HEK293; 3 – OVCAR4; 4 – OVCAR8; 5 – OVSAHO.

Результаты анализа жизнеспособности клеточных линий рака яичников показали, что Fx проявлял цитостатическое действие с IC50 в пределах 18.75 мкМ (рис. 5 б). Этот эффект воспроизводился во всех протестированных клеточных линиях. Ddx снижал жизнеспособность клеток на 40% только при наивысшей протестированной концентрации (100 мкМ). В то время как эффект от воздействия Fx более выражен уже в диапазоне физиологических концентраций, а токсический ответ был достигнут при концентрации 18.75 мкМ. Клеточная линия OVCAR4 показала самую высокую чувствительность к Fx и Ddx среди протестированных клеточных линий (рис. 5 б).
На основании полученных результатов можно предположить, что в случае применения Ddx, цитостатический эффект достигался за счет подавления активности гиперэкспрессированного белка HER2, отвечающего за рост клеток. Стоит также отметить, что гиперэкспрессированный HER2 ответственен за резистентность к химиотерапии опухолевых клеток [33]. Селективное взаимодействие с данным белком отчасти объясняет явление сенсибилизации клеток к цитостатикам под воздействием каротиноидов, применяемых в комбинации с химиотерапией [2].
По данным как вычислительного эксперимента, так и эксперимента с культурами клеток Ddx демонстрирует более низкую активность по сравнению с Fx (более чем в 4 раза). Но для полноты исследований проапоптической активности Ddx требуется расширенный эксперимент с использованием клеточной репортерной системы, демонстрирующей специфическую активацию процессов клеточной смерти. При этом, в качестве положительного контроля должны быть использованы существующие специфичские ингибиторы белка HER2.
Несмотря на низкую проапоптотическую активность Ddx, скорость его продукции в проточной культуре C. closterium может превышать среднюю скорость накопления Fx в 14 раз, что может сделать технологию его получения менее затратной и существенно снизить себестоимость препаратов лечебно-профилактического характера на основе микроводорослей. Отметим, в качестве профилактики онкозаболеваний человеку рекомендуется ежедневное употребление 0.5 мг в сутки Fx [https://www.oryza.co.jp/cms/wp-content/uploads/ 2019/06/e1d04e41b30d14f57abeab355f965f9a.pdf], что соответствует 0.07 г сухой биомассы C. closterium. Если в качестве профилактики использовать Ddx, как альтернативу Fx, то, учитывая более низкую активность Ddx, потребуется минимум 0.33 г сухой биомассы C. closterium в сутки.
Авторы выражают благодарность Акимову Е.А. (Institute for Molecular Medicine Finland, HiLIFE) и доктору филосифии T. Maoka (Research Institute for Production Development, Киото, Япония) за помощь в экспериментальной работе с клеточными культурами и идентификации каротиноидов.
Работа выполнена в рамках госзадания ФИЦ ИнБЮМ по теме “Исследование механизмов управления продукционными процессами в биотехнологических комплексах с целью разработки научных основ получения биологически активных веществ и технических продуктов морского генезиса” (№ госрегистрации 121030300149-0) и госзадания Министерства образования и науки Российской Федерации в рамках проекта по созданию и развитию научно-исследовательских центров мирового уровня “Цифровой биодизайн и персонализированное здравоохранение” (№ госрегистрации 075-15-2020-926).
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
De la Cuesta J.L., Manley S.L. // Limnol. and Oceanogr. 2009. V. 54. P. 1653–1664. https://doi.org/10.4319/lo.2009.54.5.1653
Wang Z., Li H., Dong M., Zhu P., Cai Y. // J. Cancer Res. Clin. Oncol. 2019. V. 145. № 2. Р. 293–301. https://doi.org/10.1007/s00432-019-02841-2
Wang C., Chen X., Nakamura Y., Yu C., Qi H. // Food & Function. 2020. V. 11. № 11. P. 9338–9358. https://doi.org/10.1039/d0fo02176h
Méresse S., Fodil M., Fleury F., Chénais B. // Int. J. Mol. Sci. 2020. V. 21. № 23. P. 1–27. https://doi.org/10.3390/ijms21239273
Jaswir I., Noviendri D., Taher M., Mohamed F., Octavianti F., Lestari W. et al. // Molecules. 2019. V. 24. № 5. P. 1–16. https://doi.org/10.3390/molecules24050947
Satomi Y. // Anticancer Res. 2017. V. 37. № 4. P. 1557–1562. https://doi.org/10.21873/anticanres.11484
Kumar S.R., Hosokawa M., Miyashita K. // Mar. Drugs. 2013. V. 11. P. 5130–5147. https://doi.org/10.3390/md11125130
Геворгиз Р.Г., Железнова С.Н., Зозуля Ю.В., Уваров И.П., Репков А.П., Лелеков А.С. // Актуальные вопросы биологической физики и химии. 2016. Т. 1. С. 73–77.
Lu X., Sun H., Zhao W., Cheng K.-W., Chen F., Liu B. // Mar. Drugs. 2018. V. 16. № 7. P. 1–13. https://doi.org/10.3390/md16070219
Kuczynska P., Jemiola-Rzeminska M., Strzalka K. // Mar. Drugs. 2015. V. 13. № 9. P. 5847–5881. https://doi.org/10.3390/md13095847
Guo B. Liu B., Yang B., Sun P., Lu X., Liu J. et al. // Mar. Drugs. 2016. V. 14. № 7. P. 1–14. https://doi.org/10.3390/md14070125
Jin, Y., Qiu S., Shao N., Zheng J. // Med. Sci. Monit. 2018. V. 24. P. 11–18. https://doi.org/10.12659/MSM.905360
Kim K.N., Heo S.J.,Kang S.M., Ahn G., Jeon Y.J. // Toxicol. in Vitro. 2010. V. 24. № 6. P. 1648–1654. https://doi.org/10.1016/j.tiv.2010.05.023
Foo S.C., Yusoff F.M., Imam M.U., Foo J.B., Ismail N., Azmi N.H. et al. // Biotechnol. Rep. (Amst). 2019. V. 21. P. 1–11. https://doi.org/10.1016/j.btre.2018.e00296
Wu H.L., Fu X.Y., Cao W.Q., Xiang W.Z., Hou Y.J., Ma J.K. et al. // J. Agric. Food Chem. 2019. V. 67. № 8. P. 2212–2219. https://doi.org/10.1021/acs.jafc.8b07126
Zhu Y., Cheng J., Min Z., Yin T., Zhang R., Zhang W. et al. // J. Cell Biochem. 2018. V. 119(9). P. 7274–7284. https://doi.org/10.1002/jcb.27022
Железнова С.Н., Геворгиз Р.Г., Бобко Н.И., Лелеков А.С. // Актуальная биотехнология. 2015. Т. 14. № 3. С. 46–48.
Железнова С.Н., Геворгиз Р.Г. // Актуальные вопросы биологической физики и химии. 2020. Т. 5. № 1. С. 201–207.
Рябушко В.И., Железнова С.Н., Нехорошев М.В. // Альгология, 2017. Т. 27(1) С. 15–21. https://doi.org/10.15407/alg27.01.015
Jeffrey S.W., Mantoura R.F.C., Wright S.W. // JMBA. 1997. V. 77(3). 661 p. https://doi.org/10.1017/S0025315400036389
Hashimoto T., Ozaki Y., Taminato M., Dass S.K., Mizuno M., Yoshimura K. et al. // BJN. 2009. V. 102. № 2. P. 242–248. https://doi.org/10.1017/S0007114508199007
Whittle S.J., Casselton P.J. // Br. Phycol. J. 1975. V. 10. № 2. P. 192–204. https://doi.org/10.1080/00071617500650181
Kuczynska P., Jemiola-Rzeminska M.I. // Appl. Phycol. 2017. V. 29. P. 79–87. https://doi.org/10.1007/s10811-016-0961-x
Englert G., Biornland T., Liaaen-Jensen S. // Magnetic Resonance in Chemistry. 1990. V. 28. № 6. P. 519–528. https://doi.org/10.1002/mrc.1260280610
Maeda H., Hosokawa M., Sashima T., Funayama K., Miyashita K. // Biochem. Biophys. Res. Communs. 2005. V. 332. № 2. P. 392–397. https://doi.org/10.1016/j.bbrc.2005.05.002
Friesner R.A., Banks J.L., Murphy R.B., Halgren T.A., Klicic J.J., Mainz D.T. et al. // J. Med. Chem. 2004. V. 47. № 7. P. 1739–1749. https://doi.org/10.1021/jm0306430
Burley S.K., Berman H.M., Bhikadiya C., Bi C., Chen L., Di Costanzo L. et al. // Nucleic Acids Res. 2019. V. 47. (Database issue), D464–D474. https://doi.org/10.1093/nar/gky1004
Sastry G.M., Adzhigirey M., Day T., Annabhimoju R., Sherman, W. // J. Comput Aided Mol. Des. 2013. V. 27. № 3. P. 221–234. https://doi.org/10.1007/s10822-013-9644-8
Wu C., Jin X., Tsueng G., Afrasiabi C., Su A.I. // Nucleic Acids Res. 2016. V. 44. (D1). P. 313–316. https://doi.org/10.1093/nar/gkv1104
Kanehisa M., Sato Y., Kawashima M., Furumichi M., Tanabe M. // Nucleic Acids Res. 2016. V. 44. (D1). P. 457–462. https://doi.org/10.1093/nar/gkv1070
Rampogu S., Son M., Baek A., Park C., Rana R. M., Saravanan A.Z. et al. // Computational Biology and Chemistry 2018. V. 74. P. 327–338. https://doi.org/10.1016/j.compbiolchem.2018.04.002
Yoshioka T, Shien K, Namba K, Torigoe H., Sato H., Tomida S. et al. // Cancer Sci. 2018. V. 109. № 4. P. 1166–1176. https://doi.org/10.1111/cas.13546
Harris F.R., Zhang P., Yang L., Hou X., Leventakos K., Weroha S.J. et al. // Mol. Oncol. 2019. V. 13. № 2. P. 132–152. https://doi.org/10.1002/1878-0261.12414
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


