Прикладная биохимия и микробиология, 2022, T. 58, № 3, стр. 273-279
Механизм деацетилирования хитина и хитозана при длительной щелочной обработке
В. Ю. Новиков 1, 2, *, И. Н. Коновалова 2, Н. В. Долгопятова 2
1 Полярный филиал Всесоюзного научно-исследовательского института рыбного хозяйства и океанографии (Полярный научно-исследовательский институт морского рыбного хозяйства и океанографии
им. Н.М. Книповича)
183038 Мурманск, Россия
2 Мурманский государственный технический университет (МГТУ), кафедра химии
183010 Мурманск, Россия
* E-mail: nowitaly@yandex.ru
Поступила в редакцию 20.08.2021
После доработки 16.11.2021
Принята к публикации 30.12.2021
- EDN: AQBQEJ
- DOI: 10.31857/S0555109922030096
Аннотация
Исследовано деацетилирование крабового хитина в растворах гидроксида натрия NaOH при получении хитозана. Сделаны предположения о механизме реакции на двух участках кинетической кривой, соответствующих быстрому и медленному деацетилированию. Быстрое деацетилирование связано с атакой гидроксид-ионами (OH–) ацетамидных связей хитина. Реакция деацетилирования начиналась на границе полной гидратации ионов OH– при концентрации NaOH около 20% и ее скорость росла с увеличением концентрации щелочи. При концентрации NaOH выше 50% скорость быстрого деацетилирования снижалась, по-видимому, вследствие уменьшения концентрации гидроксид-ионов в результате ионной ассоциации Na+ и OH–. При медленном деацетилировании скорость реакции с увеличением концентрации щелочи снижалась и деацетилирование останавливалось при концентрации NaOH – 60%. Вероятно, основная причина остановки реакции заключается в образовании кинетически устойчивого аниона хитозана в реакции бимолекулярного нуклеофильного замещения второго порядка SN2 с участием двух гидроксид-ионов.
Природные полисахариды хитин и хитозан представляют интерес для многих отраслей пищевой промышленности, медицины, сельского хозяйства [1]. Известно, что биологическая активность и другие свойства хитозана определяются двумя параметрами: молекулярной массой (ММ) и степенью деацетилирования (СД), при этом для удовлетворения потребности различных областей эти параметры должны изменяться независимо друг от друга.
До настоящего времени основной объем исследований проведен на хитозане со СД более 70% [2]. В сведениях, приведенных в научно-технической литературе, не обнаружено однозначной связи свойств хитозана с СД. В большинстве случаев необходимые свойства хитозана увеличиваются с ростом СД, например, такие как адсорбционная емкость [3], вязкость растворов, неньютоновские реологические свойства и энергии активации потока [4], антибактериальная и противогрибковая активность [5]. Хитозан с СД более 90% считается перспективным материалом для регенерации периферических нервов [6].
В некоторых случаях требуется полисахарид с низкой или средней СД. С увеличением СД снижаются прочность мембран при растяжении, но увеличивается индекс набухания [7]. Растворимость в воде наблюдается при средней СД около 50% [8]. Исследование ферментативного расщепления гликозидных связей хитозана лизоцимом показало, что максимальная скорость расщепления наблюдалась при средней СД около 50%, при СД более 60% скорость расщепления снижалась, а при СД 97% хитозан лизоциомом не расщеплялся [9, 10].
При щелочном деацетилировании хитина, которое используется для промышленного получения хитозана, в отсутствии молекулярного кислорода гликозидные связи, по аналогии с простой эфирной связью, являются устойчивыми, а ацетамидные связи легко расщепляются, что позволяет получать высокомолекулярный хитозан с высокой СД.
Процесс регулирования СД полисахарида ограничен особенностью кинетики реакции щелочного деацетилирования, которая заключается в быстром росте СД в первые 30–60 мин до значений 75–80% и медленном росте СД в течение нескольких часов после 60 мин до 85% [11, 12]. Небольшое повышение СД до 90–95% достигается при длительной обработке хитозана в концентрированной щелочи при высокой температуре и сопровождается значительным уменьшением ММ.
Существует способ дискретного деацетилирования хитина, позволяющий быстро увеличить СД практически до 100% с сохранением высокой ММ [13].
Вопрос, связанный с причиной остановки реакции щелочного деацетилирования после 60 мин от начала реакции, остается нерешенным.
Известно, что гликозидные связи хитина и хитозана проявляют устойчивость к действию концентрированных растворов щелочей. В деаэрированных растворах и в растворах с акцепторами окислительных радикалов деструкция полисахаридной цепи очень мала [14], при этом СД достигает и сохраняется на уровне 80–85% [15].
Изучение механизма реакции деацетилирования в настоящее время остается актуальным, поскольку независимое друг от друга регулирование ММ и СД хитозана является важной практической задачей.
Цель работы – выяснение особенностей механизма реакции деацетилирования хитина при длительной обработке в концентрированных растворах щелочи.
МЕТОДИКА
Объектами исследования служили образцы хитина, полученные из панциря камчатского краба Paralithodes camtschaticus по технологии, включающей депротеинизацию 4%-ным раствором NaOH, деминерализацию 7.2%-ным раствором HCl и повторную депротеинизацию 4%-ным раствором NaOH [12]. Высушенные на воздухе образцы хитина измельчали на конусной дробилке и просеивали через сито со стороной ячейки 0.1 мм.
Реакцию деацетилирования проводили в стеклянных колбах на глицериновой бане при температуре 100.0 ± 0.2°C при постоянном перемешивании. Объем раствора NaOH 20 см3, масса хитина 0.5 г. Начало реакции фиксировали с момента смешивания нагретых отдельно друг от друга до 100.0 ± 0.2°C порошкообразного хитина и концентрированного раствора NaOH. Реакцию прерывали быстрым переносом реакционной смеси в избыток (1 : 15 об./об.) охлажденного до 6 ± 2°C 96%‑ного этилового спирта. Осадок центрифугировали и промывали 80%-ным этиловым спиртом до нейтрального pH. Полученный хитозан сушили в сушильном шкафу при температуре 60 ± 2°C.
Концентрация NaOH была 40, 45, 50, 55 и 60%. Для получения растворов с концентрацией более 50% в раствор NaOH после нагревания его до 100°C при перемешивании добавляли расчетное количество кристаллического NaOH, после полного растворения щелочи раствор смешивали с хитином.
СД определяли методом ИК-спектроскопии по методике, описанной в работе [16]. ИК-спектры снимали на Фурье ИК-спектрофотометре IRTracer 100 (“Shimadzu Corp.”, Япония) в диапазоне 700–2000 см–1. СД (%) рассчитывали по формуле:
Концентрацию ацетамидных групп (CA, моль/дм3) в реакционной смеси рассчитывали по формуле:
где СД – степень деацетилирования, %; m – масса навески хитина, г; MA – молярная масса ацетилированного звена хитина, г/моль; V – объем раствора, дм3.РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Известно, что кинетическая кривая реакции деацетилирования хитина состоит из двух участков: первый – быстрое деацетилирование до 70–80% за 1–1.5 ч, и второй – медленное деацетилирование до 85–90% в течение нескольких часов [11, 12, 17]. До настоящего времени основным фактором, определяющим такую кинетику реакции, считают наличие кристаллических областей в хитине, в которых скорость деацетилирования очень низкая из-за плотной упаковки молекул и трудности проникновения внутрь реакционных частиц – гидроксид-ионов [18]. Существуют другие гипотезы, объясняющие снижение скорости деацетилирования: изменение морфологии частично деацетилированного хитина при промывках, существование обратной реакции ацетилирования, снижение концентрации щелочи в процессе деацетилирования, влияние пористости частиц хитина на диффузию гидроксид-ионов и продуктов реакции, а также влияние сольватации или гидратации реагирующих частиц на их взаимодействие с хитином [12]. На основании данных литературы и собственных результатов нами был сделан вывод, что основным фактором, определяющим снижение скорости деацетилирования на втором участке кинетической кривой, является не степень кристалличности хитина, а особенности химической реакции в концентрированных растворах электролитов.
Замедление кинетики реакции деацетилирования наблюдалось и при гомогенном деацетилировании хитина [18].
Ранее в работах [19–21] было выдвинуто предположение о том, что решающую роль в гетерогенном щелочном деацетилировании хитина играет гидратация ионов щелочи – гидроксид-ионов и макромолекул хитина/хитозана. Изучение кинетики реакции щелочного деацетилирования хитина позволило сделать вывод о существовании двух параллельных процессов, один из которых ускоряет деацетилирование, другой вызывает замедление реакции. Предложенный механизм состоит из реакции взаимодействия гидроксид-ионов с разной степенью гидратации и молекулы хитина и реакции гидратации молекулы хитина, которая замедляет процесс деацетилирования.
На участке быстрого деацетилирования кинетической кривой скорость деацетилирования резко росла с увеличением концентрации щелочи и уменьшением степени гидратации гидроксид-ионов [21]. Реакция деацетилирования начиналась при концентрации щелочи около 20%. Этот процесс может быть описан с точки зрения теории существования границы полной гидратации (ГПГ) ионов электролита в воде, при которой все молекулы воды связаны и входят в состав первичной гидратной оболочки растворенных ионов [22]. До ГПГ реакция деацетилирования практически не происходит. После ГПГ, когда гидратная оболочка гидроксид-ионов становится неполной, их активность начинает проявляться в реакции с ацетамидной связью хитина. По всей видимости, реакция деацетилирования начинается при переходе через ГПГ, когда количества молекул воды недостаточно для построения полных гидратных оболочек и в реакции деацетилирования уже не участвуют свободные молекулы воды. В соответствии с механизмом реакции нуклеофильными частицами, атакующими ацетамидную связь в этих условиях, являются гидроксид-ионы. Реакционная способность гидроксид-ионов растет с уменьшением степени гидратации при изменении концентрации щелочи от 20 до 50% [21].
Другой причиной, вызывающей уменьшение скорости реакции на участке быстрого деацетилирования кинетической кривой, является гидратация молекулы хитина. Ранее было установлено, что гидратная оболочка влажного хитина вызывала снижение скорости деацетилирования хитина [19].
В настоящем исследовании получены кинетические кривые деацетилирования хитина при концентрациях NaOH от 40 до 60% и времени деацетилирования до 480 мин (рис. 1).
Рис. 1.
Кинетические кривые деацетилирования хитина (СД, %) при концентрации NaOH (%): 1 – 40, 2 – 45, 3 – 50, 4 – 55, 5 – 60.

Для оценки скорости реакции деацетилирования были построены кинетические кривые изменения концентрации ацетамидных звеньев хитина/хитозана в моль/дм3 (рис. 2).
Рис. 2.
Кинетические кривые изменения концентрации ацетамидной группы хитина при деацетилировании в растворе NaOH с концентрацией (%): 1 – 40, 2 – 45, 3 – 50, 4 – 55, 5 – 60.
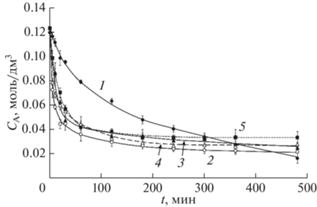
Для участка быстрого деацетилирования кинетической кривой (0–90 мин) были рассчитаны начальные скорости реакции деацетилирования по тангенсу угла наклона касательной к кинетической кривой в нулевой момент времени. Скорости реакции деацетилирования на участке медленного деацетилирования (120–480 мин) были рассчитаны путем линейной аппроксимации кинетических кривых в диапазоне от 240 до 480 мин. Результаты изучения влияния концентрации щелочи на скорость реакции деацетилирования на обоих участках кинетической кривой приведены на рис 3.
Рис. 3.
Влияние концентрации щелочи (С, %) на скорость реакции деацетилирования на участках кинетической кривой быстрого (1) и медленного деацетилирования (2).
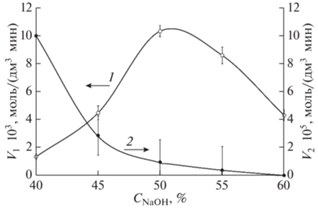
Ранее было показано, что скорость реакции на участке быстрого деацетилирования кинетической кривой при увеличении концентрации щелочи до 50% растет [21]. В настоящей работе мы установили, что при концентрации щелочи более 50% скорость реакции замедлялась, а при концентрации щелочи 60% снижалась до значения V1 = 4.31 ± 0.4 × 10–3 моль/(дм3 ⋅ мин) (рис. 3, кривая 1). Это свидетельствовало о влиянии на механизм реакции деацетилирования процесса ассоциации катионов и анионов щелочи при их высокой концентрации, что приводило к уменьшению содержания в реакционной смеси свободных гидроксид-ионов.
На участке медленного деацетилирования кинетической кривой при увеличении концентрации щелочи от 40 до 60% скорость реакции снижалась и при концентрации щелочи 60% реакция останавливалась: V2 = (0.00 ± 1.2) × 10–5 моль/(дм3 ⋅ мин) (рис. 3, кривая 2). Следует отметить, что при концентрации щелочи выше 50% уменьшалась не только скорость реакции деацетилирования но и максимально достигаемая СД на этом участке кинетический кривой (рис. 1).
Ранее было высказано предположение, об ингибирующем действии воды, образующейся при протекании реакции деацетилирования хитина [19]. Вода вызывает гидратацию макромолекул полисахарида, что приводит к снижению скорости деацетилирования. Однако не было дано объяснения, почему при большой концентрации щелочи (55–60%), когда количества воды, участвующей в процессе гидратации значительно меньше, чем в разбавленных растворах, скорость деацетилирования на участке медленного деацетилирования кинетической кривой замедляется. Для ответа на этот вопрос рассмотрим механизм реакции щелочного гидролиза (расщепления) ацетамидной связи.
Известно, что реакция щелочного гидролиза ацетамидных связей является реакцией бимолекулярного нуклеофильного замещения второго порядка SN2, при котором сильный нуклеофил гидроксид-ион атакует ацетамидную связь [23]. В результате суммарной реакции деацетилирования вода не образуется и не расходуется. В растворах щелочи при атаке амидного углерода гидроксид-ионом (условно “первый гидроксид-ион”) образуется анионный тетраэдрический интермедиат $\left( {{{{\mathbf{T}}}_{{{{{\mathbf{O}}}^{ - }}}}}} \right),$ который может или превратиться в исходное соединение, или распасться до продуктов гидролиза. Пути распада интермедиата $\left( {{{{\mathbf{T}}}_{{{{{\mathbf{O}}}^{ - }}}}}} \right)$ могут включать его взаимодействие с разными формами, находящимися в растворе, осуществляющими перенос протона от –OH– к ацетамидной связи –NHR. В разбавленных растворах в качестве переносчика протона постулируется вода (схема 1) [23].
При высокой концентрации щелочи увеличивается вероятность отрыва протона H+ вторым гидроксид-ионом с образованием молекулы воды и второго интермедиата $\left( {{{{\mathbf{T}}}_{{{{{\mathbf{O}}}^{{2 - }}}}}}} \right),$ который затем распадается с образованием ацетат-иона и амид-иона. Расщепление ацетамидной связи в концентрированном растворе щелочи может быть изображено схемой (2) , где R – остаток молекулы хитина.
В соответствии с этим механизмом полученный амид-ион –NHR– отнимает протон H+ у молекулы воды с образованием молекулы хитозана по схеме (3) [24]:
В концентрированной щелочи при отсутствии “свободной воды” амид-ион -NHR–, являясь более сильным нуклеофилом, чем гидроксид-ион, отнимает H+ у молекулы воды, входящей в гидратную оболочку гидроксид-иона.
Вероятно, уменьшение скорости реакции деацетилирования на участке медленного деацетилирования кинетической кривой при увеличении концентрации щелочи до 60% может быть следствием образования амидного аниона хитина RHN–, который стабилизируется в высоко концентрированном растворе щелочи. В этом случае на деацетилированных звеньях хитина накапливается избыточный отрицательный заряд, который отталкивает гидроксид-ионы, что и приводит к снижению скорости реакции деацетилирования. Если этот анион будет достаточно стабилен, то реакция деацетилирования может остановиться (об этом свидетельствует изменение наклона участка медленного деацетилирования кинетической кривой на рис. 1 при увеличении концентрации NaOH). При концентрации щелочи менее 50% в растворе происходит нейтрализация заряда аниона хитина за счет переноса протона от молекулы воды с образованием нейтральной молекулы хитозана и гидроксид-иона. При этом отрицательный заряд на молекуле хитина уменьшается, а скорость реакции деацетилирования на участке медленного деацетилирования кинетической кривой увеличивается. При высокой концентрации щелочи “свободной воды” практически нет, и анион хитозана должен отнять молекулу воды у гидратированных ионов электролита. При увеличении концентрации щелочи, то есть при уменьшении степени гидратации ее ионов, энергия связи ионов щелочи с молекулами воды увеличивается. Вероятность отрыва молекулы воды анионом хитозана снижается, поэтому время жизни “квазистабильного” аниона хитозана увеличивается.
Влияние амид-аниона на реакцию деацетилирования может заключаться в следующем. Так как реакция деацетилирования осуществляется в гетерогенных условиях, молекулы хитина находятся в упорядоченном состоянии, за счет образования между ними водородных связей [25]. Отрицательный заряд на амид-ионе одной линейной молекулы может вступить во взаимодействие с атомом углерода в ацетамидной группе соседней молекулы, на котором существует частичный положительный заряд. Величина отрицательного заряда на атоме азота амидной группы одной молекулы снижается, а положительный заряд на атоме углероде ацетамидной группы второй молекулы частично нейтрализуется, что приводит к уменьшению нуклеофильности амид-иона первой молекулы и электрофильности атома углерода ацетамидной группы второй молекулы полисахарида. Вследствие этого снижается вероятность реакции амид-иона с водой и скорость нуклеофильной реакции гидроксид-иона по ацетамидной связи. В целом это приводит к замедлению скорости и остановке реакции деацетилирования.
При промывке водой амид-ион переходит в нейтральную форму и его воздействие на ацетамидную группу соседней молекулы прекращается.
Для подтверждения этой гипотезы было изучено влияние добавления воды на кинетику реакции деацетилирования. Воду добавляли в реакционную смесь хитина и 50%-ного NaOH до концентрации NaOH 40%, через 3 ч после начала реакции, когда кинетика деацетилирования вышла на “плато” участка медленного деацетилирования кинетической кривой (рис. 4, кривая 1). Из данных, приведенных на рис. 4, следует, что добавление воды приводит к увеличению скорости реакции и СД (рис. 4, кривая 2). По-видимому, добавление воды в 50%-ный раствор щелочи до концентрации NaOH 40% приводит к исчезновению образующегося аниона хитозана в соответствии с реакцией (3), что дает возможность дальнейшему протеканию реакции деацетилирования. Увеличение скорости деацетилирования в условиях эксперимента на этом участке кинетической кривой (рис. 4, кривая 2) может быть объяснено тем, что при увеличении степени гидратации гидроксид-ионов энергия гидратации снижалась, что приводило к увеличению вероятности отрыва части молекул воды анионом хитозана для завершения реакции деацетилирования.
Рис. 4.
Кинетическая кривая деацетилирования хитина в 50%-ном растворе NaOH при 100°C без добавления воды (1) и с добавлением воды (2) через 3 ч после начала реакции до концентрации NaOH – 40%.

На основании полученных результатов сделан вывод о том, что основную роль в гетерогенном деацетилировании хитина играют эффекты гидратации макромолекул полисахарида и гидроксид-ионов щелочи. На участке быстрого деацетилирования кинетической кривой гидратация гидроксид-ионов и макромолекул хитина ингибирует реакцию деацетилирования, на участке медленного деацетилирования процесс гидратации приводит к увеличению скорости реакции деацетилирования.
Список литературы
Sustainable Agriculture Reviews 36. Chitin and Chitosan: Applications in Food, Agriculture, Pharmacy, Medicine and Wastewater Treatment. /Eds. G. Crini and E. Lichtfouse. Cham: Springer Nature Switzerland AG, 2019. 432 p.
Elnashar M. Bio-applications of Chitosan // Handbook of Chitosan Research and Applications. /Ed G. Richard Mackay and Jennifer M. Tait. N.Y.: Nova Science Publishers, 2012. P. 139–162.
Cadaval T.R.S., Camara A.S., Dotto G.L., Pinto L.A. de A. // Desalin. Water Treat. 2013. V. 51. № 40–42. P. 7690–7699. https://doi.org/10.1080/19443994.2013.778797
Wang W., Xu D. // Int. J. Biol. Macromol. 1994. V. 16. № 3. P. 149–152.https://doi.org/10.1016/0141-8130(94)90042-6
Younes I., Sellimi S., Rinaudo M., Jellouli K., Nasri M. // Int. J. Food Microbiol. 2014. V. 185. P. 57–63. https://doi.org/10.1016/j.ijfoodmicro.2014.04.029
Wenling C., Duohui J., Jiamou L., Yandao G., Nanming Z., Xiufang Z. // J. Biomater. Appl. 2005. V. 20. № 2. P. 157–177. https://doi.org/10.1177/0885328205049897
Chen R.H., Hua H.D. // J. Appl. Polym. Sci. 1996. V. 61. № 5. P. 749–754. https://doi.org/10.1002/(SICI)1097-4628(19960801)61: 5<749::AID-APP5>3.0.CO;2-O
Varum K.M., Ottoy M.H., Smidrod O. // Carbohydr. Polym. 1994. V. 25. № 2. P. 65–70. https://doi.org/10.1016/0144-8617(94)90140-6
Kurita K., Kaji Y., Mori T., Nishiyama Y. // Carbohydr. Polym. 2000. V. 42. № 1. P. 19–21. https://doi.org/10.1016/S0144-8617(99)00127-7
Zhang H., Neau S.H. // Biomaterials. 2001. V. 22. № 12. P. 1653–1658. https://doi.org/10.1016/S0142-9612(00)00326-4
Chang K.L.B., Tsai G., Lee J., Fu W.R. // Carbohydr. Res. 1997. V. 303. № 3. P. 327–332. https://doi.org/10.1016/s0008-6215(97)00179-1
Новиков В.Ю., Коновалова И.Н., Долгопятова Н.В. Химические основы технологии получения хитина и его производных из панциря ракообразных. СПб: ГИОРД, 2012. 208 с.
Mima S., Miya M., Iwamoto R., Yoshikawa S. // J. Appl. Polym. Sci. 1983. V. 28. № 6. P. 1909–1917. https://doi.org/10.1002/app.1983.070280607
Younes I., Ghorbel-Bellaaj O., Chaabouni M., Rinaudo M., Souard F., Vanhaverbeke C., Jellouli K., Nasri M. // Int. J. Biol. Macromol. 2014. V. 70. P. 385–390. https://doi.org/10.1016/j.ijbiomac.2014.06.051
Galed G., Diaz E., Goycoolea F.M., Heras A. // Nat. Prod. Commun. 2008. V. 3. № 4. P. 543–550. https://doi.org/10.1177/1934578x0800300414
Shigemasa Y., Matsuura H., Sashiwa H., Saimoto H. // Int. J. Biol. Macromol. 1996. V. 18. № 3. P. 237–242. https://doi.org/10.1016/0141-8130(95)01079-3
Новиков В.Ю., Орлова Т.А., Воронина И.Э. // Известия вузов. Пищевая технология. 1990. № 5. С. 64–67.
Kurita K., Sannan T., Iwakura Y. // Makromol. Chem. 1977. V. 178. № 12. P. 3197–3202. https://doi.org/10.1002/macp.1977.021781203
Новиков В.Ю., Коновалова И.Н., Кучина Ю.А., Долгопятова Н.В., Черкун Ю.А. // Вестник МГТУ. 2017. Т. 20. № 3. С. 515–525. https://doi.org/10.21443/1560-9278-2017-20-3-515-525
Новиков В.Ю., Коновалова И.Н., Кучина Ю.А., Князева А.И., Кузнецов В.Я. // Известия Уфимского научного центра РАН. 2016. № 3(1). С. 76–78.
Новиков В.Ю., Коновалова И.Н., Кучина Ю.А., Долгопятова Н.В., Черкун Ю.А. // Известия Уфимского научного центра Российской академии наук. 2018. № 3(3). С. 80–84. https://doi.org/10.31040/2222-8349-2018-2-3-60-63
Мищенко К.П., Полторацкий Г.М. Термодинамика и строение водных и неводных растворов электролитов. Л.: Химия, 1976. 328 с.
Чаллис Б.С., Чаллис Дж.А. // В кн. Общая органическая химия. Карбоновые кислоты и их производные. Соединения фосфора. Т. 4. /Ред. О. И. Сазерленд. Пер. с англ. М.: Химия, 1983. С. 388–356.
Brown R.S. // In “The Amide Linkage. Structural Significance in Chemistry, Biochemistry, and Materials Science”. / Ed. by A. Greenberg, C. M. Breneman, J. F. Liebman. Hoboken. New Jersey: John Wiley and Sons, 2003. P. 85–114.
Roberts G.A.F. Chitin Chemistry. Basingstoke, London: The Macmillan Press Ltd., 1992. 368 p.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология





