Прикладная биохимия и микробиология, 2022, T. 58, № 3, стр. 280-286
Тромборезистентность полиуретановых пластин, модифицированных кватернизированным хитозаном и гепарином
Н. Н. Дрозд 1, *, А. П. Луньков 2, Б. Ц. Шагдарова 2, **, Ю. В. Жуйкова 2, А. В. Ильина 2, В. П. Варламов 2
1 Национальный медицинский исследовательский центр гематологии Министерства здравоохранения
Российской Федерации
125167 Москва, Россия
2 Институт биоинженерии, Федеральный исследовательский центр “Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Россия
* E-mail: nndrozd@mail.ru
** E-mail: shagdarova.bal@gmail.com
Поступила в редакцию 20.08.2021
После доработки 25.10.2021
Принята к публикации 05.11.2021
- EDN: TEEFLS
- DOI: 10.31857/S0555109922020040
Аннотация
Для получения модифицированных полиуретановых (ПУ) пластин на их поверхность послойно наносили кватернизированный хитозан (КватХит; степень замещения 50%, степень дезацетилирования 87%) и нефракционированный гепарин (НФГ). Рельеф поверхности пластин исследовали с помощью АСМ. После обработки значительно увеличивались среднеквадратичная шероховатость, высота неровностей профиля ПУ пластин. Величина контактного угла модифицированных ПУ пластин снижалась с 86.1 ± 11.3° до 63.2 ± 3.68°. Для оценки in vitro устойчивости ПУ пластин к появлению сгустков крови на поверхности (тромборезистентность, ТРЗ) использовали кровь доноров и тест на время рекальцификации крови. При инкубации модифицированных ПУ пластин с кровью в течение 20–180 мин ТРЗ достигала 78.43 ± 4.02–88.94 ± 1.98%. Время рекальцификации крови человека, содержащей ПУ пластины с покрытием КватХит – НФГ (20 мин – 483 ± 22.64 с и 40 мин – 576.5 ± 24.64 с), достоверно отличалось от времени рекальцификации крови человека, содержащей ПУ пластины без покрытия (20 мин – 257.5 ± 12.84 с и 40 мин – 273.3 ± 16.6 с). Таким образом, послойная модификация ПУ пластин КватХит и НФГ приводила к высокой устойчивости в отношении появления сгустков крови на поверхности.
В результате контакта с кровью таких медицинских устройств, как дренажные трубки, сосудистые стенты и катетеры, протезы кровеносных сосудов, оборудование для систем искусственного или вспомогательного кровообращения, искусственные клапаны сердца, возможна активация плазменного и клеточного гемостаза, что может привести к появлению фибриновых сгустков крови (тромбов) на поверхности приспособлений [1–3]. Для снижения такой вероятности поверхности материалов медицинских устройств (на основе полимеров, сплавов, металлов, керамических материалов, цементов, смол и т.д.) модифицируют [4, 5]. Стратегии модификации материалов устойчивых к появлению тромбов (тромборезистентность) включают изменения химического состава и морфологии поверхности (влияющих на заряд, гидрофобность/гидрофильность, профиль поверхности, пористость), а также иммобилизацию антикоагулянтов (лекарственные средства, препятствующие появлению сгустков крови) или высвобождение с поверхности соединений с антитромботической активностью (наряду с антикоагулянтами, это могут быть и антиагреганты) [5–7].
Используемые в таких целях антикоагулянты, полисахарид гликозаминогликан нефракционированный гепарин (НФГ), прямой ингибитор тромбина бивалирудин, комплекс гепарина с антитромбином (плазменный ингибитор сериновых протеиназ свертывающей системы крови), ингибитор кукурузного трипсина [5, 8–10]. Разнообразие медицинских устройств с активным покрытием НФГ представлено рядом компаний – производителей [11]. Механизм антикоагулянтного действия НФГ связан с активацией плазменного ингибитора сериновых протеиназ свертывающей системы крови – антитромбина [12]. Активация факторов коагуляции приводит к наработке фибрина и возможному появлению тромбов, а активация ингибитора факторов коагуляции снижает вероятность развития тромбоза. НФГ на поверхности устройств действует как катализатор и не расходуется [11, 13].
Методы иммобилизации гепарина на поверхности материала (полимеры, металлы, сплавы) могут быть различны. Возможно соединение через промежуточное вещество, через активацию, простая инкубация, обработка плазмой и облучение или комбинация методов [4, 5].
В последние годы возросло число публикаций, в которых описано улучшение гемосовместимости и тромборезистентности поверхностей, контактирующих с кровью медицинских приспособлений, за счет включения полисахаридов (гепарин, хитозан, целлюлоза, крахмал), а также моноакрилата полиэтиленгликоля, кластера фосфата кальция, оксида графена и нанопластин графена, фиброина шелка, N‑винил-2-пирролидона, урокановой кислоты, композиции поливинилового спирта/цирконийоксинитрата, гиалуроновой кислоты, фуллеренолов [5, 14, 15]. Выбор полисахаридов связывают с широкой распространенностью, биосовместимостью и отсутствием токсичности.
Для достижения гемосовместимости нередко используют послойное нанесение на поверхность материала гепарина или соединений с антикоагулянтной активностью, чередуя с каким-либо другим соединением. В работе [16] для снижения активации тромбоцитов и скорости гемолиза магниевого сплава, перспективного для сердечно-сосудистого стента, модифицировали поверхность комбинируя химическую обработку с последующим послойным нанесением функционализованного хитозаном оксида графена и гепарина. Авторы работы [17] предложили нетоксичную пленку на основе поли-L-молочной кислоты, часто используемую для изготовления биорезорбируемых сосудистых каркасов, с отличной гемосовместимостью, которая достигалась путем нанесения слоев сульфатированного полисахарида китайского ямса и хитозана со степенью деацетилирования (СД) 95%. Модификация многослойным полиэлектролитом “tanfloc” (гидрофильное, катионное и конденсированное амино-производное танина)/гепарин поверхности титановых нанотрубок привела к появлению противотромботической активности [18].
Несмотря на достижения науки о структурах и биоматериалах контактирующих с кровью актуальность новых разработок несомненна.
Цель работы – анализ in vitro устойчивости поверхности полиуретановых пластин, обработанных слоями кватернизированного хитозана (КватХит) и НФГ, к появлению тромбов (тромборезистентность, ТРЗ).
МЕТОДИКА
В работе был использован коммерческий предварительно обработанный термопластичный полиуретан на основе полиэфира Elastollan 1180a50 (ПУ; BASF Polyurethanes GmbH, Германия). Кватернизированный хитозан (КватХит) со степенью замещения (СЗ) 50%, полученный на основе хитозана с молекулярной массой (ММ) 200 кДа и СД 87% (“Биопрогресс”, Москва), синтезирован по методике [19]. Нефракционированный гепарин (НФГ; “Белмедпрепараты”, Беларусь). Для активации пластин ПУ использовали 1,6-диизоцианатогексан 98%, дибутилдилаурат олова 95% (“Sigma”, США). Другие используемые химические вещества были аналитического класса.
Модификация поверхности полиуретана. Пластину ПУ 1.54 г размером 5 × 5 см, помещали в 100 мл толуола под током азота. Спустя 15 мин, добавляли 5 мл гексаметилендиизоцианата и 0.25 мл дибутилдилаурата олова. Температура реакции 70°C, время реакции 2 ч. По окончании реакции активированную ПУ (актПУ) пластину промывали толуолом, высушивали на воздухе 24 ч.
Затем предварительно активированную и высушенную пластину помещали в 1%-ный раствор КватХит с СЗ 50%, растворенного в 1%-ной уксусной кислоте.
Послойная поверхностная прививка КватХит и НФГ. Процесс получения первого полиэлектролитного бислоя на гидрофильной предварительно активированной и обработанной КватХит ПУ пластине состоял из нескольких последовательных шагов. Первоначально пластину погружали в 0.5% раствор НФГ, приготовленный в 0.15М NaCI, на 15 мин при 23°С. Обработанную пластину промывали дистиллированной водой трехкратно по 5 мин. После чего пластину погружали в 0.1%-ный раствор КватХит, содержащий 0.15М NaCI, приготовленный в 1%-ной уксусной кислоте, и выдерживали при 23°С 15 мин. Промывали дистиллированной водой трехкратно по 5 мин. Далее процесс нанесения бислоев многократно повторяли (n = 9), в результате чего были получены модифицированные ПУ (мПУ) пластины. Последний слой поверхности пластины – нефракционированный гепарин.
ИК-спектроскопия. Спектры образцов были записаны с использованием методики измерения нарушенного полного внутреннего отражения (НПВО) на Фурье-спектрометре Vertex 70 V (“Bruker”, Германия) с использованием аксессуара Pike ATR с алмазным рабочим элементом (“Nicolet”, США); спектры НПВО были усреднены с разрешением 4 см–1. Вся необходимая коррекция была сделана с помощью программного пакета Omnic 8 (“Nicolet”, США).
Атомно-силовая микроскопия. Исследования рельефа поверхности образцов в нанометровом масштабе проводили с помощью атомно-силового микроскопа NTEGRA Prima (“NT-MDT SI”, Россия) в полуконтактном режиме на воздухе. Сканирование осуществлялось с частотой 0.9–1.50 Гц, с разрешением 512 × 512 точек. Использовали кремниевые кантилеверы серии ETALON HA-NC (“TipsNano”, Россия) с резонансной частотой кантилевера 235(A) и 140(B) кГц, радиусом закругления менее 10 нм, жесткостью 12(А) и 3.5(В) Н/м. Обработку результатов проводили с помощью программ NOVA и ImageAnalysis P9 (“NT-MDT SI”, Россия).
Оценка гидрофильности пластин. Измерения производили на цифровом угломере Contact Angle Meter 110 VAC (“Cole-Parmer”, США). Образец фиксировали на предметном стекле. Затем стекло помещали в поле зрения видеокамеры прибора перед источником света. Далее на поверхность образца с помощью микрошприца наносили каплю дистиллированной воды объемом 0.015 мл и измеряли контактный угол между поверхностью и каплей. Контактный угол измеряли не менее чем для 10 капель при температуре 25°C, рассчитывали среднее значение.
Подготовка крови. В исследовании применяли кровь из локтевой вены доноров, стабилизированную водным раствором 0.106 М лимоннокислого натрия Na3C6H6O7 (кровь отбирали до метки в пластиковый шприц S-Monovette 5 mL 9NC, (“Sarstedt”, Германия). Все доноры давали письменное информированное согласие на взятие и использование крови в ФГБУ “НМИЦ гематологии” Минздрава России.
Определение времени рекальцификации крови (ВРК). Влияние ПУ пластин на время свертывания цельной крови человека в тесте ВРК оценивали в соответствии с методом, описанным в статье [20]. Образцы пластин (0.5 × 0.5 см) помещали в пластиковые пробирки эппендорфы, добавляли 0.5 мл стабилизированной 0.106 М Na3C6H6O7 крови человека. Через 20 и 40 мин (при 37°C) отбирали 0.1 мл крови в пробирку для определения времени свертывания, добавляли 0.1 мл раствор CaCl2 (конечная концентрация 0.01 M) и фиксировали время появления фибринового сгустка в секундах на программируемом полуавтоматическом коагулометре АПГ2-01 (Минилаб-701-М, НПО “Эмко”, Россия).
Влияние ПУ пластин на образование сгустков крови. Определяли на поверхности ПУ пластин в соответствии с рекомендациями в работе [21] c некоторыми модификациями. Образцы пластин (0.5 × 0.5 см) помещали в пластиковые пробирки. Затем добавляли 0.5 мл стабилизированной 0.106 М Na3C6H6O7 крови человека и активировали свертывание добавлением водного раствора CaCl2 (конечная концентрация 0.05 M). Через 20, 40, 60, 120, 180 мин (при 37°C) пластины извлекали, фотографировали и помещали в гемолизирующий раствор на 1 ч (37°C). Затем определяли оптическую плотность раствора, полученного после инкубации с пластинами, при длине волны 545 нм на спектрофотометре SmartSpec Plus (“Bio-Rad”, США) [22]. Тромборезистентность (%) пластин рассчитывали по следующей формуле:
Статистическую обработку результатов проводили с использованием программ Biostat и Statistica. Для сравнения ненормально распределенных данных применяли непараметрический U-критерий Манна-Уитни. Результаты работы представлены средними арифметическими значениями ± стандартные ошибки средних арифметических от 6–12 независимых определений. Статистически значимые отличия рядов данных наблюдали при p < 0.05.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
На первой стадии ПУ пластины были активированы с помощью бифункционального реагента гексаметилендиизоцианата. В результате активации происходило введение активной функциональной группы на поверхности ПУ пластин, способной взаимодействовать с производным хитозана, содержащим свободные аминогруппы.
Затем обработанные КватХит ПУ пластины модифицировали методом “слой на слой” полиэлектролитами – НФГ, КватХит, НФГ.
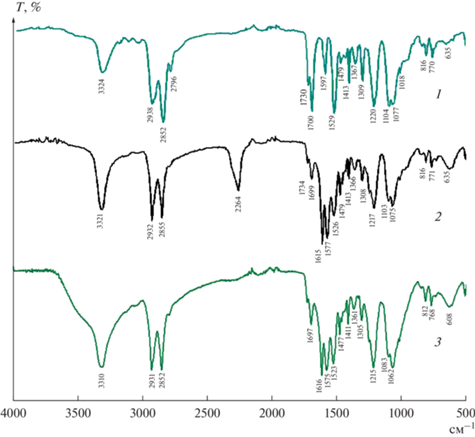
Модифицированная с помощью диизоционата ПУ пластина имела характерный пик в ИК-спектре при 2264 см–1, соответствующий колебаниям новой NCO-функциональной группы (рис. 1, спектр 2). Дальнейшая обработка водным раствором КватХит привела к исчезновению данного сигнала в результате частичного гидролиза активной функциональной группы и взаимодействия с производным хитозана. Также наблюдали сдвиг и уширение сигнала колебаний O–H в области 3310 см–1 за счет вклада гидроксильных групп КватХит на поверхности ПУ пластины (рис. 1, спектр 3).
Поверхность полиуретановых пластин до и после модификации исследовали методом атомно-силовой микроскопии, результаты представлены на рис. 2 и в табл. 1. Исходная поверхность ПУ пластины до модификации относительно гладкая, перепад высот составлял около 100 нм, и достигался, преимущественно, за счет наличия характерных крупных борозд на его поверхности.
Рис. 2.
АСМ-изображения поверхности пластин: а – исходный ПУ; б – актПУ; в – актПУ + 1 слой КватХит; г – актПУ + + 9 бислоев КватХит/НФГ.

Таблица 1.
Высота профиля и среднеквадратичная шероховатость поверхности ПУ пластин, рассчитанные с помощью АСМ, а также данные по измерению контактного угла
| Образец | Перепад высот, нм | Среднеквадратичная шероховатость, нм | Контактный угол, ° |
|---|---|---|---|
| ПУ | 105.3 ± 11.1 | 8.3 ± 4.4 | 86.1 ± 11.3 |
| актПУ | 875.8 ± 150.9 | 143.1 ± 20.7 | 76.5 ± 9.2 |
| актПУ + 1 слой КватХит | 901.6 ± 170.1 | 160.3 ± 34.6 | – |
| мПУ | 760.1 ± 182.2 | 135.5 ±40.1 | 63.2 ± 3.68 |
Рельеф поверхности актПУ пластины значительно отличался от исходной, появлялись выступы и впадины (рис. 2б). После обработки изоцианатом как среднеквадратичная шероховатость, так и высота неровностей профиля, значительно увеличивались в 17 и в 8 раз соответственно (табл. 1). АСМ-изображение ПУ пластины после нанесения на активированную поверхность 1 слоя КватХит представлено на рис. 2в. Морфология поверхности была практически аналогична образцу актПУ пластины: присутствие выступов и впадин также наблюдалось, но на их поверхности различалась полимерная пленка КватХит в виде фибриллярных структур, дополнительно усложняющих рельеф пластины и приводящих к увеличению шероховатости на 12%.
Микрофотография образца мПУ пластины после активации изоцианатом и модификации 9 бислоями КватХит и НФГ представлена на рис. 2г. Снижение шероховатости по сравнению с образцом с 1 слоем КватХит может быть связано с постепенным заполнением впадин, образовавшихся после активации изоцианатом, и сглаживанием общего рельефа в процессе послойного нанесения полимерной пленки.
Измерения значений контактного угла были использованы для характеристики свойств поверхности ПУ пластины до и после модификации полимерным покрытием. Известно, что гидрофобные свойства поверхности материала могут вызывать значительную адгезию тромбоцитов, что может привести к тромбозу [24]. Из данных, представленных в табл. 1 следовало, что снижение величины контактного угла на ПУ пластине, как после активации поверхности изоцианатом, так и в дальнейшем, после нанесения на активированную поверхность 9 полимерных бислоев, может быть связано с наличием функциональных групп –OH и –NН2 на поверхности модифицированных пластин. Придание материалу гидрофильных свойств должно способствовать повышению гемосовместимости медицинских изделий на его основе.
Поверхности материалов для медицинских устройств не должны провоцировать коагуляцию крови или плазмы [25]. В табл. 2 показано, что инкубация крови с мПУ пластинами (0.5 × 0.5 см) приводила к достоверному увеличению (p < 0.05) времени свертывания в тесте ВРК (20 мин – 483.00 ± 22.64 с и 40 мин – 576.50 ± 24.64 с), по сравнению с контролем – инкубация крови с ПУ пластинами (20 мин – 257.50 ± 12.84 с и 40 мин – 273.30 ± 16.60 с), в 1.88 и 2.11 раза соответственно. Следует отметить, что показания в контроле с ПУ пластинами (20 и 40 мин) достоверно не отличались от показаний в контроле без ПУ пластин.
Таблица 2.
Влияние ПУ пластин на время рекальцификации крови человека in vitro
| Вариант опыта | Инкубация, мин | Время рекальцификации крови, с |
|---|---|---|
| Контроль без ПУ | 0 | 290.20 ± 15.80 |
| Контроль с ПУ | 20 | 257.50 ± 12.84 |
| 40 | 273.30 ± 16.60 | |
| Опыт с мПУ | 20 | 483.00 ± 22.64* |
| 40 | 576.50 ± 24.64** |
На рис. 3 (инкубация 180 мин) показаны различия между размерами фибриновых сгустков крови на пластинах ПУ (контроль) и мПУ пластинами (опыт). Ранее нами была обнаружена связь между площадью сгустков крови на фотографиях поверхностей пластин и оптической плотностью растворов, полученных после инкубации пластин в гемолизирующем растворе [23]. С увеличением размера сгустка оптическая плотность раствора после гемолиза возрастала. При инкубации крови человека с ПУ пластинами 20, 40, 60, 120, 180 мин оптическая плотность раствора, полученного после инкубации пластин с гемолизирующим раствором, достигала 0.2563 ± 0.0479 – 0.6208 ± 0.1107 отн. ед., что было в 3.5–13.8 раз выше, чем после инкубации с мПУ пластинами 0.0246 ± 0.0023–0.0899 ± ± 0.0162 отн. ед. (табл. 3). То есть, размеры сгустков на ПУ пластинах были больше, чем на мПУ пластинах. Рассчитанная по оптическим плотностям тромборезистентность мПУ пластин достигала 78.43 ± 4.02–88.94 ± 1.98%. Достоверных различий между тромборезистентностью мПУ пластин после инкубации 20 и 180 мин не наблюдали.
Рис. 3.
Изображения фибриновых сгустков крови на пластинах, время инкубации 180 мин: а – ПУ пластина (контроль); б – мПУ пластина (опыт).

Таблица 3.
Оптическая плотность раствора, полученного после инкубации ПУ пластин с гемолизирующим раствором (n = 6–12)
| Образцы | Время инкубации, мин | OD545, отн. ед. | ТРЗ, % |
|---|---|---|---|
| Опыт с мПУ | 20 | 0.0246 ± 0.0023 | 88.02 ± 1.76 |
| 40 | 0.0453 ± 0.0051 | 83.62 ± 2.06 P vs 20 min = 0.157 |
|
| 60 | 0.0544 ± 0.0083 | 88.94 ± 1.98 P vs 20 мин = 0.665 P vs 40 мин = 0,046 |
|
| 120 | 0.0738 ± 0.0109 | 78.43 ± 4.02 P vs 20 мин = 0.078 P vs 40 мин = 0.544 P vs 60 мин = 0.069 |
|
| 180 | 0.0899 ± 0.0162 | 85.22 ± 1.06 P vs 20 мин = 0.426 P vs 40 мин = 0.888 P vs 60 мин = 0.147 P vs 120 мин = 0.426 |
|
| Контроль с ПУ | 20 | 0.3400 ± 0.0505 | – |
| 40 | 0.2563 ± 0.0479 | – | |
| 60 | 0.4009 ± 0.0250 | – | |
| 120 | 0.2611 ± 0.0329 | – | |
| 180 | 0.6208 ± 0.1107 | – |
Таким образом, обработка поверхности полиуретановых пластин слоями КватХит и НФГ приводила к проявлению ими высокой устойчивости к образованию сгустков крови.
Химическая часть работы выполнена в рамках гранта РФФИ 20-33-70168. Биологическая часть работы выполнена в рамках НИР по Государственному заданию ФГБУ “НМИЦ гематологии” Минздрава России РК № АААА-А21-121011290079-5.
Список литературы
Jaffer I.H., Weitz J.I. // Acta Biomater. 2019. V. 94. P. 2–10. https://doi.org/10.1016/J.ACTBIO.2019.06.021
Avci-Adali M., Ma C., Labarrere C.A., Net C., Kassab G.S., Dabiri A.E. // Front. Bioeng. Biotechnol. 2020. V. 8:123. https://doi.org/10.3389/fbioe.2020.00123
Sukavaneshvar S. // Adv. Drug Deliv. Rev. 2017. V. 112. P. 24–34. https://doi.org/10.1016/J.ADDR.2016.07.009
Maitz M.F., Martins M.C.L., Grabow N., Matschegewski C., Huang N., Chaikof E.L., Barbosa M.A., Werner C., Sperling C. // Acta Biomater. 2019. V. 94. P. 33–43. https://doi.org/10.1016/J.ACTBIO.2019.06.019
Patel H. // Blood Coagul. Fibrinolysis. 2021. V. 32. № 4. P. 237–247. https://doi.org/10.1097/MBC.0000000000001011
Ashcraft M., Douglass M., Chen Y., Handa H. // Biomater. Sci. 2021.V. 9. № 7. P. 2413–2423. https://doi.org/10.1039/D0BM02154G
Jin S., Huang J., Chen X., Gu H., Li D., Zhang A., Liu X., Chen H. // ACS Appl. Bio Mater. 2020. V. 3. № 1. P. 570–576. https://doi.org/10.1021/acsabm.9b00969
Yau J.W., Stafford A.R., Liao P., Fredenburgh J.C., Roberts R., Brash J.L., Weitz J.I. // Acta Biomater. 2012. V. 8. № 11. P. 4092–4100. https://doi.org/10.1016/j.actbio.2012.07.019
Yang Y., Li X., Qiu H., Li P., Qi P., Maitz M.F., You T., Shen R., Yang Z., Tian W., Huang N. // ACS Appl. Mater. Interfaces. 2018. V. 10. № 9. P. 7649–7660. https://doi.org/10.1021/acsami.7b06108
Patent FR. 2016. WO 2016/201202 Al
Biran R., Pond D. // Adv. Drug Deliv. Rev. 2017. V. 112. P. 12–23. https://doi.org/10.1016/J.ADDR.2016.12.002
Guerrini M., Guglieri S., Beccati D., Torri G., Viskov C., Mourier P. // Biochem. J. 2006. V. 399. № 2. P. 191–198. https://doi.org/10.1042/BJ20060656
Tan J., Cui Y., Zeng Z., Wei L., Li L., Wang H., Hu H., Liu T., Huang N., Chen J., Weng Y. // J. Biomed. Mater. Res. A. 2020. V. 108. № 6. P. 1295–1304. https://doi.org/10.1002/jbm.a.36902
Caputo H.E., Straub J.E., Grinstaff M.W. // Chem. Soc. Rev. 2019. V. 48. № 8. P. 2338–2365. https://doi.org/10.1039/C7CS00593H
Kajzer W., Szewczenko J., Kajzer A., Basiaga M., Jaworska J., Jelonek K., Nowińska K., Kaczmarek M., Orłowska A. // Mater. 2021. V. 14. № 10. https://doi.org/10.3390/ma14102551
Gao F., Hu Y., Li G., Liu S., Quan L., Yang Z., Wei Y., Pan C. // Bioact. Mater. 2020. V. 5. № 3. P. 611–623. https://doi.org/10.1016/j.bioactmat.2020.04.016
Yu Y., Cui R., Wang X., Yang H., Li H. // Int. J. Biol. Macromol. 2020. V. 155. P. 14–26. https://doi.org/10.1016/j.ijbiomac.2020.03.180
Sabino R.M., Kauk K., Madruga L.Y.C., Kipper M.J., Martins A.F., Popat K.C. // J. Biomed. Mater. Res. A. 2020. V. 108. № 4. P. 992–1005. https://doi.org/10.1002/jbm.a.36876
Shagdarova B., Lunkov A., Il’ina A., Varlamov V. // Int. J. Biol. Macromol. 2019. V. 124. P. 994–1001. https://doi.org/10.1016/j.ijbiomac.2018.11.209
Gulliani G.L., Hyun B.H., Litten M.B., Am. J. Clin. Pathol. 1976. V. 65. № 3. P. 390–396. https://doi.org/10.1093/ajcp/65.3.390
Wang X., Hu L., Li C., Gan L., He M., He X., Tian W., Li M., Xu L., Li Y., Chen Y. // Int. J. Biol. Macromol. 2016. V. 83. P. 19–29. https://doi.org/10.1016/J.IJBIOMAC.2015.11.052
Dash B.C., Réthoré G., Monaghan M., Fitzgerald K., Gallagher W., Pandit A. // Biomaterials. 2010. V. 31. № 32. P. 8188–8197. https://doi.org/10.1016/j.biomaterials.2010.07.067
Drozd N.N., Shagdarova B.T., Zhuikova Y.V., Il’ina A.V., Vasiliev M.N., Vasilieva T.M., Hein A.M., Varlamov V.P. // Prog. Chem. Appl. Chitin Its Deriv. 2019. V. 24. https://doi.org/10.15259/PCACD.24.001
Obiweluozor F.O., Tiwari A.P., Lee J.H., Batgerel T., Kim J.Y., Lee D., Park C.H., Kim C.S. //Mater. Sci. Eng. C. 2019. V. 99. P. 1274–1288. https://doi.org/10.1016/J.MSEC.2019.02.054
Gorbet M., Sperling C., Maitz M.F., Siedlecki C.A., Werner C., Sefton M.V. // Acta Biomater. 2019. V. 94. P. 25–32. https://doi.org/10.1016/J.ACTBIO.2019.06.020
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология