Прикладная биохимия и микробиология, 2022, T. 58, № 3, стр. 287-293
Фунгицидная и бактерицидная активность хитозанов с разной молекулярной массой и медных комплексов на их основе
Э. В. Попова 1, *, Н. М. Коваленко 1, Н. С. Домнина 2
1 Всероссийский научно-исследовательский институт защиты растений
196608 Санкт-Петербург, Россия
2 Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Россия
* E-mail: elzavpopova@mail.ru
Поступила в редакцию 25.08.2021
После доработки 23.11.2021
Принята к публикации 10.01.2022
- EDN: NUJRXB
- DOI: 10.31857/S0555109922030114
Аннотация
Изучены антибактериальная и антигрибная активности хитозанов с молекулярной массой (ММ) 5, 10, 50, 150 кДа и степенью деацетилирования 85%, а также медных комплексов, полученных на их основе. Установлено, что активность хитозана зависела от ММ хитозана и его концентрации. Показано, что в пределах концентраций 0.02–0.1% антибактериальная и антигрибная активности медных комплексов не зависели от ММ хитозана и была более высокой по сравнению с хитозаном.
Широко распространенный в природе полисахарид хитозан по-прежнему привлекает внимание исследователей благодаря своим уникальным физико-химическим свойствам и биологической активности, а также полной безопасности для окружающей среды [1–4]. В связи с тем, что хитозан получают специальными методами из разнообразных природных источников, то для него характерна структурная неоднородность по многим параметрам [2]. К ним следует отнести молекулярную массу (ММ), количественное соотношение ацетилированных и деацетилированных звеньев в цепи, а также характер их расположения в полимерной цепи. Именно эти особенности хитозана обусловливают многообразие его биологических свойств, что подтверждается многочисленными исследованиями в этой области [5, 6].
Большинство работ, связанных с изучением механизмов антибактериального и антигрибного действия этого биополимера, свидетельствуют о том, что биоцидная активность хитозана связана с его поликатионной структурой и способностью связываться с отрицательно заряженными поверхностными структурами клеток [5, 7]. Механизм проявления такой активности до сих пор не понятен, однако есть четкие доказательства того, что взаимодействие хитозана и его производных с клеточными мембранами на молекулярном уровне приводит к гибели клеток [8–10]. Это так называемый “антибактериальный эффект” хитозана [8]. Первой мишенью действия хитозанового полимера в случае грамотрицательных бактерий становится липополисахарид, который заряжен отрицательно и входит в состав внешней мембраны. У грамположительных бактерий главной мишенью для хитозана могут быть тейхоевые кислоты, отрицательный заряд которым придают многочисленные остатки фосфорной кислоты. В обоих случаях такое взаимодействие нарушает нормальное функционирование обменных процессов клетки с внешней средой, изменяя проницаемость цитоплазматической мембраны, в результате чего усиливается отток веществ из клетки.
Необходимо отметить, что если некоторые авторы выявляют различия в чувствительности грамотрицательных и грамположительных бактерий к хитозану, то в ряде работ делается вывод, что структурные различия клеточной стенки бактерий не являются определяющим при их взаимодействии с полисахаридом [11].
В работе Ильиной с соавт. [12] утверждается, что антибактериальная активность хитозана в отношении грамотрицательных и грамположительных микроорганизмов может зависеть не только от его молекулярной массы, но и от степени дезацетилирования (СД). При тестировании хитозанов с ММ 4 кДа, но с изменяющейся величиной СД (55, 73, 78 и 86%) была установлена тенденция к увеличению уровня гибели клеток по мере увеличения СД полимера. По мнению авторов, высокая концентрация положительных зарядов в цепи хитозана с максимальной СД приводила к образованию наиболее прочной связи с поверхностью клеточной стенки микроорганизмов.
К такому же выводу пришли авторы работы [13] при изучении антибактериальной активности ряда образцов хитозанов, ММ которых изменяли от 2 до 224 кДа и СД с 16 до 84%. Активность образцов оценивали по ингибированию роста и целостности мембран на примере Bacillus cereus, Escherichia coli, Salmonella typhimurium. Авторы пришли к выводу, что хитозаны с высокой СД проявляли повышенную антибактериальную активность [13].
В литературе до сих пор не установлена однозначная корреляция между значением ММ хитозана и его биологическими свойствами [7, 13]. В работе [14] показано, что с увеличение ММ хитозана при воздействии на растущие клетки Bacillus cereus антимикробный эффект усиливался в ряду олигосахаридов до образцов с ММ 628 кДа, что объяснялось увеличением количества аминогрупп, способных прочно связываться с поверхностными структурами клетки. Другие исследователи [15] приходят к противоположному выводу – о более высокой антибактериальной активности низкомолекулярных хитозанов. Биоцидное действие этих полимеров авторы связывают с тем, что такие образцы обладают большей проникающей способностью через клеточную стенку бактерий, что нарушает их функционирование, влияя на физиологические процессы, происходящие внутри клеток, что влечет за собой гибель клетки. К такому же выводу пришли авторы [16] при изучении бактерий, таких как Staphylococcus aureus, Bacillus cereus, Klebsiella pneumoniae и Escherichia coli. Установлено, что чем ниже молекулярная масса хитозана, тем выше антибактериальный эффект. Молекулы низкомолекулярного хитозана могут связываться с ДНК, проникая в ядро клетки, подавляя синтез мРНК [6]. Анализ влияния различных факторов на антибактериальную активность хитозана представлен в последних обзорах [7, 17].
К настоящему времени установлено, что хитозан имеет прямое фунгистатическое действие, которое зависит от его физико-химических свойств, а также вида микроорганизма [18]. К хитозану чувствительны грибы и оомицеты, содержащие незначительное количество хитозана в клеточных стенках, а зигомицеты, содержащие большое количество хитозана в клеточных стенках, устойчивы к его воздействию. Энтомопатогенные грибы, обладающие высокой хитинолитической активностью, устойчивы к действию хитозана.
Противоречивые данные относительно корреляции между противогрибковой активностью и молекулярной массой хитозана также получены в ряде работ [17, 19–21]. Результаты исследования процесса ингибирования хитозаном десяти растительных патогенных грибов: Colletotrichum gloeosporioides, Fusarium oxysporum f.sp cubense, Colletotrichum capsici, Pythium aphanidermatum, Phytophthora parasitica, Curvularia lunata, Rhizoctonia solani, Helminthosporium oryzae, Sphaceloma ampelinum и Fusarium graminearum показали, что полимеры с низкой ММ обладали более высокой степенью ингибирования мицелия, чем высокомолекулярные хитозаны [17, 21]. В работе [19], наоборот, установлено, что с увеличением молекулярной массы растет и антигрибная активность против Candida albicans, Candida krusei и Candida glabrata.
Необходимо добавить, что и вид микроорганизма также определяет их восприимчивость к хитозану с разной молекулярной массой, что показано в работе [20]. Грибы Puccinia asparagi и Fusarium oxysporum оказались чувствительнее к хитозану с низкой молекулярной массой, тогда как против Stemphylium solani более эффективен был хитозан с высокой молекулярной массой.
Также важным фактором проявления противогрибковой активности является степень деацетилирования хитозана: с увеличением СД возрастает и антигрибная активность [22]. Варьирование двух характеристик хитозана (СД и ММ) позволяет найти комбинацию, приводящую к максимальному результату по этому параметру. Вывод, что антигрибная активность больше при высоком значении СД и низкой величине МM был подтвержден на различных видах патогенов: Candida albicans [22], Aspergillus fumigatus [23] и Aspergillus flavus [24].
Механизм антигрибного действия хитозана по аналогии с бактериями связывают с нарушением структуры клеточной стенки, ведущим к изменению морфологии мицелия, жизнеспособности спор, нарушению целостности грибной цитоплазматической мембраны, что приводит к выходу из клеток цитоплазматического содержимого. Электростатическое взаимодействие положительно заряженных свободных аминогрупп хитозана с отрицательно заряженными фосфолипидами мембран клеток грибов подтверждается его зависимостью от рН, различного для низко- и высокоацетилированного хитозана с одинаковой молекулярной массой и концентрацией в среде [18–24]. В связи с этим хитозаны с большей СД (86–90%) во всех случаях проявляли более сильное фунгистатическое действие. Этот параметр играет решающую роль в адгезии хитозана к клеткам мицелия и спор грибов. Таким образом, можно считать установленным, что любая биологическая активность хитозана в первую очередь определяется наличием положительного заряда на его макромолекулах.
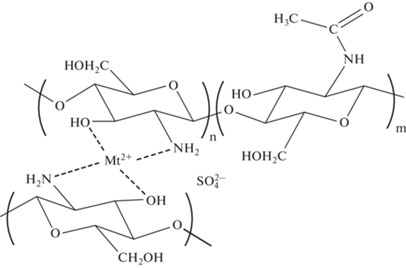
В последние два десятилетия многие исследования были направлены на повышение активности хитозана за счет увеличения плотности положительного заряда, за счет введения в его состав биологически активных веществ, целенаправленно усиливающих его биоцидную активность. С этой точки зрения большой интерес представляет способность хитозана образовывать комплексы с различными металлами, которые, с одной стороны, сами обладают биоцидной активностью и, с другой стороны, могут использоваться растениями в качестве катализаторов биохимических процессов. В последнее время наиболее распространенной стратегией повышения антимикробных свойств хитозана является его использование в сочетании с металлами и их наночастицами [25–27].
Ранее нами [28] были получены комплексы хитозана (ММ = 3–150 кДа) с металлами (Cu, Zn, Fe), показывающие высокую антигрибную активность в отношении F. oxysporum. Наиболее активными оказались комплексы хитозана с медью.
Цель работы – сравнительное изучение антибактериальной и антигрибной активностей хитозанов с СД 85% и разной ММ, а также медных комплексов, полученных на их основе.
МЕТОДИКА
Методом окислительной деструкции [29] высокомолекулярного хитозана Хит-150 (ММ = 150 кДа, СД = 85%) получено 3 образца с ММ 5, 10 и 50 кДа, соответственно Хит-5, Хит-10, Хит-50. Значение СД, определенное для всех образцов методом потенциометрического титрования [30], составляло 85%.
На основе полученных образцов синтезированы комплексы хитозана с медью (Хит + Cu), как описано в работе [28]. Для этого 0.5 г хитозана растворяли в 100 мл 4%-ной уксусной кислоты, вносили 0.77 г CuSO4 × 5H2O, добавляли раствор щелочи (10%-ный KOH), доводя pH до 5.6. Смесь перемешивали при 20°С в течение 3 ч, затем продукт осаждали ацетоном, центрифугировали, промывали этанолом, фильтровали и высушивали в вакууме. Выход комплекса состовлял 60–80% в зависимости от ММ хитозана.
Содержание меди в предварительно минерализованных образцах комплексов хитозана определяли фотометрически на приборе “UV-2600 Shimadzu” (Япония) по известной методике, использованной ранее в работе [28], основанной на взаимо-действии ионов Cu с органическим реагентом (пикрамин-эпсилон) с образованием окрашенного комплексного соединения. ИК-спектры хитозана и его комплексов снимали на Фурье-спектрометре “Spectrum BX” (“Perkin Elmer Inc.”, США) в таблетках с KBr.
Получены и испытаны следующие образцы: хитозаны (Хит-5; Хит-10; Хит-50; Хит-150) и медные комплексы на их основе (Хит-5 + Cu; Хит-10 + + Cu; Хит-50 + Cu; Хит-150 + Cu).
Во всех экспериментах по оценке биологической активности хитозанов и их комплексов для растворения была использована 0.1%-ная янтарная кислота, не обладающая антимикробной активностью.
Антибактериальную активность образцов хитозана оценивали по их способности подавлять рост культур бактерий, вызывающих заболевания сельскохозяйственных культур: Bacilus polymyxa (Prazmowski 1880) Mace 1989 – бактериальная гниль клубней картофеля; Pseudomonas syringae syringae pv tomato – пятнистость томата; Erwinia carotovora (syn. Pectobacterium carotovorum) – вызывает болезни картофеля и др. растений, называемые “черная ножка”.
Тест-культуры получены из коллекций типовых культур ВНИИСХМ и лаборатории микробиометода ВИЗР (Россия). Оценку антимикробной активности образцов хитозана проводили методом диффузии в агар (метод лунок) раствора испытуемого соединения [31]. Метод основан на сравнении ингибирования роста тест-микроорганизма испытуемым раствором хитозана по отношению к контролю (дистиллированная вода) и определении биологической активности по зоне ингибирования роста тест-микроорганизма (радиус зоны ингибирования роста тест-организма в мм).
В стерильные чашки Петри разливали охлажденный до 45°С картофельно-глюкозный агар. После застывания на поверхность агара наносили 0.2 мл суспензии испытуемых бактерий с титром 106 КОЕ/мл. После посева агара чашки оставляли на 1–2 ч для впитывания инокулюма. Затем на поверхности агара стерильным сверлом делали лунки диаметром 6 мм. В лунки каждой чашки одновременно вносили по 0.2 мл раствора испытуемых образцов в концентрации 0.2% и раствора стандарта. В качестве стандарта служил 0.1%-ный раствор янтарной кислоты. После этого чашки оставляли в течение 1–2 ч при комнатной температуре, а затем помещали в термостат и выдерживали при 25°С в течение 48 ч. Для каждого рабочего раствора измеряли зоны ингибирования роста тест-штамма микроорганизмов в мм (радиус).
Изучение антигрибной активности препаратов проводили методом агаровых блоков [32]. В качестве тест-культур использовали Fusarium oxysporum (Schlecht.) f. sp. lycopersici (Sacc.), вызывающего фузариозное увядание томата, Slerotinia sclerotiorum, вызывающего белую гниль огурцов, томата и др. культур, а также Cochliobolus sativus (S. Ito & Kurib.) Drechsler ex Dastu – возбудителя темно бурой пятнистости пшеницы. При тестировании методом блоков в теплую агаризованную среду Чапека вносили растворы испытуемых образцов хитозана и медных комплексов на его основе, рассчитывая конечную концентрацию в среде. После застывания среды на ее поверхности устанавливали агаровые блоки 7-суточной тест-культуры, вырезанные стерильным пробочным сверлом, затем чашки Петри помещали в термостат при 22‒25°С. Фунгистатическую активность оценивали по диаметру подавления роста тест-культуры на 5 сут выращивания. Контролем служили чашки со средой Чапека без испытуемых веществ.
Влияние хитозановых образцов на прорастание конидий С. sativus проводили также в капле (200 мкл) на предметных стеклах, в темноте при 22°С, во влажной камере в течение 24, 48 и 72 ч. К 0.1мл 0.05%-ного раствора образца добавляли 0.1 мл суспензии спор аскомицета (104). Прорастание конидий оценивали микроскопированием, просматривая не менее 100–200 спор в варианте опыта и в контроле (в воде). Частоту прорастания выражали в процентах от общего числа спор, просмотренных в контроле и опыте [33].
Все опыты проводили в 3-кратной повторности, полученные данные обрабатывали с использованием методов описательной статистики (на основе стандартных ошибок средних ±SEM). Наименьшая существенная разница (НСР) использовалась для сравнения средних значений при р < 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Известно, что благодаря наличию функциональных групп хитозан является хорошим хелатирующим агентом и легко образует комплексы с ионами металлов с переменной валентностью [34]. Для доказательства образования и подтверждения структуры комплексов хитозан-металл, как правило, используют спектральные методы [35].
Ранее было показано [28], что в результате координации между металлом (Cu) и аминными группами хитозана в ИК-спектрах наблюдалось смещение максимумов поглощения валентных и деформационных колебаний NH-связей в сторону низких частот и появлялся максимум при 1560 см–1, обусловленный деформационными колебаниями NH-связей в аминных группах хитозана, связанных с металлом. На основании этих данных была предложена структура комплексов хитозан-металл, подтвержденная в последующем другими исследователями [6].
Содержание меди в комплексах, рассчитанное в максимуме поглощения при 551 нм, составило 10 ± 1%, что соответствует мольному соотношению медь : хитозан – 1 : 4.
Известно, что механизм действия хитозанов на микроорганизмы связан с нарушением целостности наружной мембраны [5, 10].
С учетом разного строения клеточных стенок бактерий для испытания прямой антибактериальной активности были взяты грамотрицательные (P. syringae, E. carotovora) и одна грамположительная (B. polymyxa) бактерии.
В табл. 1 приведены экспериментальные данные по антигрибной и антибактериальной активностям хитозанов и медных комплексов, полученных на их основе.
Таблица 1.
Антигрибная и антибактериальная активности образцов хитозанов и соответствующих комплексов с медью (концентрация 0.2%)
| Образец | Ингибирование роста мицелия на 5 сут, % | Диаметр зоны отсутствия роста тест-культур, мм | |||
|---|---|---|---|---|---|
| F. oxysporum | S. sclerotiorum | Грам (–) | Грам (+) | ||
| P. syringae | E. carotovora | B. polymyxa | |||
| Хит-5 | 79.6 | 82.2 | 0.80 | 1.5 | 1.5 |
| Хит-10 | 83.1 | 83.3 | 1.0 | 1.5 | 1.5 |
| Хит-50 | 82.3 | 82.2 | 1.5 | 1.8 | 1.7 |
| Хит-150 | 79.1 | 66.6 | 0.5 | 0.7 | 0.7 |
| Хит-5 + Cu | 85.7 | 83.3 | 2.5 | 2.0 | 1.8 |
| Хит-10 + Cu | 87.5 | 86.6 | 2.0 | 2.0 | 1.5 |
| Хит-50 + Cu | 87.5 | 83.5 | 3.0 | 3.3 | 3.5 |
| Хит-150 + Cu | 85.0 | 78.9 | 2.5 | 3.0 | 2.5 |
| 0.1%-ный водный раствор янтарной кислоты | 0 | 0 | 0 | 0 | 0 |
| НСР* (р < 0.05) | 2.2 | 2.0 | 0.05 | 0.1 | 0.15 |
Следует отметить, что большинство исследователей при изучении антибактериальной и антигрибной активности хитозана в качестве растворителя используют 0.2%-ную соляную или уксусную кислоты [36], которые сами по себе обладают антимикробной активностью. В данной работе для растворения образцов хитозанов использовали водный раствор янтарной кислоты, не влияющую на линейный рост тест-культур (см. табл. 1). Показано, что все образцы хитозана обладали высокой антигрибной активностью, сдерживая рост мицелия гриба F. oxysporum на 79.1–83.1%, а S. sclerotiorum на 66.6–83.3%. Например, на 5 сут культивирования антигрибная активность хитозанов с ММ 5–50 кДа практически не менялась по отношению к грибу S. sclerotiorum, а с увеличением ММ хитозана до 150 кДа снижалась до 66.6%. Как и ожидалось, медные комплексы хитозанов обладали более высокой степенью ингибирования роста мицелия грибов по сравнению с хитозанами.
Из табл. 1 видно, что все образцы хитозана с ММ от 5 до 150 кДа обладали антибактериальной активностью, как по отношению к грамположительным, так грамотрицательным бактериям. Менее чувствительным к действию хитозанов оказался штамм Pseudomonas syringae, что, скорее всего, связано с его особенностями.
Модельный опыт по оценке действия хитозана Хит-5 на прорастание конидий C. sativus показал, что при концентрации 0.05% на вторые сутки достигался 50%-ный ингибирующий эффект, который постепенно повышался по мере увеличения концентрации полимера (табл. 2).
Таблица 2.
Влияние концентрации хитозана с молекулярной массой 5 кДа (Хит-5) на прорастание конидий С. sativus на 2 и 3 сут
| Концентрация хитозана, % | Количество проросших конидий С. sativus, % | |
|---|---|---|
| 2 сут | 3 сут | |
| Контроль (без хитозана) | 85 | 100 |
| 0.02 | 60 | 80 |
| 0.05 | 55 | 80 |
| 0.1 | 45 | 85 |
| 0.2 | 15 | 70 |
| 0.5 | 10 | 65 |
| НСР (р < 0.05) | 3.2 | 3.5 |
Результаты оценки антигрибной активности хитозана с разной молекулярной массой в отношении C. sativus представлены в табл. 3. Отмечена следующая тенденция: чем меньше ММ, тем в большей степени выражена противогрибковая активность. Закономерным является рост антигрибной активности по мере увеличения концентрации образца. Например, радиальный рост С. sativus подавлялся от 58.7 до 68.6% на 5 сут инкубации при увеличении концентрации хитозана Хит-5 с 0.05 до 0.1%. При более низкой концентрации (0.02%) хитозан мог ингибировать только 48.0% радиального роста мицелия гриба на 5 сут инкубации.
Таблица 3.
Влияние концентрации образцов хитозана (%) и соответствующих медных комплексов на подавление роста мицелия на 5 сут и прорастание конидий С. sativus на 2 сут
| Образец | Подавление роста мицелия, % | Количество проросших конидий, на 2 сут, % от контроля* | ||
|---|---|---|---|---|
| концентрация образца, % | ||||
| 0.1 | 0.05 | 0.02 | 0.05 | |
| Хит-5 | 68.6 | 58.7 | 48.0 | 70 |
| Хит-10 | 71.1 | 55.0 | 46.2 | 75 |
| Хит-50 | 64.3 | 47.5 | 43.7 | 70 |
| Хит-150 | 61.1 | 45.3 | 40.0 | 70 |
| Хит-5+ Cu | 88.6 | 84.0 | 70.0 | 10 |
| Хит-10+ Cu | 86.1 | 83.0 | 71.1 | 7 |
| Хит-50+ Cu | 85.8 | 85.2 | 73.7 | 5 |
| Хит-150+ Cu | 88.0 | 86.0 | 75.0 | 5 |
| НСР (р < 0.05) | 2.3 | 1.8 | 2.0 | 4.6 |
Введение меди с образованием комплекса значительно повышало биоцидную активность по сравнению с активностью исходного хитозана, что связано с увеличением положительного заряда хитозана в присутствие ионов металлов. Кроме того, это повышало способность поликатиона адсорбироваться на отрицательно заряженной поверхности клетки микроба. Из результатов, представленных в табл. 3 видно, что медные комплексы хитозана независимо от его исходных характеристик проявляли высокую антигрибную активность, подавляя рост мицелия гриба C. sativus на 85.8–88.6% при концентрации 0.1%. Повышенная антигрибная активность комплексов сохранялась при применении их и в меньших концентрациях. В пределах концентраций 0.02–0.1% биоцидная активность комплексов практически не зависела от величины ММ исходного хитозана. Эта же закономерность выявлена в опыте по оценке влияния испытуемых образцов (0.05%) на прорастание конидий гриба C. sativus.
Установлено, что при использовании образцов хитозана в концентрации 0.05% разница в ингибировании прорастания конидий C. sativus определялась временем экспозиции, но не величиной ММ полимера (табл. 4). При этом из данных табл. 4 видно, что медный комплекс на основе хитозана Хит-5 полностью подавлял прорастание конидий гриба С. sativus в течение 2 сут и приводил к значительному снижению количества проросших спор аскомицета (до 10%) по сравнению с контролем (100%) на 3 сут инкубации.
Таблица 4.
Действие хитозанов и их медных комплексов на прорастание конидий С. sativus (концентрация образцов 0.05%)
| Образец | Количество проросших конидий С. sativus, % | ||
|---|---|---|---|
| 1 сут | 2 сут | 3 сут | |
| Контроль | 60 | 90 | 100 |
| Хит-5 | 10 | 60 | 70 |
| Хит-10 | 15 | 70 | 75 |
| Хит-50 | 10 | 65 | 70 |
| Хит-150 | 15 | 60 | 70 |
| Хит-5+ Cu | 0 | 0 | 10 |
| Хит-10+ Cu | 0 | 0 | 7 |
| Хит-50+ Cu | 0 | 0 | 5 |
| Хит-150+ Cu | 0 | 0 | 5 |
| НСР (р < 0.05) | 1.5 | 2.8 | 3.3 |
В результате проведенных исследований получены оригинальные данные, которые позволили выявить общие закономерности в проявлении биологической активности хитозанов с разной молекулярной массой, но с одинаковой СД (85%), а также их медных комплексов на всех тест-объектах. Так, с увеличением ММ от 5 до 50 кДа антимикробная и антибактериальная активности увеличивались, а затем наблюдалась тенденция к их снижению. Включение в хитозан меди с образованием хелатного комплекса (Хит + Cu) способствовало повышению биологической активности независимо от величины ММ и типа микроорганизма. Это открывает возможность успешного использования комплексов хитозана с медью в сельскохозяйственной практике против широкого круга возбудителей болезней растений.
Список литературы
El Hardrami A., Adam L. R., El Hadrami I., Daayf F // Marine Drugs. 2010. V. 8. № 4. P. 968–987.
Хитозан. / Ред. К.Г. Скрябин, С.Н. Михайлов, В.П. Варламов. М.: Центр “Биоинженерия” РАН, 2013. 593 с.
Kabanov V.L., Novinyuk L.V. // Food Syst. 2020. № 3. P. 10–15.
Wang W., Xue C., Mao X. // Int. J. Biol. Macromol. 2020. V. 164. P. 4532–4546.
Варламов В.П., Ильина А.В., Шагдарова Б.Ц., Луньков А.П., Мысякина И.С. // Успехи биологической химии. 2020. Т. 60. С. 317–368.
Ardean C., Davidescu C.M., Nemes N.S.¸ Negrea A., Ciopec M., Duteanu N., Negrea P. Duda-Seiman D., Mus-ta V. // Int. J. Mol. Sci. 2021. V. 22. № 14. P. 7449.
Jianhui Li., Shaoling Z. // European Polymer Journal. 2020. V. 138. https://doi.org/10.1016/j.eurpolymj.2020.109984
Hosseinnejad M., Jafari S.M. // Int. J. Biol. Macromol. 2016. V. 85. P. 467–475.
Verlee A., Mincke S., Stevens C.V. // Carbohydr. Polym. 2017. V. 164. P. 268–283.
Matica M.A., Aachmann F.L., Tøndervik A., Sletta H., Ostafe V. // Int. J. Mol. Sci. 2019.V. 20. P. 5889. https://doi.org/10.3390/ijms20235889
Kong M., Chen X.G., Xing K., Park H.J. // Int. J. Food Microbiology. 2010. V. 144. P. 51–63.
Ильина А.В., Варламов В.П. // Прикл. биохимия и микробиология. 2003. Т. 39. № 3. С. 273–277.
Mellegård H., Strand S.P., Christensen B.E., Granum P.E., Hardy S.P. //.Int. J. Food Microbiol. 2011. V. 148. P. 48–54.
Fernandes J.C., Eaton P., Gomes A.M., Pimtado M.E., Xavier Malcata F. // Ultramicroscopy. 2009. V. 109. № 8. P. 854–860.
Kumar A.B.V., Varadaraj M.C., Tharanathan R.N. // Biomacromoleculers. 2007. V. 2. № 2. P. 566–572.
Hafdani F., Sadeghinia N. // World Acad. Sci., Engineering and Technology. International Journal of Pharmacological and Pharmaceutical Sciences. 2011. V. 5. № 2. P. 46–50.
Attjioui M., Gillet D., El Gueddari N.E., Moerschbacher B.M. // MPMI. 2021. V. 34. № 7. P. 770–778.
Matica A., Menghiu G., Ostafe V. // New Front. Chem. 2017. V 26. № 1. P. 55–63.
Seyfarth F., Schliemann S., Elsner P., Hipler U.C. // Int. J. Pharm. 2008. V. 353. № 1–2. P. 139–148.
Li R., Guo Z., Jiang P. // Carbohydrate Research. 2010. № 345. P. 1896–1900.
Singburaudom N., Piasai O., Dethaub T. // Kasetsart J. (Nat. Sci.) 2011. V. 45. P. 644–655.
Hongpattarakere T., Riyaphan O. // J. Sci. Technol. 2008. № 30. P. 1–9.
Cé R., Marchi J.G., Bergamo V.Z., Fuentefria A.M., Lavayen V., Guterres S.S., Pohlmann A.R. // Colloids and Surfaces A: Physicochemical and Engineering Aspects. 2016. № 511. P. 153–161.
de Oliveira Pedro R., Takaki M., Gorayeb T.C.C., Bianchi V.L.D., Thomeo J.C., Tiera M.J., de Oliveira Tie-ra V.A. // Microbiol. Res. 2013. V. 168. № 1. P. 50–55.
Swati Choudhary M.K., Joshi A., Saharan V. // Int. J. Current Microbiol. Appl. Sci. 2017. V. 6. № 11. P. 1335–1350.
Al-Dhabaan F.A., Shoala. Ali A.A.M., Alaa M., Abd-Elsalam K. // Int. J. Agric. Technol. 2017 V. 13. № 5. P. 753–769.
Gritsch L., Lovell C., Goldmann W., Boccaccini A. // Carbohydr. Polym. 2018. V. 179. P. 370–378.
Власов П.С., Киселев А.А., Домнина Н.С., Попова Э.В., Тютерев С.Л. // Журн. прикладной химии. 2009. Т. 82. № 9. С. 1571–1575.
Muzzarelli Riccardo, A.A. Chitin. Oxford: Pergamon Press, 1977. 309 p.
Kong X. // Carbohydr. Polym. 2012. № 88. P. 336–341.
Кулешова С.И. // Ведомости Научного центра экспертизы средств медицинского применения 2015. № 3. С. 13–17.
Методические рекомендации по испытанию химических веществ на фунгицидную активность. / Ред. Е.И. Андреева, В.С. Картомышев. НИИТЭХИМ, 1990. С. 4–5.
Palma-Guerrero J., Jansson H.-B., Salinas J., Lopez-Llorca L.V. // J. Appl. Microbiol. 2008. V. 104. № 2. P. 541–53.
Divya K., Vijayan S.,George T.K., Jisha M.S. // Fibers Polim. 2017. V. 18. № 2. P. 221–230.
Курек Д.В. В Хитозан. / Ред. К.Г. Скрябин, С.Н. Михайлов, В.П. Варламов. М.: Центр “Биоинженерия” РАН, 2013. С. 61–70.
Abdeltwab W.M., Abdelaliem Y.F., Metry W.A., Eldeghedy M. // J. Adv. Lab. Res. Biol. 2019. V. 10. № 1. P. 8–15.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология