Прикладная биохимия и микробиология, 2022, T. 58, № 3, стр. 294-301
Применение хитозана в защите пшеницы от болезней и повышении урожайности
Л. Е. Колесников 1, *, Э. В. Попова 2, И. И. Новикова 2, Ю. Р. Колесникова 3, Е. Д. Балагурова 1
1 Санкт-Петербургский государственный аграрный университет"
196601 Санкт-Петербург, Россия
2 Всероссийский научно-исследовательский институт защиты растений
196608 Санкт-Петербург, Россия
3 Федеральный исследовательский центр Всероссийский институт генетических ресурсов растений
им. Н.И. Вавилова (ВИР)
190000 Санкт-Петербург, Россия
* E-mail: kleon9@yandex.ru
Поступила в редакцию 24.08.2021
После доработки 24.10.2021
Принята к публикации 10.01.2022
- EDN: QFBWWE
- DOI: 10.31857/S0555109922030072
Аннотация
Изучена эффективность защитного действия двух комплексов хитозана с биологически активными веществами. Комплекс Хитозан I – включал 0.1%-ный раствор (по хитозану, хитозана 100 и 50 кДа (1 : 1), янтарную кислоту, глутаминовую кислоту, 0.025%-ную салициловую кислоту. Хитозан II включал 0.1%-ный раствор (по хитозану), хитозана 50 кДа, янтарную кислоту, глутаминовую кислоту; 0.0015%-ную индолилуксусную кислоту и 0.1%-ный салицилат хитозана 60 кДа, который имел в своем составе 25% ионно-связанных фрагментов салициловой кислоты. Комплексы Хитозан I и Хитозан II существенно снижали поражение пшеницы бурой ржавчиной и септориозно-пиренофорозной пятнистостью, а в варианте Хитозан I отмечено снижение развития мучнистой росы. Салицилат хитозана (0.1%) уменьшал степень поражения пшеницы корневой гнилью на 79%, желтой ржавчиной на 29.1%, подавлял развитие мучнистой росы, увеличивал урожайность на 32.8% и статистически достоверно повышал значения 55.6% показателей, характеризующих рост и развитие пшеницы, продуктивность и урожайность. Комплексы “Хитозан I” и “Хитозан II” оказали существенное влияние на 11.1% и 27.8% показателей продуктивности пшеницы соответственно.
В настоящее время большое внимание при возделывании сельскохозяйственных культур уделяется ресурсосберегающим технологиям, основанным на использовании биопрепаратов, содержащих биологически активные вещества, в том числе различные органические соединения. Биопрепараты на основе хитозана могут стать альтернативой химическим препаратам, поскольку известно, что хитозан стимулирует рост и развитие растений, а также повышает фитоиммунитет [1]. Химические пестициды и удобрения, особенно при неправильном применении, могут наносить существенный урон агроэкосистемам и представлять реальную опасность для окружающей среды. Биопрепараты на основе хитозана можно использовать для замачивания семян, опрыскивания растений или внесения в почву. Однако в связи с тем, что хитозан не растворяется ни в органических растворителях, ни в воде, то в качестве основы препаратов целесообразно использовать его производные и их олигомеры [2].
Хитозан и его производные обладают выраженным антимикробным, противовирусным, фунгицидным действием [3]. Однако эффективность его олигомеров зависит от молекулярной массы хитозана [4]. В частности, сильным бактерицидным действием обладает N-карбоксибутилхитозан [5], композиты хитозана, содержащие никель и медь [6].
Хитозан в концентрации 1.0 мг/мл ингибировал рост большинства микромицетов in vitro, однако некоторые микромицеты, в основном из класса зигомицет, проявляли устойчивость к фунгицидному действию хитозана, что обусловлено наличием в составе их клеточных стенок природного хитозана [7].
В работе [8] описаны 24 производных хитозана (N-алкил, N-бензилхитозаны, N-додецилхитозан, N-(2,6-дихлорбензил, N-(p-изопропилбензил и др.), обладающие фунгицидными свойствами, в частности, в отношении Pyricularia grisea и Botrytis cinerea. Производное хитозана, полученное добавлением к хитозану N-метиленфосфоновой кислоты, ингибировало развитие Fusarium solani f. sp. eumartii (F. eumartii), а также было эффективно против Botrytis cinerea и Phytophthora infestans. Кроме того, такая модификация хитозана обладала высокой избирательностью токсического действия на микромицетов, что особенно важно при разработке биопрепаратов на ее основе [9].
При воздействии на растения хитозан может стимулировать реакции сверхчувствительности и синтез фитоалексинов, защитных белков и ингибиторов протеиназ [10, 11].
При обработке пшеницы наночастицами салицилата хитозана на различных стадиях роста и развития растений выявлено повышение активности фотосинтетических пигментов (хлорофилла a и b) и ряда показателей, характеризующих структуру урожайности, в том числе, длину колоса, количество колосков в колосе, массу зерна колоса [12].
Хитозан и салициловая кислота (0.5 и 1.0 мМ) повышали устойчивость пшеницы к засухе, о чем свидетельствует морфологические, физиологические и фитохимические характеристики растений. Роль хитозана и СК в снижении негативных последствий водного стресса и повышении засухоустойчивости растений обусловлена их участием в регуляции осмотического баланса растений путем накопления пролина и растворимых сахаров, снижения уровня малонового диальдегида и активацией антиоксидантной системы [13]. Положительное действие хитозана на пшеницу, возделываемую в условиях недостаточного увлажнения, подтверждается в работе [14].
Таким образом, профилактическая обработка растений хитозаном и его производными может способствовать повышению их адаптивного потенциала к условиям выращивания, способствует выработке антиоксидантных ферментов, вторичных метаболитов и абсцизовой кислоты [15].
В ВИЗР С. Л. Тютеревым [16] разработана концепция создания препаратов-индукторов на основе хитозана для применения в защите растений. Увеличение биологической эффективности препаратов достигается путем создания механической смеси хитозана с биологически активными веществами (БАВ) – сигнальными молекулами, физиологически активными органическими кислотами, в том числе – салициловой кислотой (СК), которая в качестве основного индуктора устойчивости занимает ключевую позицию в защите растений от вредных организмов [17].
Цель настоящей работы – анализ эффективности двух комплексов хитозана с добавлением различных биологически активных веществ и 0.1%-ного салицилата хитозана при выращивании мягкой пшеницы.
МЕТОДИКА
Для проведения исследований был использован сорт мягкой пшеницы Triticum aestivum L. Ленинградская 6, к-64900, предоставленный отделом генетических ресурсов пшеницы ВИРа.
Образцы пшеницы были высеяны на учетных делянках площадью 1.0 м2 рядовым способом посева с междурядьями 15 см и расстоянием в ряду 1–2 см (400 зерен/м2). Глубина заделки семян: 5–6 см. Полевой опыт по определению влияния хитозановых комплексов и 0.1%-ного салицилата хитозана на продуктивность пшеницы и интенсивность развития возбудителей болезней был заложен в трехкратной повторности.
– Схема опыта предусматривала четыре варианта: без обработки (контроль – вода);
– комплекс Хитозан I – 0.1%-ный раствор по хитозану: хитозан 100 кДа : хитозан 50 кДа (1 : 1), янтарная кислота, глутаминовая кислота, 0.025% салициловая кислота. Для приготовления 100 мл 0.1% раствора хитозана к 100 мг смеси хитозанов – хитозана 100 кДа : хитозана 50 кДа (1 : 1) добавляли 50 мг янтарной и 50 мг глутаминовой кислоты, в дальнейшем, смесь растворяли в 100 мл воды;
– комплекс Хитозан II – 0.1% раствор по хитозану: Хитозан 50 кДа; янтарная кислота, глутаминовая кислота; 0.0015% индолилуксусной кислоты);
– 0.1%-ный салицилат хитозана 60 кДа, содержащий 25% ионно-связанных фрагментов салициловой кислоты.
Схема полевого опыта включала обработку семян пшеницы Ленинградка 6, к-64900 препаратами перед посевом и четырехкратное опрыскивание вегетирующих растений в фазы кущения, выхода в трубку, колошения и цветения. Норма расхода рабочей жидкости при обработке семян полусухим способом – 1 мл/100 г, при опрыскивании растений – 100 мл/м2.
Продуктивность пшеницы характеризовали с помощью определения 18 показателей: длины колоса, числа колосков в колосе, числа зерен в колосе, массы зерен одного колоса, массы 1000 зерен, массы колоса, высоты растения, фазы растения по шкале Эукарпиа (Цадокса), числа и длины корней (главный зародышевой корень, зародышевые и колеоптильные корни), количества и длины узловых корней, массы корней, продуктивной и общей кустистости, площади флагового и предфлагового листа пшеницы, массы вегетативной части растений (без корней и колоса). В каждом варианте опыта оценивали 20 растений [18].
Потенциальную урожайность пшеницы Yр. (т/га) рассчитывали по продуктивной кустистости и числу растений, высеянных на 1 м2: Yр = 10 × × MкKпPп, где Mк – масса зерен колоса одного растения, г; Kп – продуктивная кустистость образца; Pп – плотность посева (количество растений на 1 м2).
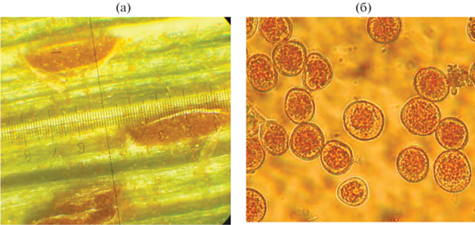
Оценку степени поражения растений гельминтоспориозной корневой гнилью Bipolaris sorokiniana (Sacc.) Shoem. (рис. 1), по вариантам опыта проводили в лабораторных условиях в фазы кущения пшеницы и колошения-цветения в соответствии с общепринятой методикой [19].
Рис. 1.
Конидии Bipolaris sorokiniana (Sacc.) Shoem. – возбудителя гельминтоспориозной корневой гнили (увеличение 600×).
При оценке интенсивности поражения пшеницы возбудителями болезней анализировали комплекс показателей патогенеза с использованием общепринятых шкал учета и расчетных дополняющих характеристик: мучнистая роса Blumeria graminis (DC.) Speer. (степень развития, число и площадь пятен с налетом); бурая ржавчина пшеницы (рис. 2); Puccinia triticina Erikss. (степень развития, число пустул, площадь пустулы); желтая ржавчина пшеницы Puccinia striiformis West. (степень развития, число и длина полос с пустулами, число пустул в полосе, суммарное число пустул на лист, площадь пустулы); септориозно-пиренофорозная пятнистость Stagonospora nodorum (Berk.) Berk., Septoria tritici Roberge et Desm., Pyrenophora tritici repentis (Died.) Drechsler (степень развития). Оценивали интенсивность поражения флаговых и предфлаговых листьев пшеницы [20].
Размер пустул для видов ржавчины и пятен с налетом для возбудителя мучнистой росы устанавливали с помощью окулярного и объективного микрометров, предполагая их эллиптическую форму, с использованием формулы: Sп. = m πab, где а и b – значения полуосей эллипса (в линиях окулярного микрометра), m – масштабный коэффициент микроскопа, Sп. – площадь пустулы или пятна с налетом (мм2).
Алгоритм компьютерной обработки данных опыта включал создание первичной электронной базы данных измерений в электронной таблице Microsoft Excel, кодирование показателей измерений и формирование кодировочной таблицы результатов опыта в системе IBM SPSS. Кроме того, для наглядного представления результатов опыта использованы графические возможности пакета Statistica.
Статистическую обработку данных осуществляли с использованием методов параметрической статистки. Рассчитывали средние значения показателей, стандартную ошибку для средних, 95%‑доверительные интервалы. Достоверные различия между средними измерениями показателей в вариантах опыта определяли по критерию Стьюдента, предполагая равенство дисперсий (распределения) сравниваемых групп при P < 0.05. Процент изменений в значениях показателей продуктивности в зависимости от применения хитозановых комплексов и 0.1%-ного салицилата хитозана был рассчитан путем сопоставления данных измерений в вариантах опыта с контролем и определения положительной и отрицательной относительной тенденции изменений, а также выявления существенности различий по критерию Стьюдента при P < 0.05.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Наибольшее снижение интенсивности развития корневой гнили пшеницы – на 79.0%, было зафиксировано в варианте опыта с использованием 0.1% салицилат хитозана (рис. 3). Кроме того, в указанном варианте опыта не отмечено симптомов развития мучнистой росы в период вегетации растений, в то время как в контроле (без обработки) интенсивность поражения пшеницы достигала 52.5 ± 2.5%.
Рис. 3.
Развитие корневой гнили (%) мягкой пшеницы (а) и септориозно-пиренофорозной пятнистости (б, %) при использовании комплексов Хитозан I (2), Хитозан II (3) и 0.1%-ного салицилата хитозана (4) по сравнению с контролем (1): I – флаговый лист; II – предфлаговый. Одинаковыми буквами обозначены варианты опыта без достоверных различий согласно 95%-ному доверительному интервалу для средних измерений показателя.

При обработке растений комплексом Хитозан II развитие мучнистой росы достоверно снизилось на 5% (t = 4.9). Однако при более точном подсчете на предфлаговом листе пшеницы числа пятен с налетом и определении площади пятен с налетом выявлено снижение значений показателей на 82.5% (t = 3.9) и 81.1% (t = 3.5) соответственно. Комплекс Хитозан I не оказывал существенного влияния на интенсивность развития мучнистой росы.
После применения полифункционального комплекса Хитозан I отмечали существенное снижение (P < 0.05) интенсивности развития бурой ржавчины пшеницы – на 17.4% по сравнению с контролем, а в варианте опыта Хитозан II – на 13.8%. Число пустул возбудителя, рассчитанное на всю площадь листа пшеницы, в указанных вариантах опыта снизилось на 92%, с 156.9 – в контроле до 12.2 шт./лист в опыте и на 65.6%, с 156.9 – в контроле до 54.0 шт./лист. Существенное снижение значений при P < 0.05 площади пустулы возбудителя бурой ржавчины – на 56.4% (с 0.097 мм2 – в контроле до 0.042 мм2) было выявлено при использовании комплекса Хитозан II. В варианте опыта Хитозан I площадь пустулы снизилась на 32.0%.
Степень поражения пшеницы возбудителем желтой ржавчины снизилась существенно – на 29.1% (t = 3.1), при применении 0.1% салицилата хитозана. В указанном варианте опыта число пустул в полосе уменьшилось на 47.1% (с 179.5 до 94.9 шт.), а число и длина полос с пустулами микромицета на флаговых листьях снизились на 40.8% (с 12.5 до 7.4 шт.) и 29.8% (с 74.7 до 52.4 мм) соответственно. На значения площади пустулы микромицета 0.1%-ный салицилат хитозана не оказывал существенного влияния. Однако при обработке растений комплексом Хитозан II выявлено снижение показателя на 35.8% (с 0.04676 мм2 – в контроле до 0.03000 мм2).
В варианте опыта с использованием 0.1%-ного салицилата хитозана не было выявлено развитие септориозно-пиренофорозной пятнистости (рис. 3). Обработка растений комплексом Хитозан I приводила к сильному снижению развития болезни на флаговых (предфлаговых) листьях с 48.6% в контроле до 1% (с 31.5% в контроле до 3% в опыте). При применении комплекса Хитозан II зарегистрировано снижение септориозно-пиренофорозной пятнистости на флаговых и предфлаговых листьях до 4 и 9% соответственно.
Максимальное изменение потенциальной урожайности пшеницы на 32.8% по сравнению с контролем (с 2.4 до 3.2 т/га) было отмечено в варианте опыта с использованием 0.1% салицилата хитозана (рис. 4).
Рис. 4.
Изменение урожайности мягкой пшеницы при использовании комплексов на основе хитозана Хитозан I (2), Хитозан II (3) и 0.1% салицилата хитозана (4) по сравнению с контролем (1). Одинаковыми буквами обозначены варианты опыта без достоверных различий согласно 95%-ному доверительному интервалу для средних измерений показателя.

Возможно, это было обусловлено увеличением важнейших элементов структуры урожайности пшеницы: числа зерен в колосе – на 73.1% (рис. 5а), массы 1000 зерен – на 70.1% (рис. 5б), продуктивной кустистости растений – на 134.7% (рис. 6), длины колоса – на 6.1%, числа колосков в колосе – на 8.2% (табл. 1).
Рис. 5.
Число зерен в колосе мягкой пшеницы (а) и масса 1000 зерен (б) при использовании комплексов на основе хитозана Хитозан I (2), Хитозан II (3) и 0.1% салицилата хитозана (4) по сравнению с контролем (1). Описание буквенных обозначений как на рис. 4.
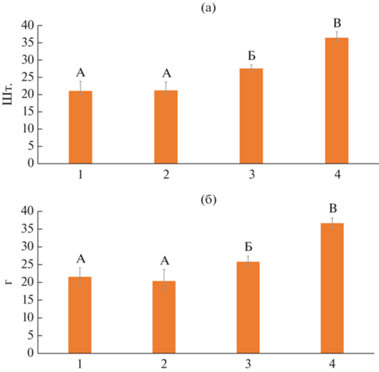
Рис. 6.
Продуктивная (II) и общая кустистость (I) мягкой пшеницы при использовании комплексов на основе хитозана Хитозан I (2), Хитозан II (3)) и 0.1% салицилата хитозана (4) по сравнению с контролем (1).

Таблица 1.
Морфометрические показатели продуктивности мягкой пшеницы при применении хитозановых комплексов и 0.1% салицилата хитозана
| Варианты опыта | Фаза растения, балл (изменения. к контролю, %) |
Число корней, шт. (изменения. к контролю, %) | Длина корней, мм (изменения. к контролю, %) | Число узловых корней, шт. (изменения. к контролю, %) | Длина узловых корней, мм (изменения. к контролю, %) |
Масса корней, г (изменения. к контролю, %) | Высота растения, см (изменения. к контролю, %) |
|---|---|---|---|---|---|---|---|
| Контроль (вода) | 55.0 ± 2.3 (–) | 6.3 ± 0.5 (–) | 61.6 ± 3.4 (–) | 8.9 ± 0.7 (–) | 61.1 ± 4.3 (–) | 1.1 ± 0.1 (–) | 68.5 ± 4.1 (–) |
| Хитозан I | 66.7 ± 1.5 (21.3)* |
5.6 ± 0.6 (–11.1) |
61.6 ± 4.8 (0.0) |
7.2 ±0.6 (–19.1) |
52.3 ± 4.2 (–14.4) |
0.2 ± 0.0 (–81.8*) |
86.0 ± 4.3 (25.5)* |
| Хитозан II | 60.8 ± 1.6 (10.5)* |
5.5 ± 0.5 (–12.7) |
68.9 ± 3.2 (11.9) |
8.1 ± 0.6 (–9.0) |
63.4 ± 2.7 (3.8) |
0.4 ± 0.1 (–63.6*) |
81.0 ± 2.3 (18.2)* |
| 0,1% салицилат хитозана | 57.4 ± 0.4 (4.4) |
8.1 ± 0.5 (28.6)* |
45.2 ± 3.0 (–26.6)* |
9.7 ± 1.4 (9.0) |
60.5 ± 2.5 (–1.0) |
1.4 ± 0.1 (27.3)* |
80.6 ± 1.8 (17.7)* |
| Варианты опыта | Площадь флагового листа, см2 (изменения. к контролю, %) |
Площадь предфлагового листа, см2 (изменения. к контролю, %) |
Масса вегетативной части, г (изменения. к контролю, %) |
Длина колоса, мм (изменения. к контролю, %) |
Число колосков
в колосе, шт. (изменения. к контролю, %) |
Масса колоса, г (изменения. к контролю, %) |
Масса зерен одного колоса, г (изменения. к контролю, %) |
| Контроль (вода) | 5.7 ± 0.2 (–) | 6.2 ± 0.3 (–) | 1.8 ± 0.1 (–) | 67.3 ± 1.6 (–) | 13.4 ± 0.6 (–) | 0.6 ± 0.1 (–) | 0.7 ± 0.0 (–) |
| Хитозан I | 5.3 ± 0.6 (–7.0) |
5.3 ± 0.4 (–14.5) |
1.8 ± 0.2 (0.0) |
68.1 ± 3.4 (1.2) |
14.1 ± 0.7 (5.2) |
0.4 ± 0.1 (–33.3) |
0.6 ± 0.0 (–14.3) |
| Хитозан II | 5.9 ± 0.4 (3.5) |
5.9 ± 0.3 (–4.8) |
2.7 ± 0.2 (50.0)* |
66.5 ± 2.1 (–1.2) |
13.0 ± 0.5 (–3.0) |
0.7 ± 0.0 (16.7) |
0.8 ± 0.0 (14.3) |
| 0,1% салицилат хитозана | 6.0 ± 0.1 (5.3) |
6.8 ± 0.2 (9.7)* |
2.1 ± 0.1 (16.7)* |
71.4 ± 1.8 (6.1)* |
14.5 ± 0.4 (8.2)* |
0.7 ± 0.0 (16.7) |
0.8 ± 0.0 (14.3) |
Кроме того, зарегистрировано существенное увеличение общей кустистости растений – на 91.0% (рис. 7), площади предфлагового листа – на 9.7%, высоты растений – на 17.7%, массы вегетативной части – на 16.7% (табл. 1).
Рис. 7.
Особенности влияния комплексов Хитозан I (I), Хитозан II (II) и 0.1% салицилата хитозана (III) на изменение величины показателей продуктивности пшеницы по сравнению с контролем. 1 – доля положительных изменений показателей; 2 – доля отрицательных изменений показателей; 3 – доля статистически достоверных положительных изменений показателей (P < 0.05); 4 – доля статистически достоверных отрицательных изменений показателей (P < 0.05).

При использовании 0.1%-ного салицилата хитозана выявлено существенное увеличение массы корней – на 27.3% (с 1.1 до 1.4 г), числа корней – на 28.6% (с 6.3 в контроле до 8.1 шт.), но снижение их длины на 26.6% (с 61.6 мм в контроле до 45.2 мм, табл. 1).
В варианте опыта Хитозан I, по сравнению с контролем, выявлено сокращение периода созревания пшеницы (по фазе онтогенеза) на 21.3% и увеличение высоты растений на 25.5%, но масса корней растений снизилась на 81.8%.
По сравнению с другими вариантами опыта наибольшее влияние на рост вегетативной массы растений (на 50.0%) отмечено при применении комплекса Хитозан II. Кроме того, в указанном варианте опыта выявлено сокращение периода созревания пшеницы (по фазе онтогенеза) – на 10.5%, существенный рост высоты растений – на 18.2%. Однако масса корней была меньше относительно контроля – на 63.6%.
Сравнительная эффективность хитозановых комплексов и 0.1%-ного салицилата хитозана в отношении 18 показателей продуктивности пшеницы приведена на рис. 7.
Максимальное относительное число положительных изменений показателей и статистически достоверное число положительных изменений показателей продуктивности, по сравнению с контролем, выявлено при использовании 0.1%-ного салицилата хитозана 88.9 и 55.6% соответственно. В варианте опыта Хитозан I – 38.9 и 11.1%, а в варианте Хитозан II – 61.1 и 27.8%, соответственно.
Таким образом, наилучшие результаты были получены при использовании 0.1%-ного салицилат хитозана как в отношении снижения развития корневой гнили, мучнистой росы, желтой ржавчины, септориозно-пиренофорозной пятнистости, так и продуктивности пшеницы. При использовании 0.1%-ного салицилата хитозана отмечено увеличение урожайности пшеницы на 32.8% по сравнению с контролем, а также статистически достоверный рост значений 55.6% показателей, характеризующих рост и развитие пшеницы, продуктивность и урожайность: длины колоса, числа колосков в колосе, числа зерен в колосе, высоты растений, массы корней, числа корней, продуктивной и общей кустистости, площади предфлагового листа, массы вегетативной части. Комплексы Хитозан I и Хитозан II способствовали существенному снижению поражения пшеницы возбудителями бурой ржавчины и септориозно-пиренофорозной пятнистости, а в варианте Хитозан I отмечено уменьшение развития мучнистой росы. Комплекс Хитозан I оказал положительное влияние только на 11.1% показателей продуктивности: фаза развития и высота растений, а комплекс Хитозан II – на 27.8% показателей, характеризующих фазу онтогенеза, высоту растений, массу вегетативной части растений.
Таким образом, результаты работы могут найти практическое применение при разработке экологически оптимальных технологий возделывания пшеницы и улучшении фитосанитарного состояния посевов.
Работа выполнена в рамках государственного задания согласно тематическому плану ВИР по проекту № 0662-2019-0006 “Поиск, поддержание жизнеспособности и раскрытие потенциала наследственной изменчивости мировой коллекции зерновых и крупяных культур ВИР для развития оптимизированного генбанка и рационального использования в селекции и растениеводстве”.
Список литературы
Dwivany F., Meitha K., Kuswati, Esyanti R., Nugrahapraja H. // Res. J. Biotechnol. 2021. V. 16. № 2. P. 87–92.
Kim S. In Book: Chitin, Chitosan, Oligosaccharides and Their Derivatives. Biological Activities and Applications. /Ed. Se-Kwon Kim. CRC Press, 2010. P. 605–617.
El Hadrami A., Adam L.R., El Hadrami I., Daayf F. // Mar. Drugs. 2010. V. 8. P. 968–987. https://doi.org/10.3390/md8040968
Kulikov S.N., Chirkov S.N., Il’ina A.V., Lopatin S.A., Varlamov V.P. // Appl. Biochem. Microbiol. 2006. V. 42. № 2. P. 200–203. https://doi.org/10.1134/s0003683806020165
Muzzarelli R., Tarsi R., Filippini O., Giovanetti E., Biagini G., Varaldo P.E. // Antimicrob. Agents Chemother. 1990. V. 34. № 10. P. 2019–2023.
Olanipekun E., Ayodele O., Olatunde O., Olusegun S.J. // Int. J. Biol. Macromol. 2021. V. 183. https://doi.org/10.1016/j.ijbiomac.2021.05.162
Allan C.R., Hadwiger L.A. // Exp. Mycol. 1979. № 3. P. 285–287.
Rabea E.I., EI Badawy M., Rogge T.M., Stevens C.V, Hofte M., Steurbaut W., Smagghe G. // Pest Manag. Sci. 2005. V. 61. P. 951–960. https://doi.org/10.1002/ps.1085
Mesas F., Terrile M., Silveyra M., Zúñiga A., Rodriguez M.S., Casalongué C., Mendieta J. // Plant Pathol. J. 2021. V. 37. № 6. P. 533–542. https://doi.org/10.5423/PPJ.OA.06.2021.0090
Pospieszny H., Chirkov S., Atabekovb J. // Plant Science. 1991. V. 79. P. 63–68.
Faoro F., Sant S., Iriti M., Maffi D., Appiano A. In: “Chitin Enzymology” / Ed. R.A.A. Muzzarelli. Italy: Atec, 2001. P. 57–62.
Kadam P.M., Prajapati D., Kumaraswamy R.V., Kumari S., Khaidem A., Pal A., Harish, Sharma S.K., Saharan V. // Plant Physiol. Biochem. 2021. V. 162. P. 699–705. https://doi.org/10.1016/j.plaphy.2021.03.021
Seraj, R.G.M., Behnamian, M., Ahmadikhah, A. Shariati V., Dezhsetan S. //Acta Physiologiae Plantarum. 2021. V. 43. № 7. P. 101. https://doi.org/10.1007/s11738-021-03264-8
Morovvat S., Sadrabadi R., Noferest K., Darban A., Salati M. // Agrivita J. Agric. Sci. 2021. V. 43. https://doi.org/10.17503/agrivita.v43i1.2796
Pongprayoon W., Siringam T., Panya A., Roytrakul S. // Applied Science and Engineering Progress. 2020. V. 15. № 1. https://doi.org/10.14416/j.asep.2020.12.007
Тютерев С.Л. Природные и синтетические индукторы устойчивости растений к болезням. Санкт-Петербург: ВИЗР, 2014. 212 с.
Васюкова Н.И., Озерецковская О.Л. //Прикл. биохимия и микробиология. 2007. Т. 43. № 4. С. 405–411.
Колесников Л.Е., Попова Э.В., Новикова И.И., Прияткин Н.С., Архипов М.В., Колесникова Ю.Р. и др. // Сельскохозяйственная биология. 2019. Т. 54. № 5. С. 1024–1040.
Popov Y.V. // Plant Protection and Quarantine. 2011. № 8. C. 45–47.
Колесников Л.Е., Новикова И.И., Сурин В.Г., Попова Э.В., Прияткин Н.С., Колесникова Ю.Р. // Прикл. биохимия и микробиология. 2018. Т. 54. № 5. С. 1–8.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология