Прикладная биохимия и микробиология, 2022, T. 58, № 3, стр. 244-252
Антимикробные свойства и влияние температуры на образование вторичных метаболитов у психрофильных микромицетов
А. Е. Куварина 1, **, Ю. А. Рошка 1, Е. А. Рогожин 1, 2, Д. А. Никитин 3, А. В. Кураков 4, В. С. Садыкова 1, *
1 Научно-исследовательский институт по изысканию новых антибиотиков им. Г.Ф. Гаузе
119021 Москва, Россия
2 Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова
117997 Москва, Россия
3 Почвенный институт им. В.В. Докучаева
119017 Москва, Россия
4 Московский государственный университет им. М.В. Ломоносова, биологический факультет
119234 Москва, Россия
** E-mail: nastena.lysenko@mail.ru
* E-mail: sadykova_09@mail.ru
Поступила в редакцию 13.12.2021
После доработки 30.12.2021
Принята к публикации 10.01.2022
- EDN: VPNUXX
- DOI: 10.31857/S0555109922030084
Аннотация
Исследовали способность представителей психротолерантных микромицетов к продукции антимикробных соединений. В результате скрининга отобран (из 98 культур) перспективный продуцент антибиотиков Penicillium vulpinum КПБ F-290. Продуцент проявлял активность в отношении условно-патогенных грибов и бактерий. Выделенные активные фракции могут быть отнесены к группе антимикробных соединений, в том числе к β-лактамным антибиотикам и пептидам.
Одной из актуальных задач медицинской биотехнологии и фармакологии является поиск и выделение новых природных антимикробных соединений, которые послужили бы основой для создания лекарственных препаратов. Особый интерес вызывают антимикробные вещества, эффективные в отношении возбудителей заболеваний, устойчивых к применяемым в медицинской практике антибиотикам [1–3].
Для поиска природных биологически активных соединений в разные периоды применялись различные стратегии: от традиционного фенотипического скрининга до внедрения достижений в геномике, транскриптомике, протеомике, метаболомике и других технологий [4].
В последнее десятилетие поиск новых соединений с биологической активностью ведут среди продуцентов, выделенных из экстремальных экосистем – морей, засоленных грунтов и других источников [5]. За прошедшие 10–15 лет было выделено и охарактеризовано более 20 000 таких соединений [6, 7].
На сегодняшний день имеются сведения о перспективных антимикробных метаболитах микроорганизмов, выделенных, в основном, в местах с тропическим климатом, однако, относительно мало сведений о метаболитах обитателей холодных мест Арктики, Антарктики и придонных вод глубоководных озер [8].
По литературным данным антимикробный потенциал изолятов холодных местообитаний частично изучен у прокариот [9], в то время как в отношении микромицетов таких исследований практически не проводилось до настоящего времени. Микромицеты холодных местообитаний могут оказаться неосвоенным, ценным источником новых продуцентов, поскольку их выживание в полярных условиях требует высокой адаптивности, устойчивости ко многим стрессам. К ним относят низкую доступность питательных веществ, значительное УФ-излучение, длительное воздействие частого колебания температуры в сторону отрицательных значений и т.п. Все вышеперечисленные факторы в совокупности способствуют эволюционной адаптации так называемых психрофильных микроорганизмов и синтезу у них специфических метаболитов [10, 11]. Ряд вторичных метаболитов с антимикробной активностью был выделен из изолятов арктических и антарктических грибов [12, 13], среди которых было установлено пять новых биоактивных производных астерриновой кислоты, продуцентом которых является арктический аскомицет Pseudogymnoascus sp. Соединения проявляли антифунгальную активность в отношении Аspergillus fumigatus, а также некоторые показали антимикробную активность в отношении грамположительных и грамотрицательных бактерий [14].
Penicillium griseofulvum, выделенный из почв Гренландии, продуцирует ряд вторичных метаболитов, в том числе гризеофульвин, фульвокислоту, мицелианамид, рокфортин С, рокфортин D, ханоклавин I и элимоклавин. Все вещества проявляли антимикробную активность [15]. В работе [16] у Spriromastix sp. из глубоководных отложений Южного Атлантического океана были выделены новые соединения с уникальной структурой. Установлено, что арктический изолят Penicillium nalgiovense способен синтезировать амфотерицин B [17], а штамм Geomyces sp. 2481 – антимикотик геомицин B и антибактериальный компонент геомицин C [18]. Психротолерантный штамм Penicillium algidum синтезирует новый циклический нитропептид под названием психрофилин D [19], активный в отношении линий клеток лейкемии мышей p388. Еще один психротолерантный изолят микромицета Penicillium sp. PR19 N-1 продуцирует редкие новые сесквитерпеновые соединения эремофиланового типа. Их цитотоксические исследования показали умеренную активность в отношении линий клеток человека HL-60 (промиелоцитарная лейкемия) и A-549 (карцинома лёгкого) [20].
Предполагается, что даже известные антибиотики психрофильных штаммов могут отличаться по своей структуре от синтезируемых мезофильными микроорганизмами, что может оказаться важным аспектом в борьбе с резистентными формами патогенных и условно-патогенных микроорганизмов человека, проявляющих устойчивость к применяемым в медицинской практике антибиотикам [21].
Цель работы – оценка антибиотической активности коллекции психрофильных микромицетов, выделенных из различных почв Арктики и Антарктики и донных грунтов озера Байкал, и влияния температуры на метаболическую активность и биосинтез антибиотиков.
МЕТОДИКА
В работе были использованы 98 штаммов психрофильных и психротолерантных микромицетов из коллекции культур грибов экстремальных местообитаний МГУ им. М.В. Ломоносова, 21 из которых были выделены из грунтов Антарктиды [22–25] и 77 из грунтов (глубина 5–250 м) озера Байкал [26].
Для определения видовой принадлежности штаммов предварительно была проведена идентификация по культурально-морфологическим признакам. Выделение ДНК из чистых культур микромицетов проводили по методике Глушаковой с соавт. [27]: биомассу 5–6-суточной культуры переносили в пробирки эппендорфа на 2 мл, добавляли 400 мкл стеклянных шариков (300–500 мкм диаметром) и 500 мкл лизирующего буфера: TrisBase – 50 мM, NaCl – 250 мM, ЭДТА 50 мM, ДДС – 0.3%, pH 8.0. Приготовленную смесь взбалтывали на вортексе на скорости 3500 об./мин в течение 15 мин, затем инкубировали 1 ч при температуре 65°С, после снова взбалтывали на вортексе 15 мин и центрифугировали при 13 400 g 10 мин, затем отбирали надосадочную жидкость.
Для амплификации региона рДНК, содержащего D1/D2 домен региона 26S рДНК, использовали праймеры ITS1f (5' CTTGGTCATTTAGAGGAAGTA) и NL4 (5' GGTCCGTGTTTCAAGACGG) и смеси для ПЦР ScreenMix (ЗАО “Евроген”, Москва).
Амплификатор использовали по следующей программе: (начальная денатурация – 2 мин при температуре 96°С; затем 35 циклов: денатурация – 20 с при температуре 96°С, отжиг праймеров – 50 с при температуре 52°С, синтез ДНК – 1.5 мин при температуре 72°С; конечная достройка 7 мин при температуре 72°С). Очистку ПЦР-продукта проводили с использованием набора BigDye XTerminator Purification Kit (“Applied Biosystems”, США). Для секвенирования использовали праймер NL4.
Секвенирование ДНК проводили с помощью набора реактивов BigDye Terminator V3.1 Cycle Sequencing Kit (“Applied Biosystems”, США) с последующим анализом продуктов реакции на секвенаторе Applied Biosystems 3130xl Genetic Analyzer в Научно-производственной компании “Синтол” (Москва). Идентификацию по полученным хроматограммам проводили, используя данные Генбанка NCBI (http://blast.ncbi.nlm.nih.gov/) и СABI Bioscience Database Index Fungorum (http:// www.indexfungorum.org).
Способность к синтезу антимикробных соединений оценивали методом блоков [28]. Для дальнейших исследований отбирали штаммы, которые проявили максимальную антибиотическую активность, и затем культивировали их в жидких средах. Использовали стандартные питательные среды Чапека и Сабуро. Микромицеты выращивали стационарным способом в колбах Эрленмейера на 750 мл в течение 14 сут или глубинным способом на шейкере-инкубаторе Innova 40R (“Eppendorf New Brunswick”, США). Культуральную жидкость (КЖ) отделяли фильтрацией через мембранные фильтры на воронке Зейца под вакуумом. Затем КЖ экстрагировали этилацетатом или бутанолом в соотношении 5 : 1 3 раза. Полученные экстракты упаривали в вакууме на роторном испарителе “Rotavapor-RBüchi” (Швейцария) при 42°C досуха, остаток растворяли в водном 50%-ном этаноле и получали спиртовые концентраты. Антимикробную активность определяли в исходной КЖ, в спиртовых экстрактах КЖ и экстрактах мицелия с помощью стерильных бумажных дисков (“НИИ Пастера”, Россия), смоченных в экстрактах и высушенных в стерильных условиях. В качестве контроля использовали стандартные диски с флуконазолом для грибов (40 мкг, “НИИ Пастера”, Россия) и амоксициллином/клавулоновой кислотой для бактерий (20/10 мкг, “НИИ Пастера”, Россия). Для оценки фунгицидной активности использовали тест-штаммы: плесневый гриб Aspergillus niger INA 00760 и дрожжи Candida albicans АТСС 2091.
Антибактериальную активность оценивали с помощью тест-штаммов: грамотрицательной бактерии Escherichia coli ATCC 25922; грамположительной бактерии Bacillus subtilis АТСС 6633; грамположительной бактерии Staphylococcus aureus 209P и Micrococcus luteus NCTC 8340; пекторбактерии P. carotovorum и P. savastanoi.
Тест-культуру B. subtilis АТСС 6633 выращивали на среде Гаузе № 2 следующего состава (г/л): триптон – 2.5 (или бульон Хоттингера – 30 мл), пептон – 5, хлорид натрия – 5, глюкоза – 10; S. aureus 209P и M. luteus NCTC 8340 выращивали на среде МПА (“ЗАО НИЦФ”, Россия), а E. coli ATCC 25922 на среде LB (триптон-соевый агар). Тест-культуры P. carotovorum и P. savastanoi выращивали на среде LB с добавлением 0.5% глюкозы. Культуры микромицетов A. niger INA 00760 и C. albicans АТСС 2091 – на среде Чапека. Предварительно культуры выращивали в пробирках со скошенным питательным агаром, после чего их клетки суспендировали в физиологическом растворе до мутности 0.5 по стандарту McFarland (1.5 × 108 КОЕ/мл) и использовали в течение 15 мин. Использовали суточные культуры бактерий и пятисуточные культуры грибов и дрожжей. Все тест-культуры получены из коллекции культур НИИ по изысканию новых антибиотиков.
Анализ и разделение на активные фракции экстрактов культуральной жидкости наиболее перспективных в качестве продуцентов штаммов психротолерантных микромицетов осуществляли методом аналитической обращено-фазовой высокоэффективной жидкостной хроматографии (ОФ-ВЭЖХ) [29] с использованием аналитической колонки XBridge 5 мкм 130 Aнг размером 250 × × 4.6 мм (“Waters”, Ирландия) в линейном градиенте повышения концентрации ацетонитрила в качестве подвижной фазы (элюент А – 0.1%-ная трифторуксусная кислота, ТФУ, в деионизованной воде MQ, элюентом В – 80%-ный ацетонитрил c 0.1%-ной водной ТФУ) при скорости потока 950 мкл/мин. Для ОФ-ВЭЖХ использовали ультраградиентный ацетонитрил фирмы “Panreac” (Испания) и ТФУ производства “Sigma-Aldrich” (США). Детектирование разделяемых веществ осуществляли при длине волны 214 нм в градиенте концентрации элюента В: 16–28% – за 12 мин; 28–55% – за 20 мин; 55–85% – за 30 мин и 85–95% – за 5 мин с последующим изократическим элюированием в течение 10 мин.
Для наработки фракций для последующего проведения структурно-функционального анализа однократно наносили 300 мкл концентрата на аналитическую колонку для обращённо-фазовой ОФ-ВЭЖХ XBridge BEH 130 Анг 4.6 × 250 мм 5 мкм (Waters, Ирландия) при скорости потока подвижной фазы 1.1 мл/мин. Линейный градиент 16–70% буфера В (80% ацетонитрил в 0.1% ТФУ) за 50 мин с дальнейшим 70–95% В за 5 мин и изократическим элюированием в течение 15 мин. Детектирование поглощения было осуществлено при длине волны 220 нм.
Модификация N-концевой аминогруппы активированным эфиром Coumarin 343 X осуществляли по следующей методике [30].
Лиофилизованное вещество (~200 мкг) растворяли в 500 мМ PBS NH4HCO3 буфере с рН 7.28, для получения концентрации ~ 1 мг/мл. К полученному раствору добавляли 1080 мкл раствора активированного эфира Coumarin 343 XFITC (“Sigma-A-ldrich”, США) в 80%-ном водном диметилформамиде (ДМФ) в концентрации 4010 мкгл/мл, тщательно перемешивали, и инкубировали в течение 1 ч при комнатной температуре 37°C в темноте. Продукты реакции разделяли методом аналитической ОФ-ВЭЖХ на колонке XBridge BEH C18 4.6 × 250 мм (“Waters”, Ирландия) в линейном градиенте растворителя B (80%-ный CH3CN, 0.1%-ная ТФУ) от 16 до 28% в течение 12 мин; (основной) и 28–55% за 10 мин; 55–85% за 20 мин (дополнительный) при скорости потока 0.935 мл/мин. Поглощение детектировали при длинах волн 214 и 437 нм.
Молекулярные массы активных пиков соединений определяли методом ультра высокоэффективной жидкостной хроматографией/масс-спектрометрией (UHPLC-MS) с использованием установки для масс-спектрометрии типа “ионная ловушка” Thermo Finnigan LCQ Deca XP Plus (ThermoFisher Scientific, США) и хроматографа высокого давления Thermo Accela UPLC (ThermoFisher Scientific, США), укомплектованного микроколонкой YMC Triart (C18 150 2 мм, 1.9 µm) (YMC Co., Япония) [31]. Детектирование сигнала осуществляли по полному ионному току при распылении электроспреем ESI(+), 150–2000 au. Образцы растворяли в смеси вода/метанол/уксусная кислота (88 : 10 : 2) до конечной концентрации примерно 1 мг/мл.
Спектры поглощения активных соединений в диапазоне 200–600 нм снимали с использованием спектрофотометра UV-1800 (“Shimadzu”, Япония) с применением кварцевых кювет объемом 2 мл с длиной оптического пути 1 см.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Оценка антимикробной активности 77 штаммов из донных грунтов озера Байкал в отношении микромицетов и бактерий показала, что для культур в основном характерна антибактериальная активность. Так, доля обладающих антимикотическим действием в отношении A. niger INA 00760, составляла 2.6%, в то время как с антибактериальным действием в отношении B. subtilis АТСС 6633 составила 31.1% от общего числа исследуемых штаммов (табл. 1). Наибольшую антибактериальную активность проявили представители родов Trichoderma, Penicillium, Coniochaeta и Daldinia, а наибольшую антимикотическую активность проявили, в основном, представители микромицетов рода Trichoderma. Важно отметить, что в данном случае представители микромицетов рода Trichoderma и Penicillium встречались чаще других среди выделенных изолятов [32, 33].
Таблица 1.
Общее количество культур (%), проявивших активность в отношении тест-штаммов B. subtilis АТСС 6633 и A. niger INA 00760
| Экосистема | Всего Культур |
Неактивные | Слабоактивные | Умеренно активные | Высоко-активные | ||||
|---|---|---|---|---|---|---|---|---|---|
| B. subtilis АТСС 6633 | A. niger INA 00760 | B. subtilis АТСС 6633 | A. niger INA 00760 | B.subtilis АТСС 6633 |
A. niger INA 00760 | B. subtilis АТСС 6633 | A. niger INA 00760 | ||
| Озеро Байкал | 77 | 13 (16.9%) |
57 (74%) |
35 (45.5%) |
12 (15.6%) |
5 (6.5%) |
6 (7.8%) |
24 (31.1%) |
2 (2.6%) |
| Антарктида | 21 | 7 (33.3%) |
12 (57.1%) |
8 (38.1%) |
8 (38.1%) |
5 (23.8%) |
1 (4.8%) |
1 (4.8%) |
0 |
Оценка антимикробной активности 21 изолята почв Антарктиды в отношении тест-штаммов позволила выявить относительно немного, а именно, 4.8% культур, проявивших высокую антибактериальную активность и относящихся к представителям рода Penicillium. Стоит отметить, что ни один из протестированных изолятов не обладал высокой антимикотической активностью.
Таким образом, исходя из полученных нами результатов, среди психротолерантных штаммов преобладает антибактериальная активность. Данная специфичность может быть объяснена тем, что бактериальное сообщество этих почв представлено намного большим видовым разнообразием, в сравнении с микромицетами. Итак, продукция антибиотиков, по-видимому, является эффективным приемом межвидовой конкуренции среди грибов этих экониш. В конечном итоге, для дальнейшего исследования были отобраны наиболее активные культуры, которые на данный момент практически не изучены в качестве продуцентов антибиотиков для медицинской и фармакологической промышленности [34]: Cadophora luteo-olivacea MT303851, Acremonium zonatum MT303852, Cladosporium cladosporioides КПБ F-288, Penicillium vulpinum КПБ F-290, Antarctomyces psychrotrophicus MT303855, Sarocladium kiliense КПБ F-292 (табл. 2).
Таблица 2.
Антимикробная активность отобранных штаммов при различных температурах*
| Изоляты | Тест-организмы | Зоны ингибирования роста (мм) при разных температурах культивирования | |
|---|---|---|---|
| 15°С | 20°С | ||
| Cadophora luteo-olivacea MT303851 | B.subtilis АТСС 6633 | 7 ± 0.3 | 18 ± 0.3 |
| E. coli ATCC 25922 | 0 | 0 | |
| A.niger INA 00760 | 6 ± 0.1 | 10 ± 0.1 | |
| C.albicans ATCC 2091 | 6 ± 0.2 | 10 ± 0.2 | |
| Acremonium zonatum MT303852 | B.subtilis АТСС 6633 | 8 ± 0.2 | 10 ± 0.6 |
| E. coli ATCC 25922 | 0 | 0 | |
| A.niger INA 00760 | 6 ± 0.1 | 9 ± 0.2 | |
| C.albicans ATCC 2091 | 8 ± 0.4 | 17 ± 0.3 | |
| Cladosporium cladosporioides КПБ F-288 | B.subtilis АТСС 6633 | 0 | 0 |
| E. coli ATCC 25922 | 6 ± 0.3 | 10 ± 0.2 | |
| A.niger INA 00760 | 0 | 0 | |
| C.albicans ATCC 2091 | 0 | 0 | |
| Penicillium vulpinum КПБ F-290 | B.subtilis АТСС 6633 | 10 ± 0.5 | 31 ± 0.4 |
| E. coli ATCC 25922 | 9 ± 0.4 | 25 ± 0.1 | |
| A.niger INA 00760 | 8 ± 0.1 | 15 ± 0.1 | |
| C.albicans ATCC 2091 | 9 ± 0.3 | 22 ± 0.3 | |
| Antarctomyces psychrotrophicus MT303855 | B.subtilis АТСС 6633 | 0 | 0 |
| E. coli ATCC 25922 | 0 | 0 | |
| A.niger INA 00760 | 0 | 0 | |
| C.albicans ATCC 2091 | 7 ± 0.1 | 10 ± 0.6 | |
| Sarocladium kiliense КПБ F-292 | B.subtilis АТСС 6633 | 6 ± 0.1 | 10 ± 0.2 |
| E. coli ATCC 25922 | 0 | 0 | |
| A.niger INA 00760 | 0 | 0 | |
| C.albicans ATCC 2091 | 0 | 0 | |
Оценка скорости роста культур на различных синтетических и натуральных средах показала, что все штаммы имели высокую скорость роста на двух стандартных средах: синтетической среде Чапека и среде Сабуро. В дальнейшем эти жидкие среды использовали для оценки способности к синтезу антибиотиков. Антибиотические вещества накапливались преимущественно в КЖ штаммов, а не в мицелии. Определение относительной концентрации активных соединений выявила максимальное содержание антибиотических веществ при культивировании при 20°C для всех 6 культур.
Влияние микробной конкуренции на синтез антимикробных соединений психрофильными микромицетами, по литературным данным, наиболее выражено в летний период, когда более высокие температуры приводили к повышению общей активности грибов [35]. В текущем исследовании мы также продемонстрировали, что повышение температуры явно влияет на продукцию вторичных метаболитов и увеличивает синтез антибиотиков.
Изменения температуры, происходящие в различных временных масштабах (от суточных до сезонных и более длительных периодов), могут иметь важное влияние на выживание и эволюцию микроорганизмов. В полярных почвах антибиотическая активность была продемонстрирована при температуре до 15°С [36–38].
Для дальнейшего изучения был отобран наиболее перспективный штамм Penicillium vulpinum КПБ F-290, проявивший максимальную антимикробную активность в отношении тест-культур. Штамм P. vulpinum КПБ F-290 растет при температурах от 10 до 25°С, с оптимумом около 20°С, не продуцирует антибиотики при температуре ниже 15°С, при этом был способен интенсивно секретировать метаболиты с антимикробной активностью в культуральную жидкость на 12–14 сут роста.
Штамм P. vulpinum КПБ F-290 проявлял высокую антимикробную активность в отношении условно-патогенных штаммов и B. subtilis АТСС 6633. Величины зон подавления роста этих тест-культур достигали 15 ± 2 и 31 ± 2 мм соответственно. Также штамм был активен в отношении фитопатогенных пектобактерий P. carotovorum и P. savastanoi, вызывающих мокрую гниль картофеля, и проявлял незначительную антимикробную активность как при поверхностном, так и при глубинном культивировании в отношении St. aureus 209P и M. luteus NCTC 8340. С целью увеличения биосинтеза антибиотического комплекса были апробированы различные способы культивирования: поверхностное (стационарное) и глубинное с использованием шейкера-инкубатора (табл. 3). Для максимальной продукции штаммом антибиотических веществ оптимальным способом культивирования является поверхностное (стационарное), а лучшим экстрагентом из культуральной жидкости – этилацетат.
Таблица 3.
Зоны подавления роста тест-культур штаммом P. vulpinum КПБ F-290 при поверхностном и глубинном культивировании
| Способ культивирования P. vulpinum КПБ F-290 |
Зоны подавления роста тест-культур этилацетатными/бутанольными экстрактами (10 мг/диск), мм | |||
|---|---|---|---|---|
| B. subtilis АТСС 6633 |
E. coli ATCC 25922 |
A. niger INA 00760 |
C. albicans ATCC 2091 |
|
| Поверхностное | 31/25 | 15/19 | 11/0 | 14/13 |
| Глубинное | 18/19 | 11/11 | 0/0 | 12с/12 |
В дальнейшем была разработана схема разделения антибиотического комплекса этилацетатного и бутанольного экстрактов культуральной жидкости штамма Penicillium vulpinum КПБ F-290 после поверхностного культивирования методом аналитической ОФ-ВЭЖХ, в результате которой удалось получить около 40 отдельных фракций (рис. 1). Масштабирование наработки компонентов штамма P. vulpinum КПБ F-290 осуществляли при оптимальной нагрузке по суммарному веществу и в условиях оптимизированного градиента.
Рис. 1.
Фракционирование экстракта P. vulpinum КПБ F-290 методом аналитической ОФ-ВЭЖХ: а – профиль этилацетатного экстракта штамма P. vulpinum КПБ F-290; б – профиль бутального экстракта штамма P. vulpinum КПБ F-290. Серым выделены фракции, обладавшие ингибирующей рост тест-штаммов активностью.

У этилацетатного экстракта наибольшая антимикробная активность была характерна для четырех фракций (290Э-32, 290Э-36, 290Э-37 и 290Э-39), которые элюировались с колонки в диапазоне 41–47 мин (рис. 1а). При этом отдельно было проверено наличие ингибирующих свойств суммарной несвязавшейся с неподвижной фазой фракции (“провала”) (290Э-1). Фракции 290Э-1 и 290Э-39 ингибировали рост B. subtilis АТСС 6633 и Candida albicans ATCC 2091, величина зон подавления варьировалась в пределах 30/17 ± 0.1 мм и 29/23 ± 0.2 мм соответственно. Фракции 290Э-32, 290Э-36 и 290Э-37 обладали антифунгальной активностью в отношении A. niger INA 00760, величина их зон подавления роста была в пределах 15/22/27 ± 0.2 мм соответственно. Фракция 1 характеризовалась относительно полярными свойствами и была отнесена к β-лактамным антибиотикам (в частности, пенициллинового ряда), 4 других соединения обладали более выраженными гидрофобными свойствами.
У бутанольного экстракта наибольшая антимикробная активность была отмечена также для гидрофобных фракций 290Б-25, 290Б-26 и 290Б-29, которые также элюировались в том же временном диапазоне, что и активные компоненты 290Э (рис. 1б). Все индивидуальные соединения обладали антигрибной активностью в отношении A. niger INA 00760 и C. albicans ATCC 2091, при этом фракция 290Б-26 также обладала антибактериальной активностью в отношении E. coli ATCC 25922, а 290Б-29 фракция – антибактериальной активностью в отношении B. subtilis АТСС 6633. Стоит отметить, что этилацетат оказался более эффективным экстрагентом для соединений культуральной жидкости P. vulpinum, чем бутанол: при качественной оценке суммарный выход растворенного вещества был значительно выше (рис. 1). При этом, что касается зоны выхода группы активных компонентов, то стоит отметить их частичное совпадение по наличию в каждом из экстрактов. Так, фракция 290Э-39 по времени удерживания на колонке соответствовала 290Б-29, что находит свое подтверждение по спектру их антимикробных свойств.
На грибы минимальная подавляющая концентрация (МПК) фракций в отношении A. niger INA 00760 составляла от 6.25 до 12.5 мкг/мл. В отношении C. albicans ATCC 2091 МПК варьировалась от 3.125 до 6.25 мкл/мл. На бактерии МПК в отношении B. subtilis АТСС 6633 равнялась 25 мкг/мл, а в отношении E. coli ATCC 2592 около 100 мкг/мл.
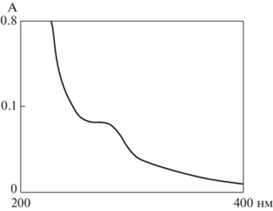
Для дальнейшей структурной характеристики была выбрана фракций 290Э-39 (290Б-29) ввиду ее наибольшего выхода по сравнению с остальными. Так, в результате ее анализа методом ESI-MS был получен тотальный масс-спектр с рядом преобладающих сигналов m/z в режиме [M + H] (756.57, 782.57, 844.69 и 885.55 Да), а также некоторых минорных (718.54 и 744.56 Да). По каждому из детектированных значений m/z показано наличие характерного изотопного распределения; также между соответствующими значениями m/z не показано наличие различий в массах, которые соответствовали какой-либо стандартной модификации (например, метильной или гидроксильной группы). Следовательно полученные значения могут соответствовать спектру фрагментации метаболита с массой [M + H] 844.69 Да с вероятным производным [M + H] 885.55 Да (рис. 2).
С целью выявления наличия свободных аминогрупп в исследуемой молекуле, которые, в частности, могли бы указать на его возможную пептидную природу, была проведена реакция модификации нативного соединения 290Э-39 (290Б-29) органическим флуорофором активированным эфиром Coumarin 343 X с последующей детекцией продуктов реакции аналитической ОФ-ВЭЖХ. Характер изменения хроматографичекой подвижности детектируемых пиков позволяет сделать вывод о наличии по крайней мере одной производной (данные не представлены). Кроме того, спектр поглощения исследуемого соединения показал близкий к типовому для большинства ген-кодируемых полипептидов профилю с характерными значениями минимумов и максимумов поглощения, соответственно, при длинах волн менее 230 нм, и диапазоне 260–280 нм (рис. 3).
Таким образом, в результате исследований был отобран психотолерантный штамм P. vulpinum КПБ F-290, изучен комплекс его вторичных метаболитов, обладающих антимикробной активностью. В состав несвязавшейся с колонкой при ОФ-ВЭЖХ анализе суммарной фракции с высокой степенью вероятности входят представители β-лактамных антибиотиков, кроме того, был выделен новый активный полипептид, обладающий антимикробным действием в отношении грамположительных бактерий, в том числе фитопатогенных пектобактерий.
Работа выполнена при финансовой поддержке Министерства науки и высшего образования Российской федерации в рамках Федеральной научно-технической программы развития генетических технологий на 2019–2027 годы (соглашение № 075-15-2021-1345, Уникальный идентификатор проекта RF----193021X0012).
Список литературы
Bull A.T. Extremophiles Handbook. / Ed. K. Horikoshi. Springer, Tokyo, 2011. P. 1204–1240. https://doi.org/10.1007/978-4-431-53898-1
Bull A.T., Googfellow M. // Microbiology. 2019. V. 165. № 12. P. 1252–1264. https://doi.org/10.1099/mic.0.000822
Bull A.T. Extremophiles Handbook. / Ed. K. Horikoshi. Springer, Tokyo, 2011. P. 3–15. https://doi.org/10.1007/978-4-431-53898-1
De Maayer P., Anderson D., Cary C., Cowan D.A. // EMBO Rep. 2014. V.15. № 5. P. 508–517. https://doi.org/10.1002/embr.201338170
Schmitt E.K., Hoepfner D., Krastel P. // J. Ind. Microbiol. Biotechnol. 2016. V. 43. № 2. P. 249–260.
Butler M.S., Blaskovich M.A., Cooper M.A. // J. Antibiot. 2017. V. 70. № 1. P. 3–24.
Imhoff J.F. // Marine Drugs. 2016. V. 14. № 1. P. 19–37.
Arenz B.E., Held B.W., Jurgens J.A., Farrell R.L., Blanchette R.A. // Soil Biol. Biochem. 2006. V. 38. https://doi.org/10.1016/j.soilbio.2006.01.016
Shevchenko M., Sukhikh S., Babich O., Noskova S., Ivanova S., Lisun V. et al. // Microorganisms. 2021. V. 9. № 1521. P. 1–12. https://doi.org/10.3390/microorganisms9071521
Madronich S., McKenzie R.L., Bjorn L.O., Caldwell M.M. // J. Photochem. Photobiol. 1998. V. 46. P. 5–19. https://doi.org/10.1016/s1011-1344(98)00182-1
Montiel P.O. // Cryo. Lett. 2000. V. 21. P. 83–90.
Li Y., Wadsö L., Larsson L. // J. Appl. Microbiol. 2009. V. 106. P. 1494–1501. https://doi.org/10.1111/j.1365-2672.2008.04110.x
O'Brien K., Leichenko R., Kelkar U., Venema H., Aandahl G., Tompkins H. et al. // Glob. Environ. Change. 2004. V. 14. P. 303–313. https://doi.org/10.1016/j.gloenvcha.2004.01.001
Figueroa L., Jiménez C., Rodríguez J., Areche C. // J. Nat. Prod. 2015. V. 78. P. 919–923.
Frisvad J.C., Frank J.M., Houbraken J.A.M.P., Kuijpers A.F.A., Samson R.A. // Stud. Mycol. 2004. V. 50. P. 23–43.
Niu S., Liu D., Hu X., Proksch P., Shao Z., Lin W. // J. Nat. Prod. 2014. V. 77. P. 1021–1030. https://doi.org/10.1021/np5000457
Svahn K.S., Chryssanthou E., Olsen B., Bohlin L., Göransson U. // Fungal Biol. Biotechnol. 2015. V. 2. № 1. P. 1–8. https://doi.org/10.1186/s40694-014-0011-x
Vaca I., Chávez, R. In: Fungi of Antarctica. Cham: Springer, 2019. P. 265–283. https://doi.org/10.1007/978-3-030-18367-7_12
Ibrar M., Ullah M.W., Manan S., Farooq U., Rafiq M., Hasan F. // Appl. Microbiol. Biotechnol. 2020. P. 1–25. https://doi.org/10.1007/s00253-020-10399-0
Lin A., Wu G., Gu Q., Z.T., Li D. // Arch. Pharm. Res. 2014. V.37. № 7. P. 839–844.
Sánchez L.A., Gómez F.F., Delgado O.D. // Extremophiles. 2008. V. 13. P. 111–120. https://doi.org/10.1007/s00792-008-0203-5
Лысак Л.В., Максимова И.А., Никитин Д.А., Иванова А.Е., Кудинова А.Г., Соина В.С. // Вестник Московского университета. 2018. Т. 73. № 3. С. 132–140.
Никитин Д.А. // Микология и фитопатология. 2021. Т. 55. № 2. С. 79–104. https://doi.org/10.31857/S0026364821020070
Никитин Д.А., Марфенина О.Е., Кудинова А.Г., Лысак Л.В., Мегелов Н.С., Долгих А.В. и др. // Почвоведение. 2017. № 9. С. 1122–1133. https://doi.org/10.1134/S1064229317070079
Никитин Д.А., Семенов М.В. // Микробиология. 2022. Т. 91. № 1. С. 1–13. https://doi.org/10.31857/S0026365622010098
Sykhikh S.A., Babich O.O., Dyshlyuk L.S., Bulgakova O.M. //. Characteristics of Microbial Communities of Lake Baikal. International Scientific Review of the Problems of Natural Sciences and Medicine. Collection of Scientific Articles X International Correspondence Scientific Specialized Conference. USA, Boston. 2019. P. 49–55.
Glushakova A.M., Kachalkin A.V., Chernov I.Y. // Eurasian Soil Science. 2011. V. 44. № 8. P. 886–892. https://doi.org/10.1134/S1064229311080059
Егоров Н. С. Основы учения об антибиотиках. 6-е изд М.: Изд-во МГУ, Наука, 2004. 528 с.
Tan Z.T., Leow H.Y., Lee D.C.W., Karisnan K., Song A.A.L., Mai C.W. et al. // The Open Biotechnology J. 2019. V.13. P. 18–26. https://doi.org/10.2174/1874070701913010018
Zheng L., Zhao H., Han Y., Qian H., Vukovic L., Mecinović J. et al. // Nat. Chem. 2019. V. 11. № 4. P. 359–366. https://doi.org/10.1038/s41557-018-0204-7
Efimenko T.A., Glukhova A.A., Demiankova M.V., Boykova Y.V., Malkina N.D., Sumarukova I.G. et al. // Life (Basel). 2020. V. 10. № 91. P. 1–16. https://doi.org/10.3390/life10060091
Никитин Д.А., Лысак Л.В., Кутовая О.В., Грачева Т.А. // Почвоведение. 2021. № 11. С. 1346–1362. https://doi.org/10.31857/S0032180X21110101
Никитин Д.А., Семенов М.В., Семиколенных А.А., Максимова И.А., Качалкин А.В., Иванова А.Е. // Микология и фитопатология. 2019. Т. 53. № 4. С. 210–222.
Bérdy J. // J. Antibiot. 2005. V. 58. № 1. P. 1–26. https://doi.org/10.1038/ja.2005.1
Bell T.H., Callender K.L., Whyte L.G., Greer C.W. // Biology. 2013. V. 2. № 2. P. 533–554. https://doi.org/10.3390/biology2020533
Convey P., Chown S.L., Clarke A., bArnes D.K.A., Bokhorst S., Cummings V. et al. // Ecol. Monogr. 2014. V. 84. P. 203–244. https://doi.org/10.1890/12-2216.1
Davey M., Pickup J., Block W. // Antarct. Sci. 1992. V. 4. P. 383–388.
Peck L.S., Convey P., Barnes D.K.A. // Biol. Rev. 2006. V. 81. P. 75–109. https://doi.org/10.1017/S1464793105006871
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология