Расплавы, 2020, № 5, стр. 498-507
Экспериментальное исследование диаграммы плавкости системы LiF–MnCl2
В. Н. Докутович a, *, И. В. Корзун a, Н. К. Ткачев a
a Институт высокотемпературной электрохимии УрО РАН
Екатеринбург, Россия
* E-mail: v.dokutovich@ihte.uran.ru
Поступила в редакцию 28.02.2020
После доработки 24.03.2020
Принята к публикации 29.03.2020
Аннотация
Солевые смеси находят широкое применение в самых различных областях науки и техники. Для разработки новых композиций и поиска оптимальных составов для их практического использования необходимо изучение фазовых диаграмм. В настоящее время имеется ряд существенных пробелов в понимании и описании диаграмм плавкости взаимных солевых смесей. Реакция обмена в так называемых тройных взаимных системах приводит к целому ряду существенных особенностей, проявляющихся на фазовой диаграмме. В качестве объекта исследования была выбрана солевая смесь LiF–MnCl2, которая является одной из пограничных бинарных систем во взаимной смеси Li, Mn || F, Cl. Цель настоящей работы – изучение фазовых равновесий в системе LiF–MnCl2, включающее анализ возможности протекания в ней обменной реакции и построение диаграммы плавкости. В данной работе исследования проводили методом синхронного термического анализа (СТА) с использованием термоанализатора STA 449C Jupiter фирмы NETZSCH (Германия). Исследуемые соли, обладая высокой агрессивностью, после плавления начинают “выползать” по стенкам тигля. Кроме того, высокая летучесть компонентов смесей при высоких температурах приводит к неконтролируемому изменению состава. Это затрудняет интерпретацию полученных результатов. В связи с этим было принято решение разработать и сконструировать прибор дифференциального термического анализа (ДТА), в котором в качестве контейнеров используются герметичные ампулы из нержавеющей стали марки 12Х18Н10Т. Впервые методами ДТА и ДСК были исследованы фазовые равновесия жидкость–твердое во взаимной солевой системе LiF–MnCl2. Результаты РФА застывших плавов подтвердили наличие в них только двух исходных веществ (фторида лития и хлорида марганца), что хорошо согласуется с результатами термодинамического анализа реакции обмена 2LiF + MnCl2 = 2LiCl + MnF2. Фазовая диаграмма системы LiF–MnCl2 имеет вид простой двухкомпонентной системы с одной эвтектической точкой. Эвтектика близка к составу 0.547LiF–0.453MnCl2 и характеризуется температурой 734.2 К.
ВВЕДЕНИЕ
Солевые смеси находят широкое применение в самых различных областях науки и техники. Для разработки новых композиций и поиска оптимальных составов для их практического использования необходимо изучение фазовых диаграмм. За последние десятилетия накоплен огромный материал по фазовым равновесиям в различных солевых смесях. Как правило, изучались системы с одинаковыми катионами или анионами [1, 2]. Системы, содержащие различные ионы, изучены гораздо меньше. На наш взгляд, исследование таких объектов может представлять значительный интерес, как с теоретической, так и практической точки зрения.
С точки зрения практического применения, соли лития и содержащие их солевые смеси, благодаря своей высокой электропроводности и электрохимической активности, являются перспективными электролитами при электрометаллургических процессах, в тепловых источниках тока [3, 4]. Получение высокочистого марганца также важно для различных областей его применения, таких как: новые полупроводниковые материалы с уникальными физико-химическими свойствами, необходимые для развития новых технологий, электроники и оптоэлектроники; измерительные приборы; создание квантовых генераторов, компьютеров нового поколения и преобразователей энергии света в электрическую. Марганец также используется в производстве точных приборов, микросхем и микрочипов в электронике, телефонной и спутниковой связи.
В настоящее время имеется ряд существенных пробелов в понимании и описании диаграмм плавкости взаимных солевых смесей. Реакция обмена по типу LiX + MeY2 = = MeX2 + LiY, где X или Y обозначают галоген в так называемых тройных взаимных системах (а фактически четверных: LiX–LiY–MeX2–MeY2) приводит к целому ряду существенных особенностей, проявляющихся на фазовой диаграмме. Следует добавить, что экспериментальные сведения о пограничных бинарных системах часто являются противоречивыми, сильно устаревшими и основываются на экстраполяции линий ликвидус в область высоких температур. Поэтому до сих пор существует необходимость систематического анализа диаграмм плавкости в подобных солевых смесях. Отметим, что галогениды марганца, хрома, железа и других переходных металлов являются весьма трудными объектами для экспериментального изучения в силу их высокой склонности к окислению и гидролизу даже следами кислорода или паров воды. В результате, калориметрические измерения с помощью стандартных приборов Netsch или Setaram, как правило, проблематичны и способны привести к порче приборов из-за необратимого загрязнения чувствительных датчиков. Таким образом, приходится возвращаться к проверенным временем методам, таким как, дифференциально-термический анализ. При этом особое внимание должно быть уделено капсулированию образцов в герметичные и корозионно-стойкие контейнеры [5, 6].
Экспериментальных данных о тройных взаимных системах, в которых присутствуют соли переходных металлов известных в литературе до сих пор крайне мало. Если говорить о фазовых диаграммах взаимных систем, в которых возможно образование устойчивого соединения смешанного состава на пограничной (бинарной) диаграмме, например, Li, Me || F, Cl, или адиагональных по классификации Бергмана [7], то здесь ключевым и наиболее интересным моментом является возможность одновременного протекания реакции обмена и образования устойчивого соединения (в рассматриваемом примере LiMeFCl2 или LiMeF2Cl) [8–17].
Впервые в работе [18] для бинарной хлоридной смеси LiCl–MnCl2 сообщалось о существовании соединения Li2MnCl4 шпинельного типа. Недавно мы подтвердили его присутствие на диаграмме плавкости с Tm = 855 K [19].
В качестве объекта данного исследования была выбрана солевая смесь LiF–MnCl2, которая является одной из пограничных бинарных систем во взаимной смеси LiF–MnCl2–LiCl–MnF2.
Цель настоящей работы – изучение фазовых равновесий в системе LiF–MnCl2, включающее анализ возможности протекания в ней обменных реакций и построение диаграммы плавкости.
ЭКСПЕРИМЕНТ
1. Метод синхронного термического анализа
Фазовые равновесия в солевых системах в последние годы успешно исследуются методом дифференциальной сканирующей калориметрии (ДСК) [20]. В данной работе исследования проводили методом синхронного термического анализа (СТА) с использованием термоанализатора STA 449C Jupiter фирмы NETZSCH (Германия). Этот комплекс позволяет одновременно выполнять исследования одного и того же образца методом дифференциальной сканирующей калориметрии (ДСК) и термогравиметрии (ТГ). Измерения выполняли в режиме нагрева со скоростью 5 К/мин в атмосфере высокочистого аргона (99.998%). Контейнерами служили тигли из сплава Pt–Rh с пробитыми крышками. Однако эта методика имеет некоторые недостатки. Исследуемые соли, обладая высокой агрессивностью, после плавления начинают “выползать” по стенкам тигля. Кроме того, высокая летучесть компонентов смесей при высоких температурах приводит к неконтролируемому изменению состава. Это затрудняет интерпретацию полученных результатов. Поэтому данным методом удалось исследовать только некоторые композиции. В связи с этим было принято решение разработать и сконструировать прибор дифференциального термического анализа (ДТА), в котором в качестве контейнеров используются герметичные ампулы из нержавеющей стали марки 12Х18Н10Т.
2. Метод дифференциального термического анализа
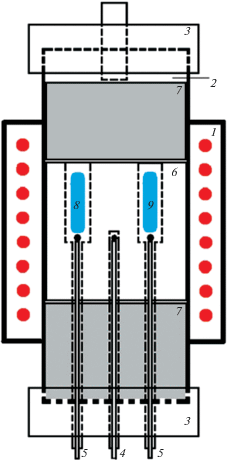
Методика измерения кривой охлаждения была реализована следующим образом. Схема установки приведена на рис. 1. Ампулы из нержавеющей стали, содержащие исследуемую солевую смесь и α-Al2O3 в качестве эталона, помещали в специальные гнезда в металлическом блоке, находящемся в кварцевой пробирке. На блок опускали теплоизолирующую заглушку и закрывали резиновой пробкой. После чего откачивали газовую атмосферу пробирки, нагревая ее до 473 К и выдерживая при этой температуре в течение 30 минут, для термической десорбции следов влаги. После этого пробирку заполняли аргоном высокой чистоты и нагревали выше температуры плавления самого тугоплавкого компонента (до 1273 К). Выдержав 10 минут, отключали нагрев печи и фиксировали изменение во времени температуры металлического блока, а также разницы температур между эталонной и исследуемой ампулами. Измерения проводили с шагом в 10 градусов от 1273 до 573 К с помощью хромель-алюмелевых термопар, откалиброванных по образцовой платино-платинородиевой термопаре.
Рис. 1.
Схема установки для ДТА: 1 – печь; 2 – кварцевая пробирка; 3 – резиновые пробки; 4 – хромель-алюмелевая термопара для измерения температуры в ячейке; 5 – хромель-алюмелевые термопары для измерения дифференциального сигнала тепловых эффектов; 6 – металлический блок; 7 – термоизолирующие блоки; 8 – ампула с исследуемой смесью; 9 – ампула с эталоном.
3. Метод рентгенофазового анализа
Фазовый состав солевых смесей определяли на сертифицированном оборудовании ЦКП ИВТЭ УрО РАН с помощью автоматического рентгеновского дифрактометра Rigaku D/MAX-2200VL/PC (Япония).
4. Метод термодинамического анализа
Термодинамические расчеты реакции обмена 2LiF + MnCl2 = 2LiCl + MnF2 проводили с помощью программного пакета HSC Chemistry 7.11 с встроенными базами данных термодинамических характеристик индивидуальных веществ.
5. Подготовка солей
Фторид лития квалификации “х. ч.” сушили под разряжением при температуре 473 К до установления постоянного давления. Затем соль подвергали трехкратной зонной перекристаллизации. Хлорид марганца получали, обезвоживая кристаллогидрат MnCl2 ⋅ 4H2O квалификации “х. ч.” парами четыреххлористого углерода. Подробная методика осушки описана в работе [19]. Безводные соли хранили в боксе в атмосфере сухого азота. Температуры плавления индивидуальных безводных LiF (1122.0 K) и MnCl2 (928.1 К), определенные методом ДСК, хорошо согласуются со справочными данными [21].
6. Приготовление солевых смесей
Солевые смеси: 0.875LiF–0.125MnCl2, 0.750LiF–0.250MnCl2, 0.625LiF–0.375MnCl2, 0.500LiF–0.500MnCl2, 0.375LiF–0.625MnCl2, 0.125LiF–0.875MnCl2 (для ДТА), 0.875LiF– 0.125MnCl2, 0.440LiF–0.560MnCl2, 0.200LiF–0.800MnCl2 (для ДСК) готовили по точным навескам. Все операции проводили в боксе.
7. Изготовление ампул из нержавеющей стали
Составные части ампул изготавливали из трубок из нержавеющей стали марки 12Х18Н10Т подходящего диаметра и толщины (рис. 2). Ампулы и переходники сваривали для дальнейшей герметизации под вакуумом. Готовые ампулы с переходниками промывали раствором соляной кислоты, затем дистиллированной водой, тщательно сушили под разряжением при 473 К и заполняли инертным газом. Затем помещали в бокс в атмосферу сухого азота и заполняли приготовленными по точным навескам солевыми смесями. В эталонную ампулу помещали порошок α-Al2O3. Масса навески исследуемых солевых смесей и эталона была равна 1 г. На переходник надевали резиновый шланг и пережимали его зажимом. Загруженные ампулы переносили из бокса к месту заваривания, подключали к вакуумному насосу и откачивали газ до значения 2 ⋅ 10–2–3 ⋅ 10–2 мм рт. ст., в течение 30 мин. Прокаливали на бензиновой горелке переходник до красного каления (для придания мягкости металлу) и саму пробирку до температуры 393–403 К (для удаления следов влаги). Повторно откачивали газ до прежнего значения давления, обжимали и заваривали тонкостенную трубку переходника, лишнюю часть обрезали.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В табл. 1 приведены результаты термодинамических расчетов реакции обмена 2LiF + MnCl2 = 2LiCl + MnF2. Проанализировав температурную зависимость константы равновесия реакции, мы сделали вывод, что равновесие смещено в сторону исходных веществ даже при самой высокой температуре.
Таблица 1.
Результаты термодинамических расчетов
| 2LiF + MnCl2 = 2LiCl + MnF2 | |||||
|---|---|---|---|---|---|
| Т, К | ΔH, кДж | ΔS, Дж/К | ΔG, кДж | К | lg K |
| 673 | 45.014 | 24.419 | 28.580 | 6.048 ∙ 10–3 | –2.218 |
| 773 | 45.440 | 25.009 | 26.109 | 1.720 ∙ 10–2 | –1.764 |
| 873 | 45.938 | 25.613 | 23.578 | 3.883 ∙ 10–2 | –1.411 |
| 973 | 48.478 | 30.322 | 18.975 | 9.578 ∙ 10–2 | –1.019 |
| 1073 | 52.405 | 34.102 | 15.814 | 1.699 ∙ 10–3 | –0.770 |
| 1173 | –2.424 | –14.789 | 14.923 | 2.165 ∙ 10–3 | –0.665 |
| 1273 | 27.667 | 10.862 | 13.840 | 2.704 ∙ 10–3 | –0.568 |
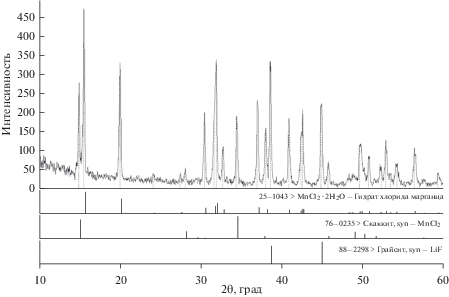
После проведения ДТА все ампулы были вскрыты, застывшие плавы исследованных смесей были подвергнуты рентгенофазовому анализу. На рис. 3 представлена рентгенограмма смеси 0.750LiF–0.250MnCl2 в качестве примера. Результаты РФА показали, что все плавы содержат два вещества: LiF и две формы (безводную и гидратированную) MnCl2. Обнаружение кристаллогидрата дихлорида марганца объясняется высокой гигроскопичностью соли и проведением РФА на воздухе.
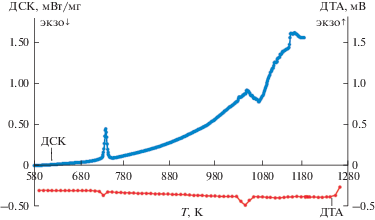
Анализ кривых ДСК и ДТА показал наличие двух термических эффектов, соответствующих точкам солидуса и ликвидуса на фазовой диаграмме системы LiF–MnCl2. На рис. 4 показано хорошее соответствие между кривыми ДСК и ДТА для смеси 0.125LiF–0.875MnCl2.
В табл. 2 собраны экспериментальные результаты термического анализа смеси LiF–MnCl2 и индивидуальных солей LiF и MnCl2.
Таблица 2.
Результаты термического анализа смеси LiF–MnCl2
| Состав солевой смеси, мол. % | T солидуса, К | T ликвидуса, К | Метод измерения | |
|---|---|---|---|---|
| LiF | MnCl2 | |||
| 1 | 0 | 1122.0 | ДСК | |
| 0.875 | 0.125 | 734.2 | 1050.2 | ДТА |
| 0.875 | 0.125 | 734.3 | 1053.5 | ДСК |
| 0.750 | 0.250 | 734.2 | 897.2 | ДТА |
| 0.625 | 0.375 | 734.2 | 801.2 | ДТА |
| 0.500 | 0.500 | 734.2 | 753.2 | ДТА |
| 0.440 | 0.560 | 733.0 | 801.8 | ДСК |
| 0.375 | 0.625 | 734.2 | 830.2 | ДТА |
| 0.250 | 0.750 | 731.2 | 839.2 | ДТА |
| 0.200 | 0.800 | 730.8 | 848.2 | ДСК |
| 0.125 | 0.875 | 734.2 | 878.2 | ДТА |
| 0 | 1 | 928.1 | ДСК | |
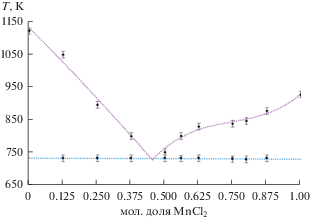
Проанализировав данные, приведенные в табл. 2, можно прийти к выводу, что фазовая диаграмма системы LiF–MnCl2 имеет вид простой двухкомпонентной системы с одной эвтектической точкой (рис. 5). При построении солидуса использовали линейную аппроксимацию, линии ликвидуса аппроксимировали полиномами третьей степени. Точку эвтектики определили, экстраполируя правую часть ликвидуса (с наибольшим количеством экспериментальных точек) до пересечения с линией солидуса. По нашим данным эвтектика близка к составу 0.547LiF–0.453MnCl2 и характеризуется температурой 734.2 К.
ЗАКЛЮЧЕНИЕ
Впервые методами ДТА и ДСК были исследованы фазовые равновесия жидкость-твердое во взаимной солевой системе LiF–MnCl2. Были исследованы 9 составов при нагреве и последующем охлаждении расплавленных смесей. Результаты РФА застывших плавов подтвердили наличие в них только двух исходных веществ (фторида лития и хлорида марганца), что хорошо согласуется с результатами термодинамического анализа реакции обмена 2LiF + MnCl2 = 2LiCl + MnF2.
Фазовая диаграмма системы LiF–MnCl2 имеет вид простой двухкомпонентной системы с одной эвтектической точкой.
Эвтектика близка к составу 0.547LiF–0.453MnCl2 и характеризуется температурой 734.2 К.
Исследование выполнено при частичной финансовой поддержке Российского фонда фундаментальных исследований (проект № 18-03-00606А).
Список литературы
Посыпайко В.И., Алексеева Е.А. Диаграммы плавкости солевых систем. Справочник в 2 ч. М.: “Металлургия”. 1977.
Bale C.W. FactSage. Thermochemical Software and Databases. 2010–2016. http:// www.factsage.com.
Janz G.J. Thermodynamic and transport properties for molten salts: correlation equations for critically evaluated density, surface tension, electrical conductance, and viscosity data // J. Phys. Chem. Ref. Data. 1988. 17. № 2. P. 44–205.
Rattanaphan S., Kanlahasuth Ph. Enhanced electrical conductivity by modifying LiCl–KCl mole fraction at high temperature // IJASEAT. 2016. 4. № 2. P. 201–206.
Lantelme F., Groult H. Molten salts chemistry from lab to applications. Elsevier. San Diego. 2013.
Василькова И.В., Ефимов А.И., Питиримов Б.З. Комплексообразование в системах MeCl–CrCl3 (Me – щелочной металл) // ЖНХ. 1964. 9. № 4. С. 900–904.
Бергман А.Г., Бухалова Г.А. Термодинамические взаимоотношения в тройных взаимных системах с комплексообразованием // Изв. сектора физ.-хим. анализа. 1952. 21. С. 228–249.
Банашек Е.И., Бергман А.Г. Тройная адиагональная взаимная система из фторидов и хлоридов натрия и бария. // Докл. Академии Наук СССР. 1947. 56. № 5. С. 485–486.
Бергман А.Г., Домбровская Н.С. Об обменном разложении в отсутствии растворителя // Журн. Росс. физ.-хим. общества. 1929. 61. С. 1451–1478.
Гаркушин И.К. Анализ, прогнозирование и экспериментальное исследование рядов систем из галогенидов щелочных и щелочноземельных элементов. Екатеринбург: УрО РАН. 2006.
Воздвиженский В.М. Прогноз двойных диаграмм состояния. М.: Металлургия. 1975.
Беляев И.Н., Ревина О.Я. Система MeF–MnF2 (Me–Li, Na, K, Rb, Cs) // Журн. неорганической химии. 1966. 11. № 6. С. 1446–1450.
de Kozak M.A. Systems of CrF3–MF (M = Li, Na and K) // C. R. Acad. Sc. Paris. Serie C. 1969. 268. P. 416–418.
Dessureault Y., Pelton A. D. Contribution to the quasichemical model of reciprocal molten salt solutions // J. Chim. Phys. 1991. 88. P. 1811–1830.
Pelton A.D., Sharma R.A. Thermodynamic evaluation of phase equilibria in MCl3–MF3–MgCl2–MgF2 systems where M = La, Nd, Ce // Calphad. 1996. 20. № 2. P. 231–246.
Chartrand P., Pelton A.D. Thermodynamic Evaluation and Optimization of the LiCl–NaCl–KCl–RbCl–CsCl–MgCl2–CaCl2–SrCl2 system using the modified quasichemical model // Canadian Metallurgical Quarterly. 2000. 39. № 4. P. 405–420.
Kang Y.B., Pelton A.D. The shape of liquid miscibility gaps and short-range-order // J. Chem. Thermodynamics. 2013. 60. P. 19–24.
Sandonnini C., Scarpa G. Binary systems of MnCl2 with alkali chlorides // Atti della Reale Accad. dei Lincei. 1913. ser. 5. 22. № II. P. 163–168.
Корзун И.В., Докутович В.Н., Степанова Е.В., Ткачев Н.К. Фазовая диаграмма бинарной системы LiCl–MnCl2 //Расплавы. 2018. № 6. С. 642–651.
Rycerz L. Practical remarks concerning phase diagrams determination on the basis of differential scanning calorimetry measurements // J. Therm. Anal. Calorim. 2013. 113. P. 231–238.
Термодинамические свойства индивидуальных веществ. Электронный справочник в 6-ти томах. М.: Наука. 1978–2004. http://twt.mpei.ac.ru/TTHB/2/OIVT/IVTANThermo/Rus/index.htm
Дополнительные материалы отсутствуют.