Расплавы, 2021, № 2, стр. 187-198
Электровыделение кремния из расплава KCl–K2SiF6
Т. А. Гевел a, b, *, С. И. Жук a, b, Ю. А. Устинова a, А. В. Суздальцев a, b, Ю. П. Зайков a, b
a Уральский федеральный университет
Екатеринбург, Россия
b Институт высокотемпературной электрохимии УрО РАН
Екатеринбург, Россия
* E-mail: Timofey.Gevel@at.urfu.ru
Поступила в редакцию 15.11.2020
После доработки 03.12.2020
Принята к публикации 07.12.2020
Аннотация
В работе изучена возможность применения системы KCl–K2SiF6 для электролитического получения кремния. При помощи комплекса электрохимических методов анализа (циклическая хроновольтамперометрия, квадратно-волновая вольтамперометрия, хроноамперометрия) исследована кинетика электровосстановления ионов кремния на стеклоуглероде в расплаве KCl с добавкой 5 мас. % K2SiF6 при температуре 790°С. Показано, что электровосстановление кремния в условиях эксперимента протекает в одну обратимую 4-х электронную стадию. Были определены формально-кинетические параметры электровосстановления кремния в условиях нестационарной поляризации. По уравнению Берзинса–Делахея для электрохимически обратимого процесса оценен коэффициент диффузии электроактивных ионов, который составил 1.87 · 10–6 см2/с. На основании электрохимических измерений выбраны параметры электроосаждения кремния волокнистой структуры из исследуемых расплавов. Электроосаждение кремния на стеклоуглеродной подложке проводили в потенциостатическом режиме при потенциале от –0.1 до –0.25 В относительно кремниевого электрода сравнения. В результате были получены осадки кремния развитой структуры со средним размером частиц 200–300 нм.
ВВЕДЕНИЕ
В настоящее время кремний находит все большее применение в чистых и относительно безопасных отраслях возобновляемой и малой энергетики [1–3]. В частности, активно проводятся теоретические и экспериментальные работы, направленные на разработку литий-ионных аккумуляторов с анодами на основе кремниевых нанокомпозитных структур, которые обладают улучшенными эксплуатационными характеристиками [4–7]. Одним из перспективных способов получения кремния с управляемыми размерами и морфологией является его электроосаждение из расплавленных солей. Известны способы получения микро- и наноразмерных осадков кремния из расплавленных солей галогенидов щелочных и щелочноземельных металлов в широком диапазоне температур (500–1400°С) с применением в качестве источника кремния коммерческого кремния n-типа, гексафторсиликата калия, тетрахлорида кремния, диоксида кремния и других соединений [7–15]. Наиболее эффективной системой для работы с диоксидом кремния считается FLiNaK, однако компоненты данной системы практически нерастворимы в воде и, ввиду относительно высоких температур кипения, не могут быть отделены от катодного осадка кремния без его плавления с использованием вакуумной дистилляции. В качестве водорастворимой для получения кремния позиционируется система KCl–KF с мольной долей KF до 66% [7–12], которая является хорошим растворителем как для K2SiF6, так и для SiO2. Показано, что при электролизе данной системы могут быть получены как сплошные осадки дендритной и эпитаксиальной формы, так и микро- и наноразмерные осадки с развитой поверхностью. Из недостатков способов получения кремния при электролизе данной системы стоит отметить: агрессивность KF к материалам реакторов, необходимость удаления примесей типа H2O, HF из KF при подготовке расплавленной смеси KCl–KF и термическая неустойчивость тетрафторида кремния. Все этих факторы могут приводить к нестабильности состава расплава, появлению примесей в получаемом кремнии и необходимости дополнительного контроля с целью регулирования морфологией осадка при электролизе. Для устранения этих недостатков ведется поиск альтернативных сред для получения кремния с пониженным содержанием фторида в системе [16–18], а также сред, не содержащих химически агрессивные фториды.
В настоящей работе при помощи комплекса электрохимических методов анализа и электролизных испытаний изучена принципиальная возможность электролитического получения кремния из расплава KCl с добавкой 5 мас. % K2SiF6 при температуре 780°С.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Приготовление расплавов. Электролиты с содержанием K2SiF6 5 мас. % готовили путем смешения индивидуальных солей квалификации “х. ч.” (Реахим, Россия) и их последующего плавления в стеклоуглеродном тигле непосредственно перед экспериментами. В работах [19, 20] было показано, что используемый хлорид калия квалификации “х. ч.” по чистоте близок к перекристаллизованной соли. Вследствие этого дополнительную очистку приготовленного расплава от электроположительных примесей не проводили.
Описание установки. Электрохимические измерения и электролизные испытания проводили в трехэлектродной герметичной кварцевой ячейке в атмосфере высокочистого аргона при температуре 790°С (рис. 1).
Рис. 1.
Схема и фотографии экспериментальной ячейки и фторопластовой крышки: 1 – электрод сравнения; 2 – противоэлектрод; 3 – рабочий электрод; 4 – фторопластовая крышка; 5 – стеклоуглеродный стакан.

Рабочую ячейку размещали в кварцевой реторте, стенки которой изнутри защищали от фторсодержащих возгонов никелевыми экранами. Стеклоуглеродный тигель с исследуемым расплавом размещали на дне реторты, которую герметично закрывали фторопластовой крышкой. В крыше были выполнены отверстия с выходными штуцерами, в которых крепили экранированные кварцевыми трубками рабочий электрод (стеклоуглерод), кремниевый противоэлектрод и кремниевый квазиэлектрод сравнения. Дополнительно в крышке были предусмотрены отверстия для термопары, подачи газа или загрузки кремнийсодержащих добавок, а также для дополнительного рабочего электрода. Герметизацию осуществляли при помощи пробок из вакуумной резины, а также стальных и пластиковых хомутов.
Электрохимические измерения. Электрохимические измерения проводили методами циклической хроновольтамперометрии, квадратно-волновой вольтамперометрии и хроноамперометрии с использованием PGSTAT AutoLAB 302Nи ПО Nova 1.11 (The Metrohm, Нидерланды). Перед измерением электроды выдерживали в течение 30 мин в расплаве для установления стабильной (в пределах ±5 мВ) разницы потенциалов между рабочим электродом и квазиэлектродом сравнения. С целью определения и компенсации омического падения напряжения в измерительной использовали методы импедансометрии и прерывания тока (I-Interrupt).
Электроосаждение кремния проводили в потенциостатическом режиме на стеклоуглеродные пластины площадью 2 см2 с использованием PGSTAT AutoLAB 302N. Анодом служил монокристаллический кремний n-типа.
Анализ осадка. По окончании электролизных испытаний осадки поднимали над расплавом, выдерживали в течение 30 мин в аргоне с целью стекания расплава, после чего охлаждали до комнатной температуры и извлекали из ячейки. Осадок счищали с подложки и многократно промывали в бидистилляте. Для диспергирования осадка применяли ультразвуковой диспергатор SONOPULS UW mini 20. Диспергирование проводили в периодическом режиме при заданной мощности 0.995 кДж длительностью импульса 90 с. Содержание кремния в расплаве до и после электрохимических измерений и электролизных испытаний определяли атомно-эмиссионным методом с использованием спектрометра iCAP 6300 Duo Spectrometer (Thermo Scientific, США). Структурные характеристики катодного осадка определяли на сканирующем электронном микроскопе Phenom ProX (Phenom-World, Нидерланды), анализаторе адсорбции азота SORBI No 41 (Россия) и лазерном дифракционном анализаторе Malvern Mastersizer 2000 (Malvern Instruments, Великобритания).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЯ
Хроновольтамперометрия. На рисунке 2 приведены циклические хроновольтамперограммы, полученные при разной скорости развертки потенциала в расплаве KCl c добавкой 5 мас. % K2SiF6 при температуре 790°С. На них виден один пик электровосстановления кремния (кремнийсодержащих ионов), а также один пик электроокисления кремния в области потенциалов около –0.12 и 0.08 В относительно потенциала кремниевого квазиэлектрода сравнения, соответственно. Из этого можно предположить, что электровосстановление кремния протекает в одну стадию по реакции:
Рис. 2.
Вольтамперограммы, полученные на стеклоуглеродном электроде в расплаве KCl с 5 мас. % K2SiF6 при температуре 790°С и скорости развертки потенциала от 0.01 до 1.5 В/с.

Для уточнения особенностей механизма электровосстановления кремния на стеклоуглероде из исследуемого расплава на рис. 3 приведены критериальные зависимости ip–v0.5 и Ep–ln v [21].
Рис. 3.
Зависимости Ep–ln v и ip–v0.5, полученные в результате вольтамперных измерений на стеклоуглероде в системе KCl с добавкой 5 мас. % K2SiF6 при температуре 790°С.

Из приведенных хроновольтамперограмм и зависимостей ip–v0.5 и Ep–ln v можно отметить следующее [21]:
– постоянство потенциала пика электровосстановления кремния при изменении скорости развертки потенциала (Ep–ln v) свидетельствует об электрохимической обратимости исследуемого процесса;
– плотность тока пика линейно меняется в зависимости от квадратного корня скорости развертки потенциала, что характерно для процесса, контролируемого диффузией.
В результате анализа для оценки коэффициента диффузии использовали уравнение Берзинса–Делахея для электрохимически обратимого процесса, контролируемого линейной диффузией [21]:
(2)
${{i}_{{\text{p}}}} = \frac{{1.082{{z}^{{1.5}}}{{F}^{{1.5}}}D_{{{\text{OX}}}}^{{0.5}}C_{{{\text{OX}}}}^{0}{{v}^{{0.5}}}}}{{{{{(\pi RT)}}^{{0.5}}}}},$Концентрацию $С_{{{\text{OX}}}}^{0}$ рассчитывали по формуле $C_{{{\text{OX}}}}^{0} = {{\omega \rho } \mathord{\left/ {\vphantom {{\omega \rho } M}} \right. \kern-0em} M}$, где ω – массовая доля K2SiF6; ρ – плотность расплава, ${{\rho }_{t}} = 1.539 - 0.00059(t - 750)$, г/см3 [16, 22]; М – молярная масса K2SiF6, г/моль; t – температура, °С. В первом приближении считали, что добавка 5 мас. % K2SiF6 не оказывает влияния на плотность расплава, а концентрация K2SiF6 на протяжении электрохимических измерений оставалась постоянной и составляла 2.96 · 10–5 моль/см3. Величина коэффициента диффузии составила 1.87 · 10–6 см2/с.
Кваратно-волновая вольтамперометрия. Помимо использования классической циклической хроновольтамперометрии с целью уточнения кинетических параметров процесс электровосстановления кремния из расплава KCl–K2SiF6 был исследован методом квадратно-волновой вольтамперометрии [23]. Вольтамперные зависимости получали в интервале частот от 40 до 100 Гц (скорость развертки потенциала от 0.2 до 0.5 В/с) с амплитудой 0.02 В. Полученные вольтамперные зависимости приведены на рис. 4. На них виден один четкий пик электровосстановления кремния при потенциале около –0.1 В, что также указывает на одностадийность исследуемого электродного процесса. Зависимости пика плотности тока от квадратного корня частоты имеют линейный вид (рис. 5), что указывает на диффузионный характер затруднений процесса. В этом случае из ширины полупика (W1/2) по уравнению (3) может быть оценено число электронов, принимающих участие в электродном процессе [21].
(3)
${{W}_{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}} = 3.52{{RT} \mathord{\left/ {\vphantom {{RT} {zF.}}} \right. \kern-0em} {zF.}}$Рис. 4.
Вольтамперные зависимости, полученные методом квадратно-волновой вольтамперометрии на стеклоуглероде в расплаве KCl с 5 мас. % K2SiF6 при температуре 790°С и разной частоте реверса потенциала.

Рис. 5.
Зависимость пикового значения тока от корня квадратного частоты реверса потенциала на вольтамперограммах, полученных методом квадратно-волновой вольтамперометрии.

Число электронов, участвующих в электродном процессе при потенциале около ‒0.1 В, рассчитанное по уравнению (3) составило z = 3.83 → z = 4, что подтверждает электровосстановление кремния по реакции (1).
Хроноамперометрия. Для выявления затруднений, связанных с зарождением новой фазы, процесс электровосстановления кремния на стеклоуглероде в расплаве KCl–K2SiF6 был исследован методом хроноамперометрии. На рис. 6 представлены хроноамперограммы, полученные при импульсах катодного потенциала от –0.03 до –0.15 В относительно кремниевого квазиэлектрода сравнения. Диапазон потенциалов выбирали на основании результатов вольтамперных измерений. На полученных хроноамперограммах отсутствуют пики в области времен 0.1–0.2 с, характерные для протекания исследуемого процесса в условиях замедленного зарождения новой фазы [9, 24].
Рис. 6.
Хроноамперограммы, полученные на стеклоуглероде в расплаве KCl с 5 мас. % K2SiF6 при температуре 790°С при разном импульсе перенапряжения.

Электролизные испытания. Электролизные испытания проводили с использованием катодов – пластин из стеклоуглерода в расплаве KCl с содержанием 5 мас. % K2SiF6 при 790°С. На основании имеющихся литературных представлений и полученных нами результатов было предположено, что повышение катодного перенапряжения (разности потенциалов между рабочим электродом и кремниевым квазиэлектродом сравнения) будет способствовать электроосаждению более крупных дендритов кремния. Поэтому электроосаждение проводили в диапазоне значений катодного перенапряжения от 0.1 до 0.25 В в течение 10 ч. Параметры и результаты электролизных испытаний приведены в табл. 1.
Таблица 1.
Параметры электрохимического синтеза кремния в расплаве (мас. %) 95KCl–5K2SiF6 при температуре 790°С
| Катодное перенапряжение, В | Плотность тока, мА/см2 | Осадок | Средний размер, мкм | |
|---|---|---|---|---|
| 1 | 0.25 | 30–0.2 | Волокна, дендриты | 0.2–1 |
| 2 | 0.15 | 25–0.2 | Волокна | 0.2–0.3 |
| 3 | 0.1 | 18–0.2 | Волокна | 0.2–0.3 |
На рис. 7 представлены фотографии осадков, полученных в ходе электролиза расплава KCl–K2SiF6 при разном катодном перенапряжении. Во всех случаях были получены осадки, плохо адгезированные к поверхности подложки. При этом по характерному цвету (от коричневого до бежевого) можно сделать предположение, что они были представлены дендритными микро- и субмикроразмерными структурами.
Рис. 7.
Фотографии катодных осадков кремния, полученных при электролизе расплава KCl с 5 мас. % K2SiF6 при температуре 790°С на стеклоуглероде при катодном перенапряжении 0.25 (1), –0.15 (2) и –0.10 (3) В.

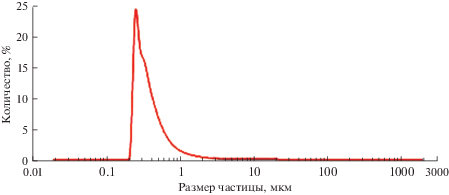
С целью ускорения отмывки осадка от остатков соли дополнительно применяли многократное диспергирование осадков. Для анализа структуры и размерных характеристик был выбран осадок с наименьшей скоростью осаждения в бидистилляте, который был получен при электролизе с катодным перенапряжением 100 мВ. На рис. 8 приведен гранулометрический состав полученного осадка, а на рис. 9 – его микрофотографии. По структурным особенностям полученный в данной работе осадок схож с осадками, полученными ранее в работе [7].
ВЫВОДЫ
В работе при помощи комплекса электрохимических методов анализа изучена кинетика электровосстановления кремния на стеклоуглероде из расплавленной системы KCl с добавкой 5 мас. % K2SiF6 при температуре 790°С. Определены формально-кинетические параметры электровосстановления кремния в условиях нестационарной поляризации и показано, что исследуемый процесс является электрохимически обратимым, при этом в условиях эксперимента протекает в одну 4-х электронную стадию. Для электрохимически обратимого процесса по уравнению Берзинса–Делахея оценен коэффициент диффузии электроактивных ионов, который составил 1.87 · 10–6 см2/с.
На основании электрохимических измерений выбраны параметры для электроосаждения кремния волокнистой структуры из исследуемых расплавов. Электроосаждение кремния на стеклоуглеродной подложке проводили в потенциостатическом режиме при потенциале от –0.1 до –0.25 В относительно кремниевого квазиэлектрода сравнения. В результате были получены осадки кремния развитой структуры со средним размером частиц 200–300 нм.
Из представленных результатов следует, что система KCl–K2SiF6, наряду с рекомендованной ранее системой KF–KCl–K2SiF6, может быть использована для электролитического получения кремния.
Работа выполнена в рамках соглашения № 075-03-2020-582/1 от 18.02.2020 (№ темы 0836-2020-0037). Состав расплавов и структура осадков были изучены на оборудовании ЦКП “Состав вещества” Института высокотемпературной электрохимии УрО РАН. Авторы выражают благодарность А.Е. Вахромеевой, Н.Г. Молчановой и Д.М. Солодянкиной за выполнение анализа кремния.
Список литературы
Li G., Jin Y., Akram M.W., Chen X. Research and current status of the solar photovoltaic water pumping system – A review // Renewable and Sustainable Energy Reviews. 2017. 79. P. 440–458.
Liu Z., Sofia S.E., Laine H.S., Woodhouse M., Wieghold S., Peters, I.M., Buonassisi T. Revisiting thin silicon for photovoltaics: A technoeconomic perspective // Energy and Environmental Science. 2020. 13. P. 12–23.
Juzeliūnas E., Fray D.J. Silicon electrochemistry in molten salts // Chemical Reviews. 2020. 120. P. 1690–1709.
Armand M., Axmann P., Bresser D., Copley M., Edstrom K., Ekberg Ch., Guyomard D., Lestriez B., Novak P., Petranikova M., Porcherl W., Trabesinger S., Wohlfahrt-Mehrens M., Zhang H. Lithium-ion batteries – current state of the art and anticipated developments // J. Power Sources. 2020. 479. 228708.
Ren W., Zhou Y., Li J.-T., Huang L., Sun Sh.-G. Si anode for next-generation lithium-ion battery // Current Opinion in Electrochem. 2019. 18. P. 46–54.
Galashev A.Y., Suzdaltsev A.V., Ivanichkina K.A. Design of the high performance Microbattery with silicene anode // Mat. Sci. & Eng. B. 2020. 261. № 114718.
Зайков Ю.П., Исаков А.В., Аписаров А.П., Чемезов О.В. Получение кремния электролизом галогенидных и оксидно-галогенидных расплавов // Цветные металлы. 2013. № 2. С. 58–62.
Maeda K., Yasuda K., Nohira T., Hagiwara R., Homma T. Silicon electrodeposition in water-soluble KF-KCl molten salt: Investigations on the reduction of Si(IV) ions // J. Electrochem. Soc. 2015. 162. № 9. P. D444–D448.
Зайков Ю.П., Жук С.И., Исаков А.В., Гришенкова О.В., Исаев В.А. Электроосаждение кремния из расплава KF–KCl–KI–K2SiF6 // Расплавы. 2016. № 5. С. 441–454.
Фроленко Д.Б., Мартемьянова З.С., Барабошкин А.Н., Плаксин С.В. Электроосаждение кремния из фторидно-хлоридных расплавов // Расплавы. 1993. № 5. С. 42–49.
Ветрова Д.А., Кузнецов С.А. Электрохимическое поведение редокс пары Ti(IV)/Ti(III) в расплаве KCl–KF–K2TiF6 в присутствии катионов щелочноземельных металлов // Расплавы. 2020. № 2. С. 208–220.
Zhuk S.I., Isakov A.V., Apisarov A.P., Grishenkova O.V., Isaev V.A., Vovkotrub E.G., Zaykov Y.P. Electrodeposition of continuous silicon coatings from the KF–KCl–K2SiF6 melts // J. Electrochem. Soc. 2017. 164. № 8. P. H5135–H5138.
Кузнецова С.В., Долматов B.C., Кузнецов С.А. Вольтамперометрическое исследование электровосстановления комплексов кремния в хлоридно-фторидном расплаве // Электрохимия. 2009. 45. С. 797–803.
Sakanaka Y., Murata A., Goto T., Hachiya K. Electrodeposition of porous Si film from SiO2 in molten BaCl2–CaCl2–NaCl // J. Alloys and Comp. 2017. 695. P. 2131–2135.
Zou X., Ji L., Yang X., Lim T., Yu E.T., Bard A.J. Electrochemical formation of a p-n junction on thin film silicon deposited in molten salt // J. Amer. Chem. Soc. 2017. 139. P. 16 060–16 063.
Худорожкова А.О., Исаков А.В., Катаев А.А., Редькин А.А., Зайков Ю.П. Плотность расплавов KF–KCl–KI // Расплавы. 2020. № 3. С. 291–301.
Худорожкова А.О., Исаков А.В., Редькин А.А., Зайков Ю.П. Температуры ликвидуса расплавов KF–KCl–KI // Расплавы. 2019. № 4. С. 375–383.
Vorob'ev A.S., Isakov A.V., Kazakovtseva N.A., Khudorozhkova A.O., Galashev A.E., Zaikov Yu.P. Calculations of silicon complexes in KF–KCl–KI–K2SiF6 and KF–KCl–KI–K2SiF6–SiO2 molten electrolytes // AIP Conference Proceedings. 2019. 2174. 020072.
Ковров В.А., Муллабаев А.Р., Шишкин В.Ю., Зайков Ю.П. Растворимость Li2O в расплаве LiCl–KCl // Расплавы. 2018. № 1. С. 61–68.
Николаев А.Ю., Муллабаев А.Р., Суздальцев А.В., Ковров В.А., Холкина А.С., Шишкин В.Ю., Зайков Ю.П. Очистка хлоридов щелочных металлов методом зонной перекристаллизации для использования в операциях пирохимической переработки отработавшего ядерного топлива // Атомная энергия. 2020. (в печати).
Bard A.J., Faulkner L.R. Electrochemical methods: fundamentals and applications, 2nd ed. John Wiley & Sons. N.Y. 2001.
Минченко М.В., Степанов В.П. Ионные расплавы: упругие и калорические свойства. Екатеринбург: УрО РАН. 2008. С. 338.
Филатов А.А., Суздальцев А.В., Николаев А.Ю., Зайков Ю.П. Кинетика электровыделения циркония и алюминия из расплавов KF–AlF3–ZrO2 // Расплавы. 2019. № 3. С. 287–304.
Исаев В.А., Гришенкова О.В., Зайков Ю.П. Потенциостатические транзиенты тока при диффузионном контроле роста новой фазы // Расплавы. 2018. № 4. С. 420–427.
Дополнительные материалы отсутствуют.