Растительные ресурсы, 2020, T. 56, № 2, стр. 165-172
Экдистероиды и фенольные соединения некоторых видов Caryophyllaceae
Л. Н. Зибарева 1, *, Е. С. Филоненко 1, Е. А. Кастерова 1, Т. П. Анцупова 2, Г. Б. Ендонова 2, С. В. Нестерова 3
1 Томский государственный университет, Сибирский ботанический сад
г. Томск, Россия
2 Восточно-Сибирский государственный университет технологий и управления
г. Улан-Удэ, Россия
3 Ботанический сад-институт ДВО РАН
г. Владивосток, Россия
* E-mail: zibareva.lara@yandex.ru
Поступила в редакцию 27.02.2020
После доработки 03.03.2020
Принята к публикации 18.03.2020
Аннотация
Методом ВЭЖХ проведено изучение компонентного состава экдистероидов и фенольных соединений семи видов (13 образцов) семейства Caryophyllaceae Juss. (Гвоздичные). Установлено, что состав, содержание экдистероидов и флавоноидов Silene jenisseensis Willd., Silene repens Patrin из разных районов Бурятии и Дальнего Востока России различаются. Выявлены характерные вторичные метаболиты в образцах S. jenisseensis – 20-гидроксиэкдизон, 2-дезоксиэкдизон, экдизон, ориентин. Установлено отсутствие мажорного экдистероида 20-гидроксиэкдизона в видах Lychnis sibirica L., Stellaria dichotoma L., Dianthus superbus L., Eremogone meyer (Fenzl) Ikonn., Stellaria longifolia Muhl. ex Willd и образце Silene repens из Бурятии (Куйтун). Большее содержание экдистероидов определено в S. jenisseensis (3.5%) из Бурятии, в S. repens Приморского края – 1.2%. Показано, что наибольшее содержание флавоноидов наблюдали в Stellaria longifolia – 4.6%. Для изученных видов родов Silene L. и Lychnis L. характерно присутствие ориентина, тогда как для других родов – витексина и изовитексина.
Род Silene L. семейства Caryophyllaceae Juss. является одним из многочисленных родов мировой флоры. По данным Greuter [1] в нем насчитывается более 700 видов. Для рода Silene характерен широкий ареал, большая часть видов произрастает в странах Средиземноморья. Только в Греции встречается не менее 119 видов [1], в Турции – 122, в Иране – 141, в северной Африке – 92, а в целом в Европе – 203 вида [2]. На территории СНГ произрастает 206 видов [3], в Сибири – 40, в Томской области – 4 вида [4], на Дальнем Востоке России – 9 видов [3].
Известно, что для Caryophyllaceae характерным признаком является присутствие тритерпеновых гликозидов (сапонинов), кроме того, в компонентный состав входят алкалоиды, флавоноиды, кумарины. Внимание к семейству Гвоздичных возросло многократно в последние годы в связи с обнаружением гормонов линьки насекомых в растениях этого семейства. Большая часть видов, синтезирующих искомые соединения, встречается в трибе Lychnideae подсемейства Caryophyllоideae – родах Silene L., Lychnis L., Petrocoptis A. Braun, Sagina L., Saponaria L. Растения семейства Гвоздичные характеризуются разнообразным составом экдистероидов, наличием множества новых соединений, обнаруженных пока только в них, высоким содержанием мажорных компонентов фракции экдистероидов. Из растений этого семейства выделено более 93 экдистероидов. В настоящее время по литературным и нашим экспериментальным данным экдистероиды обнаружены более чем в 140 видах Silene [4–6]. Ни в одном из других семейств не выявлено такое множество экдистероидсодержащих видов. Наиболее часто встречающимися являются такие экдистероиды как 20-гидроксиэкдизон (20Е), полиподин В (ПВ), витикостерон Е, 2-дезокси –производные 20Е, экдизона (Е), интегристерона А. Для растений рода Silene свойственно наличие большого числа не только свободных экдистероидов, но и различных производных.
Из соединений полифенольного комплекса Caryophyllaceae наиболее изучены флавоноиды. Показано, что виды рода Silene [7, 8] содержат виценины, изовитексин, ориентин, гомоориентин, изосапонарин, адонивернит, сапонаретин, витексин и др. Так в S. compacta установлено присутствие 24 фенольных соединений, включая оксикоричные кислоты и флавоноиды (гесперидин, рутин, гиперозид, лютеолин, кемпферол, апигенин и др.) [9]. В 26 видах рода Silene, включая S. graminifolia Otth, S. jenisseensis Willd, S. chlorantha Willd, S. italica (L.) Pers. обнаружены виценин-2, витексин [10], в S. schafta S.G.Gmel. ex Hohen –шафтозид [11], в S. nutans L. – луценин-2, виценин-2, шафтозид, изошафтозид и С-моногликоиды [12].
В других родах семейства Caryophyllaceae Cerastium L., Arenaria L., Stellaria L., Allochrusa Bunge ex Boiss. обнаружен виценин [13]. Следует заметить, что С-гликозиды флавонов встречаются реже других флавоноидов.
В связи с тем, что экдистероиды обладают широким спектром фармакологического действия, а виценин-1 в комплексе с тригонеозидом Ib рекомендуется для лечения аутоиммунных заболеваний [14], виценин-2 проявляет антиоксидантные, противовоспалительные, противоопухолевые и гепатопротекторные свойства, антидиабетическую активность, т.к. сильно ингибирует α-глюкозидазу [15], поиск перспективных источников таких ценных вторичных метаболитов является актуальным.
Целью данного исследования является выявление перспективных образцов видов родов Silene, Lychnis, Eremogone, Stellaria, Dianthus, содержащих экдистероиды и флавоноиды.
МАТЕРИАЛ И МЕТОДЫ
Надземная часть исследуемых видов собрана в фазу цветения в 2012–2017 гг. (табл. 1). Измельчение сухого сырья проводили с помощью универсальной роторной ножевой лабораторной мельницы ЛМ 201 с размольной камерой, охлаждаемой водой (ООО Плаун, Россия). Размер размолотого образца 500–10 мкм. Навеску воздушно-сухого сырья массой около 1 г пятикратно экстрагировали 70% этиловым спиртом на водяной бане при температуре 55 °С. Полученные экстракты фильтровали и концентрировали с помощью ротационного испарителя IKA HB 10 digital (Германия) при температуре 50 °С. Полученные экстракты использовали для дальнейшего анализа.
Таблица 1.
Виды растений Caryophyllaceae, использованные в эксперименте Table 1. Caryophyllaceae species used in the experiment
| № | Образцы Samples |
Место сбора сырья Origin of the raw materials |
|---|---|---|
| 1 | Silene jenisseensis Willd. (смолевка енисейская) | Республика Бурятия, Муйский р-н, окр. п. Таксимо, высота
над ур. моря 516 м, открытая местность, луг Republic of Buryatia, Muisky district, near Taksimo village, elevation above sea level 516 m, open area, meadow |
| 2 | S. jenisseensis | Республика Бурятия, окр. г. Улан Удэ, высота над ур. моря 500 м, разреженный лес Buryatia, the vicinity of Ulan Ude, elevation above sea level 500 m m., sparse forest |
| 3 | S. jenisseensis | Республика Бурятия, Баргузинский р-н, с. Улюн, высота над ур. моря 490 м, скалистый
склон юго-восточной экспозиции, разреженный лиственничный лес Republic of Buryatia, Barguzinsky district, Ulyun village, elevation above sea level 490 m, rocky slope of the southeast exposure, sparse larch forest |
| 4 | S. jenisseensis | Республика Бурятия, окр. г. Улан Удэ (ст. Комушка), высота
над ур. моря 597 м, разнотравно-злаковая степь Republic of Buryatia, suburbs of Ulan Ude (Komushka), elevation above sea level 597 m, motley grass-grass steppe |
| 5 | S. jenisseensis | Приморский край, Ханкайский р-н, окр. п. Турый Рог, побережье о. Ханка Primorsky Territory, Khankaisky district, outskirts of Tury Rog village, coast of Lake Khanka |
| 6 | S. repens Patrin (смолевка ползучая) | Республика Бурятия, Курумканский р-н, улус Барагхан, заимка Куйтун, высота над ур.
моря 495 м Republic of Buryatia, Kurumkansky district, Baraghan ulus, Kuitun settlement, elevation above sea level 495 m |
| 7 | S. repens | Республика Бурятия, Окинский р-н, база отдыха “Шумак”,
высота над ур. моря 1500 м, субальпийский луг Republic of Buryatia, Okinsky district, recreation center “Shumak”, elevation above sea level 1500 m, subalpine meadow |
| 8 | S. repens | Приморский край, Лазовский р-н, окр. п. Заповедное, бухта Киевка Primorsky Territory, Lazovsky District, outskirts of Zapovednoye village, Kievka Bay |
| 9 | Lychnis sibirica L. (лихнис сибирский) | Республика Бурятия, окр. г. Улан Удэ, п. Верхняя Березовка, высота над ур. моря 500
м, сухой сосновый лес Republic of Buryatia, outskirts of Ulan Ude, Verkhnyaya Berezovka, elevation above sea level 500 m, dry pine forest |
| 10 | Eremogone meyeri (Fenzl) Ikonn. (еремогоне Мейера) | Республика Бурятия, Селенгинский р-н, высота над ур. моря 580 м,
щебнистый склон Buryatia, Selenginsky district, height above sea level 580 m, detrital slope |
| 11 | Stellaria longifolia Muhl. ex Willd. (звездчатка длиннолистная) | Республика Бурятия, Заиграевский р-н, п. Онохой, высота над ур. моря 542 м, берег
р. Уда Republic of Buryatia, Zaigraevsky district, Onokhoy village, elevation above sea level 542 m, the bank of the Uda River |
| 12 | Stellaria dichotoma L. (звездчатка развилистая) | Республика Бурятия, Иволгинский р-н, окр. п. Сотниково, высота над ур. моря 521 м,
разнотравно-злаковая степь Republic of Buryatia, Ivolginsky district, outskirts of Sotnikovo village, elevation above sea level 521 m, motley grass-grass steppe |
| 13 | Dianthus superbus L. (гвоздика пышная) | Республика Бурятия, окр. г. Улан Удэ, п. Верхняя Березовка, высота над ур. моря 525
м, редкоствольный смешанный сосново-лиственничный лес Republic of Buryatia, outskirts of Ulan Ude, Verkhnyaya Berezovka, elevation above sea level 525 m, sparse mixed pine-larch forest |
Анализ биологически активных веществ выполнен методом высокоэффективной жидкостной хроматографии (ВЭЖХ) на жидкостном хроматографе Shimadzu LC-20AD (Япония), диодно-матричный детектор, хроматографическая колонка Perfect Sil Target ODS-3; 4.6 × 250 мм, размер зерна сорбента – 5 мкМ. Элюент А: смесь ацетонитрила, изопропилового спирта (5 : 2 v/v); элюент В: 0.1% трифторуксусная кислота. Время анализа – 60 мин. Скорость элюирования – 1 мл/мин. Режим элюирования: градиент низкого давления; программа градиента: 0–40 мин 15–35% элюент А, 40–60 мин 35% элюент А. Объем пробы 5 мкл. Аналитическая длина волны λmax = = 242 нм для регистрации экдистероидов и 272 нм – флавоноидов. Идентификацию сигналов на хроматограммах осуществляли сопоставлением времен удерживания и максимумов поглощения компонентов экстрактов и стандартных образцов. Фенольные соединения идентифицированы с использованием стандартов (Sigma-Aldrich, Lachema; чистота ≥ 95.0%). Экдистероиды – 20-гидроксиэкдизон, 2-дезоксиэкдизон, 2-дезокси-20-гидроксиэкдизон, экдизон, птеростерон, 20-гидроксиэкдизон-2-ацетат, используемые в качестве внутренних стандартов, ранее выделены и идентифицированы методами масс-спектрометрии и ядерно-магнитного резонанса [6, 16, 17]. Содержание БАВ рассчитывалось по площадям пиков образца и соответствующих стандартов с помощью калибровочной кривой, построенной с использованием программного обеспечения LC Postrun Calibration Curve. Анализ проводили в 3-х повторностях, статистические расчеты осуществляли в Microsoft Excel, 2007. Данные представлены в виде среднего арифметического и стандартной ошибки.
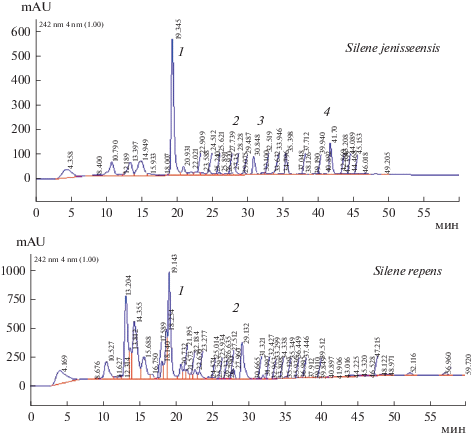
Рис. 1.
ВЭЖХ этанольных экстрактов Silene jenisseensis (Республика Бурятия, г. Улан Удэ) и Silene repens (Приморский край); 1 – 20-гидроксиэкдизон, 2 – экдизон, 3 – 2-дезокси-20-гидроксиэкдизон, 4 – 2-дезоксиэкдизон. Fig. 1. HPLC of ethanol extracts of Silene jenisseensis (Republic of Buryatia, Ulan Ude) and Silene repens (Primorsky Territory) 1 – 20-hydroxyecdysone, 2 – ecdysone, 3 – 2-deoxy-20-hydroxyecdysone, 4 – 2-deoxyecdysone.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Ввиду сложной классификации родов семейства Caryophyllaceae, которая основана преимущественно на морфологических признаках растений, получение данных о составе и содержании вторичных метаболитов будет способствовать выяснению целого ряда спорных вопросов о филогенетическом статусе некоторых видов. Известно, что экдистероиды имеют хемотаксономическое значение в роде Silene [6], а флавоноиды являются хемотаксономическими маркерами в ряде семейств [18]. В связи с тем, что в настоящее время идентифицированы флавоноиды лишь в 5% видов многочисленного рода Silene, то новые данные дополнят информацию об особенностях состава вторичных метаболитов рода.
ВЭЖХ анализ показал, что во всех исследованных образцах растений Silene jenisseensis обнаружены экдистероиды – 20-гидроксиэкдизон, экдизон, птеростерон, 2-дезокси-20-гидроксиэкдизон, 20-гидроксиэкдизон-2-ацетат, 2-дезоксиэкдизон (табл. 2). Показано, что состав и уровни экдистероидов в исследованных образцах S. jenisseensis сильно различаются.
Таблица 2.
Состав и содержание экдистероидов в изученных образцах Caryophyllaceae (% на абс. сух. сырье) Table 2. Composition and content of ecdysteroids in the studied samples of Caryophyllaceae (% on dry weight basis)
| №* | 20-Гидроксиэкдизон 20-Hydroxyecdysone |
Экдизон Ecdysone |
Птеростерон Pterosterone |
2-Дезокси-20-гидроксиэкдизон 2-deoxy-20- hydroxyecdysone |
20-Гидроксиэкдизон-2-ацетат 20-Hydroxyecdysone-2-acetate |
2-Дезоксиэкдизон 2-deoxyecdysone |
Суммарное содержание
экдистероидов** Total content of ecdysteroids** |
|---|---|---|---|---|---|---|---|
| 1 | 2.03 ± 0.01 | 0.06 ± 0.02 | 0.01 ± 0.01 | 0.25± 0.02 | 0.01 ± 0.01 | 0.42 ± 0.03 | 3.54 ± 0.06 |
| 2 | 0.32 ± 0.02 | 0.03 ± 0.01 | 0.01 ± 0.01 | 0.03 ± 0.01 | 0.04 ± 0.01 | 0.04 ± 0.01 | 0.54 ± 0.03 |
| 3 | 0.64 ± 0.03 | 0.03 ± 0.01 | 0.05± 0.01 | 0.004± 0.001 | 0.13± 0.01 | 1.09 ± 0.01 | |
| 4 | 0.61 ± 0.02 | 0.02 ± 0.01 | 0.02 ± 0.01 | 0.73± 0.01 | |||
| 5 | 0.21 ± 0.03 | 0.01 ± 0.01 | 0.03 ± 0.02 | 0.36 ± 0.02 | |||
| 6 | |||||||
| 7 | 0.43 ± 0.03 | 0.68 ± 0.02 | |||||
| 8 | 0.85 ± 0.03 | 0.06 ± 0.02 | 1.25 ± 0.03 |
Примечание: * – Нумерация образцов соответствует таковой в таблице 1; ** – суммарное содержание экдистероидов, включая неидентифицированные, данные представлены в виде среднего арифметического и стандартной ошибки (m ± SEM). Note: * – The numbering of samples corresponds to that in table 1; ** – total content of ecdysteroids, including unidentified, data are expressed as arithmetic mean and standard error (m ± SEM).
Общими компонентами являются 20-гидроксиэкдизон, 2-дезокси-20-гидроксиэкдизон и 2-дезоксиэкдизон. В образцах Муйского, Баргузинского районов и окрестности г. Улан Удэ обнаружены дополнительно экдизон и 20-гидроксиэкдизон-2-ацетат, в растениях Муйского р-на и окрестности г. Улан Удэ – птеростерон. Кроме того, в образцах S. jenisseensis обнаружен ряд неидентифицированных соединений с максимумами поглощения 240–248 нм, свойственными экдистероидам (рис. 1). Из-за отсутствия стандартов некоторых экдистероидов идентифицировать их пока не представляется возможным.
Наиболее богатыми по общему содержанию экдистероидов, включая неидентифицированные, являются образцы растений S. jenisseensis, произрастающие в Бурятии в Муйском, Баргузинском районах и окрестности г. Улан Удэ (ст. Комушка) – 3.5, 1.1 и 0.7% соответственно. Наименьший уровень содержания экдистероидов определен в образце из Приморского края – 0.4%.
Изучение состава экдистероидов в S. repens показало, что во всех образцах присутствует мажорный компонент экдистероидсодержащих видов – 20-гидроксиэкдизон, за исключением образца 6 из местности Куйтун, в котором не обнаружены и другие экдистероиды. Следует отметить, что в образце из Приморского края дополнительно выявлен экдизон. Большее содержание экдистероидов определено в растениях S. repens приморского происхождения – 1.2%, практически в 2 раза больше, чем в субальпийском образце из Бурятии.
В экстрактах видов Lychnis sibirica и Stellaria dichotoma обнаружены только минорные неидентифицированные экдистероиды, тогда как в видах Dianthus superbus, Eremogone meyeri и Stellaria longifolia из Бурятии экдистероиды не выявлены, аналогично, как и в образцах одноименных видов, произрастающих на Алтае [19, 20].
Ранее установлено, что растения S. jenisseensis алтайского происхождения содержали 20-гидроксиэкдизон [20]. Как показано другими авторами, этот вид, помимо 20-гидроксиэкдизона, 2-дезоксиэкдизона, 2-дезокси-20-гидроксиэкдизона, интегристерона А, понастерона А, синтезирует дакрихайнанстерон [21], обнаруженный ранее только в 3 видах Asteraceae и Podocarpaceae [19, 13 ]. Согласно литературным данным [22], в S. jenisseensis в цветках и листьях содержится 4.21 мг/г и 1.65 мг/г 20-гидроксиэкдизона, 0.79 мг/г 2-дезоксиэкдизона в цветках и менее 0.01 мг/г в листьях, по 0.7 мг/г 2-дезокси-20-гидроксиэкдизона в этих же органах, в то время как в образцах S. jenisseensis, исследованных в настоящей работе, содержится значительно больше экдистероидов.
В литературе [22] приводятся данные о выделении и идентификации 2-дезокси-20-гидроксиэкдизона, 2-дезоксиэкдизона, полиподина В, 20-гидроксиэкдизона и интегристерона А в монгольских растениях S. repens, показано, что содержание экдистероидов и флавоноидов – составляет 1.1 и 2.4% соответственно. Ранее сообщалось о присутствии экдистероидов в видах Lychnis sibirica и Stellaria dichtoma [23–25].
На основании хроматографических и спектральных данных (табл. 3) в экстрактах S. jenisseensis выявлен ряд флавоноидов: виценин-2, ориентин, цинарозид и апигенин. Цинарозид обнаружен в двух образцах S. jenisseensis из Бурятии, его содержание больше в растениях, собранных в с. Улюн.
Таблица 3.
Состав и содержание фенольных соединений в изученных образцах Caryophyllaceae (% на абс. сух. сырье) Table 3. The composition and content of phenolic compounds in the studied samples of Caryophyllaceae (% on dry weight basis)
| №* | Виценин-2 Vicenin-2 |
Ориентин Orientin |
Цинарозид Cynaroside |
Витексин Vitexin |
Изовитексин Isovitexin |
Неидентифици-рованный флавоноид** Unidentified flavonoid** |
Суммарное содержание Total content |
|---|---|---|---|---|---|---|---|
| 1 | 0.53 ± 0.03 | 0.44 ± 0.04 | 2.36 ± 0.04 | ||||
| 2 | 0.10 ± 0.02 | 0.13 ± 0.03 | 0.25 ± 0.03 | 1.14 ± 0.05 | |||
| 3 | 0.04 ± 0.01 | 0.17 ± 0.03 | 0.49 ± 0.03 | 2.23 ± 0.04 | |||
| 4 | 0.13 ± 0.02 | 0.33 ± 0.04 | 0.89 ± 0.03 | ||||
| 5 | 0.01 ± 0.01 | 0.02 ± 0.01 | 0.09 ± 0.01 | 0.53 ± 0.04 | |||
| 6 | 0.12 ± 0.02 | 0.12 ± 0.02 | 0.02 ± 0.01 | 0.53 ± 0.05 | 2.27 ± 0.04 | ||
| 7 | 0.67 ± 0.03 | 0.67 ± 0.04 | 2.94 ± 0.05 | ||||
| 8 | 1.04 ± 0.03 | 0.25 ± 0.03 | 1.57 ± 0.04 | 4.10 ± 0.05 | |||
| 9 | 0.01 ± 0.01 | 0.10 ± 0.02 | 0.003 ± 0.001 | 0.29 ± 0.02 | 0.10 ± 0.02 | 1.94 ± 0.04 | |
| 10 | 0.22 ± 0.02 | 0.03 ± 0.01 | 0.04 ± 0.01 | 0.11 ± 0.01 | 1.16 ± 0.04 | ||
| 11 | 0.08 ± 0.01 | 0.27 ± 0.02 | 0.36 ± 0.04 | 4.57 ± 0.06 | |||
| 12 | 0.14 ± 0.02 | 0.002 ± 0.001 | 0.05 ± 0.01 | 1.64 ± 0.05 | |||
| 13 | 0.04 ± 0.01 | 0.03 ± 0.01 | 0.08 ± 0.01 | 0.69 ± 0.03 |
Примечание: * – Нумерация образцов соответствует таковой в таблице 1; ** – неидентифицированный флавоноид – tR 13.5 мин, данные представлены в виде среднего арифметического и стандартной ошибки (m ± SEM). Note: * – the numbering of samples corresponds to that in table 1; ** – unidentified flavonoid tR 13.5 min. data are expressed as arithmetic mean and standard error (m ± SEM).
Во всех образцах S. repens обнаружен ориентин, в растениях из заимки Куйтун – виценин-2 и витексин, в образце из Приморского края – витексин. Характерной особенностью всех изученных видов рода Silene является наличие ориентина, причем большее содержание определено в приморском образце S. repens.
Наблюдается хемотаксономическое проявление состава фенольных соединений в родах семейства Caryophyllaceae. Как следует из данных табл. 3, состав фенольных соединений видов разных родов различается. Так, если для видов Silene и Lychnis свойственно присутствие ориентина, то в изученных видах других родов Caryophyllaceae – Eremogone, Stellaria, Dianthus он не обнаружен. Наиболее часто встречаемыми флавоноидами в видах Lychnis sibirica, Stellaria longifolia, Stellaria dichotoma и Dianthus superbus, являются витексин и изовитексин. В Dianthus superbus обнаружен рутин. На основании совпадения времени удерживания и максимумов поглощения стандарта и пиков в экстрактах сделано предположение о присутствии байкалина в образце S. repens из Куйтуна и видах Stellaria, что требует дальнейшего подтверждения.
Методом ВЭЖХ обнаружен ряд других неидентифицированных флавоноидов с максимумами поглощения 271 и 331 нм, которые, по мнению В.Н. Дармограя, характерны для С-гликозидов флавонов [7]. Так, флавоноид с временем удерживания 13.3–13.5 мин является мажорным (рис., табл. 3) и выявлен в большинстве образцов Caryophyllaceae. Наибольшее содержание его установлено в S. repens из Приморского края – 1.6%.
Содержание ориентина колеблется в образцах Silene в интервале 0.02–1.0%, виценина-2 в видах Silene и Lychnis – в интервале 0.01–0.1%, наибольшее оказалось в Eremogone meyeri. Уровни витексина в исследованных образцах варьируют в пределах 0.003–0.1%, изовитексина – 0.002–0.3%. Общее содержание флавоноидов с учетом неидентифицированных в образцах Silene jenisseensis колеблется в интервале 0.5–2.4%, в S. repens – 2.3–4.1%, наибольшие уровни отмечены в надземной части Stellaria longifolia (4.6%).
Таким образом, проведенный анализ позволил выявить перспективные образцы видов Caryophyllaceae. Установлены закономерности состава синтезируемых биологически активных веществ в разных родах Caryophyllaceae.
ВЫВОДЫ
1. ВЭЖХ анализ показал, что состав и содержание экдистероидов различается в видах разных родов. В образцах вида Silene jenisseensis обнаружены 20-гидроксиэкдизон, экдизон, птеростерон, 2-дезокси-20-гидроксиэкдизон, 20-гидроксиэкдизон-2-ацетат, 2-дезоксиэкдизон. В S. repens обнаружены 20-гидроксиэкдизон и дополнительно экдизон в приморском образце. В видах других родов –Lychnis sibirica и Stellaria dichotoma выявлены минорные неидентифицированные экдистероиды.
2. Состав фенольных соединений, экдистероидов и их содержание в одноименных видах Silene различаются в зависимости от места сбора. Наибольшим содержанием экдистероидов отличается Silene jenisseensis (Муйский район, Республика Бурятия) и Silene repens (Приморский край).
3. Впервые установлено, что видам Silene и Lychnis свойственно присутствие ориентина и большинству исследованных образцов – неидентифицированного флавоноида с временем удерживания 13.3–13.5 мин, кроме того, наиболее часто выявляемым в роде Silene является виценин-2, тогда как в других родах – витексин и изовитексин.
4. Наибольшим содержанием флавоноидов характеризуются Stellaria longifolia (Заиграевский район, Республика Бурятия) и Silene repens (Приморский край).
Список литературы
Greuter W. 1995. Silene (Caryophyllaceae) in Greece: a subgeneric and sectional classification. – Taxon. 44: 543–581. https://doi.org/10.2307/1223499
Tutin T.G., Burges N.A., Chater A.O., Edmondson J.R., Heywood V.H., Moore D.M., Valentine D.H., Walters S.M., Webb D.A. 1993. Silene L. – Flora Europea, ed. 2. Cambridge. 1: 191–218.
Растительные ресурсы СССР. Цветковые растения, их химический состав, использование. Семейства Magnoliaceae – Limoniaceae. 1985. Л. 460 с.
Mamadalieva N.Z., Lafont R., Wink M. 2014. Diversity of Secondary Metabolites in the Genus Silene L. (Caryophyllaceae) – Structures, Distribution, and Bio-logical Properties. – Diversity. 6: 415–499. https://doi.org/10.3390/d6030415
Зибарева Л.Н. 2009. Фитоэкдистероиды семейства Caryophyllaceae. – Сибирский экологический журнал. 5: 753–764. https://www.sibran.ru/journals/issue.php?ID=120627&ARTICLE_ID=129606
Zibareva L., Yeriomina V.I., Munkhjargal N., Girault J.P., Dinan L, Lafont R. 2009. The Phytoecdysteroid Profiles of 7 Species of Silene (Caryophyllaceae). – Archives of insect biochemistry and physiology. 72(4): 234–248. https://doi.org/10.1002/arch.20331
Darmograi V. 1977. Flavonoids of plants of the genera Silene and Otites, family Caryophyllaceae. – Chemistry of Natural Compounds. 13: 102–103. https://link.springer.com/article/10.1007/BF00566187
Дармограй С.В., Фурса Н.С., Дармограй В.Н. 2009. Некоторые результаты изучения видов рода володырник (Сucubalus L.) семейства Caryophyllaceae Juss. – В сб.: Труды Рязанского отделения русского ботанического общества. Вып. 1: Флора и растительность. С. 141–142.
Boğa M. 2017. Chemical Constituents, Cytotoxic, Antioxidant and Cholinesterases Inhibitory Activities of Silene compacta (Fischer) Extracts. – Marmara Pharm. J. 21(3): 445–454. https://doi.org/10.12991/marupj.306789
Richardson M. 1978. Flavonols and C-Glycosyl flavonoids of the Caryophyllales. – Biochem. Syst. Ecol. 6(4): 283–286. https://doi.org/10.1016/0305-1978(78)90046-7
Chopin M.J., Bouillant M.L., Wagner H., Galle K. 1974. Endgültige Struktur von Schaftosidaus Silene schafta. – Phytochemistry. 13: 2583–2586. https://doi.org/10.1016/S0031-9422(00)86940-X
Olennikov D.N. 2019. Ecdysteroids, flavonoids, and phenylpropanoids from Silene nutans. –Chemistry of Natural Compounds. 55(1): 127–130. https://doi.org/10.1007/s10600-019-02632-8
Дармограй С.В., Филиппова А.С., Ерофеева Н.С., Афанасьев А.А., Дармограй В.Н. 2017. Фитохимическое изучение некоторых полифенольных и стероидных соединений отдельных видов растений родов Cerastium L., Arenaria L., Stellaria L., Allochrusa Bunge ex Boiss. Семейства гвоздичные (Caryophyllaceae Juss.). – Международный журнал прикладных и фундаментальных исследований. 12: 54–58. https://applied-research.ru/ru/article/view?id=11962
Бхаскаран С., Вишвараман М. Композиция для лечения аутоиммунных заболеваний и способы, связанные с ней: Пат. 2575585, № 2013153238/15; Заявл. 10.06.15; Опубл. 20.02.16, Бюл. № 5.
Islam M.N., Ishita I.J., Jung H.A., Choi J.S. 2014. Vicenin 2 isolated from Artemisia capillaris exhibited potent anti-glycation properties. – Food Chemical Toxicol. 69: 55–62. https://doi.org/10.1016/j.fct.2014.03.042
Зибарева Л.Н., Балтаев У.А., Свиридова Т.П., Cаатов З., Абубакиров Н.К. 1995. Виды рода Lychnis L. ‑ перспективные источники экдистероидов. – Растительные ресурсы. 31(4): 1–9.
Зибарева Л.Н. 2012. Фитоэкдистероиды растений семейства Сaryophyllaceae. Saarbrüсken. 195 с.
Высочина Г.И. 2004. Фенольные соединения в систематике и филогении семейства гречишных. – Нск. 240 с.
The Ecdysone Handbook. http://ecdybase.org
Ревина Т.А., Ревушкин А.С., Ракитин А.В. 1988. Экдистероидсодержащие виды во флоре Горного Алтая. – Растительные ресурсы. 4: 565–570.
Olennikov D.N., Kashchenko N.I. 2017. Phytoecdysteroids from Silene jenisseensis. – Chem. Nat. Compd. 53(6): 1199–1201. https://doi.org/10.1007/s10600-017-2239-1
Munkhzhargal N., Zibareva L.N., Lafont R., Pribytkova L.N., Pisareva S.I. 2010. Investigation of Ecdysteroid Content and Composition of Silene repens Indigenous in Mongolia and Introduced into Western Siberia. – Russ. J. Bioorg. Chem. 36(7): 923–928. https://doi.org/10.1134/S1068162010070216
Zibareva L., Volodin V., Saatov Z., Savchenko T., Whiting P., Lafont R., Dinan L. 2003. Distribution of phytoecdysteroids in the Caryophyllaceae. – Phytochemistry. 64(2): 499–517. https://doi.org/10.1016/S0031-9422(03)00376-5
Дармограй С.В., Ерофеева Н.С., Филиппова А.С., Дубоделова Г.В., Морозова В.А. 2016. Исследование химического состава звездчатки вильчатой (Stellaria dichotoma L.). – Наука молодых – Eruditio Juvenium. 4: 60–64. https://doi.org/10.23888/HMJ2016460-64
Novozhilova E., Rybin V., Gorovoy P., Gavrilenko I., Doudkin R. 2015. Phytoecdysteroids of the East Asian Caryophyllaceae. – Pharmacogn. Mag. 11(42 – S-uppl. S1): 225–230. https://doi.org/10.4103/0973-1296.157746
Дополнительные материалы отсутствуют.
Инструменты
Растительные ресурсы


