Теплофизика высоких температур, 2019, T. 57, № 5, стр. 685-688
Уравнение для описания равновесного двухфазного состояния веществ
А. И. Витвицкий *
ЛТИ им. Ленсовета
Санкт-Петербург, Россия
* E-mail: avitvitskiy@mail.ru
Поступила в редакцию 22.08.2018
После доработки 22.03.2019
Принята к публикации 16.05.2019
Аннотация
Для описания равновесного состояния веществ в системах кристалл–газ и жидкость–газ в исследованных и неисследованных условиях на примере серебра, азота и диоксида углерода использовано уравнение с двумя коэффициентами–параметрами. Для теплоты фазового перехода веществ из конденсированного состояния в газообразное показана зависимость от температуры с одним коэффициентом. Оценена точность расчета равновесного давления и теплоты перехода веществ из конденсированных состояний в газообразное.
ВВЕДЕНИЕ
Фазовое равновесие химических веществ в закрытых системах кристалл–газ (КГ) и жидкость–газ (ЖГ) в присутствии инертного газа при давлении Р характеризуется зависимостью от температуры его равновесного парциального давления Рр = хрР (где хр – мольная или объемная доля исследуемого вещества в газовой фазе), традиционно называемого давлением насыщенного пара. В открытых системах нагревание вещества при Р до температуры фазового перехода Тфп (кристалл → → газ и жидкость → газ) приводит к возрастанию равновесного парциального давления до величины Рр = Р при хр = 1. Результаты исследований равновесного двухфазного состояния веществ представлены [1–3 ] в виде таблиц, так как термодинамика не позволяет описать одним уравнением зависимость Рр от Т (или Тфп от Рр) во всем исследованном интервале температур.
Цель работы – показать уравнение для описания равновесного двухфазного состояния веществ в исследованных и неисследованных условиях на примере серебра (Ag), азота (N2) и диоксида углерода (СО2) в системах КГ и ЖГ.
ОПИСАНИЕ РАВНОВЕСИЯ И ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
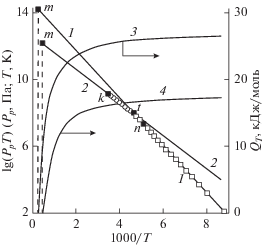
Если параметры равновесного состояния веществ в системах КГ или ЖГ представить графически в координатах lg(PpT)–1/T, получается [4–6] логарифмическая прямая. Наклон данной прямой определяется индивидуальной температурой Тm – параметром предельной точки m с координатами Т = Тm и Рр = Рm, что показано (рис. 1) на примере диоксида углерода по данным [2, 5]. Логарифмическим прямым соответствует экспоненциальное уравнение
(1)
${{P}_{p}} = \frac{{{{P}_{m}}{{T}_{m}}}}{T}{{{\text{e}}}^{{\left( {1 - {{{{T}_{m}}} \mathord{\left/ {\vphantom {{{{T}_{m}}} T}} \right. \kern-0em} T}} \right)}}}.$Коэффициенты-параметры Тm и Рm уравнения (1) можно определить графически или аналитически, используя параметры равновесного состояния двух произвольных точек (Рр1 при Т1 и Рр2 при Т2), по уравнениям
В табл. 1 и 2 для Ag и N2 в системах КГ и ЖГ показана точность расчета Рр по уравнению (1) с использованием приведенных в табл. 1 и 2 значений Тm и Рm. При изменении Рр в системах КГ и ЖГ на 14 порядков для Ag и на 9 для N2 среднее отклонение (∆, %) справочных величин Рр от рассчитанных по (1) не превышает ±2.2% при максимальном отклонении 4.3% (для N2). Для использованных условий равновесного состояния СО2 (рис. 1, светлые точки) получены [5] коэффициенты-параметры в системе КГ Тm = 3321.5 К и Рm = 5.685 × × 1010 Па, в системе ЖГ Тm = 2248.8m К и Рm = = 5.930 × 108m Па. Для СО2 при изменении Рр на шесть порядков среднее отклонение ∆ равно ±0.7% при максимальном отклонении 2.6% (в системе КГ – при 140 К) [5].
Таблица 1.
Равновесное состояние Ag в системах КГ и ЖГ
| По данным [1 ] | Рр, Па, по (1) | Δ, % | QT, кДж/моль по (3) | |
|---|---|---|---|---|
| Т, К | Рр, Па | |||
| КГ | ||||
| 800.15 | 1.33 × 10–7 | 1.318 × 10–7 | –0.9 | 291.7 |
| 846.15 | 1.33 × 10–6 | 1.316 × 10–6 | –1.1 | 281.3 |
| 898.15 | 1.33 × 10–5 | 1.330 × 10–5 | 0.0 | 280.9 |
| 957.15 | 1.33 × 10–4 | 1.349 × 10–4 | 1.4 | 280.4 |
| 1027.15 | 1.33 × 10–3 | 1.350 × 10–3 | 1.5 | 279.9 |
| 1101.15 | 0.0133 | 0.01341 | 0.8 | 279.2 |
| 1191.15 | 0.133 | 0.133 | 0.7 | 278.5 |
| 1235.05t* [7] | 0.364t [7] | 0.3640t | 0.0 | 278.1t |
| 34 685m | – | 7.491× 109m | – | 0 |
| Среднее значение | ±0.8 | – | ||
| ЖГ | ||||
| 1235.05t [7] | 0.364t [7] | 0.3640t | 0.0 | 265.0t |
| 1301.15 | 1.33 | 1.347 | 1.3 | 264.4 |
| 1436.15 | 13.3 | 13.35 | 0.3 | 263.3 |
| 1603.15 | 133 | 132.0 | –0.8 | 261.9 |
| 1816.15 | 1.33 × 103 | 1.313 × 103 | –1.3 | 260.2 |
| 2093.15 | 1.33 × 104 | 1.317 × 104 | –1.0 | 257.8 |
| 2436.15n* | 1.013 × 105 | 1.0129 × 105 | 0.0 | 255.0n |
| 4668.15k* [8] | 3.36 × 107k [8] | 3.508 × 107k | 4.2 | 236.4k |
| 33 108m | – | 2.189 × 109m | – | 0 |
| Среднее значение | ±1.1 | – | ||
Таблица 2.
Равновесные состояния N2 в системах КГ и ЖГ
| По данным [1 ] * | Рр, Па, по (1) | Δ, % | QT, кДж/моль, по (3) | |
|---|---|---|---|---|
| Т, К | Рр, Па | |||
| КГ | ||||
| 28.95 | 1.33 × 10–3 | 1.390 × 10–3 | 4.3 | 7.22 |
| 31.35 | 1.33 × 10–2 | 1.378 × 10–2 | 3.5 | 7.20 |
| 34.15 | 0.133 | 0.1324 | –0.5 | 7.18 |
| 37.55 | 1.33 | 1.301 | –2.2 | 7.15 |
| (40.75)** | 13.3 | 7.839 | (–69.7) | (7.12) |
| 47.05 | 133 | 129.7 | –2.5 | 7.07 |
| 53.95 | 1.33 × 103 | 1.298 × 103 | –2.4 | 7.02 |
| 63.14t | 1.25 × 104t | 1.250 × 104t | 0.0 | 6.94t |
| 897.75m | – | 4.839 × 108m | – | 0 |
| Среднее значение | ±2.2 | – | ||
| ЖГ | ||||
| 63.14t | 1.25 × 104t | 1.250 × 104t | 0.0 | 6.05t |
| 63.45 | 1.33 × 104 | 1.323 × 104 | –0.5 | 6.04 |
| 77.35n | 1.013 × 105 | 1.018 × 105 | 0.5 | 5.93n |
| 83.85 | 2.027 × 105 | 2.073 × 105 | 2.2 | 5.87 |
| 94.05 | 5.066 × 105 | 5.137 × 105 | 1.4 | 5.79 |
| 103.85 | 1.013 × 106 | 1.028 × 106 | 1.5 | 5.71 |
| 115.85 | 2.027 × 106 | 2.028 × 106 | 0.0 | 5.61 |
| 126.15k | 3.39 × 106k | 3.250 × 106k | –4.3 | 5.52k |
| 790.39m | – | 1.004 × 108m | – | 0 |
| Среднее значение | ±1.3 | – | ||
Если параметры равновесных двухфазных состояний Ag, N2 и СО2 представить графически в координатах ln(PmTm/(PpT))–((Tm/T) – 1), получается прямолинейная зависимость, на которую ложатся все показанные в табл. 1 и 2 и на рис. 1 параметры равновесных состояний Ag, N2 и СО2 для систем КГ и ЖГ. На рис. 2 в указанных координатах для систем ЖГ представлены параметры критической и тройной точек, для систем КГ параметры тройных точек и точек с наименьшей исследованной температурой.
Приведенный на рис. 2 результат обработки экспериментально-справочного материала, по-видимому, свидетельствует об универсальности зависимости
(2)
${{{{P}_{m}}{{T}_{m}}} \mathord{\left/ {\vphantom {{{{P}_{m}}{{T}_{m}}} {\left( {{{P}_{p}}T} \right)}}} \right. \kern-0em} {\left( {{{P}_{p}}T} \right)}} = {{{\text{e}}}^{{\left( {{{Tm} \mathord{\left/ {\vphantom {{Tm} T}} \right. \kern-0em} T}} \right) - 1}}},$из которой выводится уравнение (1), а также зависимость от Тфп теплоты фазового перехода одного моля кристаллического или жидкого вещества в газообразное состояние (QT, Дж/моль)
где Qm = RTm. В последних столбцах табл. 1 и 2 показаны рассчитанные по уравнению (3) величины QT для Ag и N2. На рис. 1 для СО2 в системах КГ и ЖГ расчетная величина QT представлена в интервале температур вплоть до Тm.Уравнения (1) и (2) позволяют не только достаточно точно описать равновесное двухфазное состояние веществ в исследованных условиях (см. табл. 1 и 2), но также достаточно надежно экстраполировать полученные результаты (см. логарифмические прямые рис. 1 и 2) в неисследованную область, а именно для системы КГ к температуре, близкой к абсолютному нулю (0 К < Т < Тt), и в область “перегретых кристаллов” (Тt < Т < Тm); для системы ЖГ – в область “переохлажденной жидкости” (0 К < Т < Тt) и в сверхкритическую область (Тk < Т < Тm). Как пишет М.А. Леонтович [9], жидкие вещества можно переохладить на десятки градусов ниже температуры тройной точки, если предотвратить зародышеобразование твердой фазы, используя чистые запаянные сосуды. Предлагаемые Леонтовичем способы борьбы с неконтролируемым образованием зародышей третьей фазы, по-видимому, применимы при получении кристаллов с температурой выше Тt.
В табл. 3 рассчитанные по уравнению (3) величины QT сопоставлены с экспериментально-справочными значениями энтальпии газообразования (“испарения” ∆Н) для процессов жидкость → газ и кристалл → газ при характерных температурах. С учетом точности эксперимента и расчетов величины ∆Н и QT имеют практически одинаковые значения. Исключением являются результаты сравнения при критической температуре, так как в термодинамике принято считать, что при критических параметрах в системе ЖГ исчезают различия теплофизических свойств газа и жидкости. Однако на практике многие вещества при сверхкритических условиях используются в качестве растворителей11. Уравнения (1)–(3) показывают температурный предел (T = Tm) растворяющей способности сверхкритических жидкостей.
Таблица 3.
Теплота газификации конденсированных Ag, N2 и СО2
| Переход | По данным [7] | QT, кДж/моль | |
|---|---|---|---|
| Тфп, К | ∆Н, кДж/моль | ||
| Ag | |||
| Кристалл → газ | 298.15 | 284.9 ± 0.8 | 285.9 |
| 1235.05t | 278.0 ± 0.8 | 278.1t | |
| Жидкость → газ | 1235.05t | 266.7 ± 0.8 | 265.0t |
| 2436.15n [1 ] | 254.2 [1 ] | 255.0n | |
| 4668.15k [8] | 0 | 236.4k | |
| N2 | |||
| Кристалл → газ | 63.15t | 6.77 ± 0.01 | 6.94t |
| Жидкость → газ | 63.15t | 6.05 ± 0.01 | 6.05t |
| 77.35n | 5.58 ± 0.01 | 5.93n | |
| 126.14k | 0 | 5.52k | |
| СО2 | |||
| Кристалл → газ | 194.65n | 25.23 ± 0.02 | 26.00 |
| 216.57t | 24.6 ± 0.5 | 25.82 | |
| Жидкость → газ | 216.57t | 16.2 ± 0.4 | 16.90t |
| 304.15k [2] | 0 | 16.17k | |
ЗАКЛЮЧЕНИЕ
Уравнения (1) и (2) позволяют экстраполировать результаты описания двухфазного равновесного состояния серебра, азота и диоксида углерода в область температуры от 0 К до предельного значения Тm, которое для веществ в системе жидкость–газ значительно превышает критическую температуру.
Уравнение (3) показывает, что теплота перехода конденсированного вещества в газообразное состояние зависит от температуры и не зависит от давления.
Точность расчетных величин определяется точностью исходного экспериментально-справочного материала.
Список литературы
Новый справочник химика и технолога: Общие сведения. Строение вещества. Физические свойства важнейших веществ. Ароматические соединения. Химия фотографических процессов. Номенклатура органических соединений. Техника лабораторных работ. Основы технологии. Интеллектуальная собственность / Под ред. Москвина А.М. СПб.: НПО “Профессионал”, 2006. 1464 с.
CRC Handbook of Chemistry and Physics / Ed. by Lide D.R. 85th ed. London–N.Y.–Washington. 2004–2005. Section 4, 6.
Морачевский А.Г., Сладков И.Б. Физико-химические свойства молекулярных неорганических соединений (экспериментальные данные и методы расчета): Спр. изд. 2-е, перераб. и доп. СПб.: Химия, 1996. 312 с.
Витвицкий А. Химические вещества. Условия равновесных состояний и преобразований. Saarbrucken: LAP LAMBERT Acad. Publ. RU, 2017. 64 с.
Витвицкий А.И. Параметрическое уравнение для кривых кипения и возгонки // ЖПХ. 2011. Т. 84. № 12. С. 2063.
Витвицкий А.И. Термическая диссоциация кристаллических веществ // ЖПХ. 2016. Т. 89. № 2. С. 185.
Термические константы веществ / Под ред. Глушко В.П. Спр. в 10-ти т. М.: АН СССР. ВИНИТИ, 1965–1982.
Чукуров П.М. Серебро // Химическая энциклопедия в 5-ти т. Т. 4 / Под ред. Зефирова Н.С. М.: БРЭ, 1995. С. 323.
Леонтович М.А. Введение в термодинамику. Статистическая физика. Учеб. пособ. 2-е изд., стер. СПб.: “Лань”, 2008. С. 136.
Дополнительные материалы отсутствуют.
Инструменты
Теплофизика высоких температур