Теоретические основы химической технологии, 2020, T. 54, № 2, стр. 202-207
Экстракция Fe(III), Zn(II) и Mn(II) в системе с “зеленым” растворителем для тиоцианата триоктилметиламмония
М. И. Федорова a, И. В. Зиновьева a, Ю. А. Заходяева a, *, А. А. Вошкин a
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
* E-mail: yz@igic.ras.ru
Поступила в редакцию 03.12.2019
После доработки 04.12.2019
Принята к публикации 05.12.2019
Аннотация
Предложен экологически безопасный растворитель – полипропиленгликоль 425 для экстракции ионов металлов из хлоридных растворов тиоцианатом триоктилметиламмония. Получены количественные характеристики экстракции Fe(III), Zn(II) и Mn(II) тиоцианатом триоктилметиламмония в системе полипропиленгликоль 425–NaCl–H2O. На примере экстракции Fe(III), Zn(II) и Mn(II) показано, что закономерности экстракции ионов металлов сохраняются и замена растворителя не приводит к потере экстракционной способности тиоцианата триоктилметиламмония. Установлен механизм экстракции исследуемых ионов металлов. Предложенная экстракционная система потенциально может быть использована для очистки Mn(II) от Fe(III) и Zn(II).
ВВЕДЕНИЕ
Принципы “зеленой” химии в экстракции проявляются в разработке химико-технологических процессов извлечения и разделения веществ, направленных на снижение потребления энергии, использование альтернативных безвредных растворителей, получение безопасного и высококачественного продукта. Принципы “зеленой” химии определяют поиск новых экстракционных систем для выделения и разделения веществ, что является одной из важнейших научных и практических задач. Наиболее полно этим условиям отвечают экстракционные системы на основе водорастворимых полимеров и неорганических солей, которые являются отличной альтернативой традиционным системам. Водорастворимые полимеры (полиэтиленгликоль, полипропиленгликоль и др.) обладают способностью образовывать с неорганическими солями гетерогенные системы [1–3], которые в настоящее время используют в гидрометаллургических процессах для селективного извлечения ионов металлов [4–7].
Традиционная экстракция ионов металлов из водных растворов в органический растворитель невозможна без использования нейтральных или ионообменных экстрагентов. К настоящему времени проведен значительный объем исследований процессов выделения и разделения ионов металлов с использованием фосфорорганических кислот (Cyanex 272, Cyanex 301, D2EHPA и PC88A) [8, 9], сульфокислот [10], нейтральных экстрагентов (трибутилфосфата, сульфоксидов, метилизобутилкетона, Hostarex DK-16 и LIX 54 [11, 12], третичных аминов (Alamine 336) [13]) и др.
Одними из наиболее востребованных экстрагентов являются ионные жидкости, которые обладают спектром уникальных свойств, обусловливающих заметное увеличение эффективности и селективности извлечения ионов металлов из водных растворов [14–17]. Так, например, в [18–21] извлечение ряда ионов металлов проводят с помощью хлорида, тиоцианата и сульфата триоктилметиламмония из сульфатных и хлоридных сред. Данные экстрагенты имеют высокую экстракционную способность по отношению к Fe, Zn, Co, V. Одним из практических применений ионных жидкостей является выделение ряда ценных металлов из отходов электроники.
Замена традиционных органических растворителей в процессах экстракционного извлечения, разделения и очистки металлов является актуальной задачей. Известны работы по введению высокоэффективных экстрагентов в двухфазные водные системы, в частности Cyanex 272 и D2EHPA в систему L64 + Na2SO4 + H2O [22]. Однако концентрации экстрагентов были очень низкими (45 и 76 ммоль/кг соответственно), что обусловлено их низкой растворимостью в полимере, поэтому заметного влияния на извлечение Zn и Mn не наблюдалось. Следует отметить, что введение минеральных солей четвертичных аммониевых оснований в системы на основе водорастворимых полимеров в достаточно высоких концентрациях позволило бы существенно повысить эффективность экстракции и экологическую безопасность таких процессов. Проведенные нами поисковые исследования показали, что наибольшей растворяющей способностью по отношению к минеральным солям триоктилметиламмония обладают двухфазные водные системы на основе полипропиленгликоля 425.
Таким образом, целью данной работы является разработка экологически безопасной экстракционной системы на основе тиоцианата триоктилметиламмония и полипропиленгликоля 425, а также оценка ее эффективности в экстракции Fe(III), Zn(II) и Mn(II).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исходные растворы хлоридов переходных металлов получали растворением точных навесок FeCl3 · 6H2O, ZnCl2 и MnCl2 · 4H2O квалификации “х. ч.” в дистиллированной воде, взвешенных на аналитических весах AND HR-100AZ.
В качестве экстрагента использовали раствор тиоцианата триоктилметиламмония в толуоле. Тиоцианат триоктилметиламмония был приготовлен из хлорида триоктилметиламмония (Aliquat 336) путем его встряхивания с 1.6 М раствором тиоцианата калия в соотношении 1 : 1 [18] в течение 20 мин до полного замещения хлорид-ионов на тиоцианат-ионы с последующей промывкой органической фазы водой.
Экстракцию ионов металлов с исходной концентрацией 0.01 моль/л проводили из 2 М раствора хлорида натрия, подкисленного соляной кислотой (до рН 1.5), раствором тиоцианата триоктилметиламмония в толуоле заданной концентрации. Соотношение органической и водной фаз составило 1 : 3.
Также экстракцию ионов металлов проводили из 2 М раствора хлорида натрия, подкисленного соляной кислотой (до рН 1.5), раствором тиоцианата триоктилметиламмония в полипропиленгликоле с молекулярной массой 425 (ППГ-425). Во всех экспериментах содержание полипропиленгликоля 425 составляло 30 мас. %. Соотношение полимерной и солевой фаз составило 1 : 3.
Экстракцию ионов металлов (Fe(III), Zn(II), Mn(II)) проводили при температуре 25°С в градуированных пластиковых пробирках в термостатированном шейкере Enviro-Genie (Scientific Industries, Inc.) при скорости вращения 30 об./мин до установления термодинамического равновесия (60 мин).
Концентрацию ионов металлов в исходных растворах и в водных фазах после экстракции определяли спектрофотометрическим методом с использованием 4-(2-пиридилазо)резорцина, образующего комплексы с металлами, которые поглощают в видимой области спектра на следующих длинах волн: Zn (490 нм), Mn (496 нм). Для определения железа(III) использовали сульфосалициловую кислоту, при этом максимум поглощения приходится на 420 нм. Концентрацию ионов металлов в органических фазах определяли по разности между концентрациями в исходном растворе и в водной фазе после экстракции. Определение значений оптической плотности проводили с использованием прибора Cary-60 (Agilent Tech.) в кварцевых кюветах l = 10 мм.
Представленные экспериментальные данные являются результатом серии экспериментов и обработаны методами математической статистики.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В качестве замены органического растворителя нами предложено использовать водорастворимый полимер – полипропиленгликоль 425 для экстракции ионов металлов из хлоридных растворов тиоцианатом триоктилметиламмония. Исследуемый экстрагент обладает высокой растворимостью в полипропиленгликоле 425 и распределяется преимущественно в полимерную фазу.
Проведено сравнение экстракции Fe(III), Zn(II) и Mn(II) из 2 М раствора хлорида натрия раствором тиоцианата триоктилметиламмония в толуоле и полипропиленгликоле 425.
На рис. 1 приведены изотермы экстракции Fe(III), Zn(II) и Mn(II) из 2 М раствора NaCl 0.05 М раствором тиоцианата триоктилметиламмония в толуоле и полипропиленгликоле 425. Как видно, при извлечении ионов металлов в среде толуола изотермы экстракции имеют возрастающий характер и выходят на насыщение при соотношении концентраций металла в органической фазе и исходной концентрации экстрагента для Fe(III) 1 : 1, для Zn(II) 1 : 2.
Рис. 1.
Изотермы экстракции ионов металлов из 2 М раствора NaCl 0,05 М раствором тиоцианата триоктилметиламмония в толуоле (пунктирная линия) и полипропиленгликоле 425 (сплошная линия): 1, 2 – Zn(II); 3, 4 – Fe(III); 5, 6 – Mn(II).
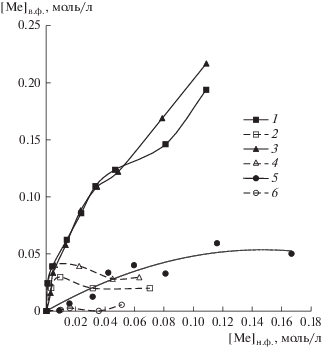
Изотермы экстракции для Fe(III) и Zn(II) тиоцианатом триоктилметиламмония в полипропиленгликоле 425 (рис. 1, кривые 1, 3, 5) имеют характерное плато, которое указывает на наличие двух механизмов экстракции. На начальном участке экстракция ионов металлов протекает преимущественно за счет анионного обмена с солью четвертичного аммониевого основания с выходом на насыщение при соотношениях концентрации металла в верхней фазе и исходной концентрации экстрагента, равных 2 : 1. Далее изотерма экстракции имеет возрастающий характер и в полимерную фазу переходят хлоридные комплексы металлов ${\text{FeCl}}_{4}^{ - }$ и ${\text{ZnCl}}_{4}^{{2 - }},$ как это было показано ранее в работе [23]. В случае экстракции Mn(II) зависимость носит возрастающий характер во всем диапазоне концентраций ионов металла.
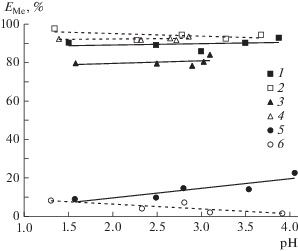
Получены зависимости эффективности экстракции Fe(III), Zn(II) и Mn(II) из 2 М раствора NaCl 0.05 М раствором тиоцианата триоктилметиламмония в толуоле и полипропиленгликоле 425 от кислотности среды (рис. 2). Как видно, ионы металлов в обеих экстракционных системах экстрагируются в широком диапазоне значений рН, при этом эффективность извлечения ионов металлов остается практически неизменной. Это указывает на то, что протон не влияет на извлечение ионов металлов в исследуемых системах.
Рис. 2.
Зависимость степени извлечения ионов металлов от равновесных значений рН солевой фазы 0.05 М раствором тиоцианата триоктилметиламмония в толуоле (пунктирная линия) и полипропиленгликоле 425 (сплошная линия): 1, 2 – Zn(II); 3, 4 – Fe(III); 5, 6 – Mn(II).
Проведены экспериментальные исследования экстракции Fe(III), Zn(II) и Mn(II) из 2 М раствора хлорида натрия (рН 1.5) раствором тиоцианата триоктилметиламмония в толуоле в зависимости от концентрации экстрагента. Результаты представлены на рис. 3 (пунктирные линии).
Рис. 3.
Зависимость степени извлечения ионов металлов от концентрации тиоцианата триоктилметиламмония в полипропиленгликоле 425 (сплошная линия) и толуоле (пунктирная линия) ([Me]исх = 0.01 моль/л): 1, 2 – Zn(II); 3, 4 – Fe(III); 5, 6 – Mn(II).
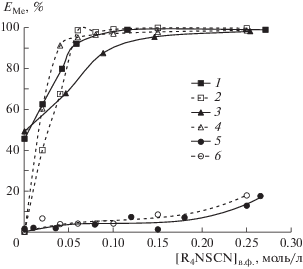
Из полученных зависимостей (рис. 3, кривые 2, 4, 6) видно, что выход на постоянное значение степени извлечения для Fe(III) и Zn(II) наступает при концентрации соли четвертичного аммониевого основания 0.06 моль/л, для Mn(II) – 0.1 моль/л. При этом заметна селективность экстрагента по отношению к Fe(III) и Zn(II) по сравнению с Mn(II).
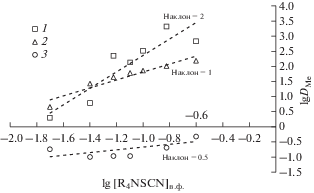
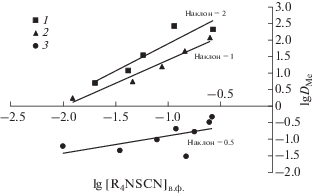
Для установления механизма экстракции ионов металлов роданидом триоктилметиламмония нами была построена билогарифмическая зависимость коэффициента распределения от концентрации экстрагента для исследуемой системы (рис. 4). Полученные зависимости имеют прямолинейный характер.
Рис. 4.
Билогарифмическая зависимость коэффициента распределения ионов металлов от концентрации тиоцианата триоктилметиламмония в толуоле ([Me]исх = 0.01 моль/л): 1 – Zn(II); 2 – Fe(III); 3 – Mn(II).
Из литературных данных [24] известно, что при использовании в качестве экстрагента тиоцианата триоктилметиламмония возможно образование смешанных анионных комплексов для ряда металлов. Экстракцию ионов металлов тиоцианатом триоктилметиламмония можно описать в общем виде уравнением
с константой равновесия
В логарифмическом виде уравнение имеет вид
По углу наклона логарифмической зависимости коэффициента распределения от концентрации экстрагента (рис. 4) определили количество тиоцианат-ионов, приходящихся на один ион металла. В случае экстракции Fe(III) в органической фазе преимущественно образуются экстрагируемые соединения состава ${\text{(}}{{{\text{R}}}_{{\text{4}}}}{\text{N)}}\left[ {{\text{Fe(SCN)C}}{{{\text{l}}}_{{\text{3}}}}} \right]{\text{,}}$ для Zn(II) – ${{{\text{(}}{{{\text{R}}}_{{\text{4}}}}{\text{N)}}}_{{\text{2}}}}\left[ {{\text{Zn(SCN}}{{{\text{)}}}_{{\text{2}}}}{\text{C}}{{{\text{l}}}_{{\text{2}}}}} \right]{\text{,}}$ что согласуется с данными изотерм экстракции (рис. 1) и литературными данными [24].
Проведены исследования экстракции Fe(III), Zn(II) и Mn(II) из 2 М раствора хлорида натрия (рН 1.5) тиоцианатом триоктилметиламмония в полипропиленгликоле 425 в зависимости от концентрации экстрагента (рис. 3, кривые 1, 3, 5) в условиях, аналогичных вышеприведенным экспериментам. Содержание полипропиленгликоля в системе было постоянным и составляло 30 мас. %. Характер полученных зависимостей для исследуемых металлов аналогичен зависимостям для экстракционной системы на основе толуола. Из полученных зависимостей (рис. 3, кривые 1, 3, 5) видно, что при концентрации 0.1 моль/л соли четвертичного аммониевого основания наблюдается количественное извлечение Zn(II), при 0.15 моль/л – Fe(III). При этом степень извлечения Mn(II) во всем исследуемом диапазоне концентраций не превышает 20%. Использование полипропиленгликоля 425 позволяет селективно извлекать из хлоридных растворов в полимерную фазу с высокими значениями степени извлечения Fe(III) и Zn(II), используя в качестве экстрагента тиоцианат триоктилметиламмония.
Получена билогарифмическая зависимость коэффициента распределения ионов металлов от концентрации тиоцианата триоктилметиламмония (рис. 5). По углам наклона зависимостей можно предположить состав экстрагируемых комплексов Fe(III) и Zn(II): ${\text{(}}{{{\text{R}}}_{{\text{4}}}}{\text{N)}}\left[ {{\text{Fe(SCN)C}}{{{\text{l}}}_{{\text{3}}}}} \right]$ и ${{{\text{(}}{{{\text{R}}}_{{\text{4}}}}{\text{N)}}}_{{\text{2}}}}\left[ {{\text{Zn(SCN}}{{{\text{)}}}_{{\text{2}}}}{\text{C}}{{{\text{l}}}_{{\text{2}}}}} \right]{\text{,}}$ что согласуется с ранее полученными экспериментальными и литературными данными [24].
Рис. 5.
Билогарифмическая зависимость коэффициента распределения ионов металлов от концентрации тиоцианата триоктилметиламмония в полипропиленгликоле 425 ([Me]исх = 0.01 моль/л): 1 – Zn(II); 2 – Fe(III); 3 – Mn(II).
Таким образом, использование полипропиленгликоля 425 в качестве растворителя вместо толуола позволяет проводить экстракцию Fe(III), Zn(II) и Mn(II) из хлоридных растворов без потери эффективности извлечения. Закономерности межфазного распределения ионов металлов в предложенной системе аналогичны таковым в системе с толуолом.
ЗАКЛЮЧЕНИЕ
Предложен альтернативный растворитель для экстракции ионов металлов из хлоридных растворов тиоцианатом триоктилметиламмония. Получены количественные характеристики экстракции Fe(III), Zn(II) и Mn(II) тиоцианатом триоктилметиламмония в полипропиленгликоле 425. На примере экстракции Fe(III), Zn(II) и Mn(II) показано, что закономерности экстракции ионов металлов сохраняются и замена растворителя не приводит к потере экстракционной способности тиоцианата триоктилметиламмония. Установлен механизм экстракции исследуемых ионов металлов. Предложенная экстракционная система потенциально может быть использована для очистки Mn(II) от Fe(III) и Zn(II).
Исследование выполнено при финансовой поддержке Российского фонда фундаментальных исследований в рамках научного проекта № 18-29-24170.
ОБОЗНАЧЕНИЯ
| D | коэффициент распределения |
| E | степень извлечения, % |
| [Ме] | концентрация ионов металла, моль/л |
| [R4NSCN] | концентрация тиоцианата триоктилметиламмония, моль/л |
ИНДЕКСЫ
Список литературы
Zakhodyaeva Y.A., Rudakov D.G., Solov’ev V.O., Voshkin A.A., Timoshenko A.V. Liquid-liquid equilibrium of aqueous two-phase system composed of poly(ethylenexide) 1500 and sodium nitrate // J. Chem. Eng. Data. 2019. V. 64. № 3. P. 1250.
Silverio S.C., Wegrzyn A., Lladosa E., Rodríguez O., Macedo E.A. Effect of aqueous two-phase system constituents in different poly(ethylene glycol)−salt phase diagrams // J. Chem. Eng. Data. 2012. V. 57. P. 1203.
Quintao J.C., Patrício P.R., Veloso A.C.G., de Carvalho R.M.M., da Silva L.H.M., Hespanhol M.C. Liquid-liquid equilibrium of the ternary ammonium salt – poly(propylene glycol) – water system // Fluid Phase Equilib. 2017. V. 442. P. 96.
Zakhodyaeva Yu.A., Izyumova K.V., Solov’eva M.S., Voshkin A.A. Extraction separation of the components of leach liquors of batteries // Theor. Found. Chem. Eng. 2017. V. 51. № 5. P. 883.
Bulgariu L., Bulgariu D. Selective extraction of Hg(II), Cd(II) and Zn(II) ions from aqueous media by a green chemistry procedure using aqueous two-phase systems // Sep. Purif. Technol. 2013. V. 118. P. 209.
Karmakar R., Sen K. Aqueous biphasic extraction of metal ions: An alternative technology for metal regeneration // J. Mol. Liq. 2019. V. 273. P. 231.
Zakhodyaeva Y.A., Zinov’eva I.V., Tokar E.S., Voshkin A.A. Complex extraction of metals in an aqueous two-phase system based on poly(ethylene oxide) 1500 and sodium nitrate // Molecules. 2019. V. 24. № 22. P. 4078.
Batchu N.K., Sonu C.H., Lee M.S. Synergistic solvent extraction of manganese(II) with a mixture of Cyanex 272 and Cyanex 301 from chloride solutions // Hydrometallurgy. 2013. V. 140. P. 89.
Voshkin A.A., Belova V.V., Zakhodyaeva Yu.A. Iron extraction with di(2-ethylhexyl)dithiophosphoric acid and a binary extractant based on it // Russ. J. Inorg. Chem. 2018. V. 63. № 3. P. 387. [Вошкин А.А., Белова В.В., Заходяева Ю.А. Экстракция железа ди(2-этилгексил)дитиофосфорной кислотой и бинарным экстрагентом на ее основе // Журн. неорг. хим. 2018. Т. 63. № 3. С. 362.]
Yu J., Liu D. Extraction of magnesium from phosphoric acid using dinonylnaphthalene sulfonic acid // Chem. Eng. Res. Des. 2010. V. 88. P. 712.
Sadeghi N., Alandari E.K. Selective extraction of gold(III) from hydrochloric acid−chlorine gas leach solutions of copper anode slime by tri-butyl phosphate (TBP) // Trans. Nonferrous Met. Soc. China. 2016. V. 26. P. 3258.
Zhou Z., Qin W., Fei W. Extraction equilibria of lithium with tributylphosphate in three diluents // J. Chem. Eng. Data. 2011. V. 56. P. 3518.
Filiz M. Extraction of Mn(II) from aqueous hydrochloric acid solutions into Alamine 336–m-xylene system // Hydrometallurgy. 2007. V. 87. P. 58.
Voshkin A.A., Belova V.V., Khol’kin A.I. Extraction of iron(III) by binary extractants based on quaternary ammonium bases and organic acids // Russ. J. Inorg. Chem. 2003. V. 48. № 4. P. 608. [Вошкин А.А., Белова В.В., Холькин А.И. Экстракция железа(III) бинарными экстрагентами на основе четвертичных аммониевых оснований и органических кислот // Журн. неорг. хим. 2003. Т. 48. № 4. С. 691.]
Belova V.V., Voshkin A.A., Kholkin A.I., Pyartman A.K. Solvent extraction of some lanthanides from chloride and nitrate solutions by binary extractants // Hydrometallurgy. 2009. V. 97. № 3. P. 198.
Wang L.Y., Guo Q.J., Lee M.S. Recent advances in metal extraction improvement: mixture systems consisting of ionic liquid and molecular extractant // Sep. Purif. Technol. 2019. V. 210. P. 292.
Hoogerstraete T.V., Binnemans K. Highly efficient separation of rare earths from nickel and cobalt by solvent extraction with the ionic liquid trihexyl(tetradecyl)phosphonium nitrate: a process relevant to the recycling of rare earths from permanent magnets and nickel metal hydride batteries // Green Chem. 2014. V. 16. P. 1594.
Nayl A.A. Extraction and separation of Co(II) and Ni(II) from acidic sulfate solutions using Aliquat 336 // J. Hazard. Mater. 2010. V. 173. P. 223.
Swain N., Pradhan S., Mishra S. Efficiency of Aliquat 336 for hydrometallurgical separation of Sm(III) and Co(II) from nitrate medium // Miner. Eng. 2019. V. 139. P. 105872.
Nayl A.A., Aly H.F. Solvent extraction of V(V) and Cr(III) from acidic leach liquors of ilmenite using Aliquat 336 // Trans. Nonferrous Met. Soc. China. 2015. V. 25. P. 4183.
Mishra R.K., Rout P.C., Sarangi K., Nathsarma K.C. Solvent extraction of Fe(III) from the chloride leach liquor of low grade iron ore tailings using Aliquat 336 // Hydrometallurgy. 2011. V. 108. P. 93.
Leite D.d.S., Carvalho P.L.G., de Lemos L.R., Mageste A.B., Rodrigues G.D. Hydrometallurgical recovery of Zn(II) and Mn(II) from alkaline batteries waste employing aqueous two-phase system // Sep. Purif. Technol. 2019. V. 210. P. 327.
Заходяева Ю.А., Зиновьева И.В., Вошкин А.А. Экстракция хлоридных комплексов железа(III) в системе полипропиленгликоль 425–NaCl–H2O // Теор. осн. хим. технол. 2019. Т. 53. № 5. С. 510.
Wassink B., Dreisinger D., Howard J. Solvent extraction separation of zinc and cadmium from nickel and cobalt using Aliquat 336, a strong base anion exchanger, in the chloride and thiocyanate forms // Hydrometallurgy. 2000. V. 57. P. 235.
Дополнительные материалы отсутствуют.
Инструменты
Теоретические основы химической технологии


