Высокомолекулярные соединения (серия А), 2022, T. 64, № 4, стр. 267-279
ИССЛЕДОВАНИЕ СВЯЗЫВАНИЯ ЛЕКТИНОВ С ПОЛИМЕРНЫМИ ГЛИКОКОНЪЮГАТАМИ И СОДЕРЖАЩИМИ НАНОЧАСТИЦЫ СЕРЕБРА ГЛИКОКОНЪЮГАТАМИ МЕТОДАМИ ОПТИЧЕСКОЙ СПЕКТРОСКОПИИ И СВЕТОРАССЕЯНИЯ
Н. А. Самойлова a, *, М. А. Краюхина a, О. В. Вышиванная a, И. В. Благодатских a
a Институт элементоорганических соединений имени А.Н. Несмеянова Российской академии наук
119991 Москва, ул. Вавилова, 28, Россия
* E-mail: samoilova.nadezhda@gmail.com
Поступила в редакцию 28.02.2022
После доработки 21.03.2022
Принята к публикации 28.03.2022
- EDN: WAVEBF
- DOI: 10.31857/S2308112022700067
Аннотация
Осуществлен синтез гликоконъюгатов – лектин-специфичных полимеров, содержащих углеводный лиганд – спейсированный остаток N-ацетил-D-глюкозамина (β-N-Gly-GlcNAc). На основе гликоконъюгатов были получены также гликонаночастицы, содержащие спектрофотометрически детектируемую метку – наночастицы серебра. В качестве носителей для введения углеводного лиганда и одновременно стабилизатора наночастиц серебра использовали сополимеры малеинового ангидрида с этиленом или N-винилпирролидоном. Растворы гликоконъюгатов и золей гликонаночастиц серебра охарактеризованы с использованием метода рассеяния света, УФ-видимой спектроскопии и ПЭМ. Исследовано взаимодействие полученных гликоконъюгатов и гликонаночастиц серебра с N-ацетил-D-глюкозамин-специфичными лектинами Solanum tuberosum agglutinin (STA) и Wheat germ agglutinin (WGA) методами рассеяния света и УФ-видимой спектроскопии. Данные, полученные двумя физическими методами, при использовании меченых наночастицами серебра углеводсодержащих производных коррелируют между собой. Показано, что чувствительность гликоконъюгатов и гликонаночастиц серебра на основе более гидрофильного сополимера малеиновой кислоты с N-винилпирролидоном выше, чем соответствующих систем на основе более гидрофобного сополимера малеиновой кислоты с этиленом. Показано также, что исследуемые системы проявляют большую чувствительность к лектину STA, чем к лектину WGA. Гликонаночастицы серебра позволяют детектировать лектины методом рассеяния света с большей достоверностью и надежностью по сравнению с гликополимером.
ВВЕДЕНИЕ
Лектины – это белки, не относящиеся к классу иммунных, обладающие по крайней мере одним доменом распознавания углеводов, который специфически и обратимо связывается с углеводом биологических мембран клеток растений, прокариотов, эукариотов, включая высшие организмы. Способ передачи биологической информации посредством углевод-белкового узнавания является одним из основных на уровне клетки. Лектины участвуют в таких жизненно важных биологических процессах, как клеточная адгезия, дифференцировка и миграция клеток, оплодотворение, эмбриогенез, защита организма от инфекции и многих других [1, 2]. Лектины резистентны к протеолитическим ферментам (в том числе кишечным), термически стабильны, они применяются как биохимические инструменты в области иммунологии, биотехнологии и фармацевтической промышленности [3, 4]. Взаимодействие углевод–лектин широко используется в биосенсорике и протеомике. Аналитическое применение лектинов – это гисто- и цитохимия, лектиновый блоттинг, микропланшетный анализ. Лектины могут использоваться для обнаружения клеток и микроорганизмов, в исследовании гликозилирования белков, для идентификации гликанов и характеристики их структуры [5, 6]. В последнее время появились публикации о применении лектинов в диагностике и лечении рака [7]. Кроме того, недавно было показано, что растительные лектины могут использоваться как перспективные противовирусные биомолекулы в поиске стратегий ликвидации COVID-19 [8]. Известно, что диетические лектины из злаков и цельнозерновых продуктов негативно не влияют на здоровье человека. Напротив, было отмечено значительное снижение риска диабета второго типа, сердечно-сосудистых заболеваний, некоторых типов рака при применении таких продуктов [9]. Изучением, выделением и использованием лектинов из растений занимаются уже на протяжении 130 лет [10].
Существует ряд высокоточных, но достаточно трудоемких методов изучения лектин-углеводных взаимодействий. К таким методам относится иммуносорбентный анализ лектинов на основе флуорофора (FLISA) [11]. Применяют также, например, флуоресцентную спектроскопию [12], пьезоэлектрическое зондирование, спектроскопию электрохимического импеданса, поверхностный плазмонный резонанс (SPR) [13, 14], рентгеноструктурное [15], ЯМР-исследование [16] и другие методы.
В качестве модельных соединений для изучения взаимодействия углевод–лектин часто используют полимерные производные углеводов – гликоконъюгаты. Для получения таких макромолекулярных архитектур использовали методы контролируемой/“живой” радикальной полимеризации, клик-реакции, различные типы блок-сополимеризации и широкий спектр других подходов [17–24]. В биосенсорах лектинов, в изучениях по имитации поведения эритроцитов в агглютинации и других исследованиях часто применяют гликоконъюгаты, меченные металлами. В основном для этой цели используют наночастицы золота благодаря их спектральным характеристикам и особенно плазмонному резонансу. Такие гликоконъюгаты обычно получают из соответствующих производных углеводов, чаще всего содержащих тиольные группы, и стабилизированных цитратом наночастиц золота. Получение таких меченых гликоконъюгатов включает ряд синтетических стадий [25–29]. Актуальными задачами на сегодняшний день остаются разработка простых методов синтеза модельных гликоконъюгатов, а также разработка чувствительных и простых аналитических инструментов идентификации и детектирования лектинов.
В данной работе в качестве гликоконъюгатов предложено использовать полимерные производные спейсированного N-ацетилглюкозамина, который обладает специфичностью по отношению к ряду растительных лектинов. Полимерной матрицей служат сополимеры дикарбоновой (малеиновой) кислоты. Такие полимерные гликоконъюгаты, содержащие достаточное количество углеводных остатков, должны обеспечивать поливалентное связывание с лектином. Поскольку взаимодействия лектина и углеводов часто довольно слабые (Ka = 102–103 моль/л) [3], они могут быть в этом случае значительно усилены и проявлять кластерный эффект. Большинство растворимых лектинов имеют мультимерную структуру и несколько сайтов связывания с углеводом, что позволяет взаимодействовать с несколькими углеводными лигандами и существенно увеличивает связывающую способность. Основными преимуществами сополимеров малеиновой кислоты в контексте этой работы являются регулярность строения макромолекулярных цепей, достаточная легкость их модификации в форме сополимеров малеинового ангидрида производными углеводов. Такие полимеры успешно использовались ранее в качестве стабилизирующих агентов для наночастиц серебра [30, 31]. Эти нанокомпозиты могут применяться в виде коллоидных растворов, также допускается их получение в виде сухих материалов для длительного хранения. Мы предлагаем для исследования связывания углевод–лектин использовать специфические полимерные гликоконъюгаты на основе сополимеров малеинового ангидрида либо непосредственно, либо после введения в их структуру в качестве метки наночастиц серебра с получением гликонаночастиц. Наночастицы серебра получают из более дешевого и доступного сырья, чем в случае наночастиц золота, и они также обладают выраженным пиком плазмонного резонанса в диапазоне 400–420 нм.
В настоящей работе в качестве полимерных матриц для получения гликоконъюгатов и гликонаночастиц серебра предложено использовать сополимеры малеиновой кислоты с разным гидрофобно-гидрофильным балансом, а в качестве модельных лектинов – комплиментарные лектины растительного происхождения – Solanum tuberosum agglutinin (STA) и Wheat germ agglutinin (WGA). Благодаря поверхностному плазмонному резонансу метки наносеребра взаимодействие углевод–лектин наблюдали с помощью регистрации оптических спектров комплексов лектинов с гликонаночастицами серебра. Применение метода статического и динамического рассеяния света (СРС-ДРС) позволило дополнительно исследовать специфическое комплексообразование не только для гликонаночастиц серебра, но и для не помеченных наносеребром гликоконъюгатов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы
Использовали чередующиеся сополимеры малеинового ангидрида: с этиленом (ЭМ) производства “Monsanto” (США), (Мw = 2.5 × 104) и с N-винилпиролидоном (ВМ), полученным согласно работе [32] (Мw = 4.0 × 104). В результате гидролиза ЭМ и ВМ в водных системах получались соответствующие сополимеры малеиновой кислоты – ЭМК и ВМК. NaBH4, P2O5, AgNO3, NaCl, NaOH, NaNO3 (все квалификации ч.д.а.) производства “Реахим” использовали без дополнительной очистки. Вода Milli-Q получена деионизацией на системе Milli-Q (“Millipore”). Лектины Solanum tuberosum agglutinin (STA) и Wheat germ agglutinin (WGA) (“Sigma-Aldrich”). β-N-Gly-GlcNAc был любезно предоставлен Л.М. Лихошерстовым (ИОХ РАН).
Методики синтезов
Синтез гликоконъюгатов сополимеров ВМК (глико-ВМК) и ЭМК (глико-ЭМК). Активацию сополимеров (перевод в ангидридную форму) осуществляли с помощью сушки в вакууме при температуре 110°С в течение 3 ч над P2O5.
13 мг (0.047 ммоля) N-ацетилглюкозаминсодержащего лиганда (β-N-Gly-GlcNAc) растворяли в 2 мл H2O, доведенного до pH 9 с помощью 1 M NaOH в H2O. Затем при интенсивном перемешивании добавляли активированный сополимер ВМ в количестве 62.6 мг (0.3 ммоля). Время перемешивания составляло 24 ч при 20°С. Полноту связывания лиганда контролировали методом ТСХ (Пластинки Silufol, система ацетон : этанол : вода = 1 : 1 : 5 по объему). Для проявления пластинки применяли 1%-ный раствор нингидрина в ацетоне, RfN-Gly-GlcNAc = 0.3, Rfглико-ВМ = 0.1. Полученный раствор глико-ВМК использовали без выделения. Глико-ЭМК получали по аналогичной методике. Раствор глико-ЭМК лиофилизовали для дальнейшего его использования в виде порошка.
Синтез золей, содержащих наночастицы серебра. Синтез золей наночастиц серебра, стабилизированных ВМК (ВМК/Ag0) и Э М К (ЭМК/Ag0). Синтез золя ВМК/Ag0 осуществляли в соответствии с методом [30]. Для получения полимерной соли серебра к 10 мл раствора сополимера ВМК (0.01 осново-моль/л) в воде, доведенного до pH 9 с помощью 1 М NaOH, добавляли при интенсивном перемешивании 1 мл свежеприготовленного раствора 0.1 М AgNO3 (для мольного соотношения сополимер : Ag+ = 1 : 1). По истечении 30 мин к раствору полимерной соли также при интенсивном перемешивании добавляли восстановитель – свежеприготовленный водный раствор NaBH4 (0.1 М) в 2-кратном мольном избытке по отношению к ионам серебра. Реакционную смесь выдерживали 1 сутки при комнатной температуре. Для проведения элементного анализа аликвоту раствора подвергали диализу с последующим лиофильным высушиванием. Для дальнейших исследований и синтеза гликонаночастиц серебра полученный золь использовали без выделения. Коллоидный раствор наноразмерного серебра ЭМК/Ag0 получали аналогично приведенной методике.
Синтез наночастиц серебра, стабилизированных глико-ВМК (глико-ВМК/Ag0). Раствор глико-ВМК, полученный в результате синтеза, разбавляли до концентрации 0.01 осново-моль/л. Далее к 10 мл полученного раствора приливали при интенсивном перемешивании 1 мл свежеприготовленного раствора 0.1 М AgNO3. По истечении 30 минут к раствору полимерной соли гликоконъюгата также при интенсивном перемешивании добавляли свежеприготовленный водный раствор NaBH4 (0.1 М) в 2-кратном мольном избытке по отношению к ионам серебра. Реакционную смесь выдерживали 1 сутки при комнатной температуре. Полученный золь использовали без выделения (pH золя 8.75).
Синтез наночастиц серебра, стабилизированных глико-ЭМК (глико-ЭМК/Ag0). Золь глико-ЭМК/Ag0 получали по аналогичной методике с использованием раствора глико-ЭМК. Порошок глико-ЭМК в количестве 5 мг (0.0317 ммоля) растворяли в 5 мл H2O. Далее к полученному раствору приливали при интенсивном перемешивании 0.3 мл свежеприготовленного раствора 0.1 М AgNO3. Через 30 мин к раствору полимерной соли гликоконъюгата также при интенсивном перемешивании добавляли свежеприготовленный водный раствор NaBH4 (0.1 М) в двукратном мольном избытке по отношению к ионам серебра. Реакционную смесь выдерживали 1 сутки при комнатной температуре. Полученный золь использовали без выделения (pH золя 8.84).
Методы анализа образцов
Величину pH растворов определяли с помощью pH-метра “Five FE20” (“METTLER TOLEDO”) с микроэлектродом “Micro Pro”. Точность измерения pH ± 0.02 ед.
Оптические спектры регистрировали на спектрофотометре “UVIKON-922” (BRD, Германия) и “ПЭ-5400УФ” (“Экрос”, Россия) с использованием стеклянных кювет с длиной оптического пути 1 см и спектральным диапазоном 190–1000 нм. Оптические спектры серебряных гликонаночастиц снимали при концентрации 0.05 мг/мл. Изменения в спектрах регистрировали после добавления каждой порции раствора лектина (с = = 0.5 мг/мл). Изображения наночастиц серебра с помощью ПЭМ были получены на просвечивающем электронном микроскопе “LEO 912 AB” (“OMEGA”, “Karl Zeiss”, Германия) c магнитным омега спектрометром с энергетическим фильтром, интегрированным непосредственно в оптическую систему инструмента. Напряжение ускорения электронов E = 100 кВ; увеличение от 80 до 500 000; разрешение изображения 0.2–0.34 нм. Для исследований каплю исследуемого раствора помещали на 3 мм медную сетку, покрытую формваром, и высушивали в вакууме. Распределение наночастиц серебра по размеру рассчитывали при анализе изображений с использованием по крайней мере 100 частиц.
Эксперименты методом СРС-ДРС выполняли на спектрометре “PhotoCor Complex” (Россия), снабженном автоматическим гониометром и псевдо-кросскорреляционной системой счета фотонов “PhotoCor-PC2”, одноплатным мультивременным коррелятором реального времени “PhotoCor-FC”. Источник света He-Ne-лазер “Uniphase1135P” (λ = 633 нм, мощность – 10 мВт). Интенсивность рассеяния и корреляционные функции рассеяния измеряли в разбавленных растворах в интервале углов рассеяния 30°–140° с шагом 10° при 25°С для изучения структуры частиц. Для получения кривых титрования измерения проводили под углом 90°. По полученным данным строили зависимости обратного времени релаксации от волнового вектора для определения коэффициента диффузии, гидродинамический радиус Rh вычисляли по уравнению Стокса–Эйнштейна. По диаграмме Зимма находили радиус инерции Rg. Подготовку образцов для исследования осуществляли следующим образом: сополимеры ВМК и ЭМК растворяли в воде до концентрации с = 2–3 мг/мл при перемешивании в течение 2 ч. Затем доводили до нужного pH с помощью раствора 0.1 M NaOH. Концентрация сополимера ЭМК с = 2.0 мг/мл. Раствор глико-ВМК готовили разбавлением пробы из реакционной среды до концентрации 1.5 и 3.0 мг/мл. Для исследования золей ВМК/Ag0 и ЭМК/Ag0 использовался раствор с концентрацией с = 0.1 мг/мл в воде, доведенный до pH 9 раствором 0.1 M NaOH. Золи глико-ВМК/Ag0 и глико-ЭМК/Ag0 приготавливали разбавлением реакционной системы до концентрации 0.1 мг/мл. Полученные растворы обеспыливали фильтрованием через мембранный фильтр “Durapore” с номинальным размером пор 0.22 мкм в оптическую кювету и исследовали методом рассеяния света. Образцы для исследования методом УФ-видимой спектроскопией готовили подобным образом.
Титрование гликоконъюгатов сополимеров малеиновой кислоты и золей серебра растворами лектинов
Для исследования методом рассеяния света золи глико-ВМК/Ag0, ВМК/Ag0 и глико-ЭМК/Ag0 с концентрацией с = 0.1 мг/мл, обеспыленные фильтрованием через мембрану Durapore с номинальным размером пор 0.22 мкм помещали в оптическую кювету и титровали обеспыленным раствором лектина c = 0.5 мг/мл. Для этого в оптическую кювету при перемешивании прибавляли по каплям титрант и измеряли интенсивность рассеянного света под углом 90° и автокорреляционную кривую. По полученным данным строили кривые титрования в виде зависимости относительной интенсивности рассеянного света I/I0 и гидродинамического радиуса от объемного соотношения титрант : аналит. Аналогичную работу проводили с глико-ВМК (с = 0.065 мг/мл) и глико-ЭМК (с = 0.05 мг/мл).
Для изучения взаимодействия гликонаночастиц серебра с лектинами методом УФ-видимой спектроскопии золь глико-ВМК/Ag0 доводили до концентрации с = 0.05 мг/мл (объем 1 мл, pH 8.87), чтобы обеспечить работу в линейном диапазоне прибора, и титровали раствором лектина STA (с = 0.5 мг/мл) при перемешивании на магнитной мешалке. После каждого добавления регистрировали изменение в спектре поглощения. Аналогично исследовали титрование лектином глико-ЭМК/Ag0, а также взаимодействие всех полученных гликоконъюгатов с лектином WGA.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Синтез гликоконъюгатов сополимеров малеиновой кислоты и гликонаночастиц серебра
Все коллоидные гликонаночастицы серебра были получены в два этапа: синтез полимерных гликоконъюгатов и синтез содержащих наночастицы серебра гликоконъюгатов.
Гликоконъюгаты сополимеров получены из углеводсодержащего лиганда β-N-Gly-GlcNAc, содержащего помимо остатка N-ацетилглюкозамина спейсерную группу в виде остатка глицина, и сополимера ВМК (или ЭМК). Перед проведением конъюгации сополимеры были активированы путем дегидратации при нагревании в вакууме для перевода в активированную ангидридную форму тех звеньев малеиновой кислоты, которые образовывались в результате гидролиза при хранении, как было показано ранее [33]. Конъюгация лиганда β-N-Gly-GlcNAc проходила по следующей схеме:
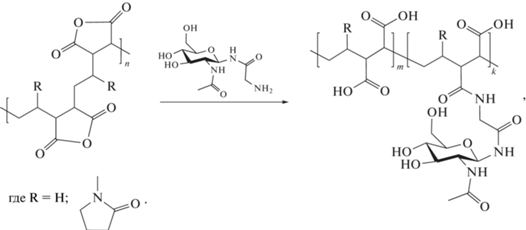
Ангидридные группы малеинового сополимера легко реагировали с первичной аминогруппой лиганда с образованием амидной связи без применения дополнительных конденсирующих агентов и органических растворителей.
Полученные гликоконъюгаты содержали приблизительно 10 мол. % углевод-модифицированных звеньев. Ранее было установлено, что более высокая плотность модифицированных звеньев может приводить к снижению способности гликоконъюгатов к связыванию, т.е. валентность гликана имеет порог для связывания с лектином [34].
Для получения гликонаночастиц серебра в качестве восстановителя использовали боргидрид натрия в присутствии ранее полученного гликоконъюгата, который выступает также как стабилизирующий агент для наночастиц серебра. Как показано методом просвечивающей электронной микроскопии, благодаря значительной разнице в редокс-потенциалах восстанавливающего агента и серебра данная методика восстановления обеспечивает образование мелких сферических наночастиц серебра, размером 2–4 нм (рис. 1 ).
Исследование взаимодействия гликонаночастиц серебра с лектинами методом УФ-видимой спектроскопии
Для изучения взаимодействия гликонаночастиц серебра с лектинами методом УФ-видимой спектроскопии золь гликонаночастиц титровали раствором лектина в диапазоне концентраций и соотношений, обеспечивающем работу прибора в линейном диапазоне измерений. После каждого добавления регистрировали изменение в спектре поглощения. Известно, что специфическое взаимодействие наночастиц серебра с белками ведет к уменьшению расстояния между наночастицами металла в результате агрегации при взаимодействии с биомолекулой, что вызывает изменение в УФ-видимом спектре за счет взаимодействия поверхностных плазмонов [35, 36].
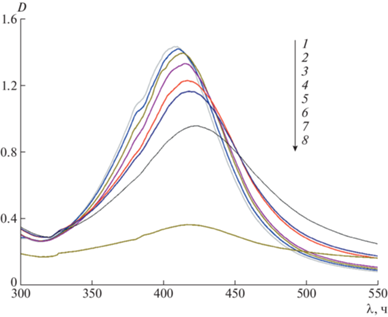
На рис. 2 показано типичное изменение в спектре исходного золя гликонаночастиц серебра при титровании его раствором лектина STA на примере использования глико-ВМК/Ag0. В данной системе спектр изменяется даже при низких концентрациях лектина (5–20 мкл STA). Наблюдаемый сдвиг максимума полосы поглощения возникает в результате взаимодействия поверхностных плазмонов при сближении наночастиц в результате углевод-лектинового взаимодействия. Значительное снижение высоты максимума при выдерживании системы в течение 1 ч и, особенно, 24 ч связано с постепенным выпадением гелеобразного осадка комплекса лектин–специфический гликоконъюгат.
Рис. 1.
Результаты просвечивающей электронной микроскопии для образцов глико-ВМК/Ag0 (а) и глико-ЭМК/Ag0 (б). Цветные рисунки можно посмотреть в электронной версии.
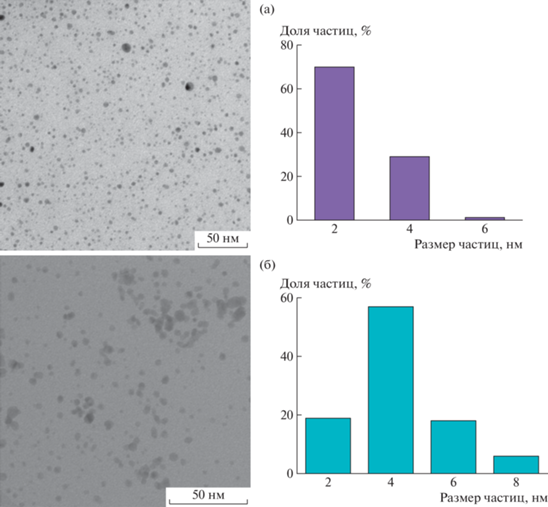
Рис. 2.
Изменение УФ-видимого спектра при титровании золя глико-ВМК/Ag0 раствором лектина STA. Количество добавленного лектина 0 (1), 5 (2), 20 (3), 40 (4), 70 (5), 90 мкл (6), а также 90 мкл через 1 (7) и 24 ч (8).
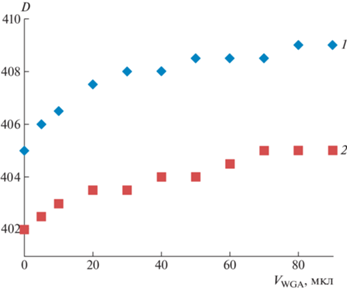
Зависимость изменения максимума поглощения золя глико-ВМК/Ag0, глико-ЭМК/Ag0 и золя наночастиц серебра, не содержащего углеводный лиганд – ВМК/Ag0, от объема добавленного лектина STA приведена на рис. 3.
Рис. 3.
Изменение положения максимума поглощения в зависимости от объема добавленного лектина STA для глико-ВМК/Ag0 (1), глико-ЭМК/Ag0 (2) и ВМК/Ag0 (3).
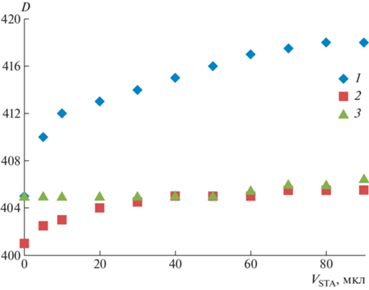
Ход кривых для гликонаночастиц серебра подтверждает достаточно высокую чувствительность к STA: уже при соотношении 0.2 мг белка/мг гликонаночастиц серебра (добавка 20 мкл белка) наблюдается сдвиг максимума спектра на 8 нм в случае глико-ВМК/Ag0 и 3 нм для глико-ЭМК/Ag0. Для сравнения был проведен холостой опыт с негликированным золем. Исследовали УФ-видимые спектры системы ВМК/Ag0 при титровании раствором STA. При этом положение максимума (рис. 3, кривая 3) во всей исследованной области концентраций белка (до 1 мг белка/мг ВМК/Ag0) не изменялось. Отсюда можно сделать заключение об отсутствии специфических взаимодействий негликированных наночастиц серебра с лектином. Полученные данные по изменению УФ-видимых спектров и характеристике рассеяния света коррелируют с описанными ранее в литературе для наночастиц золота [37].
Взаимодействие лектина WGA с гликонаночастицами серебра также контролировалось с использованием оптической спектроскопии (рис. 4).
Рис. 4.
Изменение положения максимума поглощения в зависимости от объема добавленного лектина WGA для глико-ВМК/Ag0 (1) и глико-ЭМК/Ag0 (2).
При титровании глико-ВМК/Ag0 лектином WGA (рис. 4) также наблюдали некоторое красное смещение максимума поглощения. Масштаб изменений чуть меньше, чем при взаимодействии с лектином STA: при добавлении 0.2 мг белка/мг наночастиц серебра (20 мкл лектина) сдвиг максимума составляет 2.5 нм в случае глико-ВМК/Ag0 и 1.5 нм для глико-ЭМК/Ag0. При взаимодействии гликонаночастиц серебра как с лектином STA, так и с лектином WGA, гликонаночастицы на основе более гидрофобного сополимера ЭМК демонстрируют несколько меньшие изменения спектра поглощения, чем ВМК-содержащие гликонаночастицы.
Метод рассеяния света
Для изучения взаимодействия лектинов с полимерными гликоконъюгатами и гликонаночастицами серебра методом СРС-ДРС, предварительно этим методом были охарактеризованы растворы сополимеров малеиновой кислоты, их гликоконъюгатов, полимер-стабилизированных наночастиц серебра и гликонаночастиц серебра.
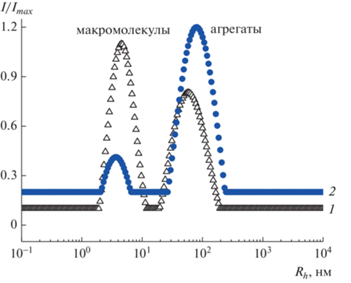
Исследование растворов сополимеров малеиновой кислоты и их гликоконъюгатов. Исследования сополимера ВМК и его гликоконъюгата, проведенные при разных значениях pH, показали, что в щелочной среде (pH 9) исходный полимер практически не агрегирован, а с понижением pH увеличивается доля и размер агрегатов в растворе (рис. S1 в дополнительных материалах). В то же время глико-ВМК агрегирован как в нейтральной, так и в щелочной среде. Сравнение распределений по размеру частиц ВМК и глико-ВМК показано на рис. 5. Полученные результаты свидетельствуют о том, что введение лиганда в макромолекулы ВМК способствует усилению тенденции к агрегации, что, по-видимому, связано с увеличением гидрофобности макромолекулы и способности к образованию водородных связей.
Рис. 5.
Распределение интенсивности рассеянного света по гидродинамическому радиусу в разбавленных растворах ВМК (с = 3 мг/мл, 0.05 M NaNO3) (1) и глико-ВМК (с = 3 мг/мл, 0.05 M NaNO3) (2).
Структуру агрегатов глико-ВМК при двух концентрациях оценили методом СРС-ДРС измеряя интенсивность рассеяния и корреляционные функции под разными углами (рис. S2 ). В табл. 1 для полимеров и их гликоконъюгатов приведены кажущиеся (без экстраполяции к нулевой концентрации) значения коэффициентов диффузии D, гидродинамических радиусов Rh молекул и агрегатов, а также радиуса инерции Rg и фактора асимметрии Rg/Rh агрегатов. Значения Rg/Rh порядка 2 свидетельствуют о несферической форме агрегатов и могут соответствовать структурам типа эллипсоида вращения или фрактала [38]. Приблизительно массовую долю агрегатов в растворе можно оценить, пользуясь упрощенными моделями гауссова клубка и фрактального агрегата. Соотношение интенсивностей рассеяния света для этих двух видов частиц I2/I1 ≈ c2$R_{2}^{2}$/c1$R_{1}^{2}$. Используя соответствующие значения Rh, а также экспериментальные значения I2/I1 ≈ 32 для концентрации 1.5 мг/мл, получим с2/с1 ≈ 0.05. Следовательно, массовое содержание агрегатов составляет приблизительно 5%.
Таблица 1.
Результаты исследования растворов ВМК, ЭМК, глико-ВМК и глико-ЭМК методом СРС-ДРС
| Образец | Dмакромол. × × 10–11, м2/с | Dагр. × 10–12, м2/с | Rhмакромол., нм | Rhагр., нм | Rgагр., нм | Rg/Rh (агр.) |
|---|---|---|---|---|---|---|
| ВМК (pH 6.6 0.05 M NaNO3), 2 мг/мл | 5.30* | 4.2* | 4.6* | 58* | – | – |
| глико-ВМК (0.05 M NaNO3), 3 мг/мл | 6.54 ± 0.12 | 3.29 ± 0.07 | 3.6±0.2 | 72 ± 2 | 159 ± 8 | 2.21 ± 0.11 |
| глико-ВМК (0.05 M NaNO3), 1.5 мг/мл | 5.8 ± 0.2 | 3.16 ± 0.07 | 4.0 ± 0.3 | 75 ± 2 | 140 ± 7 | 1.87 ± 0.09 |
| глико-ВМК (H2O), 3 мг/мл | 10.2 ± 0.05 | 2.84 ± 0.06 | 2.4 ± 0.3 | 86 ± 2 | 164 ± 5 | 1.9 ± 0.1 |
| глико-ВМК (H2O), 1.5 мг/мл | 9.7 ± 0.7 | 2.30 ± 0.07 | 2.4 ± 0.4 | 102 ± 3 | 169 ± 8 | 1.66 ± 0.08 |
| ЭМК (pH 9), 2 мг/мл | – | – | 2.8* | 230* | – | – |
| ЭМК (pH 9, 0.05 M NaNO3), 2 мг/мл | – | – | 4* | 80* | – | – |
| глико-ЭМК (pH 9, 0.05 M NaNO3), 0.05 мг/мл |
– | – | 4.4* | 108* | – | – |
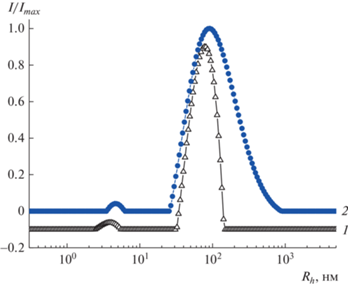
Изучение растворов более гидрофобного сополимера ЭМК методом ДРС показало, что его растворы частично агрегированы как в кислой, так и в щелочной среде [31]. Структура растворов глико-ЭМК подобна структуре растворов исходных ЭМК (рис. 6), критическая концентрация агрегации ниже 0.05 мг/мл в отличие от глико-ВМК, в растворах которого, использованных для титрования лектинами (с = 0.065 моль/л), не обнаружено агрегатов.
Рис. 6.
Распределение интенсивности рассеянного света по гидродинамическому радиусу в разбавленных растворах ЭМК (с = 2 мг/мл, 0.05 M NaNO3) (1) и глико-ЭМК (с = 0.05 мг/мл, 0.05 M NaNO3) (2).
Как для исходных сополимеров, так и для их гликоконъюгатов заметное влияние на гидродинамический радиус агрегатов оказывает ионная сила раствора: при добавлении низкомолекулярной соли в результате экранирования зарядов на цепи уменьшаются наблюдаемые величины Rh агрегатов (табл. 1), что характерно для полимерных частиц с полиэлектролитной короной.
Исследование золей наносеребра, стабилизированных сополимерами малеиновой кислоты и гликоконъюгатами сополимеров малеиновой кислоты. Проведен сравнительный анализ методом СРС-ДРС золей полимер-стабилизированных наночастиц серебра и полученных на их основе гликозилированных производных при использовании сополимеров ВМК и ЭМК с разной гидрофильностью. Распределения частиц по размеру показаны на рис. 7 и 8 соответственно.
Рис. 7.
Распределения интенсивности рассеянного света по гидродинамическому радиусу в золях ВМК/Ag0 (1) и ЭМК/Ag0 (2) в воде с добавлением NaOH до pH 9. Угол рассеяния 90°, c = 0.1 мг/мл.
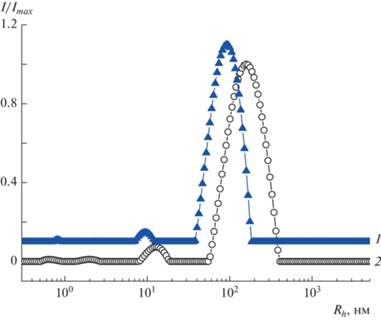
Рис. 8.
Распределения интенсивности рассеянного света по гидродинамическому радиусу в золях глико-ВМК/Ag0 (1) и глико-ЭМК/Ag0 (2). Угол рассеяния 90°, c = 0.1 мг/мл; свежеполученные золи разбавлены без выделения из реакционной массы.
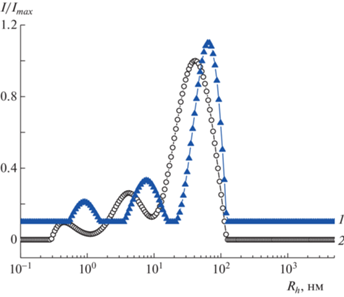
Ранее при исследовании наночастиц серебра, стабилизированных сополимерами малеиновой кислоты [31], было показано, что быстрая мода относится к унимерным полимер-стабилизированным наночастицам серебра, а медленная мода – к кластерам полимер-стабилизированных наночастиц серебра, которые образуются внутри полимерных агрегатов при восстановлении солей серебра. Как и полимерные агрегаты, кластеры составляют лишь небольшую долю от массы всех полимер-стабилизированных наночастиц серебра, хотя им соответствует преобладающая часть интенсивности рассеяния света. Как видно на рис. 7, золи на основе более гидрофобного полимера ЭМК характеризуются более крупными кластерами. Стабилизация металлических наночастиц в унимерных мицеллах и в кластерах достигается за счет совокупности структурно-механического и электростатического факторов.
На рис. 8 показаны распределения по гидродинамическому радиусу золей гликонаночастиц серебра. Для данных золей характерно широкое мультимодальное распределение по размеру частиц, наиболее интенсивный максимум соответствует кластерам с Rh = 45–60 нм. Мультимодальность может быть связана не только с наличием унимерных наночастиц серебра и кластеров, но и с дополнительным проявлением внутренних мод в результате внутренней интерференции в кластерах [39, 40].
Исследование взаимодействия гликоконъюгатов и гликонаночастиц серебра с лектинами. Для исследования взаимодействия гликонаночастиц серебра с лектинами методом рассеяния света предварительно проведен холостой опыт – титрование лектином STA негликированного золя серебра ВМК/Ag0. При добавлении лектина до объемного соотношения 0.10 (или массового соотношения 0.5) интенсивность рассеяния сохраняется постоянной в пределах ±5% (рис. S3 в дополнительных материалах). Та же тенденция наблюдается и в отношении распределений по размеру частиц. Отсюда можно сделать заключение об отсутствии специфических взаимодействий негликилированных наночастиц серебра с лектином в исследованной области концентраций по данным двух физических методов СРС-ДРС и УФ-видимой спектроскопии. Далее в нашей работе контроль связывания лектинов гликонаночастицами будет проводиться при массовых соотношениях белок/наночастицы серебра не более 0.5 во избежание наложения неспецифических взаимодействий, приводящих к агрегации. За процессом взаимодействия гликонаночастиц серебра с лектинами следили по изменению интенсивности рассеяния света при титровании лектином, а также по изменению размера агрегатов, вносящих наибольший вклад в рассеяние или среднего размера частиц в случае неразделенных мультимодальных распределений.
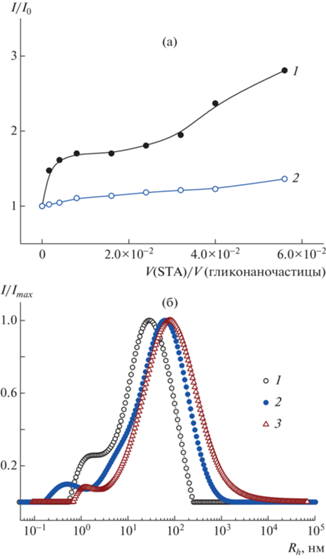
На рис. 9 представлены данные по титрованию глико-ВМК/Ag0 и глико-ЭМК/Ag0 лектином STA. Видно, что при использовании глико-ВМК/Ag0 введение минимального количества белка сопровождается заметным ростом интенсивности рассеяния и сдвигом максимума пика распределения частиц по размеру. При объемном соотношении V(STA)/V(глико-ВМК/Ag0) = 0.02–0.05 (массовое соотношение 0.10–0.25) максимум сдвигается с 30 до 65–75 нм. В этом диапазоне составов усиление агрегации можно связать со специфическим взаимодействием гликонаночастиц серебра и комплементарного белка. Такое поведение коррелирует с изменениями УФ-видимых спектров в результате взаимодействия поверхностных плазмонов при агрегации. При дальнейшем добавлении белка происходит потеря коллоидной устойчивости системы, что приводит к появлению фракции микронных частиц и постепенному частичному осаждению, что наблюдалось также методом УФ-видимой спектроскопии. В отличие от гликонаночастиц серебра на основе сополимера ВМК золь глико-ЭМК/Ag0 более слабо реагирует на добавление лектина STA (рис. 9а, кривая 2). По данным УФ-видимой спектроскопии, отклик этих гликонаночастиц серебра был также меньше, чем глико-ВМК/Ag0.
Рис. 9.
Изменение интенсивности рассеянного света при титровании золя глико-ВМК/Ag0 (1) и глико-ЭМК/Ag0 (2) раствором лектина STA (а) и изменение распределения по размеру частиц при соотношении V(STA)/V(глико-ВМК/Ag0) = 0 (1), 0.02 (2) и 0.05 (3) (б).
Для сравнения отклика различных гликонаночастиц серебра и гликоконъюгатов на лектины STA и WGA проведены соответствующие титрования. В табл. 2 показаны изменения интенсивностей рассеяния при объемном соотношении лектин : гликонаночастицы серебра (или гликополимер), равном 0.02, по сравнению с исходным раствором гликонаночастиц серебра или гликополимера. При титровании лектином WGA золей гликонаночастиц серебра обнаружена та же тенденция: отклик на добавление минимального количества лектина (объемное соотношение 0.02–0.05) в виде роста интенсивности в 1.5 раза и сдвига максимума распределения по размеру частиц от 65 до 90 нм наблюдался при использовании глико-ВМК/Ag0 (рис. S6 ), тогда как при использовании глико-ЭМК/Ag0 изменений практически не было (рис. S5 ). Эти данные также коррелируют с результатами УФ-видимой спектроскопии.
Таблица 2.
Изменение интенсивности рассеянного света I/I0 при добавлении растворов лектинов к растворам гликонаночастиц или полимерных гликонъюгатов в объемном соотношении 0.02
| Образец | Значения I/I0 при добавлении лектина | |
|---|---|---|
| STA | WGA | |
| глико-ВМК/Ag0 | 1.8 | 1.5 |
| глико-ЭМК/Ag0 | 1.2 | 1.1 |
| глико-ВМК | 2.6 | 2.1 |
| глико-ЭМК | 2.3 | 1.1 |
Титрование растворов полимерных гликоконъюгатов, не содержащих наночастиц серебра, проведено при концентрациях полимера, соответствующих его количеству в растворах гликонаночастиц (0.050–0.065 мг/мл). При титровании глико-ЭМК лектином WGA интенсивность рассеяния и размер частиц практически не изменялись (рис. S8 ), тогда как при титровании лектином STA происходило значительное повышение интенсивности рассеяния, но изменение кривых распределения по размерам в основном было связано с появлением крупных микронных частиц (рис. S7 ). Можно предположить, что взаимодействие полимерных гликоконъюгатов с более крупными макромолекулами STA приводит к быстрой потере устойчивости коллоидными частицами.
Как было отмечено выше, растворы глико-ВМК характеризовались отсутствием агрегации и низкой интенсивностью рассеяния, что не позволило проанализировать изменение размера частиц при добавлении лектина, хотя некоторое повышение интенсивности рассеяния наблюдалось (рис. S9 ).
Таким образом, проведенные исследования показывают, что гликонаночастицы, содержащие частицы наносеребра, позволяют детектировать лектины STA и WGA методом рассеяния света с большей достоверностью и надежностью по сравнению с гликополимером.
ЗАКЛЮЧЕНИЕ
Синтезированы гликоконъюгаты сополимеров малеиновой кислоты с этиленом или N-винилпирролидоном, специфичные к ряду растительных лектинов. Полученные гликоконъюгаты использовали как стабилизаторы плазмонно-резонансных наночастиц серебра.
Методом рассеяния света исследованы структуры растворов гликоконъюгатов сополимеров малеиновой кислоты и гликонаночастиц серебра. Показано, что растворы гликоконъюгата проявляют большую тенденцию к агрегации, чем исходный полимер. Золи гликонаночастиц серебра и немодифицированных полимер-стабилизированных наночастиц содержат унимерные частицы и кластеры наночастиц.
Исследовано взаимодействие полученных гликоконъюгатов и гликонаночастиц с β-N-ацетил-D-глюкозамин-специфичными лектинами STA и WGA методами рассеяния света и УФ-видимой спектроскопии. Показано, что методы УФ-видимой спектроскопии и рассеяния света чувствительны к углевод-лектиновому взаимодействию и коррелируют между собой при использовании меченых наночастицами серебра углеводсодержащих производных.
Гликонаночастицы, содержащие частицы наносеребра, позволяют детектировать лектины STA и WGA методом рассеяния света с большей достоверностью и надежностью по сравнению с гликополимером. В отличие от гликонаночастиц серебра использование гликоконъюгата без плазмонно-резонансной метки наносеребра не позволяет применять в качестве аналитического инструмента УФ-видимую спектроскопию. Показано, что чувствительность гликоконъюгатов и гликонаночастиц серебра на основе более гидрофильного сополимера малеиновой кислоты с N-винилпирролидоном выше, чем соответствующих систем на основе более гидрофобного сополимера малеиновой кислоты с этиленом. Показано также, что исследуемые системы проявляют большую чувствительность к лектину STA, чем к лектину WGA. Данные, полученные двумя физическими методами, коррелируют между собой. Полученные результаты позволяют заключить, что гликонаночастицы на основе сополимера ВМК могут служить основой сенсорных систем на лектины STA и WGA, использующих методы рассеяния света и/или УФ-видимой спектроскопии.
Авторы выражают благодарность С.С. Абрамчуку за проведение экспериментов с ПЭМ.
Работа выполнена при поддержке Министерства науки и высшего образования Российской Федерации с использованием научного оборудования Центра исследования строения молекул Института элементоорганических соединений Российской академии наук.
Список литературы
Wu A.M., Lisowska E., Duk M., Yang Z. // Glycoconj. J. 2008. V. 26. P. 899.
Dan X., Liu W., Ng T.B. // Med. Res. Rev. 2016. V. 36. № 2. P. 221.
Liener I.E., Sharon N., Goldstein I.J. The Lectins: Properties, Functions and Applications in Biology and Medicine. New York: Acad. Press, 1986.
Hassan M.A. // Int. J. Mol. Sci. 2015. V. 16. № 4. P. 7802.
Vojdani A. // Altern. Ther. Health Med. 2015. V. 21 № 1. P. 46.
Hendrickson O.D., Zherdev A.V. // Critical Rev. Analyt. Chem. 2018. V. 48. № 4. P. 279.
Gupta A. // Materials Today: Proceedings. 2020. V. 31. № 2. P. 651.
Ahmed Md.N., Jahan R., Nissapatorn V., Wilairatana P., Rahmatullah M. // Biomed. Pharmacother. 2022. V. 146. Art. 112507.
Buul V.J., Brouns F. // J. Cereal Sci. 2014. V. 59. № 2. P. 112.
Tsaneva M., Van Damme E.J.M. // Glycoconj. J. 2020. V. 37. P. 533.
Wu A.M., Liu J.H. // Glycoconj. J. 2019. V. 36. P. 175.
Kakehi K., Oda Y., Kinoshita M. // Anal. Biochem. 2001. V. 297. № 2. P. 111.
Mahon E., Mouline Z., Silion M., Gilles A., Pinteala M., Barboiu M. // Chem. Commun. 2013. V. 49. P. 3004.
Tsvetkov Y.E., Burg-Roderfeld M., Loers G., Arda A., Sukhova E.V., Khatuntseva E.A., Grachev A.A., Chizhov A.O., Siebert H.-C., Schachner M., Jimenez-Barbero J., Nifantiev N.E. // J. Am. Chem. Soc. 2012. V. 134. № 1. P. 426.
Palmer R.A., Niwa H. // Biochem. Soc. Trans. 2003. V. 31. P. 973.
Fernández-Alonso M.C., Díaz D., Berbis M.Á., Marcelo F., Cañada J., Jiménez-Barbero J. // Curr. Protein Pept. Sci. 2012. V. 13. № 8. P. 816.
Godula K., Bertozzi C.R. // J. Am. Chem. Soc. 2010. V. 132. № 39. P. 9963.
Wang W., Chance D., Mossine V., Mawhinney T. // Glycoconj. J. 2014. V. 31. P. 133.
Yilmaz G., Becer C.R. // Front. Bioeng. Biotechnol. 2014. V. 2. Art. 39.
Pati D., Shaikh A.Y., Das S., Nareddy P.K., Swamy M.J., Hotha S., Gupta S.S. // Biomacromol. 2012. V. 13. № 5. P. 1287.
Parry A L., Clemson N.A., Ellis J., Bernhard S.S.R., Davis B.G., Cameron N.R. // J. Am. Chem. Soc. 2013. V. 135. № 25. P. 9362.
Zhang Q., Anastasaki A., Li G.-Z., Haddleton A.J., Wilson P., Haddleton D.M. // Polym. Chem. 2014. V. 5. P. 3876.
Richards S.-J., Otten L., Gibson M.J. // J. Mater. Chem. B. 2016. V. 4. № 18. P. 3046.
Sun P. // ACS Macro Lett. 2013. V. 3. № 1. P. 96.
Piskarev V.E., Lutsik-Kordovskii V.E., Piskareva E.L., Yamskov I.A. // Appl. Biochem. Microbiol. 2003. V. 39. № 5. P. 512.
Toyoshima M., Miura Y. // J. Polym. Sci., Polym. Chem. 2009. V. 47. № 5. P. 1412.
Marradi M., Chiodo F., Garcia I., Penades S. // Chem. Soc. Rev. 2013. V. 42. P. 4728.
Reynolds A.J., Haines A.H., Russel D.A. // Langmuir. 2006. V. 22. № 3. P. 1156.
Le Gueevel X. // ACS Appl. Mater. Interfaces. 2015. V. 7. № 37. P. 20945.
Samoilova N., Kurskaya E., Krayukhina M., Askadsky A., Yamskov I. // J. Phys. Chem. B. 2009. V. 113. № 11. P. 3395.
Samoilova N., Blagodatskikh I., Kurskaya E., Krayukhina M., Vyshivannaya O., Abramchuk S., Askadskii A., Yamskov I. // Colloid. J. 2013. V. 75. № 4. P. 409.
Conix A., Smets G. // J. Polym. Sci. 1955. V. 15. № 79. P. 221.
Samoilova N., Krayukhina M., Naumkin A., Yamskov I. // Monatshefte für Chemie. 2018. V. 149. P. 1179.
Godula K., Bertozzi C.R. // J. Am. Chem. Soc. 2012. V. 134. № 38. P. 15732.
Ashrafpour S., Moghadam T.T. // Surf. Interfaces. 2018. V. 10. P. 216.
Khan S.S., Srivatsan P., Vaishnavi N., Mukherjee A., Chandrasekaran N. // J. Hazard Mater. 2011. V. 192. № 1. P. 299.
Toyoshima M., Miura Y. // J. Polym. Sci., Polym. Chem. 2009. V. 47. № 5. P. 1412.
Burchard W. // Branched Polymers II. Berlin; Heidelberg: Springer, 1999. P. 113.
Stepanek P. // Dynamic Light scattering, The Method and Some Applications. / Ed. by W. Droun. Oxford: Clarendron Press, 1993.
Bloomfield V.A. // Biopolymers. 2000. V. 54. P. 168.
Дополнительные материалы
- скачать ESM.docx
- Приложение 1. Рис.1-Рис.10
Инструменты
Высокомолекулярные соединения (серия А)


