Высокомолекулярные соединения (серия Б), 2020, T. 62, № 4, стр. 269-275
Олигомерные гидроксиарилоксициклотрифосфазены пониженной функциональности на основе резорцина
Ю. В. Биличенко a, Зыонг Тиен Нгуен a, В. В. Киреев a, *, Р. С. Борисов b, c, И. С. Сиротин a, С. Н. Филатов a
a Российский химико-технологический университет им. Д.И. Менделеева
125047 Москва, Миусская пл., 9, Россия
b Институт нефтехимического синтеза им. А.В. Топчиева Российской академии наук
119991 Москва, Ленинский пр., 29, Россия
c Российский университет дружбы народов
117198 Москва, ул. Миклухо-Маклая, 6, Россия
* E-mail: kireev@muctr.ru
Поступила в редакцию 22.01.2020
После доработки 03.03.2020
Принята к публикации 19.03.2020
Аннотация
Поликонденсацией феноксихлорциклотрифосфазенов общей формулы P3N3Cl(6 –x)(OC6H5)x (х = 3.1 и 4.5) с избытком резорцина при гомогенном (пиридин) и гетерогенном (K2CO3) акцептировании HCl с выходом 60–85% синтезированы олигомерные гидроксиарилоксициклотрифосфазены P3N3Cln(OC6H5)x(OC6H4OH)y. Полное замещение атомов хлора в указанных олигомерах (n = 0) при гомогенном акцептировании HCl пиридином достигнуто только при мольном соотношении феноксихлорциклофосфазен : резорцин = 1 : 12; при соотношении 1 : 6 образующиеся олигомеры содержат до 3% Cl. Строение соединений, входящих в состав олигогидроксиарилоксициклотрифосфазенов, и их относительное содержание определены методом спектроскопии ЯМР 31Р и масс-спектрометрии MALDI-TOF.
Продукты поликонденсации хлорциклофосфазенов (ХЦФ) с двухатомными фенолами – гидроксиарилоксициклофосфазенами (ГАРФ) – представляют интерес как для синтеза различного типа фосфазенсодержащих полимеров (полиэфиров, фенолоформальдегидных и эпоксидных смол), так и для модификации обычных органических полимеров с целью улучшения их физико-механических характеристик, термо- и огнестойкости [1].
Особенностью процессов синтеза ГАРФ можно назвать высокую функциональность ХЦФ, равную шести, даже в случае низшего гомолога гексахлорциклотрифосфазена (ГХФ). Для исключения гелеобразования при взаимодействии ГХФ с дифенолами в соответствии с теорией гелеобразования Флори необходимо использование не менее, чем 15-кратного избытка дифенола [2]. Однако последующее удаление избытка дифенола является многостадийным трудозатратным процессом.
Использование для реакции с ХЦФ монофенолятов дифенолов позволяет уменьшить их избыток, но из-за наличия в монофеноляте равновесного количества дифенолята, образующиеся ГАРФ содержат в своем составе олигомеры, молекулы которых построены из соединенных диоксиароматическими радикалами двух или более частично или полностью замещенных фосфазеновых циклов [3].
Другая особенность реакции дифенолов с ХЦФ – необходимость полного замещения атомов хлора в циклах. Особенно это актуально для ГХФ, в котором полное замещение достигается или в более жестких условиях (высокая температура и продолжительность), или снова при большом избытке дифенола [4].
Уменьшить избыток дифенола удалось понижением функциональности ГХФ введением в состав его молекул инертных радикалов, в основном арилокси-групп [5]. Для повышения огнестойкости ГАРФ в последнее время при их синтезе все чаще вместо бисфенола А используют резорцин [6], осуществляя взаимодействие последнего с ХЦФ в гетерофазной системе циклогексан–пиридин [3].
Снижение функциональности образующихся ГАРФ в настоящей работе осуществлено заменой ГХФ на его частично замещенные производные – феноксихлорфосфазены (ФХФ), синтезируемые взаимодействием ГХФ с фенолятом Na в среде диоксана:
При выбранных в данной работе мольных соотношениях ГХФ : NaOC6H5 = 3.1 и 4.5 образуются смеси индивидуальных соединений, обозначенные как ФХФ-1 (х = 3.1) и ФХФ-2 (х = 4.5); строение этих олигомеров подтверждено их спектрами ЯМР 31Р (рис. 1а, 1в).
Рис. 1.
Спектры ЯМР 31Р (а, в) и масс-спектры MALDI-TOF (б, г) ФХФ-1 (а, б) и ФХФ-2 (в, г); P3N3Cl(6 –x)(OC6H5)x.
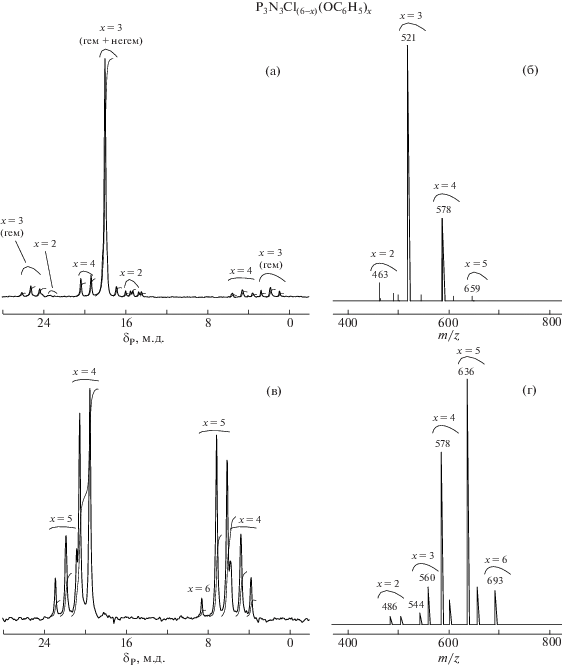
В соответствии со статистическим характером замещения в обоих случаях ФХФ содержат в преобладающем количестве соединения, задаваемые соотношением исходных веществ. Более точно состав ФХФ был установлен по их масс-спектрам MALDI-TOF (рис. 1б, 1г), результаты количественного анализа которых представлены в табл. 1. Видно, что олигомер ФХФ-1 содержит преимущественно три- (56%) и тетрафеноксихлорциклофосфазены (36%), в то время как ФХФ-2 характеризуется более широким распределением гомологов со значением х от 2 до 6 с максимумами при х = 4 (39%) и х = 5 (48%).
Таблица 1.
Состав исходных феноксихлорциклотрифосфазенов по данным масс-спектрометрии MALDI-TOF P3N3Cl(6 –x)(OC6H5)x
| Значение x | Содержание соединений (мас. %) в составе ФХФ, полученных при мольном соотношении ГХФ : фенолят натрия | |
|---|---|---|
| 1 : 3.1 (ФХФ-1) | 1 : 4.5 (ФХФ-2) | |
| 2 | 7 | 2 |
| 3 | 56 | 8 |
| 4 | 36 | 39 |
| 5 | 1 | 48 |
| 6 | – | 3 |
Для замещения сохранившихся атомов хлора в ФХФ на остатки резорцина были использованы два акцепторных метода синтеза: система несмешивающихся растворителей циклогексан–пиридин, в которой последний выступал акцептором (метод 1); и в среде ацетонитрила с акцептором карбонатом калия (метод 2):
Контроль за степенью замещения атомов хлора в ФХФ, синтезируемых по методу 1, осуществлен по спектрам ЯМР 31Р (рис. 2). При их анализе было установлено, что в случае ФХФ-1 максимальная степень замещения атомов хлора в образующихся ГАРФ при мольном соотношении фосфазен : резорцин = 1 : 6 за 6 ч достигает 66% (табл. 2), и лишь при повышении указанного соотношения до 1 : 12 формируются не содержащие хлора смешанные арилоксифосфазены (рис. 2б). Увеличение продолжительности реакции до 12 ч, вместо повышения степени замещения, приводит к почти полному разрушению ГАРФ под действием пиридина и образованию водорастворимых побочных соединений.
Рис. 2.
Спектры ЯМР 31Р продуктов реакции резорцина с ФХФ-1 (а, б) и ФХФ-2 (в) в равнообъемной смеси циклогексан–пиридин при Т = 90°С в течение 6 ч. Мольное соотношение ФХФ : резорцин = 1 : 6 (а) и 1 : 12 (б, в). P3N3Cln(OC6H5)x(OC6H4OH)y.
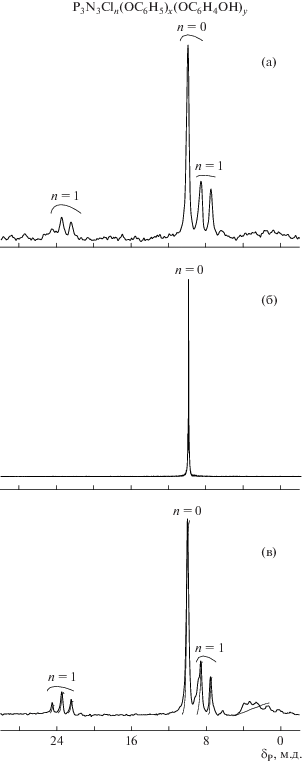
Таблица 2.
Изменение во времени степени замещения атомов хлора в продуктах реакции ФХФ-1 с резорцином (равнообъемная смесь циклогексан : пиридин, Т = 90°С, мольное соотношение ФХФ-1 : резорцин = 1 : 6) P3N3Cln(OC6H5)x(OC6H4OH)y
| Продолжительность реакции, ч | Содержание соединений (мас. %) по данным спектров ЯМР 31Р | ||
|---|---|---|---|
| гексазамещенные производные ГХФ (n = 0, x + y = 6) | пентазамещенные производные ГХФ (n = 1, x + y = 5) | продукты побочных превращений | |
| 3 | 29 | 62 | 9 |
| 4 | 52 | 29 | 19 |
| 6 | 66 | 34 | 0 |
| 12 | 0 | 8 | 92 |
В случае ФХФ-2 добиться полного замещения атомов хлора не удалось даже при мольном соотношении фосфазен : резорцин = 1 : 12 (рис. 2в).
Содержание индивидуальных соединений в ГАРФ, синтезируемых в смеси циклогексан–пиридин при мольных соотношениях ФХФ-1 : резорцин = 1 : 6 (ГАРФ -1-6) и 1 : 12 (ГАРФ-1-12) было установлено с помощью масс-спектров MALDI-TOF (табл. 3). Как следует из таблицы, в составе олигомера, полученного при большом избытке дифенола (ГАРФ-1 -12), содержится всего четыре соединения вместо семи в ГАРФ-1-6, т.е. за счет конвертации части из этих семи в полностью замещенные гексаарилоксициклотрифосфазены.
Таблица 3.
Соединения, образующиеся при взаимодействии ФХФ-1 с резорцином по данным масс-спектрометрии MALDI-TOF (равнообъемная смесь циклогексан : пиридин, Т = 90°С, 6 ч)
| m/z | Предполагаемая формула соединений | Содержание (мас. %) | |
|---|---|---|---|
| соединений | фосфора в соединениях* | ||
| Мольное соотношение ФХФ-1 : резорцин = 1 : 6 (ГАРФ-1-6) | |||
| 651 | P3N3Cl(OC6H5)4(OC6H4OH) | 14 | 14.3 |
| 668 | P3N3Cl(OC6H5)3(OC6H4OH)2 | 24 | 13.9 |
| 725 | P3N3(OC6H5)4(OC6H4OH)2 | 12 | 12.8 |
| 741 | P3N3(OC6H5)3(OC6H4OH)3 | 40 | 12.5 |
| 1172 | (P3N3)2Cl(OC6H5)7(OC6H4O)2 | 3 | 15.8 |
| 1299 | (P3N3)2Cl(OC6H5)6(OC6H4OH)3(OC6H4O)2 | 4 | 14.3 |
| 1372 | (P3N3)2(OC6H5)6(OC6H4OH)4 (OC6H4O) | 3 | 13.5 |
| Мольное соотношение ФХФ-1 : резорцин = 1 : 12 (ГАРФ-1-12) | |||
| 726 | P3N3(OC6H5)4(OC6H4OH)2 | 18 | 12.8 |
| 741 | P3N3(OC6H5)3(OC6H4OH)3 | 63 | 12.5 |
| 757 | P3N3(OC6H5)2(OC6H4OH)4 | 12 | 12.3 |
| 1372 | (P3N3)2(OC6H5)6(OC6H4OH)4(OC6H4O) | 7 | 13.5 |
Также особенностью ГАРФ-1-12 является содержание в них только одного соединения (m/z = = 1372), молекулы которого построены из соединенных м-диоксифениленовым мостиком двух пентазамещенных тримерных фосфазеновых циклов с наиболее вероятной брутто-формулой:
В ГАРФ-1-6 подобных соединений содержится три со значениями m/z = 1172, 1299 и 1372; их суммарное содержание достигает 10%.
С целью упрощения стадии выделения и очистки ГАРФ их синтез был осуществлен по методу 2 в среде ацетонитрила в присутствии избытка карбоната калия в качестве акцептора HCl при температуре кипения растворителя 80°С.
Спектры ЯМР 31Р, полученные по второму методу ГАРФ-2 (рис. 3), подобны спектрам олигомеров ГАРФ-1 (см. рис. 2). Единственным отличием является невозможность достижения полного замещения атомов хлора в исходных ФХФ-2: содержание хлора в конечных ГАРФ-2 составляет не более 5% независимо от использованного избытка резорцина. Причиной этого может быть гетерогенность процесса и недостаточная для этого метода температура реакции (80°С), ограниченная температурой кипения ацетонитрила. Относительно содержания индивидуальных соединений в ГАРФ, синтезируемых методом 2 (табл. 4), то по данным MALDI-TOF оно близко к таковому для олигомеров, полученных методом 1.
Рис. 3.
Спектры ЯМР 31Р продуктов реакции резорцина с ФХФ-1 (а, б) и ФХФ-2 (в, г) в среде ацетонитрила при Т = 80°С в присутствии избытка К2СО3 в течение 10 ч. Мольное соотношение ФХФ : резорцин = 1 : 6 (а, в) и 1:12 (б, г); P3N3Cln(OC6H5)x(OC6H4OH)y.
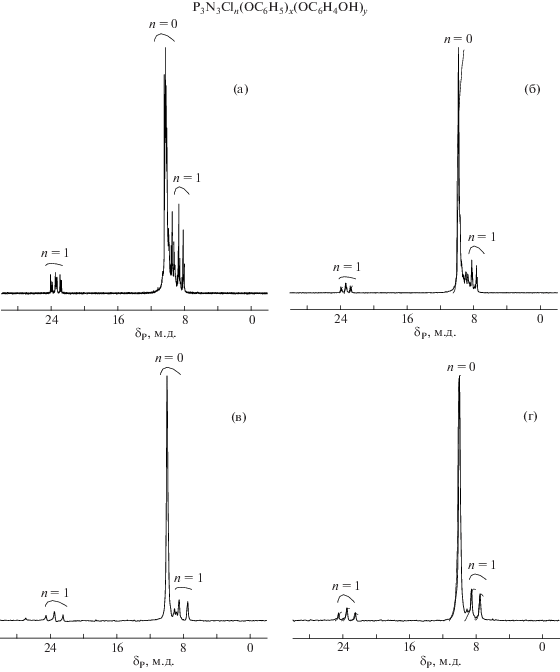
Таблица 4.
Основные соединения в составе олигомера ГАРФ-2-6, полученного из ФХФ-2 и резорцина по данным масс-спектрометрии MALDI-TOF (синтез в ацетонитриле, 10 ч, мольное соотношение ФХФ-2 : резорцин = 1 : 6)
| m/z | Формула соединений | Содержание (мас. %) | |
|---|---|---|---|
| соединений | фосфора в соединениях* | ||
| 651 | P3N3Cl(OC6H5)4(OC6H4OH) | 10 | 14.3 |
| 710 | P3N3(OC6H5)5(OC6H4OH) | 37 | 13.1 |
| 726 | P3N3(OC6H5)4(OC6H4OH)2 | 16 | 12.8 |
| 1232 | (P3N3)2(OC6H5)9(OC6H4OH)(–O–) | 18 | 15.1 |
| 1324 | (P3N3)2(OC6H5)9(OC6H4OH)(OC6H4O) | 14 | 14.0 |
| 1939 | (P3N3)3(OC6H5)13(OC6H4OH)(OC6H4O)2 | 5 | 14.3 |
Остается непонятной причина появления в составе ГАРФ-2 молекул со связью Р–О–Р между двумя фосфазеновыми циклами (соединение m/z = 1232). Видимо, они образуются вследствие побочных реакций гидролиза связи Р–Cl и последующих взаимодействий по схеме:
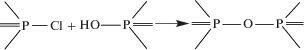
Все синтезированные в настоящей работе ГАРФ – растворимые в ацетоне, ТГФ, хлороформе и ДМСО порошкообразные аморфные вещества с температурой размягчения 80–120°С. Они содержат 11–13% фосфора, являются полностью негорючими веществами и могут быть использованы для модификации органических полимеров с целью повышения их огнестойкости, а также для синтеза фосфазенсодержащих эпоксидных смол и полибензоксазинов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исходные вещества
Гексахлорциклотрифосфазен – белое кристаллическое вещество (Tпл = 113.0°С; спектр ЯМР 31P – синглет с δP = 19.9 м.д.); получали по методике, описанной в работе [7 ] .
Резорцин – белые кристаллы (Tпл = 110.8°С); очищали многократной перекристаллизацией из толуола.
Фенол – белые кристаллы (Тпл = 69°C, Ткип = = 150°C); очищали перегонкой при атмосферном давлении.
Ацетонитрил – сушили прокаленным CaO и перегоняли при атмосферном давлении; Ткип = 81.6°C.
Пиридин – осушали над KOH с добавкой небольшого количества ГХФ и очищали перегонкой при атмосферном давлении; Ткип = 115.6°C.
Циклогексан – сушили прокаленным CaO и перегоняли при атмосферном давлении; Ткип = 80.7°C.
Карбонат калия – белые гигроскопические кристаллы; осушали прокаливанием.
Синтез смешанных гидроксиарилоксициклотрифосфазенов на основе ФХФ-1 и резорцина в смеси пиридина и циклогексана
В круглодонную колбу с обратным холодильником и мешалкой, загружали циклогексан и ФХФ-1; после полного растворения последнего в колбу добавляли раствор резорцина в пиридине. Синтез вели в течение 6 ч при постоянном перемешивании и температуре 90°С. После окончания реакции растворители отгоняли в вакууме на роторном испарителе. Остаток растворяли в ледяной уксусной кислоте, после чего осаждали в 10-кратный избыток воды; выпавший осадок многократно промывали, отфильтровывали и высушивали. Загрузки компонентов и выход продуктов приведены в табл. 5.
Таблица 5.
Загрузка исходных компонентов и выход ГАРФ-1
| Мольное соотношение ФХФ-1 : резорцин | Количество, моль | Объем, мл | Выход ГАРФ-1, % | ||
|---|---|---|---|---|---|
| ФХФ-1 | резорцин | циклогексан | пиридин | ||
| 1 : 5 | 0.0019 | 0.0095 | 15 | 15 | 60 |
| 1 : 6 | 0.0019 | 0.0115 | 0 | 30 | 64 |
| 15 | 15 | 80 | |||
| 20 | 10 | 60 | |||
| 10 | 20 | 78 | |||
| 1 : 8 | 0.0019 | 0.0154 | 15 | 15 | 82 |
| 1 : 10 | 0.0019 | 0.0192 | 25 | 25 | 82 |
| 1 : 12 | 0.0019 | 0.0231 | 15 | 15 | 83 |
| 25 | 25 | 76 | |||
| 1 : 12 | 0.0057 | 0.069 | 30 | 30 | 83 |
Синтез смешанных гидроксиарилоксисодержащих циклотрифосфазенов на основе ФХФ-2 и резорцина в ацетонитриле в присутствии K2CO3
В круглодонную колбу с обратным холодильником и мешалкой загружали ФХФ-2, резорцин и ацетонитрил. В образовавшийся раствор добавляли избыток карбоната калия и при кипении ацетонитрила перемешивали реакционную смесь 10 ч.
По окончании реакции и охлаждения раствор отфильтровывали от солей и отгоняли растворитель на роторном испарителе. К остатку добавляли хлороформ, в котором растворим продукт реакции, но не растворяется избыток резорцина; для растворения последнего добавляли 10-кратное количество воды. После разделения образовавшейся двухфазной системы из органического слоя отгоняли на роторном испарителе хлороформ, а остаток высушивали. Загрузки компонентов и выход продуктов приведены в табл. 6.
МЕТОДЫ ИССЛЕДОВАНИЯ
Спектры ЯМР 31P и ЯМР 1H записывали на приборе “Bruker AM-360” на частотах 146 и 360 МГц соответственно.
Масс-спектрометрический анализ MALDI-TOF осуществляли на приборе “Bruker Auto Flex II”.
Исследование выполнено при финансовой поддержке РХТУ им. Д.И. Менделеева. Проект номер Г-2020-025.
Список литературы
Levchik S.V., Weil E.D. // J. Fire Sci. 2006. № 24. P. 345.
Бригаднов К.А. Дисс. … канд. хим. наук. М.: РХТУ им. Д.И. Менделеева, 2018.
Kireev V.V., Chistyakov E.M., Filatov S.N., Prudskov B.M., Borisov R.S. // Polymer Science B. 2011. V. 53. № 7–8. P. 412.
Сиротин И.С. Дисс. … канд. хим. наук. М.: РХТУ им. Д.И. Менделеева, 2013.
Kireev V.V., Bilichenko Y.V., Borisov R.S., Jianxin Mu, Kuznetsov D.A., Eroshenko A.V., Filatov S.N., Sirotin I.S. // Polymers. 2019. V. 11. № 12. P. 1914.
Bilichenko Y.V., Nguyen D.T., Lobova Y.V., Borisov R.S., Polyakov V.A., Sirotin I.S., Filatov S.N., Kireev V.V. // Polymer Science B. 2019. V. 61. № 3. P. 309.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия Б)


