Высокомолекулярные соединения (серия Б), 2021, T. 63, № 2, стр. 99-104
СИНТЕЗ ПОЛИАМИД-ГРАФТ-ПОЛИОКСАЗОЛИНОВ НА ОСНОВЕ МАКРОИНИЦИАТОРА СУЛЬФОНИЛХЛОРИДНОГО ТИПА
М. П. Курлыкин a, М. М. Дудкина a, А. В. Теньковцев a, *
a Институт высокомолекулярных соединений Российской академии наук
199004 Санкт-Петербург, Большой пр., 31, Россия
* E-mail: tenkovtsev@yandex.ru
Поступила в редакцию 03.06.2020
После доработки 11.08.2020
Принята к публикации 25.08.2020
Аннотация
Предложен синтез полиамидов, содержащих латеральные сульфонилхлоридные группы. Так, представленные полимеры могут служить макроинициаторами для термочувствительных полиоксазолинов. Доказано, что полимеризация на мультисульфохлоридных инициаторах протекает в условиях отсутствия реакции необратимого обрыва и позволяет получать полимеры с относительно узким молекулярно-массовым распределением.
В течение последних лет термочувствительные водорастворимые полимеры вызывают все бóльший интерес у исследователей. Эта тенденция обусловлена широкими перспективами практического применения данных полимеров в различных областях, в частности биотехнологии при адресной доставке лекарств. Опубликованные к настоящему времени работы [1] демонстрируют повышенное внимание к стимул-чувствительным полимерам сложной архитектуры, что позволяет более тонко регулировать температуру их фазовых переходов, а также способность к комплексообразованию. Наибольшие успехи в этом направлении достигнуты в синтезе сферических молекулярных щеток и звездообразных полимеров [2], в то время как термочувствительные привитые сополимеры – цилиндрические молекулярные щетки остаются малоизученными объектами. Более того, информация о получении и изучении стимул-чувствительных привитых сополимеров, содержащих полимеризационные и поликонденсационные цепи, в литературе ограничена. Следует отметить, что такие сополимеры интересны не только с фундаментальной, но и с практической точки зрения, поскольку сочетание в одной макромолекуле сильно различающихся по химической природе компонентов позволяет контролируемо варьировать свойства полимера. Учитывая перспективы использования термочувствительных полимеров в биомедицинских приложениях, здесь особо выделяются поли-2-алкил-2-оксазолины различной природы; для этого класса полимеров доказана биосовместимость и способность (в водных растворах) претерпевать обратимые переходы клубок–глобула при физиологических значениях температуры.
Описанные в литературе методы синтеза поликонденсационно-полимеризационных щеток основаны на получении мультицентровых макроинициаторов, расстояние между инициирующими группами в которых определяется строением основной цепи поликонденсационного полимера [3–6]. При этом важно, что используемые пути синтеза привитых сополимеров уже на стадии макроиницаторов являются многостадийными процессами. Последнее ограничивает возможность их получения в количестве, необходимом для проведения комплексных исследований.
Ранее [7] был предложен новый подход к синтезу полимеризационно-поликонденсационных цилиндрических щеток с полиоксазолиновыми боковыми цепями, основанный на применении различной реакционной способности хлорангидридных и сульфохлоридных групп по отношению к гидроксильной и иминогруппам. Также показана возможность получения макроинициаторов сложноэфирного типа в мультиграммах и использования их без дополнительной очистки для полимеризации оксазолинов, в том числе в условиях однократного синтеза (процесс “one-pot”).
Настоящая работа посвящена развитию этого подхода для синтеза полиамид-графт-полиоксазолинов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для синтеза полимеров использовали 5-хлорсульфонилизофталоилхлорид, полученный по методике [8]; 2-этил-2-оксазолин и 2-изопропил-2-оксазолин [9] перегоняли над гидридом кальция в вакууме; 1,8-диамино-3,6-диокса-октан фирмы “Aldrich” сушили над молекулярными ситами 4А. Растворители абсолютировали по стандартным методикам.
Спектры ЯМР 1Н снимали на приборе “Bruker AC-400” (400 МГц) для растворов в хлороформе. Диализ проводили с применением диализных мешков (“CellaSep”, “Orange Scientific”) c MWCO 3500 D. Значения молекулярных масс и дисперсности определяли на хроматографе “Shimadzu LC-20AD” с колонкой “TSKgel G5000HHR” (5 мкм, 7.8 × 300 мм, “TosohBioscience”), используя детекторы рефрактометрический и по светорассеянию. Подвижной фазой служил раствор LiBr (0.1 моль/л) в ДМФА при 60°C. В качестве стандартов использовали образцы полиэтиленоксида (“Merck”).
Получение поли-1,8-диамино-3,6-диокса-октан- (5'-хлорсульфонил)изофталамида
К раствору 1.48 г (0.01 моля) 1,8-диамино-3,6-диокса-октана (I) в 10 мл N-метилпирролидона, охлажденному до –15°С, при перемешивании в течение 15 мин добавляли 3.01 г (0.01 моля) 5-хлорсульфонилизофталоилхлорида (II). Через 1 ч в реакционную смесь вводили 1 мл окиси пропилена. Смесь перемешивали при комнатной температуре в течение 12 ч, затем полиамид осаждали в эфир. Для очистки полимер непрерывно экстрагировали эфиром в аппарате Сокслета в течение 8 ч, после чего сушили до постоянной массы. Выход продукта – количественный.
Спектр ЯМР 1Н (CDCl3:CF3COOD = 3 : 2; δн, м.д.): 8.52 (2Н, c Ar–Н), 8.46 (2Н, т Ar–Н), 3.63–3.67 (12Н, м, СН2).
Полимеризация 2-этил-2-оксазолина с использованием поли-1,8-диамино- 3,6-диокса-октан-(5'-хлорсульфонил)изофталамида в качестве инициатора
Ампулу с заданным количеством инициатора (⁓200 мг, содержащего ∼0.5 ммоля сульфохлоридных групп), соответствующее количество 2-этил-2-оксазолина (соотношение инициатор : моно-мер = 1 : 50 по функциональным группам) и 3 мл сульфолана нагревали при 100°С в течение 120 ч. Далее ампулу вскрывали, добавляли 50%-ный водный этанол (1 мл) и выдерживали при комнатной температуре одни сутки. Раствор полимера подвергали диализу относительно воды еще в течение 24 ч и лиофильно сушили.
Спектр ЯМР 1Н (CDCl3; δн, м.д.): 8.8–8.6 (шм, Ar–H), 3.5 (шс, NHCH2CH2 + СH2 основной цепи), 2.2–2.6 (шс, СОCH2CH3), 1.89–1.35 (м, СН2), 1.12 (шс, СОCH2CH3).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Как известно, реакционная способность хлорангидридной и сульфохлоридной групп по отношению к нуклеофилам, в частности гидроксильным и аминогруппам, существенно различается. Это позволяет получать сложные полиэфиры с латеральными хлорсульфонильными группами, которые были использованы для синтеза цилиндрических щеток с полиоксазолиновыми боковыми цепями [7]. С целью распространения такого подхода на полимеры с другим строением основной цепи, в данной работе осуществлен синтез аналогичных графт-сополимеров с полиоксазолиновыми боковыми цепями и основной цепью амидного типа.
Как известно [10], при реакции 3-хлорсульфонилбензоилхлорида с аминами в условиях акцепторно-каталитической этерификации, при использовании в качестве акцептора пиридина или триэтиламина, селективно образуются амиды при сохранении сульфохлоридной группы. Однако оказалось, что применение данной методики для синтеза полиамидов, например получение полиамидов из 5-хлорсульфонилизофталоилхлорида и 1,8-диамино-3,6-диокса-октан, приводит к сшитым продуктам.
Этерификация хлорангидридных и сульфонилхлоридных групп в присутствии третичных аминов проходит через образование ациламмониевых производных, обеспечивая более низкие барьеры активации реакции нуклеофильного присоединения по связям С=О и S=O – первой стадии реакции хлорангидридов и сульфонилхлоридов с аминами и спиртами [11] и, очевидно, в значительной степени нивелируя реакционную способность указанных функциональных групп.
Учитывая хорошо известный факт существенного различия в реакционной способности сульфонилхлоридной и хлорангидридной групп в условиях некаталитической этерификации [12], для синтеза полиамида была применена некаталитическая поликонденсация с использованием в качестве акцептора хлористого водорода окиси пропилена [13].
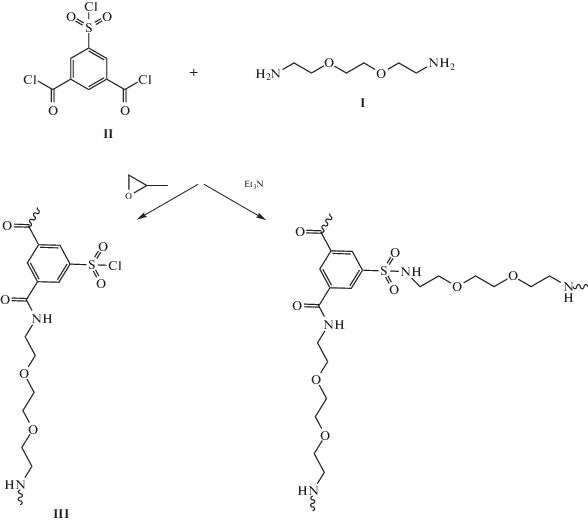
Было установлено, что при реакции эквимолекулярного количества I и II в растворе N-метилпирролидона в присутствии метилоксирана образуется соответствующий полиамид с М = 10 × 103 и дисперсностью Đ = 2.2, что является характерным для безакцепторных поликонденсационных процессов.
Полученный полиамид нерастворим в хлорированных углеводородах, нитросоединениях и нитрилах – типичных растворителях для проведения полимеризации оксазолинов. Известно [14], что дизамещенные амиды, например ДМФА – типичные растворители для полиамидов, могут быть задействованы как растворители и для синтеза полиоксазолинов. Однако наличие в составе макроинициатора групп NHCO, т.е. относительно кислых амидных протонов, теоретически может приводить к обрыву цепи при катионной полимеризации оксазолинов. С целью доказать или опровергнуть это предположение, была осуществлена модельная полимеризация 2-этил-2-оксазолина в ацетонитриле с добавлением 10 мас. % N-этилбензамида при использовании тозилхлорида в качестве инициатора. В параллельных экспериментах показано, что монозамещенные бензамиды не влияют на скорость и молекулярно-массовые характеристики образующихся полиоксазолинов. Вместе с тем, полимеризация 2-этил-2-оксазолина в N-метилпирролидоне с применением в качестве инициатора тозилхлорида не приводит к образованию полиоксазолина, что, очевидно, связано с конкурентной реакцией сульфонилхлорида и N-метилпирролидона, аналогично известной реакции сульфонилхлоридов с ДМФА [15]. Кажущееся противоречие – отсутствие эффекта при добавлении моноалкиламида и ингибирование реакции при использовании диалкиламида – по всей видимости, может быть объяснено влиянием концентрационных эффектов на кинетику конкурирующих реакций сульфонилхлорида с амидами и оксазолинами. В случае наличия в реакционной смеси небольшого количества амида предпочтительным является быстрое взаимодействие сульфохлорида и оксазолина, в то время как при наличии большого избытка диалкиламида преобладающим становится взаимодействие сульфонилхлорида с этим компонентом. В последнем случае инициирование не происходит.
Анализ возможности использования ряда растворителей для проведения прививочной полимеризации оксазолинов на макроинициаторе (III) показал, что реакция наиболее эффективно протекает в растворе сульфолана при температуре 90–110°С:
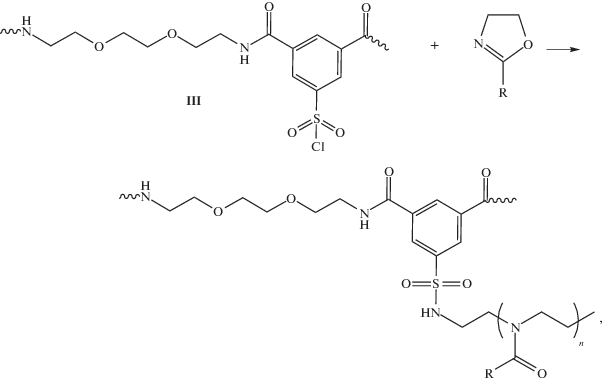
где R = C2H5 (IV), CH(CH3)2 (V).
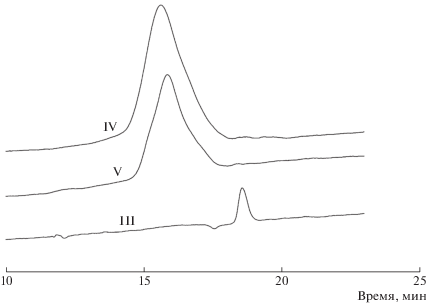
Как следует из данных ГПХ, полученные полимеры отличаются достаточно узкими мономодальными распределениями (рис. 1) и имеют Mw = 1.82 × 105 (IV) и Mw = 1.45 × 105 (V) при Đ = 2.5 для обоих полимеров.
Мономодальность распределения и наличие в спектре ЯМР характерных сигналов как остатка 5-сульфоизофталевой кислоты, так и полиоксазолиновых фрагментов, свидетельствует о полиамид-графт-полиоксазолиновой структуре представленных сополимеров.
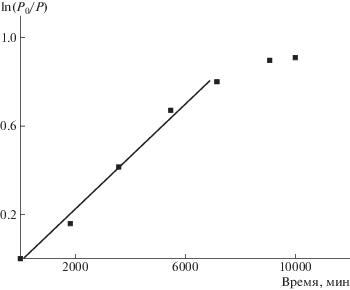
Известно, что сульфонилгалогениды способны инициировать полимеризацию 2-алкил-2-оксазолинов, которая может протекать по механизму “живых” цепей или по механизму “обрыв-реинициирование” [16]. При этом критерием контролируемости процесса полимеризации будет постоянство концентрации активных центров роста при отсутствии необратимого обрыва цепей [17]. Анализ кинетических данных полимеризации 2-этил-2-оксазолина на макроинициаторе показывает, что в описываемом случае рост привитых цепей происходит в режиме “живой” полимеризации до значительных показателей конверсии (рис. 2).
Рис. 2.
Зависимость логарифма обратной конверсии 2-этил-2-оксазолина от времени полимеризации на макроинициаторе III.
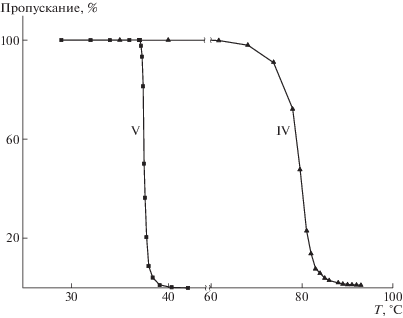
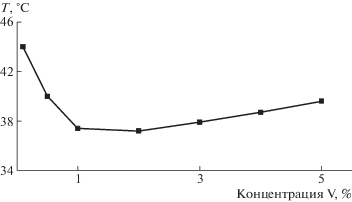
Водные растворы синтезированных полиамид-графт-поли-2-алкил- 2-оксазолинов при повышении температуры претерпевают переход клубок–глобула, сопровождающийся потерей растворимости полимера (рис. 3). Как видно, зависимость температуры фазового перехода от концентрации выражена слабо, однако в случае полимера с олиго-2-изопропил-2-оксазолиновыми боковыми фрагментами в широком диапазоне концентрации (0.5–5.0%) такая зависимость проявляется в области “физиологических” значений температуры (рис. 4).
Возможность получения аналогичных полимеров с использованием диаминов другой структуры (алифатических, ароматических), а также влияние строения основной цепи на термочувствительность графт-сополимеров – предмет дальнейших исследований.
Работа выполнена при финансовой поддержке гранта Правительства Российской Федерации для государственной поддержки научных исследований, проводимых под руководством ведущих ученых (договор № 14.W03.31.0022).
Список литературы
Qiu N., Li Y., Wang H., Duan Q., Kakuchi T. // RSC Advances. 2016. V. 6. P. 47912.
Ren J.M., McKenzie T.G., Fu Q., Wong E.H.H. // Chem. Rev. 2016. V. 116. № 12. P. 6743.
Bao H., Li L., Huat Gang L. // Macromolecules. 2010. V. 43. P. 5679.
Kurlykin M., Bursian A., Filippov A., Dudkina M., Tenkovtsev A. // Macromol. Symp. 2017. V. 375. P. 1600162.
Ivanov I.V., Meleshko T.K., Kahina A.V., Yakimansky A.V. // Russ. Chem. Rev. 2019. V. 88. № 12. P. 1248.
Ates S., Tatar-Guner P., Yagci Y., Demirel A.L. // Des. Mon. Polym. 2013. V. 16. № 2. P. 137.
Razina A.B., Ten’kovtsev A.V. // Polymer Science B. 2019. V. 61. № 5. P. 589.
Navarro R., Perrino M., Gómez M., Reinecke H. // Macromolecules. 2010. V. 43. P. 2377.
Witte H., Seeliger W. // Lieb. Ann. 1974. № 6. P. 996.
Tarasov A.V., Moskvichev Yu.A., Timoshenko G.N., Frolova O.B., Kozlova O.S. // Russ. J. Org. Chem. 2000. V. 36. № 1. P. 69.
Carey F.A., Sundberg R.J. // Advanced Organic Chemistry. Part A: Structure and Mechanisms. New York: Plenum Press, 2007.
Comprehensive Organic Chemistry: the Synthesis and Reactions of Organic Compounds. Sulphur, Selenium, Silicon, Boron, Organometallic Compounds / Eds by D. Barton, D.N. Jones, W.D. Ollis. New York: Pergamon Press, 1979. V. 3.
Liou G., Maruyama M., Kakimoto M.-A., Imai Y. // J. Polym. Sci. A. 1998. V. 36. P. 2029.
Kagiya T., Matsuda T., Hirata R. // J. Macromol. Sci. A. 1972. V. 6. № 3. P. 451
Hall H.K. jr. // J. Am. Chem. Soc. 1956. V. 78. № 5. P. 2717.
Fijten M.W.M., Hoogenboom R., Schubert U.S. // J. Polym. Sci. A. 2008. V. 46. P. 4804.
Glassner M., Vergaelen M., Hoogenboom R. // Polym. Int. 2018. V. 67. P. 32.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия Б)