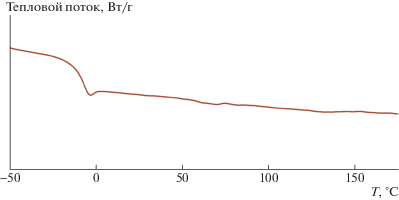Высокомолекулярные соединения (серия Б), 2021, T. 63, № 2, стр. 105-111
СИНТЕЗ И МЕТАТЕЗИСНАЯ ПОЛИМЕРИЗАЦИЯ 5-(ТРИЭТИЛСИЛОКСИМЕТИЛ)НОРБОРНЕНА
Ф. А. Андреянов a, Д. А. Алентьев a, b, *, М. В. Бермешев a
a Институт нефтехимического синтеза им. А.В. Топчиева Российской академии наук
119991 Москва, Ленинский пр., 29, Россия
b Российский химико-технологический университет им. Д.И. Менделеева
125047 Москва, Миусская пл., 9, Россия
* E-mail: d.alentiev@ips.ac.ru
Поступила в редакцию 14.08.2020
После доработки 26.08.2020
Принята к публикации 01.09.2020
Аннотация
На примере синтеза 5-(триэтилсилоксиметил)норборнена предложен простой одностадийный подход к синтезу кремнийзамещенных норборненов, основанный на реакции (5-норборнен-2-ил)метанола с гидросиланами. Изучена метатезисная полимеризация синтезированного мономера. Полученный в результате полимер является высокомолекулярным, растворимым, некристаллическим, высокоэластическим и термически стабильным.
ВВЕДЕНИЕ
Кремнийзамещенные полинорборнены представляют большой интерес как потенциальные материалы для газоразделительных мембран. Так, в последнее десятилетие был получен ряд высокопроницаемых полинорборненов, содержащих в боковой цепи триметилсилильные группы [1]. В недавних работах было показано, что наличие фрагментов Si–O–C в боковой цепи полинорборненов способствует сочетанию умеренного уровня газопроницаемости, высокой селективности разделения α газов CO2/N2, стабильности газотранспортных свойств во времени [2–6]:
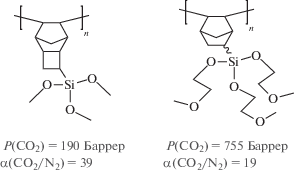
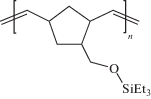
Несмотря на привлекательные свойства упомянутых выше полимеров, исходные мономеры для их получения трудоемки в синтезе. Например, синтез замещенных политрициклононенов является многостадийным и требует наличие коммерчески недоступного квадрициклана [7]. Реакция Дильса–Альдера, применяемая для синтеза замещенных норборненов, протекает с невысоким выходом и приводит к смеси экзо- и эндо-изомеров. Исходя из сказанного, требуется развитие новых, более простых подходов к синтезу кремнийзамещенных мономеров норборненового ряда. Одним из таких подходов является реакция (5-норборнен-2-ил)метанола с гидросиланами, приводящая к образованию его силиловых эфиров [8]. Этот подход обладает несколькими важными преимуществами. Во-первых, исходный (5-норборнен-2-ил)метанол коммерчески доступен. Во-вторых, использование гидросиланов различной природы может позволить в одну стадию получить широкий круг кремнийсодержащих мономеров норборненового ряда. В-третьих, вне зависимости от природы кремнийорганической группы, получаемые мономеры содержат фрагмент Si–O–C, способствующий интересным газотранспортным свойствам. В настоящей работе указанный подход применен для синтеза 5-(триэтилсилоксиметил) норборнена (NBMeOSiEt3) и исследована его метатезисная полимеризация.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы и методы
Хлористый метилен кипятили над CaH2 5 ч и перегоняли в аргоне. Толуол кипятили над натрием 4 ч и перегоняли в аргоне. Триэтилсилан и (5-норборнен-2-ил) метанол (“Aldrich”) сушили над CaH2 и перегоняли в аргоне. Сухой этанол, тетрагидрофуран, трис-(пентафторфенил)боран, катализатор Граббса первого поколения, винилэтиловый эфир, 2,2'-метилен-бис-(6-трет-бутил-4-метилфенол) (“Aldrich”) использовали без дополнительной очистки.
Метатезисную полимеризацию проводили в атмосфере аргона в главбоксе “MBraun”.
Спектры ЯМР регистрировали на спектрометре “Avance 600” (“Bruker”, США), на рабочих частотах 600, 150 и 119 МГц соответственно для спектров ЯМР 1H, ЯМР 13C и ЯМР 29Si. Растворители – CDCl3 и C6D6. Сигналы в спектрах ЯМР 1H относили по остаточным протонам в CDCl3 (7.24 м.д.), в спектрах ЯМР 13С – по центральному пику CDCl3 (77.00 м.д.) и C6D6 (128.39 м.д.), в спектрах ЯМР 29Si – по внутренним настройкам спектрометра, соответствующим тетраметилсилану (0 м.д.).
Хромато-масс-спектрометрический анализ осуществляли с использованием газо-хромато-масс-спектрометра “Finnigan MAT 95 XL”, энергия ионизации 70 эВ, диапазон масс 20–800, разрешение 1000, температура источника 200°C, скорость сканирования 1 с/декада масс, хроматограф HP 6890+, капиллярная колонка 30 м × 0.25 мм с фазой DB-5 (ПДМС, содержащий 5% фенильных групп), газ-носитель – гелий (деление потока 1:30), программирование температуры: скорость подъема температуры 5 град/мин от 30 до 120°C, 10 град/мин до 270°C и выдержка при 270°C в течение 10 мин.
Молекулярную массу оценивали методом ГПХ на хроматографе “Agilent 1260 Infinity II” (“Agilent”, США) с тройным детектированием (светорассеяние, рефрактометрия, вискозиметрия). Колонки: PLgel 10 μm MiniMIX-B, размер 250 мм × 4.6 мм (3 колонки последовательно). Растворитель – ТГФ, объем пробы 50 мкл, концентрация полимера в пробе 1 мг/мл. Калибровку проводили по ПС-стандартам, M = (1 × 103)–(9 × 106). Молекулярно-массовые характеристики рассчитывали по калибровочной зависимости, которая была линейной в диапазоне (1 × 103)–(9 × 106).
Калориметрические измерения выполняли на дифференциальном сканирующем калориметре “TA-4000” (“Mettler Toledo”, США) с ячейкой DSC-30 при скорости нагревания 20 град/мин в атмосфере аргона. Термогравиметрический анализ проводили на синхронном термоанализаторе “TGA/DSC 1” (“Mettler Toledo”) в атмосфере аргона и на воздухе при скорости нагревания 10 град/мин в диапазоне температур 30–1000°C.
Рентгенофазовый анализ выполняли с использованием детектора ASX (“Bruker”, США) и CuKα-излучения (длина волны λ = 1.54 Å).
Плотность полимера определяли на пикнометре “Ultrapyc 1200e”. Рабочий газ – гелий, объем измерительной ячейки 1.8 см3.
Синтез мономера NBMeOSiEt3
В предварительно завакуумированную и заполненную аргоном колбу в токе аргона помещали (5-норборнен-2-ил)метанол (10.0 г, 8.05 × 10–2 моль, 1 эквивалент), триэтилсилан (18.6 г, 0.160 моля, 2.0 эквивалента). Затем в колбу добавляли раствор B(C6F5)3 (0.173 г, 3.38 × 10–4 моль, 0.04 эквивалента) в абсолютном CH2Cl2 (25 мл) и перемешивали реакционную смесь в атмосфере аргона при комнатной температуре в течение 24 ч. Затем из реакционной смеси в вакууме (1 мм рт.ст.) при комнатной температуре отгоняли легколетучие фракции. Остаток переконденсировали в вакууме (0.1 мм рт.ст.). Выход 17.4 г (90%). Соотношение изомеров: 89% эндо-изомера, 11% экзо-изомера.
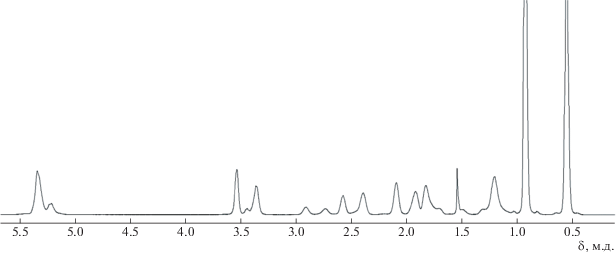
ЯМР 1H (CDCl3, δ, м.д.): 6.14–6.00 (м., 1.2H, C(2, 3)H), 5.97–5.87 (м., 0.8H, C(2, 3)H), 3.72–3.65 (м., 0.2H, CH2–O), 3.50–3.42 (м., 0.2H, CH2–O), 3.39–3.30 (м., 0.8H, CH2–O), 3.20–3.08 (м., 0.8H, CH2–O), 2.96–2.86 (м., 0.8H, C(1, 4)H), 2.81–2.69 (м., 1.2H, C(1, 4)H), 2.30–2.20 (м., 0.8H), 1.82–1.71 (м., 1H), 1.62–1.54 (м., 0.2H), 1.46–1.36 (м., 1H), 1.28–1.16 (м., 1H), 1.03–0.87 (м., 9H, Si–CH2–CH3), 0.66–0.49 (м., 6H, Si–CH2–CH3) 0.44 (м., 1H, C(6)Hэндо).
ЯМР 13C (эндо-изомер NBMeOSiEt3, CDCl3, δ, м.д.): 137.12 (C(2, 3)), 132.48 (C(2, 3)), 66.30 (CH2–O), 49.40, 43.67, 42.21, 41.67, 28.82, 6.79 (Si–CH2–CH3), 4.40 (Si–CH2–CH3).
ЯМР 13C (экзо-изомер NBMeOSiEt3, CDCl3, δ, м.д.): 136.76 (C(2, 3)), 136.69 (C(2, 3)), 67.25 (CH2–O), 44.80, 43.35, 41.70, 41.58, 29.39, 6.46 (Si–CH2–CH3), 4.50 (Si–CH2–CH3).
ЯМР 29Si (эндо-изомер NBMeOSiEt3, CDCl3, δ, м.д.): 17.90.
Масс-спектр (ионизация электронным ударом, экзо/эндо-изомер): 238 (М+, 2%/8%), 209 (NBCH2OSiEt$_{2}^{ + }$, 13%/17%), 181 (NBCH2OSiEt+, 4%/32%), 115 (SiEt$_{3}^{ + }$, 80%/55%), 103 (OSiHEt$_{2}^{ + }$, 79%/100%), 87 (SiHEt$_{2}^{ + }$, 51%/45%), 66 (CPD+, 100%/75%).
Метатезисная полимеризация NBMeOSiEt3
Раствор катализатора Граббса первого поколения (3.0 × 10–3 моль/л) в абсолютном толуоле готовили непосредственно перед полимеризацией. Для этого в виале растворяли 3.20 × 10–3 г катализатора в 1.30 мл абсолютного толуола. В виалу, снабженную магнитной мешалкой, помещали 0.70 г NBMeOSiEt3 (2.94 × 10–3 моль), 0.200 мл толуола и добавляли 0.979 мл раствора Граббса первого поколения (2.94 × 10–6 моль). Перемешивание продолжали в течение 2.5 ч, затем добавляли 2 мл толуола в связи с затруднением перемешивания при увеличении вязкости раствора. Через 3.5 ч после добавления инициатора полимеризации реакцию останавливали добавлением винилэтилового эфира, реакционную смесь дополнительно перемешивали 10 мин. Полимер осаждали в сухой этанол, содержащий ингибитор окисления (2.2'-метилен-бис-(6-трет-бутил-4-метилфенол)). Затем полимер отделяли, промывали 3 раза сухим этанолом и сушили в вакууме. Полимер дважды переосаждали из толуола в сухой этанол и сушили в вакууме при 40°C до постоянной массы. Выход: 0.64 г (92%). Mw = 1.0 × 106, Ð = 4.5, Tс = –9°C, ρ = 0.982 г/см3.
ЯМР 1H (CDCl3, δ, м.д.): 5.44–5.12 (м., 2H, C=CH), 3.61–3.28 (м., 2H, CH2–O), 2.96–2.31 (м., 2H, C=CH–CH), 2.18–1.62 (м., 3H), 1.36–1.04 (м., 2H), 1.05 (м., 9H), 0.67 (м., 6H).
ЯМР 13C (C6D6, δ, м.д.): 135.53 (С=С), 134.00 (С=С), 66.11–64.67 (CH2–O), 47.09–45.18, 44.02–40.16, 38.91–36.40, 7.62 (Si–CH2–CH3), 5.35 (Si–CH2–CH3).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Синтез мономера
Синтез NBMeOSiEt3 осуществляли на основе описанной ранее методики синтеза силиловых эфиров из спиртов [9]. Реакцию проводили в одну стадию, путем взаимодействия (5-норборнен-2-ил)метанола с триэтилсиланом в присутствии каталитических количеств B(C6F5)3 с использованием хлористого метилена в качестве растворителя.
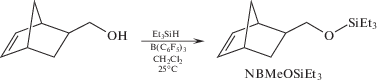
Степень прохождения реакции контролировали с помощью газожидкостной хроматографии. При комнатной температуре в течение 1 суток реакция приводила к образованию целевого мономера с высоким выходом (90%). Строение и чистота полученного продукта была подтверждена с помощью спектроскопии ЯМР на ядрах 1H и 13C.
Таким образом, на примере синтеза NBMeOSiEt3 продемонстрирована возможность получения кремнийзамещенных норборненов в одну стадию из коммерчески доступного (5-норборнен-2-ил)-метанола. Дальнейшее развитие этого подхода позволит простым путем получать широкий круг кремнийзамещенных норборненов с целью систематического изучения взаимосвязей между строением полимеров и их физико-химическими свойствами.
Метатезисная полимеризация
Синтезированный мономер (NBMeOSiEt3) был успешно вовлечен в метатезисную полимеризацию в присутствии катализатора Граббса первого поколения:
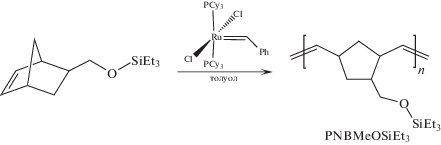
Полимеризация была проведена в различных условиях (концентрация мономера в реакционной смеси, молярное соотношение мономер : катализатор). Полученные данные (табл. 1) свидетельствуют о том, что изменение соотношения мономер : катализатор при низкой концентрации мономера существенно не сказывается на выходе и молекулярно-массовых характеристиках полимера. Увеличение концентрации мономера в реакционной смеси приводит к увеличению молекулярной массы. При этом возрастает как Mw и Mn, так и Ð. Однако при высоких соотношениях мономер/катализатор в этом случае наблюдается снижение выхода полимера. Таким образом, оптимальными условиями полимеризации NBMeOSiEt3, при которых высокомолекулярный полимер образуется с высоким выходом, но остается растворимым, являются соотношение мономер : катализатор = 1000 : 1, концентрация мономера в реакционной смеси 1.0 моль/л.
Таблица 1.
Метатезисная полимеризация NBMeOSiEt3
| Соотношение мономер : : катализатор | C,* моль/л | Выход, % | Mw × 10–3 | Mn × 10–3 | Ð |
|---|---|---|---|---|---|
| 1000 : 1 | 0.5 | 52 | 210 | 100 | 2.1 |
| 1000 : 1 | 1.0 | 62 | 400 | 130 | 3.2 |
| 1000 : 1 | 1.5 | 92 | 1000 | 230 | 4.5 |
| 3000 : 1 | 1.0 | 58 | 710 | 200 | 3.6 |
| 5000 : 1 | 1.0 | 46 | 610 | 180 | 3.4 |
Структуру образовавшегося полимера (PNBMeOSiEt3) подтверждали методом ЯМР-спектроскопии (рис. 1). Сигнал при 5.2–5.4 м.д. свидетельствует о том, что образовался ненасыщенный полимер. Наличие сигналов при 0.8–1.0 м.д. и 0.5–0.6 м.д. указывает на то, что в полимере присутствует триэтилсилильная группа.
Физико-химические свойства синтезированного полимера
Как и другие кремнийзамещенные полинорборнены, синтезированный PNBMeOSiEt3 оказался растворим в неполярных и малополярных органических растворителях и не растворим в спиртах и апротонных диполярных растворителях (табл. 2).
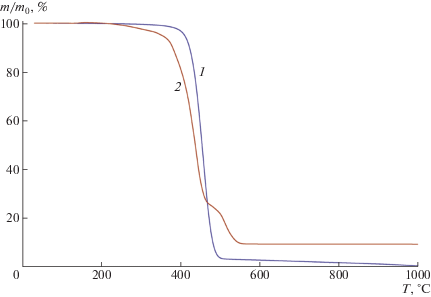
Для PNBMeOSiEt3 была обнаружена высокая термическая стабильность. По данным ТГА (рис. 2), его температура разложения (5% потери массы) составила 410°C в атмосфере аргона и 350°C на воздухе, что сопоставимо с термической стабильностью метатезисных полинорборненов, содержащих фторорганические заместители [11]. Необходимо отметить, что при нагревании в атмосфере аргона полимер разлагается практически без остатка, тогда как при нагревании на воздухе масса остатка не изменяется при температурах выше 600°C и составляет ~10 мас. %. По-видимому, продуктом разложения триэтилсилокси-группы в инертной атмосфере является летучий гексаэтилдисилоксан, тогда как на воздухе часть кремнийсодержащих групп (40–50%) окисляется до SiO2.
Синтезированный полимер оказался высокоэластическим, его температура стеклования составила –9°C (рис. 3), что значительно ниже, чем для родственного полимера с триметилсилильными группами (табл. 3). Это связано с эффектом самопластификации полимера этильными группами при атоме кремния.
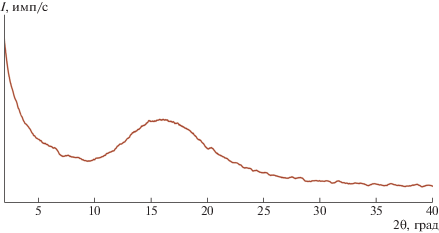
По данным рентгенофазового анализа, синтезированный полимер был некристаллическим. Его дифрактограмма имеет вид, характерный для метатезисных полимеров, и представлена одним широким пиком (рис. 4). Положение максимума этого пика и соответствующее ему расстояние, вычисленное по уравнению Вульфа–Брэгга, близки к соответствующим параметрам для полинорборнена, содержащего в боковой цепи триметилсилильные группы, жестко связанные с циклическими фрагментами основной цепи (табл. 3).
Доля свободного объема в PNBMeOSiEt3 составила 16%, что сопоставимо со значением, полученным для незамещенного метатезисного полинорборнена, и меньше значения, полученного для метатезисного полинорборнена, содержащего триметилсилильные группы в боковой цепи (табл. 3).
ЗАКЛЮЧЕНИЕ
Таким образом, в настоящей работе предложен простой одностадийный подход к синтезу кремнийзамещенных мономеров норборненового ряда, основанный на реакции коммерчески доступного (5-норборнен-2-ил)метанола с гидросиланами. С применением этого подхода синтезирован 5-(триэтилсилоксиметил) норборнен. Полученный мономер активен в метатезисной полимеризации. Найдены оптимальные условия полимеризации, при которых высокомолекулярные продукты образуются с высоким выходом. Синтезированный полимер является некристаллическим, высокоэластическим, термически стабильным.
Изучение полимеризации (5-норборнен-2-ил) метанола выполнено в рамках Государственного задания ИНХС РАН.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (код проекта 19-33-60035).
Список литературы
Finkelshtein E., Gringolts M., Bermeshev M., Chapala P. // Membrane Materials for Gas and Vapor Separation/ Ed. by Yu. Yampolskii, E. Finkelshtein. Chichester: Wiley, 2017. P. 143.
Alentiev D.A., Egorova E.S., Bermeshev M.V., Starannikova L.E., Topchiy M.A., Asachenko A.F., Gribanov P.S., Nechaev M.S., Yampolskii Yu.P., Finkelshtein E.Sh. // J. Mater. Chem. A. 2018. V. 6. P. 19393.
Maroon C.R., Townsend J., Gmernicki K.R., Harrigan D.J., Sundell B.J., Lawrence J.A., Mahurin S.M., Vogiatzis K.D., Long B.K. // Macromolecules. 2019. V. 52. P. 1589.
Belov N., Nikiforov R., Starannikova L., Gmernicki K.R., Maroon C.R., Long B.K., Shantarovich V., Yampolskii Yu. // Eur. Polym. J. 2017. V. 93. P. 602.
Gmernicki K.R., Hong E., Maroon C.R., Mahurin S.M., Sokolov A.P., Saito T., Long B.K. // ACS Macro Lett. 2016. V. 5. P. 879.
Maroon C.R., Townsend J., Higgins M.A., Harrigan D.J., Sundell B.J., Lawrence J.A., O’Brien J.T., O’Neal D., Vogiatzis K.D., Long B.K. // J. Membr. Sci. 2020. V. 595. P. 117532.
Wozniak A.I., Bermesheva E.V., Andreyanov F.A., Bori-sov I.L., Zarezin D.P., Bakhtin D.S., Gavrilova N.N., Ilyasov I.R., Nechaev M.S., Asachenko A.F., Topchiy M.A., Volkov A.V., Finkelshtein E.Sh., Ren X.-K., Bermeshev M.V. // React. Funct. Polym. 2020. V. 149. P. 104513.
Horner L., Mathias J. // J. Organomet. Chem. 1985. V. 282. № 2. P. 155.
Blackwell J.M., Foster K.L., Beck V.H., Piers W.E. // J. Org. Chem. 1999. V. 64. № 13. P. 4887.
Karpov G.O., Alentiev D.A., Wozniak A.I., Bermesheva E.V., Lounev I.V., Gusev Yu.A., Shantarovich V.P., Bermeshev M.V. // Polymer. 2020. V. 203. P. 122759.
Karpov G.O., Bermeshev M.V., Borisov I.L., Sterlin S.R., Tyutyunov A.A., Yevlampieva N.P., Bulgakov B.A., Volkov V.V., Finkelshtein E.Sh. // Polymer. 2018. V. 153. P. 626.
Belov N.A., Gringolts M.L., Morontsev A.A., Starannikova L.E., Yampol’skii Yu.P., Finkel’stein E.Sh. // Polymer Science B. 2017. V. 59. № 5. P. 560.
Gringolts M.L., Bermeshev M.V., Starannikova L.E., Rogan Yu.V., Yampol’skii Yu.P., Finkel’shtein E.Sh. // Polymer Science A. 2009. V. 51. № 11–12. P. 1233.
Matteucci S., Yampolskii Yu., Freeman B.D., Pinnau I. // Materials Science of Membranes for Gas and Vapor Separation/ Ed. by Yu. Yampolskii, I. Pinnau, B. Freeman. Chichester: Wiley, 2006. P. 1.
Askadskii A.A. // Computational Materials Science of Polymers. Cambridge: Cambridge Int. Sci. Publ. Ltd., 2003. P. 16.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия Б)