Высокомолекулярные соединения (серия Б), 2021, T. 63, № 3, стр. 183-189
ВЛИЯНИЕ МОДИФИКАЦИИ ГЕЛЬ-ПЛЕНКИ БАКТЕРИАЛЬНОЙ ЦЕЛЛЮЛОЗЫ НА ЕЕ МЕХАНИЧЕСКИЕ СВОЙСТВА И СПОСОБНОСТЬ КОВАЛЕНТНО СВЯЗЫВАТЬ ФЕРМЕНТЫ
Д. А. Кадималиев a, *, А. А. Девятаева a, И. П. Грунюшкин a, А. Н. Малафеев a, В. В. Ревин a
a Мордовский государственный университет им. Н.П. Огарева
430019 Саранск, ул. Ульянова, 26Б, Россия
* E-mail: cadimded@yandex.ru
Поступила в редакцию 13.10.2020
После доработки 23.12.2020
Принята к публикации 06.01.2021
Аннотация
Оптимизированы правила модификации гель-пленки бактериальной целлюлозы без нарушения ее пленочной структуры. Методом ИК-фурье-спектроскопии и титрования показано, что окисление периодатом натрия позволяет получить диальдегидпроизводные гель-пленки с различным количеством альдегидных групп. Подобраны условия иммобилизации ферментов пепсина и β-галактозидазы на модифицированные гель-пленки. Анализ ИК-спектров продемонстрировал, что ферменты удерживаются на гель-пленке за счет образующихся азометиновых связей между аминогруппами белка и альдегидными группами пленки. Эффективность иммобилизации зависит от вида фермента и условий проведения реакции привития; при одних и тех же условиях гель-пленка связывала больше β-галактозидазы, чем пепсина.
Современные знания о патогенезе раневого процесса определяют необходимость применения различных видов перевязочных материалов, среди которых текстильные, пленочные, пены, гидрогелевые, гидроколлоидные, импрегнированные покрытия [1, 2]. Такие материалы должны соответствовать целому ряду свойств: дренирование поверхности, создание и сохранение определенной величины влажности и воздухопроницаемости, предохранение от контаминации, отсутствие адгезии к раневой поверхности [3].
Главная роль в осуществлении перечисленных функций перевязочного средства принадлежит полимерной матрице, на которой фиксируют методами иммобилизации медикаментозные средства. Способ иммобилизации фермента и выбор полимера–носителя в первую очередь должны определяться особенностями эксплуатации раневых покрытий. В связи с доступностью и дешевизной в качестве матрицы многие исследователи продолжают использовать текстильные ткани, прежде всего медицинскую марлю [4–7]. Однако высокая степень адгезии к ране, болезненность при снятии, образование благоприятной среды для развития гнойных процессов требуют создания нового поколения полимерных и нанокомпозиционных материалов.
Наиболее подходящим материалом для этих целей являются полимеры, в частности целлюлоза. На сегодняшний день, исследованиям свойств нативной целлюлозы, подбором условий ее обработки с целью изготовления биомедицинских материалов на ее основе уделено большое внимание [8–15].
Широкий интерес к материалам на основе растительной целлюлозы оправдан их способностью к биологическому разложению, биосовместимостью, хорошими механическими свойствами, доступностью, устойчивостью и низкой цитотоксичностью [16–18]. Однако получение матриц из растительной целлюлозы для иммобилизации лекарственных препаратов довольно сложный процесс.
Вместе с тем некоторые бактерии, в частности Gluconacetobacter sucrofermentans, способны при культивировании в статических условиях образовывать целлюлозную гель-пленку, которую можно использовать для различных материалов медицинского назначения [19–21]. Однако из-за отсутствия реакционно-способных групп, гель-пленка бактериальной целлюлозы не способна прочно удерживать лекарственные препараты, в том числе протеолитические ферменты.
В качестве окислителя гель-пленки бактериальной целлюлозы в работе использовали периодат натрия, который активно применяют на практике. Периодатное окисление целлюлозы характеризуется специфическим расщеплением связи С2–С3 глюкопиранозного кольца, в результате чего образуются две альдегидные группы на элементарное звено. Альдегидные группы целлюлозы, вводимые окислением, могут адсорбировать или связывать вещества, содержащие аминогруппы (например, аминокислоты, белки, ферменты и т.д.) [22, 23].
Цель настоящей работы – подбор условий и получение модифицированной гель-пленки бактериальной целлюлозы без нарушения структуры, а также иммобилизация пепсина и β-галактозидазы на синтезированную матрицу ковалентной сшивкой.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Гель-пленку бактериальной целлюлозы (ГПБЦ) получали культивированием Gluconacetobacter sucrofermentans ВКПМ-11267 в стационарных условиях при комнатной температуре в течение семи суток в среде Хестрина–Шрамма [17, 19].
Количество образовавшейся бактериальной целлюлозы определяли весовым методом. Для этого предварительно отмытую целлюлозу помещали на полиэтиленовую пленку и оставляли до высыхания при комнатной температуре, после чего переносили ее в сушильный шкаф и выдерживали при температуре 50°С. Высушивание и взвешивание повторяли до тех пор, пока масса полисахарида не достигала постоянного значения, т.е. колебание массы не превышало значения ±0.0001 г [24].
Окисленную гель-пленку бактериальной целлюлозы получали следующим образом. В склянку из темного стекла с притертой пробкой помещали 0.1 г (0.06 моля) ГПБЦ и заливали 20 мл водного раствора NaIO4. Взбалтывали и оставляли в темном месте при температуре от 16 до 20°С.
Затем окисленную ГПБЦ последовательно промывали дистиллированной водой, подкисленной до рН 1, смесью ацетон : вода (1 : 8), ацетоном и несколько раз дистиллированной водой до рН промывных вод ~5.0–5.5. Высушивали окисленную ГПБЦ до постоянной массы при температуре 50°С [25, 26].
Определение образовавшихся альдегидных групп после модификации осуществляли с помощью йодометрического метода. Для этого в коническую колбу с притертой пробкой помещали 10 мл раствора Буры и 20 мл раствора йода. Затем быстро добавляли 0.1 г целлюлозы и закрывали пробкой. Раствор с целлюлозой выдерживали 6 ч при температуре 25°С в термостате, периодически перемешивая. Через 6 ч в колбу добавляли 15 мл 0.1 н. раствора соляной кислоты, избыток йода оттитровывали раствором тиосульфата натрия, прибавляя в конце титрования 2–3 мл раствора крахмала.
Содержание CHO-групп $\overline{\overline x} $ вычисляли по формуле:
Эффективность модификации и количество образовавшихся альдегидных групп определяли химическим методом и методом ИК-спектроскопии.
Прочность и растяжение образцов гель-пленки выполняли на универсальной испытательной машине “XLW”, толщину на толщиномере “CHY–C2”, в соответствии со стандартами ISO 4593, ГОСТ 17035-86, ГОСТ 7855-84(ASTM D645).
Анализируемые образцы в виде полупрозрачных пленок предварительно высушивали, а затем регистрировали спектры поглощения на ИК-фурье-спектрометре “IRPrestige-21” в спектральном диапазоне 450–4500 1/см с шагом 4. Обработку полученных данных проводили при помощи программы “OriginPro2015”.
Количество белка устанавливали по методу Бредфорда по калибровочному графику с сывороточным белком [28].
Иммобилизацию фермента осуществляли следующим образом. 1 мл раствора фермента – пепсина (Pepsin, “Acrosorganics” >= 0.5 Ph. Eur. U/mg) или β-галактозидазы (β-Galactosidase, FromAspergillusoryzae, 9.9 units, “Sigma”) в фосфатном буфере с рН 7.0 при концентрации от 0.01 до 0.10 мг/мл белка наносили на кусок исходной и модифицированной ГПБЦ размером 2.5 × 4.0 см (0.027 ± ± 0.002 г) и толщиной 43–46 мкм в чашке Петри и оставляли при 4°С до высыхания. Для удаления не связавшихся или слабосвязанных ферментов пленки промывали до отсутствия белка в промывных водах. Количество связавшегося с гель-пленкой фермента рассчитывали по разнице между количеством внесенного фермента и его количеством в промывных водах. Образование связей между ферментом и гель-пленкой регистрировали методом ИК-фурье- спектрометрии.
О наличии протеолитической активности и стабильности гель-пленки с пепсином судили по коагуляции молока, а β-галактозидазы – по превращению хромогенного субстрата (5-Bromo-4-chloro-3-indoxyl-β-D-Galactopyranoside, “Sigma”). Субстрат разводили в фосфатном буфере (рН 7) 1 : 1. Несколько капель субстрата наносили на пленку, о присутствии пепсина судили по появлению синей окраски. В случае β-галактозидазы от субстрата отщепляется индольная структура, которая спонтанно окисляется и выпадает в виде осадка синего цвета. Это свойство широко используют в молекулярной и клеточной биологии.
Все эксперименты повторяли пятикратно, результаты обрабатывали статистически.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Полученный продукт представлял собой гель-пленку желтоватого цвета (после очистки от остатков питательной среды и избытка клеток гель-пленка становилась белого цвета) толщиной от 43.0 до 46.6 мкм, поверхность пленки была гладкая, равномерная без уплотнений (рис. 1а). Гель-пленка бактериальной целлюлозы – это полимер, состоящий из остатков D-глюкозы, соединенных между собой β-1,4-гликозидными связями (соотношение сухой полимер : вода около 1 : 100). Гель-пленка – чистый внеклеточный продукт, не содержит лигнина, смол, жиров, восков и не требует отбеливания. ГПБЦ не загрязняет окружающую среду, способна к биоразложению и абсолютна нетоксична. Молекулы бактериальной целлюлозы располагаются строго параллельно друг другу и образуют кристаллические микрофибриллы в 100 раз тоньше микрофибрилл растительной целлюлозы [17, 19, 24].
Рис. 1.
Внешний вид гель-пленок исходной промытой (а) и после выдержки в 0.5 н. растворе NaIO4 в течение 3 (б), 6 (в) и 24 ч (г).

Исследования показали, что количество образующихся альдегидных групп в модифицированной гель-пленке зависит от времени выдержки и концентрации окислителя (табл. 1). Наибольшее количество альдегидных групп содержали образцы со временем выдержки 24 ч в растворах периодата натрия с концентрацией 0.2 и 0.5 н.
Таблица 1.
Содержание альдегидных групп в зависимости от времени выдержки в модификаторе и его концентрации
| Время выдержки, ч | Концентрация NaIO4, Н | Толщина пленки, мкм | Содержание альдегидных групп, % |
|---|---|---|---|
| 3 | 0.1 | 45.1 ± 1.8 | 9.4 |
| 0.2 | 33.2 ± 1.5 | 11.1 | |
| 0.5 | 32.7 ± 1.4 | 18.5 | |
| 6 | 0.1 | 39.6 ± 2.7 | 14.4 |
| 0.2 | 34.9 ± 1.6 | 18.3 | |
| 0.5 | 35.3 ± 1.9 | 22.0 | |
| 24 | 0.1 | 30.5 ± 1.2 | 16.6 |
| 0.2 | 27.8 ± 1.8 | 21.6 | |
| 0.5 | 27.2 ± 1.6 | 22.6 | |
| Контроль | – | 44.8 ± 1.8 | 3.0 |
Количество альдегидных групп в модифицированной целлюлозе было установлено при помощи йодометрического метода. Из табл. 1 видно, что увеличение времени выдержки и концентрации окислителя приводит к повышению содержания альдегидных групп.
Результаты табл. 2 свидетельствуют о том, что прочность всех образцов при окислении понижается. Значительное уменьшение прочности продемонстрировал образец, полученный с использованием раствора с концентрацией модификатора 0.5 н. При увеличении времени воздействия окислителя до 24 ч прочностные показатели резко понижались. Как видно на рис. 1б–1г, при длительном окислении пленка становится хрупкой и даже разрушается при незначительном воздействии. С учетом имеющихся данных для иммобилизации ферментов использовалась окисленная ГПБЦ, полученная обработкой 0.5 н. периодатом в течение 6 ч.
Таблица 2.
Влияние продолжительности выдержки и концентрации модификатора на механические свойства ГПБЦ
| Время выдержки, ч | Концентрация NaIO4, н. | Толщина, мкм | Прочность, МПа | Растяжение, % |
|---|---|---|---|---|
| Контроль | – | 44.8 ± 1.8 | 52.8 ± 2.6 | 8.2 ± 0.4 |
| 3 | 0.1 | 45.1 ± 1.8 | 51.3 ± 2.8 | 7.8 ± 0.3 |
| 0.2 | 33.2 ± 1.5 | 47.1 ± 2.3 | 6.4 ± 0.3 | |
| 0.5 | 32.7 ± 1.4 | 35.5 ± 1.5 | 6.7 ± 0.4 | |
| 6 | 0.1 | 39.6 ± 2.7 | 49.7 ± 2.3 | 7.3 ± 0.3 |
| 0.2 | 34.9 ± 1.6 | 44.2 ± 2.2 | 8.1 ± 0.5 | |
| 0.5 | 35.3 ± 1.9 | 24.2 ± 1.6 | 6.4 ± 0.3 | |
| 24 | 0.1 | 30.5 ± 1.2 | 15.2 ± 1.1 | 5.2 ± 0.3 |
| 0.2 | 27.8 ± 1.8 | 4.1 ± 0.3 | 4.5 ± 0.3 | |
| 0.5 | 27.2 ± 1.6 | 1.5 ± 0.1 | 3.7 ± 0.1 |
При взаимодействии целлюлозы с периодатом происходит окисление вторичных гидроксильных групп элементарного звена до альдегидных, сопровождающееся разрывом связи между вторым и третьим атомами углерода элементарного звена.
Целлюлоза из древесины или бактериальная целлюлоза, полученная в динамических условиях, представляет собой отдельные фрагменты структуры, не связанные между собой ковалентными связями. Процессы окисления таких фрагментов, в конечном счете, не приводят к полному изменению надмолекулярной структуры.
В случае с гель-пленкой, являющейся единой пространственной структурой в виде тесно переплетенных и связанных друг с другом ковалентными связями элементарных звеньев отдельных нитей, все происходит несколько иначе. С увеличением количества разрывов может нарушиться и даже разрушиться пространственная трехмерная структура гель-пленки.
За счет частичной деструкции целлюлозы, а именно разрыва пиранозного кольца и образования альдегидных групп, нарушается взаимодействие макромолекул целлюлозы, тем самым значительно уменьшаются прочностные характеристики окисленной ГПБЦ и повышается хрупкость пленки, что можно назвать проблемой в дальнейшем ее использовании.
Было проведено сопоставление ИК-спектров контрольных и опытных образцов гель-пленки бактериальной целлюлозы (рис. 2).
Рис. 2.
ИК-спектры исходной ГПБЦ (1) и окисленной ГПБЦ, полученной обработкой ГПБЦ 0.5 н. раствором NaIO4 в течение 3 (2), 6 (3) и 24 ч (4).
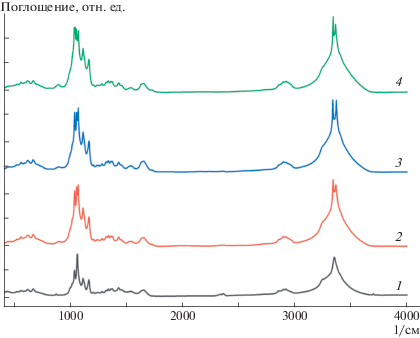
В целом ИК-спектры контрольных и опытных образцов подобны, соответствуют ИК-спектрам целлюлозы, представленным в работах [29, 30]. В ИК-спектрах окисленной ГПБЦ, полученной периодатным окислением, наблюдается заметное увеличение интенсивности полосы поглощения в области 750–900 1/см. Эта полоса связана с поглощением полуацетальных связей, образование которых обусловлено взаимодействием групп СHO с гидроксильными группами. В образцах окисленной ГПБЦ появляется пик в области 1720–1740 1/см, который указывает на наличие алифатических альдегидов. Вероятно, альдегидные группы, зафиксированные в этой области, относятся к концевым группам CHO (рис. 2) [31–35].
Окисленная ГПБЦ использовалась в качестве носителя для пепсина и β-галактозидазы. Поскольку ожидаемые азометиновые связи между аминогруппами ферментов и диальдегидными группами окисленной ГПБЦ устойчивы в слабощелочной и щелочной среде, то процедура иммобилизации проводилась при рН 7.0 [36, 37]. Полученные образцы были проанализированы ИК-спектроскопическим методом и оценивали наличие фермента по проявлению активности (табл. 3).
Таблица 3.
Эффективность иммобилизации ферментов на окисленной ГПБЦ (площадь пленки 10.5 ± 0.5 см2, вес 0.029 ± 0.001 г)
| Количество фермента в исходном растворе, мкг | Количество иммобилизованного фермента, мкг | |
|---|---|---|
| пепсина | β-галактозидазы | |
| 10.5 ± 0.5 | 4.2 ± 0.2 | 6.7 ± 0.4 |
| 20.3 ± 0.9 | 6.1 ± 0.3 | 8.4 ± 0.5 |
| 30.2 ± 1.5 | 7.1 ± 0.3 | 8.9 ± 0.5 |
| 40.4 ± 1.8 | 8.3 ± 0.5 | 11.8 ± 0.5 |
| 50.2 ± 1.8 | 14.4 ± 0.5 | 15.9 ± 0.8 |
| 60.1 ± 2.5 | 20.5 ± 0.9 | 22.6 ± 0.9 |
| 70.4 ± 2.5 | 21.3 ± 0.9 | 25.9 ± 1.0 |
| 80.6 ± 3.2 | 22.4 ± 1.1 | 26.8 ± 1.0 |
| 90.3 ± 3.4 | 23.5 ± 1.1 | 26.7 ± 1.5 |
Количество иммобилизованных ферментов зависело от концентрации белка в исходном растворе. Наибольшее их количество связывалось с пленкой при концентрации белка в исходном растворе 70.4 ± 2.5 мкг/мл. При использовании пепсина количество максимальное иммобилизованного фермента составило 21.3 ± 0.9 мкг (пепсин) и 25.9 ± 1.0 мкг (β-галактозидазы), при увеличении же концентрации белка в исходном растворе, сверх указанного выше, практически не влияло на количество связанных ферментов. Вероятно, это обусловлено с насыщением активных центров на поверхности пленки. В пересчете на грамм окисленной ГПБЦ, количество связанного фермента для пепсина составило 727 мкг, а для β-галактозидазы – 862 мкг. Эти результаты согласуются с литературными данными, согласно которым количество иммобилизованного биоактивного препарата на перевязочных материалах обычно составляет менее 1000 мкг на 1 г материала. Например, такие результаты были получены при иммобилизации протеолитических ферментов на текстильные материалы [38, 39]. При одних и тех же условиях количество иммобилизованной β-галактозидазы было больше, чем пепсина. По-видимому, это обусловлено более низким содержанием свободных аминогрупп в пепсине.
С контрольных не модифицированных гель-пленок ферменты смывались полностью после первой промывки, что свидетельствует об отсутствии или слабой связи белков с пленкой. Пленки окисленной ГПБЦ удерживали ферменты и после промывки. Определение истинной ферментативной активности иммобилизованного на окисленной ГПБЦ белка было затруднено, выделяющимися в результате протеолиза продуктами (белки молока, хромофор), которые сорбируются носителем как за счет ионогенных групп, так и за счет физической сорбции. Поэтому о присутствии ферментов на носителе можно судить качественно. При нанесении на пленку молока происходит его коагуляция за счет иммобилизованного фермента пепсина, появление синей окраски наблюдается при нанесении специфического субстрата на гель-пленку с β-галактозидазой. Соответствующая активность ферментов сохранялась и после промывания.
Для подтверждения образования азометиновой связи при взаимодействии окисленной ГПБЦ с ферментами дано сравнение ИК-спектров исходных и образовавшихся образцов (рис. 3).
Рис. 3.
ИК-спектры окисленной ГПБЦ, полученной обработкой ГПБЦ 0.5 н. раствором NaIO4 в течение 24 ч (1), пепсина (2) и продукта его взаимодействия с окисленной ГПБЦ (3), β-галактозидазы (4) и продукта его взаимодействия с окисленной ГПБЦ (5).
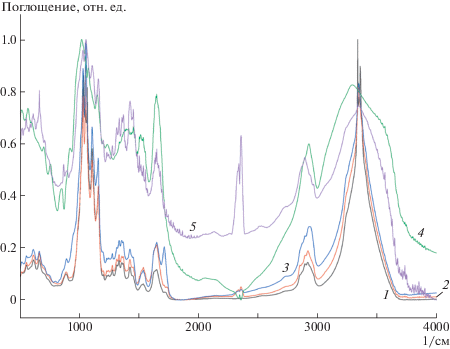
Видно, что при иммобилизации ферментов существенно понижается интенсивность пика в области 750–900 1/см, обусловленное связыванием групп CHO с аминогруппами. В ИК-спектре образца окисленной ГПБЦ с пепсином (спектр 3) и с β-галактозидазой (спектр 5) появляются полосы при частоте 1660–1670 1/см соответственно. Согласно литературным данным валентным колебаниям связи C=N в азометинах соответствует полоса 1620–1650 1/см. Однако в процессе взаимодействия этих связей с окружающими молекулами, полоса поглощения может сместиться, как в нашем случае, в область 1660–1670 1/см [40].
Согласно работам [36, 38], ковалентные связи с аминогруппами ферментов стабильны и практически не разрушаются при рН > 6.5. Известно, что pH крови человека, являясь величиной постоянной, может изменять свои значения только в строго обозначенных пределах – от 7.36 до 7.44 (в среднем – 7.4), т.е. имеет слабощелочной характер. Привитые биологические активные соединения не могут диффундировать в биологическую жидкость и вызывать аллергические или другие не желательные реакции организма. Поэтому пленки с иммобилизованными ферментами можно использовать для получения различных перевязочных материалов путем химической иммобилизации различных лекарственных препаратов, имеющих в своем составе аминогруппы. В зависимости от привитого лекарственного средства, такие материалы можно будет использовать в различных областях медицины.
Работа выполнена при поддержке Министерства науки и высшего образования Российской Федерации (выполнение Госзадания) в рамках научного проекта № FZRS-2020-0003.
Список литературы
Morton L.M., Phillips T.J. // J. Semin. Cutan. Med. Surg. 2012. V. 31. № 1. P. 33.
Boateng J.S., Matthews K.H., Stevens H.N. // J. Pharm. Sci. 2008. V. 97. P. 2892.
Юданова Т.Н., Решетов И.В. // Хим.-фарм. журн. 2006. Т. 40. № 8. С. 24.
Белов А.А., Филатов В.Н., Белова Е.Н., Филатов Н.В. Пат. 2268751 Россия. 2006.
Белов А.А., Филатов В.Н., Белова Е.Н. Пат. 2323748 Россия. 2008.
Филатов В.Н., Рыльцев В.В., Макаров В.А., Белозерская Г.Г. Пат. 238011 Россия. 2010.
Белов А.А., Бурмака В.В., Медушева Е.О., Мельниченко В.И. Пат. 2203684 Россия. 2003.
Zyu L., Kumar V., Banker G. // AAPS Pharm. Sci. Tech. 2004. V. 5. №. 4. P. 145.
Liu S.A., Cheng S.S., Chen J.S., Huang Y.W., Chen F.J., Chiu Y.T. // J. Chin. Med. Assoc. 2012. V. 75. P. 178.
Качмазов А.А., Жернов А.А. // Экспериментальная и клиническая урология. 2010. № 4. С. 69.
Solár P., Suchý P., Muselík J., Bujarová M., Havelka P., Sopuch T. // Ceska a Slovenska Farmacie. 2008. V. 57. № 1. P. 13.
Hoenich N. // Bioresources. 2006. V. 1. № 2. P. 275.
Wei B., Yang G., Hong F. // Carbohydr. Polym. 2011. V. 5. № 84. P. 536.
Громовых Т.И., Садыкова В.С., Луценко С.В., Дмитренко А.С., Фельдман Н.Б., Данильчук Т.Н., Каширин В.В. // Прикл. биохим. микробиол. 2017. Т. 53. № 1. С. 73.
Grunin L.Y., Grunin Y.B., Talantsev V.I., Nikolskaya E.A., Masas D.C. // Polymer Science A. 2015. V. 57. № 1. P. 43.
Tkacheva N.I., Morozov S.V., Grigoryev I.A., Loginov D.M., Kolchanov I.A. // Polymer Science B. 2013. V. 55. № 7–8. P. 409.
Revin V.V., Pestov N.A., Shchankin M.V., Mishkin V.M., Platonov V.I., Petrov P.S., Uglanov D.A. // Biomacromolecules. 2019. V. 20. № 3. P. 1406.
Кузнецова Т.А., Пестов Н.А., Ревин В.В. // Химия растительного сырья. 2020. Т. 2. С. 315.
Revin V.V., Liyas’kina E.V., Sapunova N.B., Bogatyreva A.O. // Microbiology. 2020. V. 89. № 1. P. 88.
Трофимов В.А., Кадималиев Д.А., Ревин В.В., Пузанов С.Ю., Петрова Е.С. Пат. 2659175 Россия. 2018.
Девятаева А.А., Пестов Н.А. // Материалы науч. конф. “XLVII Огарёвские чтения”. Саранск, 2019. С. 12.
Huanhuan Ge, Liming Zhang, Meng Xu, Jie Cao, Caicai Kang // Lecture Notes Electrical Eng. 2018. V. 444. P. 545.
Ревин В.В., Лияськина Е.В. Пат. 2523606 Россия. 2014.
Ревин В.В., Лияськина Е.В., Назаркина М.И. Пат. 2536973 Россия. 2014.
Эльчепарова С.А. Дис. … канд. хим. наук. Нальчик: КБГУ, 2014.
Кадималиев Д.А., Ревин В.В., Леднева Е.В., Герасимова Л.В. Пат. 2720099 Россия. 2020.
Роговин З.А. Химические превращения и модификация целлюлозы. М.: Химия, 2009.
Bradford M.M. // Anal Biochem. 1976. V. 72. P. 249.
Yin X., Koschella A., Heinz Th. // React. Functional Polym. 2009. V. 69. № 6. P. 341.
Cook J.R. // Monograph “Amine Functionalization of Bacterial Cellulose for Targeted Delivery Applications”. Canada, 2013. P. 256.
Ciolacu D., Ciolacu F., Popu I.V. // Cellulose Chem. Technol. 2011. V. 45. № 1–2. P. 16.
Applied Infrared Spectroscopy: Fundamentals, Techniques, Analytical Application / Ed. by A.L. Smith. New York: Wiley, 1979.
Determining the Structure of Organic Compounds / Eds. by E. Pretsch, P. Bühlmann, C. Affolter. Berlin; Heidelberg; NewYork: Springer-Verlag, 2006.
Kristiansen K.A., Potthast A., Christiansen B.E. // Carbohydr. Res. 2010. V. 345. P. 1269.
Тлупова З.А., Жанситов А.А., Эльчепарова С.А., Хаширова С.Ю. // Фундаментальные исследования. Химические науки. 2012. № 11. P. 973.
Paloma J.M., Fernandez-Lorente G., Mateo C., Ortiz C., Guisan J.M. // Enzyme Microbial Technol. 2002. V. 31. № 6. P. 781.
House J.L., Anderson E.M., Ward W.K. // J. Diabetes Sci. Technol. 2007. V. 1. № 1. P. 23.
Белов А.А., Филатов В.Н., Белова Е.Н., Казанская Н.Ф. // Вестн. МГУ. Сер. Химия. 2006. Т. 47. № 2. С. 88.
Белов А.А., Рыльцев В.В., Игнатюк Т.Е. // Химико- фармацевтический журн. 1992. № 11–12. С. 102.
Преч Э., Бюльманн Ф., Аффольтер К. ИК- и ЯМР- спектроскопия полимеров / Пер. с англ. под редакцией Г.М. Семенович. М.: Мир, 2006.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия Б)


