Высокомолекулярные соединения (серия Б), 2021, T. 63, № 4, стр. 231-250
ОСОБЕННОСТИ ТЕРМООКИСЛИТЕЛЬНОЙ ДЕСТРУКЦИИ КОМПОЗИЦИЙ НА ОСНОВЕ ЭПОКСИДНОГО ОЛИГОМЕРА С ТЕРМОПЛАСТИЧНЫМИ НАПОЛНИТЕЛЯМИ
Л. С. Шибряева a, *, И. Ю. Горбунова b, М. Л. Кербер b, П. А. Повернов a
a Институт биохимической физики им. Н.М. Эмануэля Российской академии наук
119334 Москва, ул. Косыгина, 4, Россия
b Российский химико-технологический университет им. Д.И. Менделеева
125047 Москва, Миусская пл., 9, Россия
* E-mail: lyudmila.shibryaeva@yandex.ru
Поступила в редакцию 17.12.2020
После доработки 01.04.2021
Принята к публикации 14.04.2021
Аннотация
Изучено влияние наполнителей – полисульфона и полиэфиримида – на механизм и кинетику термоокислительной деструкции композиции на основе эпоксидного олигомера, отвержденного 4,4'-диаминодифенилсульфоном, протекающей при нагревании в неизотермическом режиме. Обнаружена связь между структурой композиции, механизмом и кинетическими параметрами процесса, с одной стороны, и химической природой наполнителя, с другой. Особенности механизма и кинетики неизотермической деструкции эпоксиаминной композиции установлены термоаналитическим методом с применением дифференциальной сканирующей калориметрии. Кинетические параметры процесса определены с помощью анализа термокинетических кривых с привлечением моделей термокинетики, а также из анализа продуктов окисления. В зависимости от природы наполнителя и структуры композиции при термоокислении в полимере протекают реакции с участием связей межузловых цепей и узлов сетки эпоксидного полимера, а также радикальные реакции активных центров наполнителя. Рост плотности сетки и локализация наполнителя определяют вклад диффузионного фактора, понижают скорость термоокислительной деструкции межузловых цепей, повышают скорость распада узлов сетки.
Материалы на основе эпоксидных композиций широко востребованы в разных отраслях промышленности. Важной проблемой, связанной с получением и переработкой этих композиций, является обеспечение их стабильности в условиях высокотемпературного воздействия в воздушной среде. Вместе с тем, условия эксплуатации эпоксидных материалов требуют повышения их теплостойкости, а также стойкости к термической и термоокислительной деструкции. Решить поставленные задачи можно с помощью модификации эпоксидных композиций введением в них различных наполнителей [1–15]. Например, широко используют нанонаполнители (частицы серебра, диоксида титана, этоксисиланов, глины и монтмориллонита [3–8]), а также такие вещества, как фосфазены, карбоксилсодержащие каучуки, ароматические полиэфиры, термопласты и другие [9–17]. Модификация, оказывая влияние на механизм отверждения эпоксидного олигомера, изменяет физико-химические свойства композиций. Анализ литературы показал существование разных и порой противоречивых сведений о характере влияния модификаторов на термостойкость эпоксидных композиций [18–20]. Это обусловлено зависимостью термической и термоокислительной стойкости полимеров от целого ряда факторов.
Исследования закономерностей термоокисления полимеров на основе эпоксидных смол продемонстрировали ведущую роль таких факторов, как надмолекулярная и молекулярная структура связующего. При изучении процесса термоокислительной деструкции ненаполненного полимера на основе эпоксидной смолы “ЭД-20”, отвержденной 4,4'-диаминодифенилсульфоном в разных режимах отверждения, было показано, что кинетика и механизм процесса зависят от плотности сетки и сегментарной подвижности, которые определяют соотношение скорости термоокисления, деструкции межузловых цепей и распада узлов сетки [20].
При модификации эпоксидной композиции создаются предпосылки для существенного изменения закономерностей окисления и деструкции материала из-за участия модификатора в процессах как отверждения композиции, так и ее окисления. Закономерности термоокислительной деструкции модифицированных эпоксидных композиций, наполненных разными классами веществ, имеют отличный характер в зависимости от природы наполнителя [4–6, 16, 17, 20–25].
Например, для эпоксидно-кремнеземных композитов аминного отверждения на основе эпоксидной смолы “EPONEX-1510” и продуктов гидролиза тетраэтоксисилана в диапазоне концентрации кремнеземного наполнителя 12.5 мас. % и выше получены данные, демонстрирующие более высокую термостабильность и устойчивость к окислительным процессам у наполненных эпоксидных полимеров по сравнению с ненаполненными [6, 23]. При этом неорганический наполнитель оказывает ингибирующее действие на процесс окисления композитов: понижается максимальная скорость поглощения кислорода, температура начала основной стадии термоокислительной деструкции существенно сдвигается в сторону более высоких значений температуры. Скорость поглощения кислорода образцами практически не зависит от содержания кремнезема в композитах [6].
При изучении влияния титан-оксидного наполнителя на кинетику термоокислительной деструкции полимерной матрицы в стеклообразных эпоксидно-титановых композитах устойчивость композиционных материалов к повышенным значениям температуры и процессу окисления зависит от концентрации наполнителя. Системы, содержащие от 0.5 до 1.5 мас. % TiO2, являются более устойчивыми к термоокислению по сравнению с исходным эпоксидным полимером. При этом максимальная скорость поглощения кислорода полученными композитами в 4–13 раз ниже скорости окисления исходного полимера [4, 5].
На примере композитов, наполненных сложными олигоэфирами [17], было установлено, что термоокислительная стойкость системы прежде всего зависит от химической природы модификатора. Введение наполнителя может привести как к существенному повышению, так и понижению скорости ее окисления [17, 23]. Увеличение скорости процесса обусловлено уменьшением концентрации функциональных эпоксигрупп, участвующих в образовании сетчатых структур из-за разбавления эпоксидной системы наполнителем [17]. Присутствие наполнителя может проявить ингибирующий эффект или создать диффузионные ограничения подачи кислорода в матрицу [17, 22, 23], вследствие чего уменьшится скорость термоокисления композиции.
На основании литературных данных, кинетика и механизм термической и термоокислительной деструкции наполненных и модифицированных образцов зависят, во-первых, от структурных факторов, во-вторых, от типа химических реакций между функциональными группами в макромолекулах эпоксидного связующего и модифицирующих компонентов.
Важно отметить, что механизм деструкции наполненной или пластифицированной эпоксидной композиции определяется диффузионными процессами и, в результате, может включать несколько типов реакций, протекающих по разным схемам. При этом схемы реакций могут изменяться в ходе термоокислительного разрушения эпоксидной композиции из-за накопления продуктов окисления [22].
В рамках решения проблемы повышения термической и термоокислительной стабильности эпоксидных материалов актуальной задачей является установление роли каждого из перечисленных выше факторов, влияющих на термоокислительную деструкцию эпоксидных композиций в зависимости от природы модификатора.
Цель настоящей работы – установление особенностей кинетики и механизма термоокислительной деструкции эпоксиаминного полимера, модифицированного термопластичными наполнителями разной природы в зависимости от структуры сетки, сформировавшейся при предварительном отверждении полимера.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве объекта исследования применяли эпоксидный олигомер “ЭД-20” (промышленную смолу) с Mn = 390, отвержденный 4,4'-диаминодифенилсульфоном (ДАДФС), в соотношении 70 : 30 (мас.ч.). Такое соотношение позволяет достигать максимальной температуры стеклования 200°С. В эпоксидную композицию в качестве модификаторов вводили ароматические полиэфиры в количестве 5 мас.ч.: полисульфон (ПСФ) марки “Ultrason S-2010” (“BASF”) с Mw = 3.5 × 104, температура стеклования Tс = 191°C; полиэфиримид марки “Ultem-1010” (“General Electric”) с Mw = = 3.0 × 105, Tс = 216°C.
Смеси эпоксидного олигомера с полиэфирами получали растворением гранул полимера в олигомере при 120 (полисульфон) и 150°С (полиэфир-имид) при механическом перемешивании.
Реологическое поведение смесевых композиций “ЭД-20” с полиэфирами изучали на ротационном реометре “Physica MCR-301” (“Anton Paar”) в режиме контролируемого напряжения с использованием узла геометрии плоскость–плоскость. Напряжение сдвига варьировали от 0.01 до 100 Па, температуру – от 20 до 200°С. Динамические испытания выполняли в области линейной вязкоупругости образцов в диапазоне угловых частот 0.0628–628 с–1.
В работе применяли три режима отверждения систем: ступенчатый, при котором отверждение вели при температуре 160–180–200°С в течение 2–4–2 ч соответственно; и изотермический при двух значениях температуры 180 и 200°С в течение 12 ч.
Степень отверждения контролировали по количеству выделившейся теплоты методом ДСК на калориметре “Netzsch DSC-204 F1 Phoenix”, а также методом динамического механического анализа (ДМА) на крутильном маятнике “МК-3” в режиме свободно затухающих колебаний с определением тангенса механических потерь tgδ и динамического модуля упругости G' [13].
Температуру стеклования определяли методами ДСК и термомеханическим с использованием консистометра Хепплера.
Процессы деструкции наполненных эпоксидных полимеров изучали с помощью ДСК на микрокалориметре “Netzsch Polyma-214” (Германия). Нагревание и охлаждение образцов осуществляли в температурном диапазоне 30–500°С при скорости сканирования 4 град/мин. Навески образца составляли (5.0 ± 0.1) и (10.0 ± 0.1) мг. Эксперименты проводили в токе воздуха при скорости потока ~15 мл/мин. Регистрировали тепловые эффекты, сопровождающие термическую и термоокислительную деструкцию материала. Температурную шкалу и энтальпию плавления калибровали по стандартному образцу индия (температура плавления Тпл = 156.6°С, удельная теплота плавления ΔН = 28.44 Дж/г). Ошибка в определении температуры составляет ±0.5°С.
Анализ полученных теплофизических кривых термоокислительной деструкции осуществляли методом термокинетики с применением различных моделей, описывающих температурные зависимости для скорости химических процессов и степени превращения веществ в них.
Среднеквадратичные отклонения экспериментальных значений площади пиков термодеструкции разных образцов лежали в пределах 10%.
ИК-спектры отвержденных образцов в виде пленок записывали на спектрометре “Nicolet-380” в области волновых чисел от 400 до 4000 см–1. Для проведения ИК-анализа готовили прозрачные пленки толщиной 60–100 мкм. Содержание функциональных групп вычисляли по соотношению между оптической плотностью функциональных групп и реперного пика, характеризующего толщину образца. Ошибки в определении параметров составили ±10%.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
С целью установления особенностей кинетики и механизма термоокисления и термоокислительной деструкции эпоксиаминной композиции, наполненной термопластами, выбраны модификаторы, отличающиеся совместимостью с эпоксидным олигомером, а также получены образцы, предварительно отвержденные в разных режимах. Были рассмотрены образцы, наполненные полисульфоном, растворимым в эпоксидном олигомере и полиэфиримидом, несовместимым с эпоксидным олигомером, соответственно образующие гомогенную, однофазную и гетерофазную системы [14]. Изучение процесса отверждения эпоксидного олигомера ДАДФС в присутствии растворимого ПСФ и нерастворимого полиэфиримида, ранее проведенное в работах [15, 17], показало, что добавление термопластичного модификатора в композицию изменяет структуру сетки и ее плотность в зависимости от типа фазовой структуры, сформировавщейся в матрице при отверждении эпоксидного олигомера в присутствии наполнителей.
При выборе объектов исследования авторы работ [15, 17] считали, что влияние модификаторов полиэфиримида и ПСФ на реакционную способность эпоксиаминного полимера в процессе термоокислительной деструкции, на ее механизм и кинетику будет определяться как гетерофазностью системы и структурой сетки эпоксидной матрицы, так и химической природой компонентов.
Для более детального исследования роли структуры сетки были выбраны образцы композиций, предварительно отвержденные при 180 и 200°С в течение 12 ч, а также в ступенчатом режиме при 160–180–200°С при обработке 2–4–2 ч соответственно.
Установлено [13, 17, 20], что в качестве показателей структурных параметров образцов исходных и наполненных эпоксиаминных композиций можно использовать значения температуры стеклования и величины ударной вязкости. Эти параметры для изучаемых систем представлены в табл. 1. Так, у образцов исходного эпоксиаминного полимера с ростом температуры отверждения Tс увеличивается при неизменной ударной вязкости. У модифицированных образцов Tс увеличивается по сравнению с немодифицированными, независимо от температуры отверждения. Причем у образца, наполненного полиэфиримидом, Tс выше, чем у ПСФ; это указывает на более низкую подвижность цепей. Ударная вязкость у системы, содержащей ПСФ, с ростом температуры отверждения уменьшается, а у образцов, содержащих полиэфиримид, изменяется сложным образом. Такие показатели свидетельствуют о различиях в структуре сеток исходной и модифицированной эпоксиаминных композиций, что соответствует полученным ранее данным [13, 14, 24]. Вид зависимости для Tс и ударной вязкости от режима отверждения у модифицированных образцов может быть обусловлен отличным строением аморфных зон между узлами сетки и характером локализации наполнителей в этих зонах. Важно отметить, что у образца с полиэфиримидом наполнитель распределен в виде частиц фазы, внедренных в сетку эпоксидного полимера, у образца с ПСФ – в виде макромолекул [7].
Таблица 1.
Температура стеклования, ударная вязкость и параметры термоокислительного процесса для образцов исходных и наполненных полиэфиримидом и ПСФ композиций на основе эпоксидной смолы “ЭД-20” и ДАДФС
| Режим отверждения | Физико-химические параметры | Параметры термоокислительной деструкции | ||||
|---|---|---|---|---|---|---|
| Т, °С | время, ч | Тс, °С | ударная вязкость, кДж/м2 | Тн, °C | T = 0.1 –Tн*, °С (время, с) | (dH(t)/dt)0.5 = f(t)**, усл.ед./c (ΔT, °С) |
| ЭД-20+ДАДФС | ||||||
| 160–180–200 | 2–4–2 | 160 | 6 | 385 ± 10 | 385–404 (285) | 6.3 × 10–4 (384–450) |
| 180 | 12 | 165 | 6 | 355 ± 10 | 355–377 (330) | 6.4 × 10–4 (362–440) |
| 200 | 12 | 170 | 6 | 393 ± 10 | 393–409 (240) | 8.5 × 10–4 (400–418) |
| 5.5 × 10–4 (418–450) | ||||||
| ЭД-20+ДАДФС+полиэфиримид | ||||||
| 160–180–200 | 2–4–2 | 180 | 12 | 344 ± 10 | 344–368 (360) | 6.0 × 10–4 (340–424) |
| 180 | 12 | 180 | 5 | 353 ± 10 | 353–386 (495) | 5.6 × 10–4 (364–436) |
| 200 | 12 | 180 | 12 | 398 ± 10 | 398–414 (240) | 5.4 × 10–4 (410–425) |
| 4.1 × 10–4 (426–438) | ||||||
| ЭД-20+ДАДФС+ПСФ | ||||||
| 160–180–200 | 2–4–2 | 175 | 15 | 283 ± 10 | 283–298 (225) | 8.8 × 10–4 (280–336) |
| 180 | 12 | 175 | 9 | 320 ± 10 | 320–338 (270) | 11.1 × 10–4 (320–368) |
| 200 | 12 | 172 | 8 | 333 ± 10 | 333–343 (150) | 9.1 × 10–4 (337–373) |
Процесс термоокисления в воздушной или кислородной среде, протекающий в образцах эпоксидных композиций, можно описать кинетической схемой цепного процесса с вырожденным разветвлением кинетических цепей [25–27].
Зарождение кинетических цепей окисления –
Продолжение кинетических цепей –
Разветвление кинетических цепей –
Обрыв кинетических цепей –
Здесь R1, 2, …n OOH, ${\text{R}}_{{1,2, \ldots n}}^{ \bullet }$, R1, 2, …n ${\text{O}}_{2}^{ \bullet }$, R1, 2, …nH – гидропероксид, алкильный радикал, пероксидный радикал, связь полимера R–H соответственно; индексы 1, 2, …n, расположенные у элементов схемы реакций, относятся к каждому из компонентов эпоксидной композиции, к молекулам модификаторов, цепям эпоксидной матрицы, входящим в межузловые цепи и узлы сетки, участвующие в реакции окисления, и они отображают реакции для каждого компонента с его индексом; O2 – молекула кислорода; k1 1, 2, …n, k2 1, 2, …n, k3 1, 2, …n, k4 1, 2, …n, k5 1, 2, …n, k6 1, 2, …n – константы скорости элементарных стадий процесса окисления; δ – выход гидропероксида на моль поглощенного кислорода, δ < 1; σ – вероятность вырожденного разветвления кинетических цепей, σ < 2.
Процесс термоокислительной деструкции протекает на стадии продолжения и обрыва кинетических цепей. При этом стадия продолжения включает реакции
При окислении твердых полимеров на стадии продолжения кинетических цепей между группой ROOH и радикалом R• происходит реакция, приводящая к образованию карбонильной >С=O и гидроксильной групп одновременно с разрывом связей макромолекул С–С.
На стадии обрыва формируются гидроксильные и карбонильные группы:
Наличие нескольких активных компонентов в эпоксидной композиции, а также различие активных центров в эпоксидной матрице усложняет данную схему. Внутри каждой стадии могут реализоваться перекрестные реакции, например на стадии продолжения кинетической цепи окисления:
Перекрестные реакции могут привести как к замедлению процесса, так и его ускорению в зависимости от природы и активности компонентов-носителей свободной валентности.
Наличие нелетучих продуктов цепного окисления – карбонил- и гидроксил-содержащих фрагментов было установлено методом ИК-спектроскопии.
Вследствие сложности схемы изучаемого процесса, кинетический аспект деструкции эпоксидных композиций в воздушной среде рассмотрен в динамических условиях нагревания образца, применяя термокинетический метод. Этот метод основан на предположении, что температура образца однородна, и деструкция может быть описана уравнением реакции (в координатах уравнения Аррениусовской зависимости):
В данной работе скорость процесса была определена по временной зависимости количества тепла, выделившегося в ходе термоокислительной деструкции. Кинетические расчеты выполнены из результатов ДСК-измерений. Скорость реакции пропорциональна скорости изменения теплового потока [28–30], т.е. справедливо выражение
Здесь α – степень превращения полимера, равная dHt/Hобщ, что соответствует ~ [RH]t/[RH]общ; dα/dt – скорость изменения степени превращения; Hобщ – суммарная энтальпия реакции; dH(t)/dt – скорость изменения теплового потока.
Важно, что полученными ДСК-кривыми можно воспользоваться как для расчета кинетических параметров, так и для аппроксимации кинетической моделью. Для нахождения Eа, A и n может быть использована одна кривая ДСК.
В работе были получены термограммы ДСК в неизотермическом режиме в условиях нагревания образцов с постоянной скоростью β, равной 4 град/мин в интервале температуры 200–500°С. На термограммах всех исследуемых образцов зарегистрированы экзотермические пики термоокислительной деструкции (рис. 1). Важно отметить, что данные ДСК соответствуют данным ТГА и ДТА, что дает возможность применить термокинетические методы анализа первого по аналогии со вторыми. Методом графического дифференцирования и интегрирования экзотерм термоокислительной деструкции по времени и температуре для всех изученных образцов были получены кинетические кривые, характеризующие скорость изменения удельного тепловыделения в ходе термоокисления, и температурные зависимости этих кривых. Кривые температурных зависимостей изменения скорости тепловыделения dH(t)/dt = f(T) в ходе термоокислительной деструкции для образцов эпоксиаминных композиций ЭД-20+ДАДФС, исходных и наполненных полиэфиримидом и ПСФ, отвержденных в разных режимах, представлены на рис. 2. Важно, что кинетические кривые имеют форму, характерную для автокаталитического процесса радикально-цепного окисления с вырожденным разветвлением кинетических цепей; это соответствует представленной выше схеме и согласуется с результатами, полученными для эпоксиаминного полимера в работах [17, 20]. Значит, кинетическая кривая описывает начальную стадию с замедленной скоростью (период индукции τинд) и автоускоренный участок термоокислительной деструкции, а также характеризует кинетические параметры окисления. За период индукции можно принять время, соответствующее разнице между значением начальной температуры экзотермических пиков Tн и температуры, соответствующей степени превращения полимера до 10% (Tα = 0, 1Tн). При этом тангенсы углов наклонов линейных анаморфоз кривых dH/dt = f(T), представленных в координатах параболы (dH(t)/dt)0.5= = f(t) и осью временного интервала, можно рассматривать как фактор, характеризующий параметр автоускорения.
Рис. 1.
Кривые ТГА (а), ДТА (б) и ДСК (в) образцов ЭД-20+ДАДФС (1), ЭД-20+ДАДФС+ПФС (2), предварительно отвержденных при 200°С в течение 12 ч.
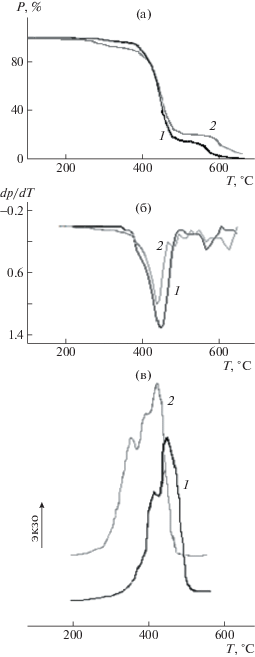
Рис. 2.
Термокинетические кривые изменения теплоты термоокислительной деструкции в ходе процесса (1–3), выраженные в координатах dH(t)/dt = f(t) и их линейные анаморфозы в координатах параболы (dH(t)/dt)0.5= f(t) (1'–3') для образцов исходной (1, 1'), содержащей полиэфиримид (2, 2') и ПСФ (3, 3') композиций, отвержденных при 200 (а) и 180°С (б) в течение 12 ч и при 160–180–200°С в течение 2–4–2 ч (в). Шкала температуры, соответствующая шкале времени нагревания образцов t, дана для определения их термической стойкости.

Указанные выше параметры активности в термоокислительной деструкции, полученные для изученных образцов, приведены в табл. 1 в сравнении с параметрами структуры. Прежде всего, данные рис. 2 демонстрируют наиболее явное различие в активности между ненаполненной, несовместимой и совместимой системами (кривые 1−3 соответственно). Причем различия между кривыми 1 и 2 выражены существенно в меньшей степени, чем у совместимой системы с ПСФ (кривая 3). При этом у всех образцов различия на начальной стадии процесса зависят от условий предварительного отверждения композиций. У совместимой системы с ПСФ температура начала деструкции эпоксиаминной композиции уменьшается на 100°С у образца, отвержденного в условиях ступенчатого режима (табл. 2), на 40 и 60°С в образцах, отвержденных при 180 и 200°С соответственно. В несовместимой системе, наполненной полиэфиримидом, начальная температура деструкции понижается на 40°С у образца, отвержденного в ступенчатом режиме, и незначительно (на 5°С) увеличивается у отвержденного образца при 200°С.
Таблица 2.
Кинетические параметры деструкции композиций на основе эпоксидной смолы ЭД-20 и ДАДФС. Расчет с помощью модели Фримена и Кэррола
| Режим отверждения | Кинетические параметры термоокислительной деструкции исходных и модифицированных композиций | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| Т, °С | время, ч | (ΔlnV)/(ΔlnW) = n + E[–Δ(1/T)/R(ΔlnW)] | (Δln V)/Δ(1/T) = n(Δln W)/Δ(1/T) – (E/R) | ||||||
| α1–3, % | ΔТ, °С | n | Eа1–3, кДж/моль | α1–3, % | ΔТ, °С | n | Eа1–3, кДж/моль | ||
| ЭД-20+ДАДФС | |||||||||
| 160–180–200 | 2–4–2 | 0.4–9.1 | 393–409 | >5 | 915 ± 50 | 1.0–10.0 | 385–401 | >5 | 810 ± 50 |
| 10.0–24.9 | 413–425 | 1.0 | 333 ± 30 | 10.4–21.1 | 401–419 | 1.0 | 360 ± 30 | ||
| 24.9–67.8 | 425–441 | 0.5 | 227 ± 10 | 21.1–67.8 | 420–441 | 0.7 | 280 ± 10 | ||
| 180 | 12 | 4.0–8.6 | 363–369 | >5 | 588 ± 50 | 1.9–7.1 | 372–388 | >5 | 1000 ± 50 |
| 9.0–37.0 | 372–404 | 0.5 | 286 ± 10 | 12.0–29.1 | 396–412 | 0.9 | 224 ± 10 | ||
| 37.0–91.0 | 404–444 | 0.4 | 183 ± 10 | 42.3–78.1 | 420–436 | 0.32 | 149 ± 10 | ||
| 200 | 12 | 0.4–9.9 | 401–417 | >5 | 857 ± 50 | 0.1–15.4 | 397–421 | >5 | 914 ± 50 |
| 9.9–22.0 | 417–425 | 1.0 | 375 ± 30 | 22.0–52.0 | 421–437 | 0.82 | 240 ± 10 | ||
| 30.2–81.6 | 429–445 | 0.6 | 244 ± 10 | 52.0–99.0 | 437–449 | 0.30 | 110 ± 10 | ||
| ЭД-20+ДАДФС+полиэфиримид | |||||||||
| 160–180–200 | 2–4–2 | 2.3–10.3 | 352–368 | >5 | 973 ± 50 | 0.3–5.0 | 352–368 | >5 | 773 ± 50 |
| 13.2–90.3 | 372–422 | 0.5 | 205 ± 10 | 9.0–73.0 | 376–416 | 1.3 | 199 ± 10 | ||
| 180 | 12 | 0.6–8.3 | 361–377 | >5 | 775 ± 30 | 0.6–5.0 | 352–368 | >5 | 582 ± 50 |
| 11.5–83.6 | 381–433 | 1.0 | 170 ± 10 | 7.3–78.0 | 376–416 | 0.96 | 183 ± 10 | ||
| 200 | 12 | 1.5–20.7 | 400–412 | >5 | 960 ± 50 | 0.4–4.6 | 402–410 | >5 | 900 ± 50 |
| 20.7–55.5 | 412–422 | 1.0 | 650 ± 50 | 4.6–20.0 | 406–420 | 1.4 | 540 ± 30 | ||
| 55.5–94.1 | 422–436 | 0.5 | 250 ± 10 | 27.8–77.2 | 422–438 | 0.4 | 311 ± 10 | ||
| ЭД-20+ДАДФС+ПСФ | |||||||||
| 160–180–200 | 2–4–2 | 0.6–9.0 | 291–304 | 1.0 | 530 ± 30 | 0.6–9.4 | 291–307 | 5.0 | 499 ± 30 |
| 9.4–66.3 | 307–331 | 0.5 | 308 ± 10 | 9.4–66.3 | 307–331 | 0.5 | 199 ± 10 | ||
| 180 | 12 | 0.5–7.9 | 328–344 | 0.9 | 485 ± 30 | 0.5–7.9 | 328–344 | 5.2 | 485 ± 30 |
| 19.4–99.0 | 352–376 | 0.45 | 223 ± 10 | 19.4–99.0 | 352–376 | 0.5 | 216 ± 10 | ||
| 200 | 12 | 1.8–9.4 | 341–345 | >5 | 1000 ± 50 | 1.8–9.4 | 341–349 | >5 | 963 ± 50 |
| 16.0–26.3 | 345–361 | 1.0 | 500 ± 30 | 9.4–26.3 | 349–357 | 2.25 | 498 ± 30 | ||
| 26.6–5.0 | 365–373 | 0.2 | 262 ± 10 | 26.3–99.0 | 361–400 | 0.14 | 274 ± 10 | ||
Несколько по-другому выглядит соотношение параметров активности образцов в радикально-цепном процессе окисления. Иначе изменяются величины периодов индукции. У образцов ЭД-20+ ДАДФС+полиэфиримид, отвержденных при 180°С и в ступенчатом режиме, величина периода индукции, по сравнению с образцами ЭД-20+ДАДФС увеличивается в 1.5 и 1.3 раза соответственно. Данное обстоятельство указывает на замедление развития радикально-цепного процесса. У образцов, наполненных ПСФ, τинд уменьшается в 1.2 раза у отвержденных в дробном режиме при 180°С и в 1.6 раза – у образца, отвержденного при 200°С. Значит, для образца с ПСФ процесс окисления эпоксидной матрицы ускоряется. Наклоны линейных анаморфоз кинетических кривых, во-первых, демонстрируют четкую тенденцию к уменьшению скорости развития окислительной деструкции у образца композиции с полиэфир-имидом и к ее росту у системы, наполненной ПСФ (табл. 1). Это соответствует результатам, полученным из соотношения величин периодов индукции. Во-вторых, наличие перегибов на линейных анаморфозах образцов исходной композиции и наполненной полиэфиримидом, отвержденных при 200°С, свидетельствует об изменении в механизме радикальных реакций, происходящих в ходе развития окислительного процесса. Важно, что у образца композиции с ПСФ такого изменения в аналогичном интервале температуры и у образцов, отвержденных при 180°С и в ступенчатом режиме, перегибов не видно. Возможно, что наличие перегибов обусловлено структурой сетки, предварительно сформировавшейся при 200°С. Процесс окисления и деструкции образцов, имеющих более рыхлую сетку, протекает однороднее.
С помощью программы “Origin-8” экспериментальные данные температурно-временных зависимостей изменения удельной теплоемкости, полученные в виде функции ΔCТ = d(dH(t)/dt)/dT = = f(t, T), при dT = 8 град для образцов эпоксиаминных исходных ЭД-20+ДАДФС и наполненных композиций, отвержденных в разных режимах, в ходе термоокислительной деструкции были интерполированы в 3D-пространство. Полученные 3D-диаграммы для композиций разного состава представлены на рис. 3, который графически отображает изменение скорости термоокислительной деструкции (Wo2) активных связей в ходе процесса пропорционально их концентрации в каждом температурно-временном интервале:
Рис. 3.
3D-диаграммы температурно-временной зависимости изменения удельной теплоемкости ΔCТ в ходе термоокислительной деструкции образцов эпоксиаминных композиций ЭД-20+ДАДФС (1), наполненных полиэфиримидом (2) и ПСФ (3), отвержденных при 200 (а) и 180°С (б) в течение 12 ч, при 160–180–200°С в течение 2–4–2 ч (в).
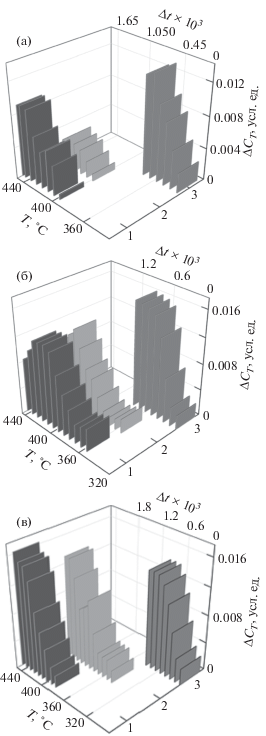
Мы принимаем, что изменение теплоемкости ΔCТ соответствует изменению концентрации активных связей, участвующих в деструкционном процессе в каждом элементе структуры в соответствующем температурно-временном интервале и отражает скорость процесса. В этом случае сравнение ΔCТ в температурно-временных областях для разных образцов (рис. 3) позволяет рассмотреть распределение активных центров и слабых связей, участвующих в термоокислительной деструкции каждого образца, и проследить динамику их изменения, т.е. продемонстрировать различия в механизме процесса.
Также можно полагать, что сравнение формы интенсивности суммарной фигуры, отображающей зависимость ΔCТ = f(t, T), и температурно-временных участков каждого элемента внутри нее позволит оценить вклад скорости окисления наполнителя, скорости разрушения связей сетки, предварительно сформировавшейся в эпоксидной матрице, а также времени вступления в окислительный процесс каждого из структурных элементов образца.
Из анализа полученных фигур зависимостей ΔCТ = f(t, T) можно сделать следующие выводы.
Во-первых, у образца ЭД-20+ДАДФС, модифицированного растворимым в эпоксидном олигомере ПСФ, наблюдается значительный сдвиг всей фигуры в низкотемпературную область. Форма этой фигуры указывает на монотонный прирост концентрации активных центров, вступающих в реакцию деструкции. Как видно на рис. 3а и 3б, отверждение данного образца при 180 и 200°С может привести к увеличению предельной скорости деструкции. У образца, отвержденного в ступенчатом режиме (рис. 3в), при самой низкой температуре начала процесса деструкции понижается предельная скорость деструкции. Полученные данные свидетельствуют о росте окислительной способности образца ЭД-20+ДАДФС+ПСФ, скорее всего, за счет окисления наполнителя. ПСФ инициирует термоокислительную деструкцию эпоксидного связующего, и процесс протекает в условиях близких к гомогенным. Густота сетки, предварительно созданная в эпоксидной матрице, определяет механизм разрушения эпоксидной составляющей.
Во-вторых, начальная температурная область фигуры образца ЭД-20+ДАДФС+полиэфиримид (термопластом несовместимым с олигоэфиром) близка к исходной эпоксиаминной композиции за исключением образца, отвержденного в ступенчатом режиме. По-видимому, это указывает на близкие значения скорости окисления модификатора и эпоксидного составляющего. Анализ фигур зависимости ΔCТ = f(t, T) образцов с полиэфиримидом демонстрирует выделение отдельных температурно-временных элементов, соответствующих изменениям скорости термоокислительной деструкции на глубоких стадиях процесса, что указывает на гетерогенный характер его протекания (рис. 3а, 3б).
В-третьих, сравнение фигур для образцов, содержащих полиэфиримид и ПСФ с исходной композицией, демонстрирует бόльшее влияние структуры сетки на деструкцию у образца с гетерогенной структурой.
В-четвертых, заметное понижение интенсивности всей фигуры, свидетельствующее об изменении скорости деструкции активных связей, наблюдается у образца, отвержденного при 200°С (12 ч). У композиции, отвержденной в ступенчатом режиме, происходит значительное смещение начала деструкции в низкотемпературную область и усиливается гетерогенность в элементах фигуры. Это может быть связано со значительным влиянием гетерогенности структуры сетки эпоксидной матрицы на проявление различий в природе деструктирующих связей эпоксидного полимера.
Таким образом, влияние модификатора на кинетику и механизм процесса может быть обусловлено совместимостью модификатора с эпоксидным олигомером. Совместимые модификаторы активируют процесс разрушения полимерных связей в гомогенном процессе. У образца, модифицированного несовместимым полиэфиримидом, процесс деструкции носит гетерогенный характер.
К определению механизмов реакций, протекающих в модифицированных эпоксидных композициях в режиме нагревания с одной постоянной скоростью
Для установления механизмов термоокислительной деструкции в изучаемых композициях рассчитаны энергия активации, предэкспоненциальный фактор и показатель порядка реакции. С этой целью были задействованы кинетические модели [29–37], основанные на температурной зависимости для скорости процесса V, величины степени превращения в виде соотношения W = = 1–α, скорости изменения степени превращения полимера dW/dt в условиях нагревания образца c постоянной скоростью β. Такой подход к решению проблемы ранее был использован авторами в работах [20, 31].
Согласно существующим в термокинетике представлениям, скорость изменения степени превращения за единицу времени t равна:
т.е. выражение (2) включает температурную зависимость двух параметров – константы скорости реакции и конверсионной составляющей. Температурная зависимость константы скорости реакции k(T) подчиняется уравнению Аррениуса: где T – абсолютная температура (К), R – универсальная газовая постоянная.Конверсионная составляющая f(α) может быть представлена выражением:
С учетом температурной зависимости для k(T) и f(α) уравнение (2) можно представить следующим образом:
или в логарифмическом виде:(4)
$~{\text{ln}}V = {\text{ln}}\left( {--dW{\text{/}}dt} \right) = {\text{ln}}A + n{\text{ln}}W--E{\text{/}}RT$Обычно для неизотермического режима при постоянной скорости нагревания (β = const) уравнение (3) применяют в дифференциальном или интегральном виде. В настоящей работе использованы модели Фримена–Кэррола [30], основанные на дифференциальной форме уравнения (4):
(5)
$\Delta {\text{ln}}V = \Delta {\text{ln}}(--dW{\text{/}}dt) = n\Delta {\text{ln}}W--({{E}_{а}}{\text{/}}R)\Delta (1{\text{/}}T)$Для определения значений энергии активации и порядка протекающих реакций были применены две модификации уравнения (5) в виде
(6)
$(\Delta {\text{ln}}V){\text{/}}(\Delta 1{\text{/}}T) = n[D{\text{ln}}W{\text{/}}\Delta (1{\text{/}}T)]--(E{\text{/}}R)$(7)
$(\Delta {\text{ln}}V){\text{/}}(\Delta {\text{ln}}W) = n + E[--\Delta (1{\text{/}}T){\text{/}}R{\text{ }}(\Delta {\text{ln}}W)]$Величины n и Ea получаются из графиков в координатах
(8)
$(\Delta {\text{ln}}V){\text{/}}(\Delta 1{\text{/}}T) = f[\Delta {\text{ln}}W{\text{/}}\Delta (1{\text{/}}T)]$(9)
$[(\Delta {\text{ln}}V){\text{/}}(\Delta {\text{ln}}W)] = f[--\Delta (1{\text{/}}T){\text{/}}R{\text{ }}(\Delta {\text{ln}}W)].$Здесь наклон прямолинейной зависимости (8) соответствует порядку реакции n, отсечение при [ΔlnW/Δ(1/T)] = 0 дает значение –E/R; в выражении (9) значение наклона равно Еа, отсечение – n.
Зависимости (8) и (9) были получены для всех исследованных образцов. На рис. 4 приведены примеры кинетических кривых для образцов эпоксиаминных композиций ЭД-20+ДАДФС, отвержденных при 200, 180°С и в ступенчатом режиме (кривые 1–3 соответственно). В табл. 2 представлены кинетические параметры, определенные из указанных зависимостей.
Рис. 4.
Кинетические кривые температурной зависимости, описывающие термоокислительную деструкцию с помощью модели Фримена и Кэррола в кординатах [(ΔlnV)/(ΔlnW)] = f[–Δ(1/T)/R(ΔlnW)], для образцов ЭД-20+ДАДФС, предварительно отвержденных при 200 (1) и 180°С (2) в течение 12 ч, при 160–180–200°С в течение 2–4–2 ч (3).
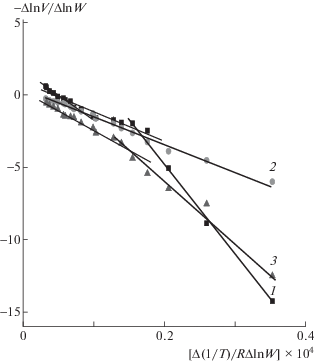
Экспериментальные данные демонстрируют, что, во-первых, графики указанных зависимостей представляют собой линейные анаморфозы, состоящие из нескольких участков, которые отличаются положением на температурной шкале и наклонами, т.е. разными Ea (рис. 4). Из отсечений этих участков следует, что помимо отличий в величинах энергии активации указанные температурные области соответствуют различным значениям порядка реакции n, следовательно, их можно отнести к разным стадиям термоокислительной деструкции, отличающимся кинетическими параметрами. Во-вторых, в табл. 2 видны различия между величинами кинетических параметров, описывающих процессы, протекающие на начальной (до α ~ 10–15%) и на более глубокой стадиях термоокисления. У всех изученных композиций начальная стадия деструкции отличается аномально высокими значениями энергии активации (от 600 до 1000 кДж/моль) и порядка реакции (n ≫ 5). При более глубокой степени превращения образца в высокотемпературной области величины энергии активации и порядка реакции существенно уменьшаются. Причем на кинетической кривой можно выделить не один, а два участка с разными Ea в зависимости от природы и структуры образцов. Например, у всех изученных композиций, отвержденных при 200°С, а также у ненаполненных образцов, отвержденных при 180°С и в ступенчатом режимах высокотемпературная область имеет по два значения Ea и n (табл. 2). Модифицированные образцы, отвержденные при 180°С и в ступенчатом режиме, характеризуются одной величиной высокотемпературной Ea и n.
С целью уточнения величин кинетических параметров термоокислительной деструкции были использованы модели Фридмена и Озавы, [30–36]. В соответствие с моделью Фридмена–Озавы для получения кинетических параметров уравнение (4) преобразовывали применительно к постоянной скорости нагревания для реакции псевдопервого порядка. Был использован график линейной зависимости скорости превращения полимера от температуры в координатах
где наклон линии равен Еа.В отличие от дифференциальных моделей анализа кинетики процессов модель Коатса и Редферна использует интегральное уравнение
В настоящей работе значения Еа были определены из наклонов прямых на графиках зависимостей в координатах
Были получены кривые зависимостей с применением моделей Фридмена–Озавы и Коатса–Редферна. Примеры последних для ненаполненных и наполненных полиэфиримида и ПСФ образцов, отвержденных при 200°С (рис. 5). Как видно, и в этом случае экспериментальные точки ложатся на прямую линию с перегибом, соответствующим низкотемпературному с высоким значением Ea и высокотемпературному с низким значением Eа участкам на температурной шкале, аналогично зависимостям (8)–(9) модели Фримена–Кэррола.
Рис. 5.
Кинетические кривые температурной зависимости, описывающие процесс термоокислительной деструкции с помощью модели Коатса–Редферна в координатах lg[–lnW/T2] = f(1/RT), для образцов ЭД-20+ДАДФС (1), ЭД-20+ДАДФС+полиэфиримид (2) и ЭД-20+ДАДФС+ПСФ (3), отвержденных при 200°С в течение 12 ч.
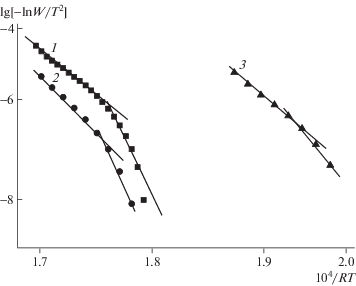
Кинетические параметры, характеризующие термоокислительную деструкцию изученных образцов, рассчитанные с помощью указанных моделей, приведены в табл. 3. Сопоставление данных этой таблицы демонстрирует удовлетворительное совпадение значений кинетических параметров, полученных для одних образцов. Различия между кинетическими параметрами процессов, протекающих на начальной и на более глубокой стадиях термоокислительной деструкции всех изученных образцов эпоксиаминных полимеров, подтверждает, что этот процесс складывается из нескольких разных стадий.
Таблица 3.
Значения эффективной энергии активации процессов термоокислительной деструкции в эпоксидных композициях, наполненных полиэфиримидом и ПСФ, полученные с применением разных кинетических моделей
| Режим отверждения | Уравнение Фримена и Кэррола (ΔlnV)/(ΔlnW) = n + E[–Δ(1/T)/R(ΔlnW)] | Уравнение Фридмана ln[–(dW/dt)/W] = f (–1/RT) | Уравнение Коатса и Редферна lg[–lnW/T2] = f(1/RT) | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Т, °С | время, ч | |||||||||||
| ΔТ, °С | Δα, % | Ea, кДж/моль | n | ΔТ, °С | Δα, % | Ea, кДж/моль | A, c–1 | ΔТ, °С | Δα, % | Ea, кДж/моль | ||
| ЭД-20+ДАДФС | ||||||||||||
| 160–180–200 | 2–4–2 | 393–417 | 0.4–12.0 | 540 ± 50 | >5 | 393–420 | 0.4–12.0 | 500 ± 50 | 2 × 1034 | 393–420 | 0.4–12.0 | 336 ± 50 |
| 420–444 | 12–68 | 280±10 | 1.0 | 420–444 | 12–78 | 330 ± 10 | 1 × 1024 | 420–444 | 12–68 | 282 ± 10 | ||
| 180 | 12 | 396–420 | 1.2–12.0 | 588 ± 50 | >5 | 396–420 | 1.2–12.0 | 387 ± 50 | 1.5 × 1025 | 396–420 | 1.2–12.0 | 430 ± 50 |
| 420–436 | 12–78 | 290 ± 10 | 0.7 | 420–436 | 12–78 | 253 ± 10 | 1.6 × 1015 | 420–436 | 12–78 | 202 ± 10 | ||
| 200 | 12 | 397–420 | 1–12 | 857 ± 50 | >5 | 397–421 | 1–12 | 755 ± 50 | 2 × 1054 | 397–420 | 1–12 | 809 ± 50 |
| 420–436 | 12–78 | 275 ± 10 | 0.7 | 420–436 | 12–78 | 370 ± 10 | 2 × 1024 | 420–436 | 12–78 | 423 ± 10 | ||
| ЭД-20+ДАДФС+полиэфиримид | ||||||||||||
| 160–180–200 | 2–4–2 | 352–376 | 0.4–8.0 | 773 ± 50 | >5 | 352–376 | 0.4–8.0 | 360 ± 50 | 8.4 × 1026 | 352–376 | 0.4–8.0 | 282 ± 50 |
| 376–416 | 8–73 | 212 ± 10 | 1.0 | 376–416 | 8–73 | 270 ± 10 | 1.7 × 1018 | 376–416 | 8–73 | 110 ± 10 | ||
| 180 | 12 | 352–376 | 0.6–4.0 | 810 ± 50 | >5 | 352–376 | 0.6–4.0 | 385 ± 50 | 4.6 × 1028 | 352–376 | 0.6–4.0 | 492 ± 50 |
| 376–433 | 4–77 | 162 ± 10 | 1.0 | 376–433 | 4–77 | 230 ± 10 | 1.6 × 1015 | 376–433 | 4–77 | 262 ± 10 | ||
| 200 | 12 | 412–426 | 5–41 | 512 ± 50 | 1 | 412–426 | 5–41 | 510 ± 50 | 1.2 × 1039 | 412–426 | 5–41 | 540 ± 50 |
| 426–440 | 41–77 | 210 ± 10 | 0.75 | 426–440 | 41–77 | 260 ± 10 | 6.4 × 1017 | 426–440 | 41–77 | 260 ± 10 | ||
| ЭД-20+ДАДФС+ПСФ | ||||||||||||
| 160–180–200 | 2–4–2 | 291–307 | 0.6–9.0 | 612 ± 50 | >5 | 291–307 | 0.6–9.0 | 402 ± 50 | 1 × 1033 | 291–307 | 0.6–9.0 | 280 ± 50 |
| 307–331 | 9–66 | 280 ± 10 | 1 | 307–331 | 9–66 | 297 ± 10 | 3.8 × 1022 | 307–331 | 9–66 | 187 ± 10 | ||
| 180 | 12 | 328–340 | 0.5–8.0 | 500 ± 50 | 5 | 328–340 | 0.5–8.0 | 493 ± 50 | 7.5 × 1033 | 328–340 | 0.5–8.0 | 390 ± 50 |
| 340–370 | 8–68 | 315 ± 10 | 0.5 | 340–368 | 8–68 | 340 ± 10 | 1.4 × 1022 | 340–368 | 8–68 | 173 ± 10 | ||
| 200 | 12 | 341–357 | 2–9 | 500 ± 50 | 2.8 | 341–357 | 1–9 | 730 ± 50 | 4.3 × 1058 | – | – | – |
| 357–370 | 9–76 | 260 ± 10 | 0.2 | 357–370 | 9–76 | 430 ± 10 | 2.3 × 1033 | 350–369 | 9–76 | 437 ± 50 | ||
Анализ параметров, полученных в работе, позволяет отметить высокие значения величин Ea, определенные для каждой из стадий, что указывает на эффективность данного параметра Еа. эфф. Эти стадии включают несколько процессов или различных реакций. Значение Ea.эфф является суперпозицией Ea этих реакций.. Можно полагать, что аномально высокие значения кинетических параметров деструкции, включая энергию активации процесса, протекающего до степени превращения полимера α ~ 10–15% (600–1000 кДж/моль), высокие величины порядка реакции (n ≫ 5), а также высокие значения предэкспоненты (табл. 4) обусловлены наложением диффузионных процессов на протекание химических реакций. При этом диффузионные процессы лимитируют эту стадию процесса. Значительное понижение величин Ea.эфф (до 400–200 кДж/моль и ниже), A и n (до 1.0–0.2) после перегиба на кинетических кривых при ~20%-ной степени превращения означает, что на этом этапе термоокисления эффективные значения параметров связаны с протеканием химических реакций. Диффузионные процессы могут быть вызваны релаксационными процессами размораживания сегментальной подвижности макроцепей в узлах сетки, движением активных частиц, участвующих в химических реакциях, а также торможением подачи кислорода в зону реакции частицами и(или) молекулами наполнителя.
Таблица 4.
Кинетические параметры термоокислительной деструкции фракций, отвержденных исходной ЭД+ДАДФС, а также наполненных полиэфиримидом и ПСФ
| Стадия термоокисли-тельной деструкции | Режим отверждения | Параметры термоокислительной деструкции | ||||
|---|---|---|---|---|---|---|
| T, °С | время, ч | ΔT, °С | α, % | Ea, кДж/моль | A, с–1 | |
| ЭД-20+ДАДФС | ||||||
| I | 160–180–200 | 2–4–2 | 356–380 | 0.5–4.0 | 430 | 1031 |
| 180 | 12 | 401–410 | 5–29 | 330 | 1023 | |
| 200 | 12 | 412–424 | 7–22 | 361 | 1031 | |
| II | 160–180–200 | 2–4–2 | 380–412 | 4.0–29.2 | 250 | 1017 |
| 180 | 12 | 410–430 | 30–50 | 270 | 1013 | |
| 200 | 12 | 425–449 | 22–62 | 254 | 1019 | |
| III | 160–180–200 | 2–4–2 | 412–444 | 29.1–78.0 | 157 | 1011 |
| 180 | 12 | 429–438 | 52–72 | 165 | 1010 | |
| 200 | 12 | 449–459 | 62–97 | 176 | 1012 | |
| IV | 160–180–200 | 2–4–2 | 449–459 | 80–97 | 94 | 105 |
| 180 | 12 | 438–450 | 72–90 | 96 | 105 | |
| 200 | 12 | – | – | – | – | |
| ЭД-20+ДАДФС+полиэфиримид | ||||||
| I | 160–180–200 | 2–4–2 | 360–368 | 1.8–4.5 | 360 | 1026 |
| 180 | 12 | 360–368 | 1.5–4.5 | 300 | 1029 | |
| 200 | 12 | 412–420 | 7.0–22.0 | 361 | 1029 | |
| II | 160–180–200 | 2–4–2 | 368–384 | 4.5–14.5 | 244.5 | 1017 |
| 180 | 12 | 368–377 | 4.5–14.5 | 180.5 | 1015 | |
| 200 | 12 | 420–428 | 22.0–49.0 | 292.0 | 1019 | |
| III | 160–180–200 | 2–4–2 | 384–400 | 14.5–37.0 | 222 | 1015 |
| 180 | 12 | 377–388 | 14.5–37.0 | 100 | 108 | |
| 200 | 12 | 428–438 | 50.0–97.5 | 213 | 1015 | |
| IV | 160–180–200 | 2–4–2 | 400–424 | 37.0–97.0 | 166 | 1010 |
| 180 | 12 | 388–428 | 58–80 | 70 | 105 | |
| 200 | 12 | – | – | – | – | |
| ЭД-20+ДАДФС+ПСФ | ||||||
| I | 160–180–200 | 2–4–2 | 380–400 | 3.0–13.3 | 273 | 1019 |
| 180 | 12 | 380–400 | 3.0–16.0 | 341 | 1027 | |
| 200 | 12 | 406–418 | 10.0–35.2 | 423 | 1030 | |
| II | 160–180–200 | 2–4–2 | 400–420 | 13.0–42.0 | 180 | 1015 |
| 180 | 12 | 400–420 | 3.3–42.5 | 218 | 1015 | |
| 200 | 12 | 412–426 | 35.0–56.0 | 231 | 1017 | |
| III | 160–180–200 | 2–4–2 | 420–440 | 42.5–88.0 | 157 | 1010 |
| 180 | 12 | 418–426 | 42.5–88.0 | 160 | 1013 | |
| 200 | 12 | 420–440 | 56.0–88.0 | 178.5 | 1012 | |
| IV | 160–180–200 | 2–4–2 | 438–448 | 88.0–97.0 | 62.5 | 104 |
| 180 | 12 | 438–448 | 88.0–97.0 | 62.5 | 104 | |
| 200 | 12 | 438–448 | 85.0–97.0 | 70.0 | 105 | |
Наиболее высокое значение Еа.эфф и n у образцов, отвержденных при 200°С (табл. 2), можно объяснить высокой плотностью сетки, звенья макроцепей которой имеют низкую сегментальную подвижность [3, 7, 8, 17, 20, 37]. Причем наблюдается тенденция к некоторому увеличению начальных значений энергии активации образцов ЭД-20+ДАДФС, наполненных полиэфиримидом и ПСФ. У образцов с более рыхлой сеткой, сформировавшейся при 180°С и в ступенчатом режиме отверждения, величины Еа.эфф существенно ниже, чем у отвержденных при 200°С (табл. 2). При этом Ea образцов, содержащих ПСФ, ниже чем у исходной композиции ЭД-20+ДАДФС и у композиции, содержащей полиэфиримид (табл. 3). У системы ЭД-20+ДАДФС с полиэфиримидом начальные значения энергии активации образцов, отвержденных при 180°С Ea = 775 кДж/моль, в ступенчатом режиме – 973 кДж/моль. У образцов ЭД-20+ДАДФС, отвержденных при 180°С, Ea равна 588 кДж/моль, в ступенчатом режиме 915 кДж/моль. У образцов, наполненных ПСФ и отвержденных при 180°С, Еа составляет 485 кДж/моль, отвержденных в ступенчатом режиме – 530 кДж/моль.
Следует отметить, что более высокие значения эффективных кинетических параметров у образцов, предварительно отвержденных при 200°С, соответствуют торможению термоокислительной деструкции на начальной стадии, например, в периоде индукции обусловлены меньшей активностью этих образцов, меньшей величиной изменения удельной теплоемкости ΔCТ, более высокой начальной температурой. Снижение этих эффектов у образцов с меньшей плотностью сетки указывает на значительную роль структурных параметров именно на начальной стадии термоокисления эпоксиаминных композиций.
Из анализа данных, представленных в табл. 3 для образцов различной совместимости компонентов и отвержденных в разных режимах, следуют существенные различия в степенях превращения полимера и показателях порядка реакции, обнаруживаемые в области высоких значений температуры после степени превращения α > 15–20%. Существование нескольких перегибов на кинетических кривых по-видимому обусловлено наложением разных по механизму реакций, протекающих в полимере одновременно.
На первой стадии, соответствующей глубине превращения полимера больше 20%, значения энергии активации приближаются к 250–300 кДж/моль, что характерно для процесса разрушения связей С–С [38], показатель реакции стремится к 1.0 или 0.6–0.7. На втором высокотемпературном интервале величина n находится в пределах 0.5–0.3, Ea имеет существенно более низкое значение (82–90 кДж/моль и соответствует радикально-цепному процессу термоокислительной деструкции [38]). У образцов, содержащих полиэфиримид и ПСФ, отвержденных в условиях формирования “рыхлой” сетки, роль ингибирующей или инициирующей способности наполнителя можно установить при высоких степенях превращения полимера.
Для более детального исследования наполненных эпоксиаминных композитов было принято, что брутто-процесс термоокислительной деструкции складывается из нескольких независимых экзотермических реакций. При этом распределение температуры в пределах образца единообразно, время потери тепла линейно с температурой в разных фракциях полимерного вещества, т.е. в реактантах 1, 2, 3 … j, тогда пользуясь моделями, предложенными в работах Мухиной [39, 40], процесс можно представить следующей схемой:
Здесь в композиции ЭД-20, отвержденной ДАДФС с наполнителями полиэфиримида или ПСФ, [RH] – суммарная концентрация реакционноспособных активных центров, участвующих в процессе деструкции; [RH1]–[RH4] – концентрация концевых групп эпоксидного полимера, звеньев в узлах сетки, звеньев в межузельных цепях, реакционно-способных групп в модификаторах соответственно; θ1–4 – кинетические параметры реакций распада связей; t – время распада.
Композиция наполненного эпоксидного полимера – система гетерогенная, кинетические уравнения включают параметры энергии активации и предэкспоненты, являющиеся не постоянными величинами [41]. В системах существует обмен свободной валентностью между различными активными центрами, осуществляется межмолекулярная передача кинетических цепей окисления и деструкции. Высокомолекулярная природа и особенности сетчатой структуры создают ограничение для перераспределения энергии между активными центрами и реакционно-способными функциональными группами. В результате возникает распределение реакционных центров по кинетическим параметрам. Для таких систем кинетическая кривая С(t) определяется как интеграл:
где f(k) – функция распределения по константам скорости; G(k, t) – система обыкновенных дифференциальных уравнений первого порядка, моделирующих кинетику для отдельных кинетических ансамблей.Для анализа кинетических кривых и получения распределения кинетических параметров предложена система интегральных уравнений, моделирующих полихронный процесс:
Вместо каждого из интегралов можно записать их сумму:
в дифференциальном виде по времениЗдесь d[RHj]/dt – скорость j-той реакции, dΔHi/dt – часть уравнения, моделирующая деструкцию j-той компоненты эпоксидной композиции.
В соответствии с данной моделью уравнение теплового баланса можно записать в виде
Расход реактантов [RH1], [RH2]… [RHj] можно представить в виде относительной величины – степени превращения компонента α. Расход реактантов можно описать уравнениями:
Изменение температуры среды
Начальные условия: T = T0= Ti и α1= α2= … = = αi = 0 при t = 0; ΔHi – тепловой эффект j-той реакции; Eаj – энергия активации j-того реактанта; Aj – предэкспонента Аррениуса для j-той реакции или частотный фактор; α1 α2 …αj – степень превращения фракции 1, 2, 3, … j-того реактанта во времени t; αs – коэффициент теплопереноса. Значения параметров с индексом j относится к реакциям 1, 2, 3, … j.
Из кинетических кривых тепловыделения каждого из образцов были выделены отдельные участки (стадии). Задачу определения температурного интервала, вводимого в уравнение теплового баланса, решали методом Тихонова [42]. Для выделенных участков получены зависимости скорости изменения степени превращения от времени и температуры, рассчитаны значения Еaj и частотного фактора Aj. Результаты расчета представлены в табл. 4. Рассчитанные величины α, Еаj и Аj, характеризующие каждый компонент (фракцию) эпоксидной композиции, который участвует в реакции соответственно своей локальной структуре, описывает процесс разрушения связей, отличающихся своей активностью по отношению к кислороду, его механизм, и вносят соответствующий вклад в брутто-процесс. Соответственно, количество фракций и их параметры различаются в зависимости от структуры образца и природы наполнителя. Число фракций согласуется с набором тех реакций, которые могут происходить в образце. Анализ величин Ea и A, характеризующих каждую фракцию, позволяет заключить, что термоокислительная деструкция изучаемых композиций может включать три и более последовательных процессов в зависимости от образца. Причем основной вклад в термоокислительную деструкцию всех образцов обусловлен разрушением связей С–С эпоксидного связующего. Например, у образца исходного ЭД-20+ДАДФС, имеющего плотную сетку (отвержденного при 200°С), деструкция протекает в три стадии, у образцов, имеющих рыхлую сетку, – в четыре. Первая фракция, которая может включать до 30% разрушенных цепей, проявляется в температурном интервале 350–420°С с величинами Еа, равными 330 ± 50 кДж/моль и А ~ 1022–27. Вторая фракция, приходящаяся на 30–50% полимера, имеет более низкие величины Еа = 270 ± 20 кДж/моль и А = 1017–18, и наконец третья (α = 50–80%) и четвертая (α = 80–97%) фракции соответствуют Еа = = 175 ± 20, А = 1011–12 и 85 ± 15 кДж/моль при А = = 105–8. Величины параметров окисления первой фракции указывают на то, что процесс, протекающий на этой стадии, можно отнести к разрушению полимера, инициированному макрорадикалами [38]. Накопление перенапряженных цепей и разрыв слабых связей с образованием макрорадикалов может происходить в периоде индукции.
В интервале температуры 350–400°С вероятна реакция изомеризации эпоксидной группы в карбонильную, которая сопровождается экзотермическим эффектом; величина Еа этой реакции составляет 214 кДж/моль [38]. Этот же этап процесса может относиться к разрушению активных связей в стыках между цепями, локализованными в сетке и межцепными связями, которые способны разрушаться с энергией активации 185–223 кДж/моль [38]. Исходя из параметров четвертой стадии, она обусловлена радикально-цепным процессом термоокислительной деструкции цепей отвержденной эпоксидной смолы. Данный процесс характеризуется энергией активации от ~92 до 120 кДж/моль [38]. Важно отметить, что в ходе термоокисления через промежуточные радикалы происходит передача кинетической цепи либо на алифатическую связь в межузловых цепях, либо в реакции внутримолекулярного замещения в ароматическое ядро. Более высокие значения Еа и предэкспонент разных фракций, по-видимому, обусловлены высокой плотностью сетки и низкой сегментальной подвижностью межузельных цепей. Величины данных параметров указывают на возможность протекания процессов с промежуточными радикалами, обеспечивающими реализацию передачи кинетической цепи окисления на связи С–С, включенные в ароматическое звено, или в межузловые алифатические цепочки.
У образцов с наполнителями характер изменения кинетических параметров при переходе от одной фракции к другой в ходе термоокислительной деструкции, а также интервалы, в пределах которых изменяются величины Еа и A, аналогичны немодифицированным эпоксиаминным полимерам. Это, по-видимому, указывает на преимущественное протекание процесса разрушения эпоксидной матрицы. При этом наблюдаемые изменения параметров Ea и A могут быть связаны со скоростью подачи кислорода или переноса свободной валентности радикалами эпоксидной матрицы к активным центрам или функциональным связям наполнителей. Также наполнитель может изменять параметры процесса за счет участия радикалов в ингибировании цепного процесса в случае полиэфиримида или его инициировании в случае ПСФ.
Плотность эпоксидного полимера может изменяться вследствие локализации наполнителя между узлами формирующейся сетки. Так как отверждение эпоксидного связующего в присутствии полиэфиримида приводит к формированию лабильных физических связей, реализуется защита узлов формирующейся сетки от напряжения, которое может в ней возникать. Это приводит к преимущественному разрыву связей в межузельных мостиках и к переходу процесса деструкции в цепное окисление алифатических связей. Локализация наполнителя полиэфиримида между узлами сетки увеличивает плотность полимера растет диффузионный коэффициент, что несколько увеличивает отрицательную энергию активации для второй–четвертой фракций полимера, т.е. снижает скорость процесса (табл. 4).
В образце, содержащем ПСФ, последний распадается на радикалы и инициирует их образование в эпоксидной матрице в периоде индукции термоокисления, сокращая последний. Вследствие того, что система совместимая, кинетически контролируемые реакции деструкции связей С–С быстро переходят в цепной процесс окисления, скорее всего, более подвижных алифатических участков межузельных цепей. Инициирование деструкции может происходить за счет распада гидропероксидов, накопившихся при термоокислении связей С–Н алифатических участков в межузельных мостиках. Это резко уменьшает отрицательную энергию активации, что указывает на увеличение скорости процесса.
В ходе термоокисления через промежуточные радикалы возникает передача кинетической цепи либо на алифатическую связь в межузловых цепях, либо в реакции внутримолекулярного замещения в ароматическое ядро. При передаче кинетических цепей появляются слабые связи, ускоряющие разрывы цепей [38]. Для более детального установления влияния наполнителей на механизм термоокисления эпоксиаминного полимера необходимо выявление реакций, которые могут происходить в исследуемых образцах эпоксиаминных композиций с наполнителями полиэфиримидом и ПСФ. С этой целью была осуществлена регистрация состава нелетучих продуктов их окисления.
Нелетучие продукты окисления
Методом ИК-спектроскопии был определен состав нелетучих продуктов, накапливающихся в пленочных образцах композиций при термоокислении в изотермических условиях. В качестве основных продуктов были выбраны эпокси-, карбонильные и гидроксилсодержащие продукты. Состав этих продуктов проанализирован из величины интенсивностей полос при 915, 1725 и 3450 см–1, отвечающих за колебания эпокси-, >C=O и ОН-групп соответственно. Для каждого из образцов оценены изменения содержания отдельных групп и соотношений между ними в зависимости от длительности окисления. Анализ данных показал различия в составе продуктов на количественном уровне и в кинетике изменения их содержания в ходе процесса (табл. 5). Как видно, на состав продуктов оказывает влияние природа наполнителя и строение сетки. Явно различаются образцы с плотной и рыхлой сеткой. Так, например, при окислении образца исходной эпоксиаминной композиции с плотной сеткой (отвержденного при 200°С в течение 12 ч), концентрации ОН- и эпоксидной групп монотонно понижаются и за 24 ч падают в ~2 и 3 раза соответственно, а группы >C=O в первые 12 ч окисления растут в 4.4 раза, затем при более глубоком окислении не изменяются. У рыхлого образца, отвержденного при 180°С, содержание ОН- и эпокси-групп падает за 24 ч в 1.4 раза, а карбонилсодержащих – возрастает в 17.5 раза в первые 12 ч, после не меняется. У образца, отвержденного в ступенчатом режиме, содержание групп ОН понижается в 1.2 раза за первые 12 ч, эпокси-групп монотонно уменьшается в ~1.6 раза за 24 ч. При этом содержание групп >С=О монотонно увеличивается в 4 раза.
Таблица 5.
Содержание продуктов окисления при 180°С композиций на основе ЭД-20 и ДАДФС с наполнителями полиэфиримид и ПСФ. Данные ИК-спектроскопии
| Режим отверждения | Время окисления, ч | Нелетучие продукты деструкции | Соотношения между содержанием функциональных групп | ||||||
|---|---|---|---|---|---|---|---|---|---|
| T, °С | время, ч | D3450 /D1840 (–ОН) |
D1725 /D1840 (>C=O) |
D915 /D1840 (эпоксид) |
D>C=O DOH– |
D >C=O Dэпоксид |
Dэпоксид $D_{{{\text{эпоксид}}}}^{0}$ |
D>C=O$D_{{ > {\text{C}} = {\text{O}}}}^{0}$ | |
| ЭД-20+ДАДФС | |||||||||
| 160–180–200 | 2–4–2 | 0 | 8.1 | 2 | 1.1 | 0.25 | 0.14 | 1.0 | 1.0 |
| 12 | 6.7 | 3.6 | 1.0 | 0.54 | 0.15 | 0.90 | 1.80 | ||
| 24 | 6.7 | 7.9 | 0.7 | 1.18 | 0.10 | 0.64 | 3.95 | ||
| 180 | 12 | 0 | 9.8 | 0.4 | 1.4 | 0.041 | 0.14 | 1.0 | 1.0 |
| 12 | 9.0 | 7.0 | 1.1 | 0.78 | 0.12 | 0.80 | 17.5 | ||
| 24 | 7.0 | 7.0 | 1.0 | 1.0 | 0.14 | 0.70 | 17.5 | ||
| 200 (окисление при 200°С) | 12 | 01224 | 11.07.95.3 | 2.611.511.5 | 2.21.00.7 | 0.241.452.17 | 0.200.130.13 | 1.00.450.32 | 1.04.424.42 |
| ЭД-20+ДАДФС+полиэфиримид | |||||||||
| 160–180–200 | 2–4–2 | 0 | 9.0 | 3.7 | 1.5 | 0.41 | 0.17 | 1.0 | 1.0 |
| 12 | 7.5 | 4.4 | 1.4 | 0.59 | 0.19 | 0.93 | 1.20 | ||
| 24 | 5.5 | 6.0 | 1.3 | 1.09 | 0.24 | 0.87 | 1.62 | ||
| 180 | 2–4–2 | 0 | 5.4 | 3.2 | 0.6 | 0.59 | 0.11 | 1.0 | 1.0 |
| 12 | 3.5 | 4.2 | 0.5 | 1.20 | 0.14 | 0.83 | 1.30 | ||
| 24 | 2.8 | 6.6 | 0.4 | 2.36 | 0.14 | 0.67 | 2.10 | ||
| 200 (окисление при 200°С) | 2–4–2 | 01224 | 5.54.64.3 | 4.34.74.8 | 1.11.00.8 | 0.781.021.12 | 0.200.220.19 | 1.00.900.73 | 1.01.091.12 |
| ЭД-20+ДАДФС+ПСФ | |||||||||
| 160–180–200 | 2–4–2 | 0 | 11.5 | 1.0 | 2.3 | 0.09 | 0.20 | 1.0 | 1.0 |
| 12 | 9.0 | 2.5 | 1.4 | 0.28 | 0.16 | 0.61 | 2.50 | ||
| 24 | 3.7 | 5.3 | 1.0 | 1.43 | 0.27 | 0.43 | 5.30 | ||
| 180 | 2–4–2 | 0 | 7.8 | 2.0 | 1.6 | 0.26 | 0.21 | 1.0 | 1.0 |
| 12 | 5.5 | 3.0 | 1.0 | 0.55 | 0.18 | 0.62 | 1.50 | ||
| 24 | 4.6 | 3.8 | 0.5 | 0.83 | 0.11 | 0.31 | 1.90 | ||
| 200 (окисление при 200°С) | 2–4–2 | 01224 | 2.72.52.5 | 1.22.02.8 | 1.41.30.6 | 0.440.801.12 | 0.520.520.24 | 1.00.930.43 | 1.01.672.30 |
Введение модификаторов оказывает влияние на механизм процесса. Изменение состава продуктов в ходе окисления осуществляется медленнее. Окисление образца ЭД-20+ДАДФС+полиэфиримид, имеющего плотную сетку (отвержденного при 200°С), в течение 24 ч приводит к уменьшению содержания ОН- и эпоксидных групп в ~1.3 раза, и увеличению групп >C=O в 1.1 раза. У образцов с рыхлой структурой, отвержденных при 180°С и в ступенчатом режимах, за 24 ч окисления содержание групп OH снижается в 1.6–1.9 раза, эпокси-групп 1.1–1.5 раза, а групп >C=O увеличивается в 1.6–2.0 раза.
У образца ЭД-20+ДАДФС+ПСФ с плотной сетчатой структурой окисление в течение 24 ч образца практически не изменяет содержания гидроксильных групп, приводит к уменьшению содержания эпоксидных групп при их росте групп >C=O в 2.3 раза (табл. 5). У образцов, имеющих рыхлую сетку, изменение состава продуктов более явно выражено. За 24 ч окисления у образцов, отвержденных при 180°С и в ступенчатом режиме, соответственно снижается содержание групп OH в 1.7 и 3.1 раза, эпоксидных групп в 3.2 и 2.3 раза и растет содержание карбонильных групп в 1.9 и 5.3 раза.
Из приведенных выше данных можно сделать следующие выводы.
Во-первых, во всех эпоксиаминных образцах с ростом глубины процесса наблюдается снижение содержания гидроксильных и эпоксидных групп при увеличении содержания карбонильных. Наибольшее изменение концентрации групп >С=О наблюдается у образца с рыхлой сеткой, а эпоксидных и гидроксильных групп – у образца с плотной сеткой (табл. 5).
Во-вторых, видно изменение соотношения между концентрацией функциональных групп с ростом глубины термоокислительного процесса, что может указывать на изменение механизма реакций деструкции.
На основании соотношений между различными функциональными группами, полученных для всех изученных образцов (табл. 5), были выделены основные типы реакций, способных развиваться в изученных образцах эпоксидного полимера при термоокислении в изотермическом режиме.
Это прежде всего падение содержания эпоксидных и рост карбонильных групп, обусловленное изомеризацией эпоксидных групп в карбонильные.
Накопление ОН- и >C=O-групп соответствует развитию радикально-цепного процесса термоокисления и термоокислительной деструкции через гидропероксид, что характерно для полиолефинов, по-видимому, этот процесс локализован в межузловых звеньях.
Наконец, уменьшение концентрации эпокси- и ОН-групп соответствует разрушению связей С–С при радикально-цепной передаче кинетических цепей радикалами, образующимися при распаде гидропероксида.
Из изменения соотношений между различными функциональными группами в изучаемых образцах можно заключить, что степень отверждения оказывает существенное влияние на механизм реакций. У недоотвержденных образцов преобладает термоокисление и термоокислительная деструкция. Это наблюдается у образцов, отвержденных в дробном режиме и при 180°С. У образцов с плотной сеткой (отверждение при 200°С, 12 ч) термоокислительная деструкция замедлена и преобладают процессы распада связей С–С.
Введение наполнителей в эпоксиаминную композицию изменяет состав функциональных групп, скорость их накопления и соотношение между концентрациями в окисленных образцах. Что указывает на изменение механизма термоокислительного процесса.
Как видно из табл. 5, модификация ЭД-20+ДАДФС по-разному изменяет скорость расходования ОН- и накопления >С=О-групп. У образцов с плотной сеткой, отвержденной при 200°С, концентрация групп ОН слабо изменяется у образца с полиэфиримидом и практически не изменяется с ПСФ. При этом скорость накопления групп >С=О, у образца, содержащего ПСФ, больше по сравнению с ПЭИ. Модификация эпоксиаминного полимера увеличивает соотношение между содержанием групп >С=O и OH при снижении скорости расходования гидроксилсодержащих групп.
У образцов с плотной сеткой, отвержденных при 200°С, содержащих полиэфиримид и ПСФ, скорость расходования групп ОН и накопления >СО ниже, по сравнению с ненаполненным образцом.
У образцов с рыхлой сеткой, отвержденных при 180°С, соотношения [>C=O]/[>C=O]0 за 24 ч окисления у образцов, модифицированных ПСФ и полиэфиримидом, увеличиваются в 1.90 и 2.06 соответственно, против 17.5 раза у немодифицированного образца. В то же время, соотношения [OH]/[OH]0 уменьшаются в 1.9 и 1.7 раза соответственно при соотношении, равном 1.4 у немодифицированного образца. На основании полученных данных можно утверждать, что модификация эпоксиаминного полимера изменяет механизм процесса передачи кинетических цепей при его термоокислении. Изменение соотношения между содержанием групп [>С=О] и [OH] в ходе термоокислительной деструкции в модифицированных образцах может указывать на преобладание в них процесса, протекающего по радикально-цепному механизму, в котором превалирует внутримолекулярная передача кинетических цепей окисления, скорее всего, внутри межузловых алифатических мостиков.
Список литературы
Matějka L., Dukh O., Kolařı́k J. // Polymer. 2000. V. 41. № 4. P. 1449.
Sun S., Sun P., Liu D. // Eur. Polym. J. 2005. V. 41. № 2. P. 913.
Novikov G.F., Rabenok E.V., Bogdanova L.M., Irzhak V.I. // Polymer Science A. 2017. V. 59. № 5. P. 741.
Сайфутдинова М.В., Михальчук В.М., Лыга Р.И. // Вестн. Тверского гос. ун-та. Сер. Химия. 2016. № 4. С. 188.
Сайфутдинова М.В., Лыга Р.И., Михальчук В.М., Дихтенко О.И. // Вестн. Новгородского гос. ун-та. 2017. № 5(103). С. 109.
Gomza Y.P., Klepko V.V., Zhil’tsova S.V., Mikhal’chuk V.M., Savenkova L.A., Konstantinova T.E., Beloshenko V.A. // Polymer Science A. 2010. V. 52. № 6. P. 628.
Il'in S.O., Plotnikova E.P., Kerber M.L., Gorbunova I.Y. // Int. Polym. Sci. Technol. 2012. V. 39. № 7. P. T57.
Ахматова О.В., Зюкин С.В., Вэй Ян Хейн, Смотрова С.А., Кербер М.Л., Осипчик В.С., Горбунова И.Ю. // Пласт. массы. 2010. № 10. С. 55.
Onuchin D.V., Brigadnov K.A., Gorbunova I.Y., Sirotin I.S., Bilichenko Y.V., Filatov S.N., Kerber M.L., Kravchenko T.P., Kireev V.V. // Polymer Science B. 2015. V. 57. № 5. C. 402.
Киреев В.В., Симонов-Емельянов И.Д., Биличенко Ю.В., Бригаднов К.А., Филатов С.Н., Апексимов Н.В., Никитина А.Р. // Пласт. массы. 2016. № 3–4. С. 26.
Onuchin D.V., Sirotin I.S., Pavlova G.A., Filatov S.N., Kireev V.V., Kerber M.L., Gorbunova I.Y. // Polymer Science B. 2018. V. 60. № 2. P. 182.
Чалых А.Е., Жаворонок Е.С., Кочкова З.А., Киселев М.Р. // Хим. физика. 2009. Т. 28. № 6. С. 91.
Сопотов Р.И., Зюкин С.В., Бродский В.А., Кербер М.Л., Дорошенко Ю.Е., Горбунова И.Ю. // Хим. пром-ть сегодня. 2014. № 11. С. 51.
Arinina M.P., Il’in S.O., Makarova V.V., Gorbunova I.Y., Kerber M.L., Kulichihin V.G. // Polymer Science A. 2015. V. 57. № 2. P. 177.
Arinina M.P., Kostenko V.A., Gorbunova I.Y., Il’in S.O., Malkin A.Ya. // Polymer Science A. 2018. V. 60. № 5. P. 683.
До Динь Чунг, Хоанг Тхе Ву, Осипчик В.С., Смотрова С.А., Горбунова И.Ю. // Пласт. массы. 2010. № 10. С. 53.
Сопотов Р.И., Зюкин С.В., Горбунова И.Ю., Кербер М.Л., Дорошенко Ю.Е., Кравченко Т.П., Ильин В.И., Тузова С.Ю. // Пласт. массы. 2015. № 11–12. С. 7.
Полимерные композиционные материалы: структура, свойства, технология / Под ред. А.А. Берлина. СПб.: Профессия, 2014.
Плакунова Е.В., Татаринцева Е.А., Панова Л.Г. // Пласт. массы. 2008. № 1. С. 11.
Shibryaeva L.S., Gorbunova I.Yu., Kerber M.L. // Russ. J. Phys. Chem. B. 2014. V. 8. № 5. P. 733.
Ciobany C., Rosu D., Cascaval C.N., Rosu L. // J. Macromol. Sci., Pure Appl. Chem. A. 2001. V. 38. P. 991.
Terekhina S., Mille M., Fayolle B., Colin X. // Polymer Science A. 2013 V. 55. № 10. P. 614.
Костенко В.А., Бичевий Л.С., Повернов П.А., Борносуз Н.В., Горбунова И.Ю. // Усп. химии хим. технол. 2018. Т. 32. № 6(202). С. 68.
Сопотов Р.И., Горбунова И.Ю. // Усп. химии хим. технол. 2013. Т. 27. № 3. С. 101.
Шибряева Л.С. Успехи в области физикохимии полимеров. М.: Химия, 2004. С. 296.
Shibryaeva L.S., Reshmin Yu.A., Shatalova O.V., Krivandin A.V., Kuksenko E.S., Gorbunova I.Yu., Kerber M.L. // Polymer Science A. 2007. V. 49. № 1. P. 12.
Tertyshnaya Y.V., Shibryaeva L.S., Ol’khov A.A. // Russ. J. Phys. Chem. B. 2015. V. 9. № 3. P. 498.
Flammersheim H.-J., Opfermann J.R. // Macromol. Mat. Eng. 2001. V. 286. № 3. P. 143.
Menczel J.D., Prime R.B. Thermal Analysis of Polymers, Fundamentals and Applications. New York: Wiley, 2009.
Chan J.H., Balke S.T. // Polym. Degrad. Stab. 1997. V. 57. № 1. P. 135.
Куличихин С.Г., Горбунова И.Ю., Кербер М.Л., Самардуков Е.В. // Высокомолек. соед. Б. 1995. Т. 37. № 3. С. 533.
Starink M.J. // Thermochim. Acta. 2003. V. 404. № 1. P. 163.
Ozawa T.J. // J. Thermal. Anal. 1986. V. 31. № 3. P. 547.
Ozawa T.J. // Thermochim. Acta. 2000. V. 355. № 1–2. P. 35.
Ozawa T.J. // J. Therm. Anal. Calorim. 2005. V. 82. № 3. P. 687.
Albu P., Bolcu C., Vlase G., Doca N., Vlase T. // J. Therm. Anal. Calorim. 2011. V. 105. № 2. P. 685.
Irzhak T.F., Irzhak V.I. // Polymer Science A. 2017. V. 59. № 6. P. 791.
Краткий справочник физико-химических величин / Под ред. К.П. Мищенко, А.А. Равделя. Л.: Химия, 1974.
Moukhina E. // J. Therm. Anal. Calorim. 2012. V. 109. № 3. P. 1203. https://doi.org/10.1007/s10973-012-2406-3
Moukhina E. // 39th North American Thermal Analysis Society Conference. Des Moines. 2011. P. 335. https://doi.org/10.1177/0954008311409262.
Пен В.Р. // Химия растительного сырья. 2004. № 2. С. 101.
Сумин М.И. Методы регуляции А.Н. Тихонова для решения оперативных уравнений первого рода / Учебно-методическое пособие. Нижний Новгород: Нижегородский гос. ун-т, 2016.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия Б)


