Высокомолекулярные соединения (серия Б), 2021, T. 63, № 5, стр. 345-353
ВЛИЯНИЕ ХИМИЧЕСКОЙ СТРУКТУРЫ СОПОЛИМЕРОВ ХИТОЗАНА С ОЛИГОЛАКТИДАМИ НА МОРФОЛОГИЮ И СВОЙСТВА МАКРОПОРИСТЫХ ГИДРОГЕЛЕЙ НА ИХ ОСНОВЕ
Т. Н. Попырина a, *, Е. А. Свидченко a, Т. С. Демина a, b, Т. А. Акопова a, А. Н. Зеленецкий a
a Институт синтетических полимерных материалов им. Н.С. Ениколопова Российской академии наук
117393 Москва, Профсоюзная ул., 70, Россия
b Институт регенеративной медицины, Первый МГМУ имени И.М. Сеченова Минздрава России
(Сеченовский Университет)
119991 Москва, ул. Трубецкая, д. 8, стр. 2, Россия
* E-mail: tanjapopyrina@yandex.ru
Поступила в редакцию 04.06.2021
После доработки 30.06.2021
Принята к публикации 19.07.2021
Аннотация
Получены и исследованы материалы в виде термически сшитых пленок и макропористых гидрогелей на основе привитых сополимеров хитозана с олигомерами лактида различного стереохимического состава, синтезированных методом твердофазной реакционной экструзии. Показано, что химическая структура сополимеров, как и молекулярная масса исходного хитозана, существенно влияют на морфологию и свойства материалов. Гетерогенная морфология материалов на основе аморфно-кристаллического олигомера лактида приводит к понижению эффективности сшивания материалов при термической обработке и более высокой степени влагопоглощения макропористых гидрогелей.
ВВЕДЕНИЕ
Разработка новых функциональных материалов с использованием экологически чистых методов их получения является устойчивым направлением развития материаловедения. Применение “зеленых” подходов для синтеза полимеров и их переработки важно при создании высокотехнологичных материалов биомедицинского назначения, например матриксов для тканевой инженерии. Имплантируемые биодеградируемые материалы служат временным “каркасом” для адгезии и роста клеток, и в дальнейшем должны замещаться здоровыми тканями. При их разработке важно обеспечить заданную структуру и свойства матрикса, а также максимально исключить потенциально токсичные компоненты [1].
Полимеры природного происхождения широко используют при создании таких матриксов, поскольку они способны к биодеградации, биосовместимы и обладают биоактивными свойствами [2]. Хитозан, продукт деацетилирования полисахарида хитина, является одним из наиболее перспективных природных полимеров для создания подобных материалов [3–6]. Одним из удобных методов получения биоактивных материалов на основе хитозана традиционно служит сублимационная сушка с получением макропористых гидрогелей, которые обеспечивают контролируемую скорость биодеградации, способны аккумулировать в порах различные добавки, организуя их целевую доставку и пролонгированное выделение; такие материалы находят широкое применение в биомедицине [7–10]. При их получении также можно использовать композиты, которые обычно приготавливают смешением компонентов в гетерогенных условиях, поскольку при комбинировании природных и синтетических макромолекул поиск совместных растворителей всегда сложен [11, 12].
При использовании пористых губок для культивирования клеточных культур необходимо переводить их в не растворимую в водных средах форму. Наиболее простым способом для хитозансодержащих материалов служит термическая обработка [13, 14]. В литературе описаны также различные способы получения устойчивых гидрогелей, которые основаны на ионных взаимодействиях или использовании сшивающих агентов. В первом случае гидрогели получаются нестабильными в средах с высокой ионной силой, а применение сшивающих агентов не всегда безопасно с точки зрения цитосовместимости и требует оптимизации условий сшивания [10, 15, 16]. Для получения хитозансодержащих гидрогелей с заданной архитектурой используют лазерные подходы, основанные на регулярном характере сшивания фоточувствительных композиций [17–19].
Один из важных факторов успешного применения хитозана в материалах биомедицинского назначения – контроль над структурой его макромолекул. Даже “базовые” характеристики хитозана (молекулярная масса и степень деацетилирования) влияют на многие его свойства: от скорости биодеградации и биологических функций до деформационно-прочностного поведения материалов на его основе [20, 21]. Направленное модифицирование химической структуры хитозана открывает ряд новых возможностей как с точки зрения технологий, доступных для формования хитозансодержащих материалов, так и для достижения требуемых свойств.
Основными реакционными центрами при модифицировании хитозана являются его аминные и гидроксильные группы, а в качестве функциональных заместителей используют сульфо-, карбоксиметил-, аллил-, сукцинил- и другие группы [22–25]. Синтез сополимеров хитозана позволяет кардинально менять свойства материалов, а диапазон привитых на хитозан фрагментов также очень широк: полианилин, полиакрилонитрил, полилактид, полиэтиленоксид, поликапролактон и т.д. [26–29]. Но наиболее часто при получении сополимеров хитозана в качестве второго компонента выбирают олиго- или полилактиды. Вызвано это тем, что сложные полиэфиры, в частности полилактид, находят широкое применение в медицине в качестве рассасывающихся шовных материалов, штифтов, имплантов и матриксов для тканевой инженерии [30–32]. Продукты гидролиза полилактида (молочная кислота) не токсичны, а при использовании с хитозаном в одном материале понижается риск воспалительных реакций при разложении в организме [33]. Но основная функция хитозана в таких материалах – повышение их биосовместимости, поскольку гидрофобность полилактида и относительно низкая совместимость с клетками/тканями лимитируют его применение в медицине [34]. Хитозан может быть наполнителем в смесевых композициях с полилактидом или выступать в качестве биоактивного покрытия при нанесении на поверхность материала [35, 36]. Но более эффективный подход для достижения оптимальных свойств материалов на основе полилактида и хитозана основан на синтезе их привитых сополимеров, содержащих фрагменты олиго/полилактида в боковых цепях хитозана. Было выявлено, что подобная модификация хитозана значительно влияет на морфологию и свойства полученных макропористых гидрогелей: распределение пор становится более широким по сравнению с образцами на основе немодифицированного хитозана; коэффициент набухания уменьшается при увеличении количества гидрофобных боковых цепей в привитых сополимерах; становится возможным контроль биодеградации материалов, содержащих привитые фрагменты лактидов [37]. Однако использование расплавных технологий для получения сополимеров хитозана с полилактидом малоэффективно [38], а проведение сополимеризации с использованием растворных технологий требует нескольких синтетических этапов и сложной очистки вследствие применения катализаторов и токсичных растворителей. Также при проведении синтеза в растворе сложно обеспечить достаточную степень полимеризации привитых цепей и высокую производительность процессов [37, 39]. Механохимический подход к синтезу сополимеров хитозана, содержащих привитые фрагменты олиго/полилактида различной длины, отличается простотой проведения процесса и возможностью исключения растворителей и катализаторов, что благоприятно для экологии и для безопасности последующего применения материалов в медицине. Этот способ позволяет достигать высокой степени прививки олиго-/полимеров лактида на хитозан и варьировать гидрофильно/липофильные свойства сополимеров за счет изменения степени полимеризации привитой цепи [40–42]. Значительным преимуществом механохимического подхода является возможность введения непосредственно в процессе сополимеризации дополнительных компонентов, например белков и, таким образом, получения многокомпонентных амфифильных систем с улучшенной биосовместимостью [42, 43].
В настоящей работе использованы полученные механохимическим способом композиции на основе привитых сополимеров хитозана с олиголактидами, в том числе содержащие коллаген, для создания макропористых губок методом сублимационной сушки. Было оценено влияние характеристик исходного хитозана и химической структуры сополимеров на морфологию и свойства получаемых материалов. Для снижения растворимости материалов при последующем использовании в качестве матриксов для тканевой инженерии применяли термическую обработку, которая не требует вовлечения в процесс дополнительных компонентов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали коммерческий хитозан (Х-350) (“Сонат”, Россия) с М = 35 × 104 и степенью деацетилирования 0.86, а также хитозан, обозначенный как Х-80, с М = 8 × 104 и степенью деацетилирования 0.89, полученный методом твердофазного деацетилирования, как описано в работе [44]. Сополимеры хитозана с олиголактидами и системы, дополнительно содержащие коллаген, были получены методом твердофазного реакционного смешения и охарактеризованы ранее [42, 45]. Основные условия получения сополимеров и их обозначения приведены в табл. 1. Реакционное смешение компонентов проводили в двухшнековом опытно-промышленном экструдере марки “Berstrorff” с диаметром шнеков 40 мм, оснащенном силовыми элементами, обеспечивающими высокую диспергирующую способность и возможность проведения механохимических реакций в условиях сдвиговых деформаций [44]. В ходе исследования варьировали состав исходных смесей; температура соэкструзии составляла 55°С. Продукты реакционного смешения фракционировали и исследовали методами ИК-, УФ-спектроскопии и динамического лазерного светорассеяния [42, 45]. Химическая структура привитых сополимеров хитозана с олиголактидами приведена ниже.
Таблица 1.
Основные условия синтеза и характеристики сополимеров хитозана с олиголактидами
| Марка | Компоненты | Состав компонентов, мас. % | Степень прививки, %* | Растворимость в 2%-ной CH3COOH, % |
|---|---|---|---|---|
| ХЛЛ-80 | Хитозан-80/олиго(L-лактид) | 40/60 | 35.1 | 51 |
| ХЛД-80 | Хитозан-80/олиго(L,D-лактид) | 40/60 | 36.7 | 48 |
| ХЛЛ-350 | Хитозан-350/олиго(L-лактид) | 50/50 | 5.4 | 60 |
| ХЛЛ-350-К | Хитозан-350/олиго(L-лактид)/коллаген | 50/46.5/3.5 | 39.2 | 53 |

(СА – степень ацетилирования, СД – степень деацетилирования, СЗ – степень замещения, СП – степень прививки).
Пленки формовали методом полива расчетного количества 1%-ного раствора полимеров в 2%-ной уксусной кислоте на полистирольные чашки Петри диаметром 9 см для получения пленок толщиной 30 мкм, сушили при комнатной температуре испарением растворителя в беспылевом шкафу (∼2 суток). Макропористые гидрогели получали замораживанием 2%-ных растворов полимеров в 4%-ной CH3COOH при –15°С с последующей сушкой под вакуумом из замороженного состояния (лиофильно). Для перевода пленок и макропористых губок в нерастворимую форму их прогревали в термошкафу при 150°С в течение 5 ч. Полученные материалы очищали от несшитых фрагментов дистиллированной водой в течение 2 ч с постоянной сменой воды. Далее пленки сушили в беспылевом шкафу, а губки замораживали при –15°С и сушили лиофильно.
Спектры поглощения пленок из образцов хитозана и его сополимеров с олиголактидами до и после термообработки регистрировали на спектрофотометре “Shimadzu UV 2501 PC” (“Shimadzu”, Япония).
Не растворимую в воде фракцию пленок и макропористых губок рассчитывали по формуле
в которой ${{W}_{h}}\,{\text{и}}\,{{W}_{p}}$ – вес губок после нагревания и после очистки соответственно.
Эксперимент повторяли 3–5 раз, данные рассчитывали как среднее значение со среднеквадратичным отклонением.
Степень набухания пленок и влагопоглощения макропористых гидрогелей α (%) находили по данным гравиметрии:
где m – навеска полимера после набухания/влагопоглощения, mo – навеска полимера до набухания/влагопоглощения. Для этого образцы инкубировали в дистиллированной воде в течение 3 ч, после чего избыток воды удаляли фильтровальной бумагой, а образцы взвешивали.Морфологию пленок исследовали методом сканирующей электронной микроскопии (СЭМ) на приборе “PhenomProX” (“PhenomWorld”, Нидерланды). Морфологию срезов макропористых гидрогелей оценивали по СЭМ-микрофотографиям путем их анализа с помощью программы ImageJ (версия 1.52).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Согласно опубликованным ранее данным, при твердофазном реакционном смешении хитозана с олиго/полиэфирами реакция протекает преимущественно по пути аминолиза сложноэфирных групп аминогруппами хитозана [41]. Это определяет достаточно широкий набор сополимеров, различающихся количеством и длиной привитых цепей в рамках одного образца, что в свою очередь влияет на их свойства, в том числе на растворимость в кислых водных средах – традиционных для хитозана растворителях. Прививка на хитозан гидрофобных фрагментов олиголактида приводит к понижению его растворимости в водных средах, а содержание нерастворимой фракции определяется степенью прививки и характеристиками исходного хитозана: чем выше ММ основной цепи, тем выше растворимость сополимеров даже при более высокой степени прививки фрагментов олиголактида (табл. 1). Характеристики полученных сополимеров, в том числе стереохимический состав привитых цепей влияют на растворимость сополимеров и структурирование их макромолекул в растворах, что в свою очередь определяет структуру и свойства образующихся материалов [45, 46].
Исследование влияния химической структуры сополимеров на морфологию и свойства материалов на их основе на начальном этапе проводили на пленочных образцах. На рис. 1 приведены СЭМ-изображения поверхности пленок из немодифицированных образцов хитозана и их сополимеров с олиголактидами до их термообработки. Образцы на основе хитозана Х-80 и Х-350, а также образец на основе сополимера, содержащего фрагменты аморфного олиго(L,D-лактида) (ХЛД-80), имеют гомогенную структуру, в то время как пленки из сополимерных образцов ХЛЛ-80, ХЛЛ-350 и ХЛЛ-350-К обладают ярко выраженной гетерогенностью, что, вероятно, связано с межмолекулярными взаимодействиями привитых боковых цепей и образованием крупных доменов при испарении растворителя и увеличении концентрации. Введение дополнительного компонента (коллагена) увеличивает неоднородность пленочных материалов.
Рис. 1.
Микрофотографии поверхности пленок из образцов исходного хитозана и сополимерных систем на их основе. Масштабная линейка 50 мкм.

Термическая обработка пленочных образцов для их перевода в не растворимую в воде форму привела к изменению морфологии поверхности, которая стала более гомогенной. Особенно это выражено для образцов на основе хитозана с относительно низкой ММ (Х-80). Поскольку меньшая ММ хитозановых цепей должна обеспечивать их большую подвижность в термопластичной полимерной матрице при нагреве, вероятно, наблюдаемый эффект связан с плавлением доменов олигоэфира, приводящим к перераспределению сетки зацеплений (рис. 2).
Термическая обработка, согласно работе [14], может приводить к повышению водостойкости, потере растворимости и увеличению прочности пленок из хитозана. Обусловлено это несколькими возможными процессами, протекающими во время прогревания материалов из хитозана в солевой форме: разложение солей, ацилирование аминогрупп выделяющимися кислотами, изменение степени кристалличности образцов, а также образование сшитых структур в ходе термоокислительной деструкции полимерных цепей. Авторы работы [14] предполагают, что образование амидов хитозана является основной причиной потери растворимости, а факт протекания процессов ацилирования подтвержден результатами ИК-спектроскопии.
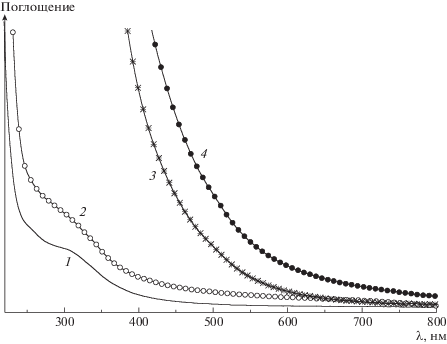
На рис. 3 представлены спектры электронного поглощения пленки из хитозана Х-350 и его сополимера ХЛЛ-350-К до и после термической обработки. Пленка образца ХЛЛ-350-К до прогревания демонстрирует более интенсивное рассеяние света по сравнению с пленкой из Х-350, что согласуется с данными о морфологии образцов, приведенными на микрофотографиях (рис. 1). В спектрах обеих пленок наблюдаются широкие слабые полосы поглощения в области 250–400 нм, которые обычно присутствуют в хитозане [45]. После прогревания обе пленки становятся оптически более однородными, в диапазоне длин волн 600–800 нм интегральный показатель рассеяния хорошо описывается зависимостью $1{\text{/}}{{\lambda }^{p}}$, где p = 4. В области длины волны менее 600 нм оптическая плотность возрастает в обеих пленках, что указывает на образование новых хромофорных групп. Характер таких хромофорных групп в образцах Х-350 и ХЛЛ-350-К одинаков. Вероятнее всего, хромофорные группы связаны с термоокислением и появлением системы сопряженных связей.
Рис. 3.
Спектры электронного поглощения пленки из хитозана Х-350 и его сополимера ХЛЛ-350-К до (1, 2) и после прогревания (3, 4).
Данные оценки эффективности термической сшивки приведены на рис. 4. Наибольшее содержание не растворимой в воде фракции после прогревания (97–99%), отмечено для пленок с гомогенной структурой поверхности – Х-80, Х-350 и ХЛД-80. В пленочных образцах, содержащих домены аморфно-кристаллического олиго(L-лактида) ХЛЛ-80, ХЛЛ-350 и ХЛЛ-350-К (рис. 1), эффективность процессов сшивания несколько снижается (до ∼ 93 мас. % нерастворимой фракции).
Морфология макропористых гидрогелей из исследуемых образцов также зависит от характеристик исходных полимеров. На рис. 5 представлены СЭМ-микрофотографии срезов гидрогелей после прогревания и очистки от несшитых фрагментов. Эффективность термической сшивки гидрогелей совпадала с данными, полученными для пленочных образцов. Изучение их морфологии показало, что все губчатые образцы имеют развитую макропористую структуру, состоящую из системы взаимосвязанных пор с широким распределением по размерам. Средний размер пор составляет 108 ± 38, 111 ± 55, 147 ± 78, 119 ± 25, 102 ± 58 и 107 ± 42 мкм для образцов Х-80, ХЛД-80, ХЛЛ-80, Х-350, ХЛЛ-350 и ХЛЛ-350-К соответственно. Как видно, средний размер пор всех образцов практически одинаков, поскольку процесс формования макропористых гидрогелей проходил при одинаковых условиях (концентрация растворов, температура замораживания). Существенное отличие в структуре имеет только образец ХЛЛ-80 на основе низкомолекулярного хитозана, для которого характерен наибольший средний размер пор 147 ± 78 мкм и более широкое распределение пор по размерам. Вероятно, это связано с минимальной эффективностью сшивки, что приводит к высокому влагопоглощению при очистке образца от несшитых фрагментов, деформации и разрыву стенок пор при повторной сублимационной сушке. Образцы на основе высокомолекулярного хитозана Х-350 и его сополимеров имеют больше вторичных пор в составе первичных по сравнению с образцами на основе низкомолекулярного хитозана, что может быть следствием различной агрегации макромолекул в растворе и, значит, особенностей кристаллизации воды при замораживании растворов.
Рис. 5.
Морфология срезов макропористых гидрогелей после прогревания/отмывки от несшитых фрагментов.

Исследование степени набухания пленок и влагопоглощения гидрогелей в воде показало (рис. 6), что образцы на основе исходного хитозана Х-80, Х-350, а также ХЛД-80, содержащего фрагменты аморфного олигомера лактида, имеют наименьшую степень влагопоглощения (4088 ± 37–4332 ± 16) мас. %). Образцы, содержащие фрагменты аморфно-кристаллического олиго(L-лактида) ХЛЛ-80, ХЛЛ-350, ХЛЛ-350-К, поглощают больше влаги (4949 ± 56 – 6049 ± 43 мас. %) по сравнению с образцом ХЛД-80, что хорошо согласуется с результатами оценки эффективности сшивки. В целом из рис. 6 следует, что в соответствии со структурой и морфологией материала макропористые гидрогели обладают на порядок большими величинами влагопоглощения по сравнению с пленочными материалами.
ЗАКЛЮЧЕНИЕ
Исследование поверхности пленок методом сканирующей электронной микроскопии выявило заметное отличие в морфологии пленок из образцов немодифицированного хитозана и сополимеров, содержащих фрагменты аморфного или аморфно-кристаллического олигомера лактида. Гетерогенная морфология материалов на основе последнего из перечисленных подтверждена данными СЭМ и спектрофотометрии и приводит к снижению эффективности сшивания материалов при термической обработке и к более высокой степени влагопоглощения макропористых гидрогелей. В целом все исследованные образцы пригодны для получения стабильных в воде гидрогелей с системой взаимосвязанных пор и перспективных для применения в различных областях, в первую очередь в качестве материалов биомедицинского назначения.
Синтез, наработка материала и регистрация спектров поглощения выполнены при поддержке Министерства науки и высшего образования Российской Федерации (тема № 0086-2019-0007) с использованием научного оборудования Центра коллективного пользования “Центр исследования полимеров” Института синтетических полимерных материалов Российской академии наук.
Список литературы
O’Brien F.J. // Mater. Today. 2011. V. 14. № 3. P. 88.
Asghari F., Mohammad S., Khosro A., Abolfazl A., Soodabeh D. // Artif. Cells. 2017. V. 45. № 2. P. 185.
Anitha A., Sowmya S., Kumar S., Deepthi S., Chenna-zhi K., Ehrlich H., Tsurkan M., Jayakumar R. // Prog. Polym. Sci. 2014. V. 39. № 9. P. 1644.
Ahmed S., Annu, Sheikh J., Akbar A. // Int. J. Biol. Macromol. 2018. V. 116. P. 849.
Ahsan S.M., Thomas M., Reddy K.K., Sooraparaju S.G., Asthana A., Bhatnagar I. // Int. J. Biol. Macromol. 2018. V. 110. P. 97.
Reys L.L., Silva S.S., Oliveira C., Lopez-Cebral R., Neves N.M., Martins A., Oliveira J.M., Silva T.H., Reis R.L. // Encyclopedia of Marine Biotechnology. New York: Wiley, 2020. P. 2619.
Kim S., Bedigrew K., Guda T., Maloney W.J., Park S., Wenke J.C., Yang Y.P. // Acta Biomaterialia. 2014. V. 10. P. 5021.
Van V.S., Dubruel P., Schacht E. // Biomacromolecules. 2011. V. 12. № 5. P. 1387.
Qian L., Zhang H. // J. Chem. Technol. Biotechnol. 2011. V. 86. № 2. P. 172.
Racine L., Texier I., Auzély-Velty R. // Polym. Int. 2017. V. 66. № 7. P. 981.
Martel-Estrada S.A., Martínez-Pérez C.A., Chacón-Nava J.G., García-Casillas P.E., Olivas-Armendáriz I. // Mater. Lett. 2011. V. 65. P. 137.
Hua W., Ying W., Xiaoying C., Quan W. // Acta Biomaterialia. 2008. V. 4. P. 76.
Demina T.S., Zaytseva-Zotova D.S., Akopova T.A., Zelenetskii A.N., Markvicheva E.A. // J. Appl. Polym. Sci. 2017. V. 134. № 13. P. 17.
Zotkin M.A., Vikhoreva G.A., Kechekian A.S. // Polymer Science B. 2004. V. 46. № 1–2. P. 39.
Kil’deeva N.R., Kasatkina M.A., Drozdova M.G., Demina T.S., Uspenskii S.A., Mikhailov S.N., Markvicheva E.A. // Appl. Biochem. Microbiol. 2016. V. 52. № 5. P. 515.
Azevedo E.P. // Int. J. Pharm. Pharm. Sci. 2015. V. 7. № 12. P. 8.
Revkova V.A., Grebenik E.A., Kalsin V.A., Demina T.S., Bardakova K.N., Shavkuta B.B., Melnikov P.A., Samoilova E.M., Konoplyannikov M.A., Efremov Y.M., Zhang C., Akopova T.A., Troitsky A.V., Timashev P.S., Baklaushev V.P. // Tissue Eng. A. 2020. V. 26. № 17–18. P. 953.
Grebenik E.A., Surin A.M., Bardakova K.N., Demina T.S., Minaev N.V., Veryasova N.N., Artyukhova M.A., Krasilnikova I.A., Bakaeva Z.V., Sorokina E.G., Boyarkin D.P., Akopova T.A., Pinelis V.G., Timashev P.S. // Biomed. Mater. 2020. V. 15. № 1. P. 015011.
Bardakova K.N., Akopova T.A., Kurkov A.V., Goncharuk G.P., Butnaru D.V., Burdukovskii V.F., Antoshin A.A., Farion I.A., Zharikova T.M., Shekhter A.B., Yusupov V.I., Timashev P.S., Rochev Y.A. // Mar. Drugs. 2019. V. 17. № 1. P. 48.
Huang M., Khor E., Lim L.Y. // Pharm. Res. 2004. V. 21. № 2. P. 344.
Jennings J.A. // Chitosan Based Biomaterials. 2017. V. 1. P. 159.
Farion I.A., Burdukovskii V.F., Kholkhoev B., Timashev P.S., Chailakhyan R.K. // Express Polym. Lett. 2018. V. 12. № 12. P. 1081.
Negm N.A., Hefni H.H., Abd-Elaal A.A., Badr E.A., Abou Kana M.T. // Int. J. Biol. Macromol. 2020. V. 152. P. 681.
Dimassi S., Tabary N., Chai F., Blanchemain N., Martel B. // Carbohydr. Polym. 2018. V. 202. № 8. P. 382.
Akopova T.A., Timashev P.S., Demina T.S., Bardakova K.N., Minaev N.V., Burdukovskii V.F., Cherkaev G.V., Vladimirov L.V., Istomin A.V., Svidchenko E.A., Surin N.M., Bagratashvili V.N. // Mendeleev Commun. 2015. V. 25. № 4. P. 280.
Kumar D., Gihar S., Shrivash M.K., Kumar P., Kundu P.P. // Int. J. Biol. Macromol. 2020. V. 163. P. 2097.
Nud'ga L.A., Petrova V.A., Frolov V.I., Gofman I.V., Maslyakova A.V., Zhuravleva N.M. // Polymer Science A. 2005. V. 47. № 2. P. 90.
Bhavsar C., Momin M., Gharat S., Omri A. // Expert Opinion on Drug Delivery. 2017. V. 14. № 10. P. 1189.
Harish Prashanth K.V., Tharanathan R.N. // Trends Food Sci. Technol. 2007. V. 18. № 3. P. 117.
Hamad K., Kaseem M., Yang H.W., Deri F., Ko Y.G. // Express Polym. Lett. 2015. V. 9. № 5. P. 435.
Chhaya M.P., Wunner F.M., De-Juan-Pardo E.M., Schilling A.F., Schantz J., Griensven M., Hutmacher D.W. // Adv. Drug Deliv. Rev. 2016. V. 107. P. 228.
Garlotta D. // J. Polym. Environ. 2001. V. 9. № 2. P. 63.
Ding S., Zhou C. // J. Appl. Polym. Sci. 2004. V. 91. P. 274.
Gritsch L., Conoscenti G., Carrubba V., Nooeaid P., Boccaccini A.R. // Mater. Sci. Eng. 2019. V. 94. № 8. P. 1083.
Demina T.S., Frolova A.A., Istomin A.V., Kotova S.L., Piskarev M.S., Bardakova K.N., Yablokov M.Y., Altynov V.A., Kravets L.I., Gilman A.B., Akopova T.A., Timashev P.S. // J. Appl. Polym. Sci. 2020. V. 137. № 3. P. 48287.
Dorati R., Pisani S., Maffeis G., Conti B., Modena T., Chiesa E., Bruni G., Musazzi U.M., Genta I. // Carbohydr. Polym. 2018. V. 199. № 2. P. 150.
Luckachan G.E., Pillai C.K. // Carbohydr. Polym. 2006. V. 64. № 2. P. 254.
Correlo V.M., Boesel L.F., Bhattacharya M., Mano J.F., Neves N.M., Reis R.L. // Mater. Sci. Eng. A. 2005. V. 403. № 1–2. P. 57.
Feng H., Dong C.M. // Biomacromolecules. 2006. V. 7. № 11. P. 3069.
Demina T.S., Akopova T.A., Vladimirov L.V., Zelenetskii A.N., Markvicheva E.A., Grandfils Ch. // Mater. Sci. Eng. C. 2016. V. 59. P. 333.
Akopova T.A., Demina T.S., Shchegolikhin A.N., Kurkin T.S., Grandfils Ch., Perov N.S., Kechekyan A.S., Zelenetskii A.N. // Int. J. Polym. Sci. 2012. V. 2012. P. 1.
Demina T.S., Kuryanova A.S., Aksenova N.A., Shubnyy A.G., Popyrina T.N., Sokovikov Y.V., Istranova E.V., Ivanov P.L., Timashev P.S., Akopova T.A. // RSC Adv. 2019. V. 9. № 64. P. 37652.
Demina T.S., Kuryanova A.S., Bikmulina P.Y., Aksenova N.A., Efremov Y.M., Khaibullin Z.I., Ivanov P.L., Kosheleva N.V., Timashev P.S., Akopova T.A. // Polymers. 2020. V. 12. № 9. P. 1911.
Akopova T.A., Zelenetskii A.N., Ozerin A.N. // Focus on Chitosan Research. New York: Nova Sci. Publ., 2011. P. 223.
Demina T.S., Bardakova K.N., Minaev N.V., Svidchenko E.A., Istomin A.V., Goncharuk G.P., Vladimirov L.V., Grachev A.V., Zelenetskii A.N., Timashev P.S., Akopova T.A. // Polymers. 2017. V. 9. № 12. P. 302.
Qu X., Wirsen A., Albertsson A. // Polymer. 2000. V. 41. P. 4841.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия Б)





