Высокомолекулярные соединения (серия Б), 2021, T. 63, № 5, стр. 340-344
БИОЦИДНЫЕ СОПОЛИМЕРЫ МЕТАКРИЛОИЛГУАНИДИН ГИДРОХЛОРИДА С МЕТАКРИЛАМИДОМ И ДИАЛЛИЛДИМЕТИЛАММОНИЙ ХЛОРИДОМ
Н. А. Сивов a, *, Н. А. Клещева a, И. Л. Валуев a, Л. И. Валуев a
a Институт нефтехимического синтеза им. А.В. Топчиева Российской академии наук
11999 Москва, Ленинский пр., 29, Россия
* E-mail: sivov@ips.ac.ru
Поступила в редакцию 16.04.2021
После доработки 19.06.2021
Принята к публикации 29.06.2021
Аннотация
Реакцией радикальной полимеризации синтезированы сополимеры метакрилоилгуанидин гидрохлорида с метакриламидом и диаллилдиметиламмоний хлоридом. Определены константы сополимеризации этих мономеров и изучена зависимость биоцидной активности сополимеров от строения цепи макромолекул. Показано, что определяющим в проявлении биоцидной активности является не только состав сополимера, но и характер распределения звеньев метакрилоилгуанидин гидрохлорида по цепи макромолекулы.
В последние годы все большее внимание уделяют синтетическим полиэлектролитам на базе гуанидинсодержащих акрилатных мономеров [1–4]. Интерес к таким полимерам обусловлен в первую очередь тем, что это одни из немногих полимеров, обладающих собственной биологической активностью, что позволяет использовать их в качестве эффективных и безопасных биоцидных и дезинфицирующих средств, флокулянтов, а также композиционных материалов, поверхность которых проявляет бактерицидную и фунгицидную активность [1, 2, 5–9]. В силу особенностей строения гуанидиновой группы ее комплексообразующие свойства, а, следовательно, и биологическая активность, в значительной степени должна определяться полимерным окружением [1, 10–14]. В связи с этим актуальным остается вопрос о взаимосвязи между биоцидной активностью сополимеров и строением полимерной цепи.
Цель настоящей работы – синтез новых гуанидинсодержащих сополимеров метакрилоилгуанидин гидрохлорида (МГГХ) с двумя различающимися по активности в реакции радикальной сополимеризации мономерами: метакриламидом и диаллилдиметиламмоний хлоридом (ДАДМАХ) и изучение зависимости биоцидной активности синтезированных сополимеров от их состава и строения.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали метилметакрилат, метакриламид, диаллилдиметиламмоний хлорид, гуанидингидрохлорид, дейтерорастворители, μ-пероксо-бис-(тетраоксосульфат) аммония (ПСА) (все фирмы “Aldrich”, США).
Синтез метакрилоилгуанидина и МГГХ проводили по ранее разработанным нами методикам [15] реакцией гуанидина с метилметакрилатом в ацетоне и последующим взаимодействием образующегося метакрилоилгуанидина с соляной кислотой.
Метакрилоилгуанидин
Получение гуанидина. В полученный раствор метилата натрия (21.6 г, 0.4 моля в 200 мл метанола) в трехгорлую колбу (объемом 0.5 л) при перемешивании порциями добавляли эквимольное количество (38.0 г, 0.4 моля) гуанидингидрохлорида. Реакционный раствор перемешивали в течение 4 ч и оставляли в холодильнике на ночь. На следующий день раствор гуанидина отфильтровывали от выпавшего осадка хлорида натрия, метанол отгоняли на роторном испарителе, остаток сушили в вукуумном шкафу для получения твердого гуанидина.
Получение метакрилоилгуанидина. К полученному накануне гуанидину в колбе, снабженной мешалкой, термометром, капельной воронкой, добавляли в качестве растворителя ацетон (300 мл) и прикапывали метилметакрилат. В процессе прикапывания метилметакрилата начал образовываться осадок (побочные циклические продукты – циклический аналог метакрилоилгуанидина). Раствор перемешивали определенное время при комнатной температуре. По окончании раствор отфильтровали от осадка, после удаления растворителя получали 37 г метакрилоилгуанидина (выход 70%).
Метакрилоилгуанидин гидрохлорид
МГГХ синтезировали прикапыванием раствора концентрированной соляной кислоты (30 мл, 0.3 моля) к раствору 37 г (0.3 моля) метакрилоилгуанидина в 300 мл ацетона при – 3°С в течение 0.5 ч, после чего перемешивали при комнатной температуре 2.5 ч. Выпавший осадок МГГХ отфильтровывали, промывали сухим ацетоном. Выход МГГХ 39 г (80%). Контроль над процессами проводили с использованием метода ЯМР-спектроскопии.
Спектральные характеристики синтезированных мономеров (табл. 1) полностью подтверждают структуру полученных мономеров (интегральные интенсивности соответствовали количеству протонов: метильная группа – 3Н, протоны при двойной связи – по 1Н, протоны, связанные с азотами в метакрилоилгуанидине – 4Н, аналогичные протоны в МГГХ – 4Н и амидный протон – 1Н [16].
Таблица 1.
Характеристики спектров ЯМР 1Н мономеров

| Соединение | Растворитель | Химические сдвиги δ, м.д. | |||
|---|---|---|---|---|---|
| CH3 | 3Ha | 3Hb | NH | ||
| Метакрилоилгуанидин | ДМСО-d6 | 1.83 | 5.24 | 5.93 | 6.62/7.78 |
| D2О | 1.89 | 5.45 | 5.83 | – | |
| МГГХ | ДМСО-d6 | 1.92 | 5.86 | 6.34 | 8.52/8.72/11.72 |
| D2О | 2.05 | 5.92 | 6.09 | – | |
Реакцию сополимеризации МГГХ и ДАДМАХ, а также МГГХ и метакриламида проводили в воде в атмосфере аргона при 60°С, используя ПСА (5 × × 10–3 моль/л) в качестве инициатора. Суммарная концентрация сомономеров составила 2 моль/л. Соотношение сомономеров менялось от 90 : 10 до 10 : 90. Время сополимеризации во всех опытах составляло 60 мин, чтобы конверсия не превышала 10–15%.
Реакционную смесь из водного раствора высаживали в ацетон, затем фильтровали и после этого образцы подвергали диализу относительно воды с целью освобождения от низкомолекулярных продуктов. Для диализа использовали мембраны Spectrapor Membrane MWCO 1000–50000. После удаления воды получившиеся сополимеры сушили в вакуумном шкафу над P2O5 при 40–60°С до постоянной массы. Образцы получившихся сополимеров анализировали.
Состав сополимеров МГГХ и метакриламида определяли по данным элементного анализа.
Расчет состава сополимеров по данным элементного анализа. По данным элементного анализа для расчета содержания сомономеров определяется параметр R, связывающий соотношение содержания азота и углерода в сополимере. При этом нами принимались во внимание следующие соображения – процентное содержание азота в сополимере складывается из долей каждого из сомономеров (уравнение (1)) и аналогично суммируется содержание углерода (уравнение (2)), при этом учитывается, что x – доля МГГХ в сополимере и (1 – x) – доля метакриламида в сополимере. Для сополимера МГГХ и метакриламида, растворимого, например, в воде, использование метода ЯМР-спектроскопии невозможно, поскольку сигналы протонов метильных и метиленовых групп разных сомономеров перекрываются.
(1)
${{{\text{N}}}_{{{\text{сополимер}}}}} = {{{\text{N}}}_{{{\text{МГГХ}}}}} \times x + {{{\text{N}}}_{{{\text{МАА}}}}} \times (1{\text{ }}--x)$(2)
${{{\text{C}}}_{{{\text{сополимер}}}}} = {{{\text{C}}}_{{{\text{МГГХ}}}}} \times x + {{{\text{C}}}_{{{\text{МАА}}}}} \times (1{\text{ }}--x),$После этого подставляем в пропорцию для параметра R значения Nсополимер и Cсополимер из уравнений (1) и (2), и, получаем выражения для расчета весовой доли МГГХ в сополимере МГГХ и метакриламида:
Подставляя значения R, рассчитанное по данным элементного анализа, получаем весовой состав сополимеров МГГХ и метакриламида. Однако, чтобы правильно подсчитать, например, константы сополимеризации данных сомономеров, следует перевести соотношения из весовых процентов в мольные проценты (или мольные доли), учитывая молекулярную массу сомономеров.
По аналогичной схеме можно вывести уравнение для сополимера МГГХ (x) и ДАДМАХ (1 – x):
Расчет состава сополимеров МГГХ и ДАДМАХ по данным ЯМР. Для сополимеров МГГХ и ДАДМАХ использовали метод ЯМР Н1.
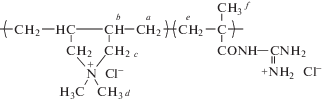
Реперным сигналом может служить интеграл сигналов десяти протонов сомономера ДАДМАХ, связанных с соседними с азотом углеродными атомами, проявляющиеся в области 3.0–4.3 м.д. (протоны c и d). По приведенной ниже формуле можно рассчитать мольную долю сомономера ДАДМАХ.
Интегральные интенсивности сигналов, проявляющихся в сильном поле 1.0–3.0 м.д соответствуют 4 протонам групп CH2 (a) и 2 протонам групп CH (b) диаллильного сомономера ДАДМАХ и 5 протонам СН2 (e) и СН3 (f) в случае МГГХ. Следовательно, по уравнению (6) мы можем определить мольную долю МГГХ – 1HМГГХ:
(6)
$\begin{gathered} 1{{{\text{H}}}_{{{\text{МГГХ}}}}} = \\ = [(\Sigma {\text{I}}{{{\text{H}}}_{{{\text{МГГХ}}}}} + {{{\text{H}}}_{{{\text{ДАДМАХ}}}}})--(1{{{\text{H}}}_{{{\text{ДАДМАХ}}}}} \times 6)]{\text{ }}:{\text{ }}5, \\ \end{gathered} $ΣIHМГГХ + HДАДМАХ – сумма интегралов 5 протонов сомономера МГГХ и 6 протонов сомономера ДАДМАХ.
Исходя из полученных величин мольных долей (уравнения (5) и (6)), можно рассчитать содержание сомономеров в сополимере в мольных процентах или долях.
Элементный анализ проводили методом пиролитической хроматографии на CHNS-анализаторе “Flash 2000 (Thermo Scientific)” (США); газ-носитель гелий, образец 1–4 мг, сжигание при 2000°С.
Спектры ЯМР регистрировали на спектрометре “Bruker DRX–500” (500.13 МГц для 1Н и 125.76 МГц для 13С) в D2О и ДМСО-d6 при 25°С. Спектры ЯМР 1H сополимеров измеряли также на спектрометре “Bruker MDS–300” (300 МГц) в D2O при 20°С, химические сдвиги определяли относительно остаточных протонов растворителя.
Методики биоцидных испытаний приведены в работе [14].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Для выяснения зависимости биоцидных свойств гуанидинсодержащих полимеров от состава и строения полимерной цепи в работе были синтезированы сополимеры МГГХ с двумя различающимися по активности в радикальной полимеризации мономерами – ДАДМАХ и метакриламидом. Сополимеризацию проводили при суммарной концентрации сомономеров 2 моль/л под действием ПСА(5 × 10–3 моль/л) в воде при 60°С до конверсии 10–15%. В табл. 2 приведены зависимости содержания звеньев МГГХ в синтезированных сополимерах от состава исходной мономерной смеси.
Таблица 2.
Зависимость составов сополимеров и средней длины последовательности звеньев МГГХ в сополимере с ДАДМАХ и в сополимере с метакриламидом от состава исходной мономерной смеси
| МГГХ в исходной смеси, мол. % | МГГХ в сополимере с ДАДМАХ, мол.% | Средняя длина последовательности звеньев МГГХ в сополимере с ДАДМАХ (±0.2) | МГГХ в сополимере с метакриламидом, мол. % | Средняя длина последовательности звеньев МГГХ в сополимере с мета-криламидом (±0.2) |
|---|---|---|---|---|
| 20 | 31 | 1.7 | 16 | 1.2 |
| 40 | 58 | 2.7 | 36 | 1.5 |
| 50 | 69 | 3.7 | 43 | 1.8 |
| 60 | 76 | 5.0 | 57 | 2.2 |
| 80 | 91 | 11.1 | 77 | 4.2 |
Видно, что во всем интервале составов сополимер с ДАДМАХ обогащен звеньями более активного МГГХ. Константы сополимеризации для этой мономерной пары, определенные по методу Майо–Льюиса, равны r1 (МГГХ) = 2.7 ± 0.6 и r2 (ДАДМАХ) = 0.6 ± 0.1.
Иная картина наблюдается для пары МГГХ с метакриламидом. В этом случае сополимер обогащается звеньями метакриламида. Константы сополимеризации для этой пары составляют r1 = = 0.8 ± 0.1(МГГХ) и r2 = 1.4 ± 0.4 (метакриламид).
Синтезированные сополимеры различаются характером распределения мономерных звеньев по цепи (табл. 2). Средняя длина последовательностей звеньев МГГХ в сополимерах МГГХ и ДАДМАХ в зависимости от состава сополимера изменялась от 2 до 11 звеньев, а сополимера МГГХ и метакриламида – от 1 до 4.
Исследования бактерицидной активности синтезированных сополимеров показали, что все сополимеры весьма активны и обладают биоцидным действием по отношению к грамположительным (St. Aureus) и грамотрицательным (E. coli) микроорганизмам (табл. 3).
Таблица 3.
Данные по бактерицидности сополимерных производных МГГХ, метакрилоилгуанидина и ДАДМАХ и ряда других полимерных соединений
| Соединение | М1 : М2* | E. coli | St. aureus | МПК** |
|---|---|---|---|---|
| МГГХ–ДАДМАХ | 67 : 33 | +++ | +++ | 21 |
| 77 : 23 | –++ | +++ | 23 | |
| 93 : 7 | –+ | –++ | 24 | |
| МГГХ–метакрилоилгуанидин | 38 : 62 | –++ | –++ | 46 |
| 76 : 24 | –++ | –++ | 42 | |
| 92 : 8 | –++ | –++ | 39 | |
| ПолиМГГХ | 100 | –+ | –++ | 58 |
| ПГМГ ГХ | – | – | – | 6 |
* Состав сополимеров по данным спектроскопии ЯМР 1Н и элементного анализа, М1 – МГГХ или метакрилат гуанидина, М2 – метакриламид или ДАДМАХ. Escherichia coli – кишечная палочка, представитель грамотрицательных бактерий и Staphylococcus Aureus 906 – золотистый стафилококк, представитель грамположительных бактерий; (+++) – сплошной лизис бактериальных клеток, полностью задерживает рост данного штамма, (–++) – – частичный лизис клеток, наблюдаются зоны подавления роста через 48 ч (–+) – частичный лизис клеток, наблюдаются зоны подавления роста через 72 ч.
Видно, что бóльшую бактерицидную активность проявляют сополимеры МГГХ с ДАДМАХ, причем определяющим в проявлении активности является не только содержание МГГХ в сополимере, но и характер распределения его звеньев по цепи, а также необходимость разделения блоков МГГХ звеньями второго сомономера – гомополимеры МГГХ имеют невысокую бактерицидную активность (предпоследняя строка табл. 3).
Бóльшая бактерицидная активность в отношении тестируемых микроорганизмов характерна для сополимеров МГГХ и ДАДМАХ (67 : 33 и 77 : 23). Сополимер МГГХ и метакриламида (38 : 62) проявляет выраженный бактерицидный эффект в отношении грамположительной культуры золотистого стафилококка. Похожий эффект наблюдается и для сополимера МГГХ и ДАДМАХ (93 : 7). Полученные значения активности для синтезированных сополимеров близки к результатам измерения активности сополимеров метакрилат гуанидина и ДАДМАХ схожего сомономерного состава [1, 14]. Если сравнивать с известным биоцидным соединением полигексаметиленгуанидин гидрохлоридом (ПГМГ ГХ) [7], то его активность оказалась значительно выше (последняя строка табл. 3). При этом следует отметить, что данный полимер, получаемый поликонденсацией, имеет невысокую молекулярную массу и фактически является сополимером, что важно.
По имеющимся к настоящему времени данным механизм биоцидного действия катионных полимерных биоцидных веществ, и, в частности, гуанидинсодержащих, подробно рассмотрен в работах [7, 13]. Поскольку микроорганизмы обычно обладают отрицательным суммарным электрическим зарядом, они субстантивны к катиону бактерицидного препарата, который, соприкасаясь с микроорганизмом, адсорбируется на клеточной мембране, вызывает ее лизис и проникает внутрь клетки, перемещая туда же присоединенные вещества или полимерные звенья, отвечающие за усиление биоцидной активности. В своей совокупности этот комплекс воздействий препарата приводит к гибели микроорганизма. Следовательно, сополимеры МГГХ и ДАДМАХ проявляют большую антибактериальную активность, чем сополимеры МГГХ и метакриламида, которые имеют меньший заряд цепи.
Таким образом, полученные результаты свидетельствуют о том, что определяющим в проявлении биоцидной активности сополимерами МГГХ является характер распределения звеньев МГГХ по цепи, необходимость разделения последовательности звеньев МГГХ звеньями другого мономера, а также плотность заряда на цепи сополимера. В связи с этим стратегия создания полимеров с высокой биоцидной активностью должна включать сополимеризацию МГГХ с другими заряженными сомономерами.
Авторы выражают благодарность М.В. Журиной (Институт микробиологии им. С.Н. Виноградского) за помощь в проведении изучения биоцидной активности сополимеров.
Работа выполнена в рамках Государственного задания ИНХС РАН.
Список литературы
Sivov N.A. Biocide Guanidine Containing Polymers: Synthesis, Structure and Properties. Leiden, the Netherlands: Brill Acad. Publ., 2006.
Sivov N.A., Martynenko A.I., Popova N.I. Handbook of Condensed Phase Chemistry. New York: Nova Science Publ. Inc., 2011. P. 287. Ch. 27–32.
Мартыненко А.И., Хаширова С.Ю., Малкандуев Ю.А., Сивов Н.А. Гунидинсодержащие мономеры и полимеры: синтез, структура и свойства. Нальчик: Изд-во М. и В. Котляровых, 2008.
Сивов Н.А. Азотсодержащие соединения. Синтез, структура, свойства, биологическая активность. Saarbrüken, Deutschland: LAP Lambert Acad. Pub., 2014.
Меняшев М.Р., Сивов Н.А., Мартыненко А И., Герасин В.А. // 26 Симпозиум по реологии. Программа и тезисы. Тверь: Изд-во ИНХС РАН им. А.В. Топчиева. 2012. С. 103.
Frommeyer M., Bergander K., Steinbuchel A. // Appl. Environ. Microbiol. 2014. V. 80. № 8. P. 2381.
Воинцева И.И., Гембицкий П.А. Полигуанидины – дезинфицирующие средства и полифункциональные добавки в композиционные материалы. М.: ЛКМ-пресс. 2009.
Duhwan Lee, Yeong Mi Lee, Cherlhyun Jeong, Jun Lee, Won Jong Kim // Chem. Med. Chem. 2014. V. 9. P. 2718.
Menyashev M.R., Gerasin V.A., Guseva M.A., Merekalova N.D., Martynenko A.I., Cивoв H.A., Sivov N.A. // Polymer Science B. 2016. V. 58. № 2. P. 226.
Платэ Н.А., Васильев А.Е. Физиологически активные полимеры. М., Химия. 1986.
Сивов Н.А., Мартыненко А.И., Бондаренко Г.Н., Филатова М.П., Кабанова Е.Ю., Попова Н.И., Сивов А.Н., Крутько Е.Б. // Нефтехимия. 2006. Т. 46. № 1. С. 44.
Martynenko A.I., Popova N.I., Kabanova E.Yu., Lachinov M.B., Sivov N.A. // Polymer Science A. 2008. V. 50. № 7. P. 771.
Афиногенов Г.Е., Панарин Е.Ф. Антимикробные полимеры. СПб.: Гиппократ, 1993.
Малкандуев Ю.А., Хаширова С.Ю., Сарбашева А.И., Байдаева М.Х., Мартыненко А.И., Попова Н.И., Сивов Н.А., Балаева С.М. // Изв. вузов. Северо-кавказский регион. 2012. № 2. С. 71.
Жанситов А.А., Мартыненко А.И., Попова Н.И., Сивов Н.А. // Изв. вузов. Химия и хим. технология. 2012. Т. 55. № 9. С. 46.
Menyashev M.R., Martynenko A.I., Popova N.I., Kleshcheva N.A., Sivov N.A. // Polymer Science B. 2016. V. 58. № 5. P. 556.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия Б)



