Высокомолекулярные соединения (серия Б), 2021, T. 63, № 6, стр. 419-426
ВЛИЯНИЕ СВОЙСТВ АНИОНА НА ПРОЦЕСС ФОРМИРОВАНИЯ ЗОЛЯ МЕДИ ПРИ ВОССТАНОВЛЕНИИ В РАСТВОРЕ ПОЛИ-N-ВИНИЛПИРРОЛИДОНА
Г. Ю. Остаева a, *, В. В. Грушина a, Е. А. Елисеева a, И. Ю. Исаева a, И. В. Моренко a, А. А. Литманович a
a Московский автомобильно-дорожный государственный технический университет (МАДИ)
125319 Москва, Ленинградский пр., 64, Россия
* E-mail: galinaostaeva@mail.ru
Поступила в редакцию 29.06.2021
После доработки 11.08.2021
Принята к публикации 17.09.2021
Аннотация
Получены золи меди путем химического восстановления Cu(II) из водных растворов солей в присутствии поли-N-винилпирролидона. Источниками наночастиц золя служили хлорид, сульфат, нитрат и ацетат меди. Изучено влияние типа аниона соли на поведение полимерной цепи в разбавленных водных растворах поли-N-винилпирролидона. Выявлено уменьшение дисперсии частиц меди по размерам и снижение среднего диаметра наночастиц, полученных восстановлением из солей в растворе поли-N-винилпирролидона, с уменьшением объема аниона и увеличением его силы.
Процесс формирования наноразмерных частиц металлов из солей при восстановлении их в разбавленных растворах полимерного стабилизатора регулируется несколькими факторами: рН среды, тип восстановителя и стабилизатора (желатин, камедь, полярный или неполярный полимер, различные гликоли и т. п.), длина полимерной цепи, концентрация веществ в растворе и их соотношение, температура, проведение процесса в инертной среде (азот, аргон) или на воздухе, выбор в качестве растворителя воды или одного из органических растворителей, а также тип прекурсора частиц. В принципе любая растворимая соль восстанавливаемого металла может служить прекурсором наночастиц. При получении золей меди чаще всего используют сульфат меди, гораздо реже хлорид [1–5]. Частицы, полученные на основе хлорида меди, отличаются меньшим средним диаметром частиц [6], в то время как из сульфатов меди при соблюдении некоторых условий удавалось получать золи даже при использовании в качестве стабилизатора низкомолекулярного ПЭГ 600 [7–9], ПАВ [10–12], желатина [13, 14], хитозана [15]. Ацетат меди представляет собой соль слабого основания и слабой кислоты. Вероятнее всего, поэтому данная соль реже прочих служит источником ионов меди. В случае с ацетатом авторы даже в качестве стандартного электродного потенциала используют СuCH3COO+/Cu + CH3COO– = = 0.285 В вместо стандартного электродного потенциала меди [16]. Слабость этого аниона, по всей видимости, замедляет скорость протекания процесса из-за двустадийности диссоциации исходной соли, что приводит к возникновению меньшего числа центров кристаллизации, а значит, к укрупнению частиц меди [17–20]. Отдельного внимания заслуживают статьи, посвященные получению золей на основе нитрата меди. Нитрат-ион имеет склонность принимать участие в окислительно-восстановительных процессах, протекающих в реакционной системе [21]. В связи с этим зачастую золи меди, синтезированные на основе данной соли, оказываются крайне неустойчивыми, и медь довольно быстро переходит из Cu0 в Cu+. Для получения наночастиц путем восстановления из нитрата меди приходится подбирать условия восстановления и выделения продукта. Так, довольно крупные структуры с размером частиц порядка 100 нм удалось получить электроосаждением из смеси воды и ацетонитрила с последующей промывкой метанолом и сушкой под вакуумом [22]. Мелкоразмерные частицы образуются в основном у тех авторов, которые проводят синтез при нагревании [23, 24], c использованием в качестве восстановителя изопропилового спирта [25, 26], этиленгликоля [27], диэтаноламина [28]. Интересно отметить, что при восстановлении частиц серебра [29–31] или никеля [32, 33] из растворов соответствующих нитратов подобных проблем не возникает, и эти соли часто и успешно применяются.
Имеется информация о влиянии на формирование медьсодержащих наночастиц аниона, не входящего в состав восстанавливаемой соли. В работе [34] рассмотрено получение наночастиц меди путем восстановления ее сульфата боргидридом натрия. В качестве стабилизаторов использовали, только галогенид или тиоцианат калия. Авторы показали, что иодид ион способствует дополнительной стабилизации частиц за счет взаимодействия с ними, а способность к дополнительной стабилизации возрастает в ряду Cl––Br––I–. Также существуют исследования, показывающие, что добавление сульфита натрия приводит к предотвращению процесса окисления наночастиц меди [35].
Наличие аниона в растворе также по-разному сказывается на поведении в нем полимера. Полианионы в присутствии мелких анионов должны сжиматься, поликатионы – координировать анионы на себе. Влияние аниона на поведение полимерной матрицы в средах с различной степенью ионизации необходимо рассматривать индивидуально в каждом случае.
Таким образом, хотя некоторые особенности получения металлических наночастиц широко рассмотрены по отдельности, влияние типа аниона в выбранной соли на конечный размер частиц и устойчивость золя металла до настоящего момента остается недостаточно изученным, имеющиеся сведения разрознены. Более того, основываясь на существующих исследованиях невозможно провести сравнительный анализ роли аниона в процессах формирования наноразмерных частиц металлов, поскольку реакции осуществлялись в различных условиях.
Чтобы сделать выводы о влиянии аниона на процесс формирования частиц меди в растворе полимера, необходимо проведение исследования, в рамках которого изменялся бы только тип соли меди, а все прочие потенциальные факторы влияния были бы одинаковы. В связи с этим в настоящей работе была изучена способность различных анионов восстанавливаемой соли координироваться на полимерной цепи при одинаковых прочих условиях синтеза, а также влияние данного фактора на формирование и свойства наночастиц путем оценки их стабильности и распределения частиц по размерам. В качестве прекурсоров наночастиц были выбраны хлорид, сульфат, нитрат и ацетат меди(II). Ионы меди восстанавливали хорошо растворимым в воде трет-бутиламин-бораном (ТБАБ), позволяющим проводить реакцию с приемлемой скоростью. Полимерным стабилизатором служил неионогенный полимер поли-N-винилпирролидон (ПВП), часто применяемый для синтеза золей металлов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали следующие материалы: двухводный хлорид меди (II) СuCl2 ∙ 2H2O, пятиводный сульфат меди (II) CuSO4 ∙ 5H2O, трехводный нитрат меди Cu(NO3)2 ∙ 3H2O, ацетат меди Cu(CH3COO)2 (“Реахим”), ТБАБ (98%, “Авиабор”), ПВП с M = 36 × 104 (“Aldrich”), дважды дистиллированную воду.
Растворы солей меди с концентрацией 0.2 моль/л и ПВП с концентрацией 0.2 осново-моль/л готовили при 20°C за 1 сутки до эксперимента, раствор ТБАБ с концентрацией 0.2 моль/л – непосредственно перед употреблением.
Для получения медьсодержащих наночастиц использовали реакцию восстановления ионов меди с ТБАБ. В водный раствор, содержащий соль меди и ПВП, добавляли рассчитанное количество свежеприготовленного раствора восстановителя. Концентрация ионов меди в реакционной смеси 0.02 моль/л, соотношение компонентов [ПВП] : [Cu2+] : [ТБАБ] = 1 : 1 : 1.5. Реакцию проводили при температуре 20 ± 0.5°C. На всех стадиях синтеза исследовали динамику изменения pH среды с помощью рН-метра “Mettler-Toledo” (Швейцария) с комбинированным электродом. Окончание реакции фиксировали по прекращению выделения газа и стабилизации рН.
Вязкость раствора полимера в присутствии различных солей меди исследовали с помощью вискозиметра Уббелоде с диаметром капилляра 0.06 см. Раствор готовили в объемном соотношении ПВП : соль меди : вода = 1 : 1 : 4, конечная концентрация ПВП в растворе составляла 0.02 осново-моль/л, соли меди – 0.02 моль/л. Вязкость растворов измеряли при 20 ± 0.5°C.
Термогравиметрический анализ образцов выполняли в атмосфере аргона на приборе “Derivatograph C” (MOM, Венгрия) при скорости нагревания 10 град/мин.
Размер наночастиц определяли методом просвечивающей электронной микроскопии. Исследования проводили на приборе JEM-1011 (“Jeol”, Япония) с цифровой камерой “Gatan” (США), работающей под управлением программы “Digital micrograph” и приборе LEO 912 AB OMEGA (“Carl Zeiss”, Германия).
Образцы для ПЭМ готовили следующим образом: каплю золя наносили на покрытую формваром медную сетку, удаляли избыток жидкости фильтровальной бумагой и высушивали при комнатной температуре в течение 5–10 мин. Для построения гистограмм распределения частиц по размерам анализировали микрофотографии и измеряли размер 200–500 частиц.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Поскольку характер протекания процесса формирования частиц меди в растворах полимеров в значительной степени обусловлен способностью полимерной цепи и растущей частицы к взаимному узнаванию (образование комплекса) [36], а с другой стороны, восстановление меди производится из солей, неизбежно наличие взаимодействия полимерной цепи не только с растущей частицей, но и с анионами соли. Это приводит, в зависимости от характера структуры полимерной цепи, силы и объема аниона, либо к условному укрупнению полимерного агрегата за счет сорбции аниона на полимере в результате локальных электростатических, кулоновских или ван-дер-ваальсовых взаимодействий, либо к сжатию полимерной цепи в результате ухудшения качества растворителя вблизи поверхности полимерного клубка, обусловленного локальным (в окружении полимерного клубка) или общим увеличением концентрации аниона в растворе. Возможность протекания подобных процессов описана в статьях [37, 38]. На примере ПВП установлен характер изменения вязкости полимера в растворах различных солей меди в сравнении с водным раствором. При одинаковых температуре и давлении, концентрации ПВП и соли меди значения вязкости ПВП различаются. Для ПВП, ПВП–CuSO4, ПВП–CuСl2, ПВП–Cu(NO3)2 и ПВП–Cu(СH3COO)2 удельная вязкость ПВП составляет 0.2557, 0.2210, 0.3120, 0.2730 и 0.2275 соответственно. Видно, что при введении в раствор сульфата или ацетата меди наблюдается незначительное снижение вязкости раствора, в то время как введение хлорида или нитрата меди приводит к увеличению вязкости конечного раствора. Причиной данного изменения, вероятно, является разная склонность анионов данных солей к гидратации в водных растворах. Незначительность величины отклонения вязкости в растворах солей от вязкости ПВП в воде обусловлена тем, что ПВП по своей структуре не является ионогенным. Кроме того, известно, что ПВП обладает ярко выраженными абсорбционными свойствами за счет наличия в молекуле группы –N–C=О.
Баланс взаимодействия полимерной цепи с анионами устанавливается в течение некоторого времени, на что указывает следующее наблюдение. При введении в раствор ПВП солей меди значения вязкости стабилизировались не сразу, а постепенно, снижаясь в течение некоторого времени. При измерении времени истечения воды или раствора ПВП без добавления солей такого эффекта не наблюдалось, причем всякий раз устойчивость вязкости раствора достигалась спустя 15–20 мин после смешения раствора ПВП с раствором соли (рис. 1).
Рис. 1.
Изменение вязкости ПВП в присутствии солей меди CuCl2 (1), Cu(NO3)2 (2), Cu(CH3COO)2 (3) и CuSO4 (4).

Данный эффект может быть обусловлен процессом ориентации заряженных частиц аниона вдоль цепи полимера. Это приводит к своего рода компоновке составляющих исследуемой смеси (в случае ацетат и сульфат ионов), что сопровождается увеличением вязкости раствора полимера, либо к сжатию цепи ПВП (в случае хлорид и нитрат ионов), и, как следствие, к снижению вязкости ПВП в солевом растворе по сравнению с раствором ПВП в воде.
Сделанные наблюдения позволяют предположить, что объемные анионы, такие как сульфат или ацетат ион создают вокруг клубка ПВП среду, которая по сравнению с водой воспринимается полимером как плохой растворитель, что вызывает сжатие цепи и, как следствие, снижение вязкости раствора по сравнению с раствором ПВП–вода. В то же время более активные и меньшие по объему ионы хлора и нитрат-ионы успешно абсорбируются на цепи ПВП, формируя вместе более объемные агрегаты, нежели исходные клубки ПВП в воде, что приводит к увеличению вязкости полимера в растворе этих солей. Активность ионов и их объем меняются в ряду Сl– < ${\text{NO}}_{3}^{ - }$ < < ${\text{SO}}_{4}^{{2 - }}$ < CH3COO–, вязкость растворов ПВП уменьшается в последовательности Сl––${\text{NO}}_{3}^{ - }$–CH3COO––${\text{SO}}_{4}^{{2 - }}$. Поскольку диссоциация на ионы в случае ацетата меди происходит не полностью, концентрация ацетат-иона в растворе оказывается ниже теоретически возможной. Этим объясняется более высокая вязкость полимера в растворе ацетата меди, чем в растворе сульфата меди при условии сохранения одинаковых концентраций и температуры.
В ходе реакции восстановления ионов меди ТБАБ изменяется pH среды. Однако динамика изменения pH и характер продуктов реакции в присутствии различных солей меди различны. Из зависимостей рН среды от продолжительности реакции видно (рис. 2), что время пребывания реакционной системы на начальной стадии, на участках падения pH, при наиболее низком значении pH и на участке дальнейшего роста pH зависела от типа аниона соли. Продолжительность различных стадий, как и всего процесса формирования наночастиц меди, увеличивалась с уменьшением объема аниона ${\text{SO}}_{4}^{{2 - }}$ < CH3COO– < < ${\text{NO}}_{3}^{ - }$ < Сl–, т.е. с повышением вязкости системы. В растворах солей с меньшим объемом аниона полимерные цепи более развернуты, что в свою очередь обусловливает возрастание числа контактов макромолекулы с поверхностью растущих наночастиц и увеличением продолжительности стадий реакции восстановления. Аналогичную картину наблюдали при получении наночастиц Cu2O в присутствии ПВП с разной ММ [39]. Вследствие большей вязкости полимера с более высокой ММ скорость роста частиц новой фазы снижалась. Это объяснялось как диффузионными процессами, так и изменением числа адсорбционных контактов макромолекул и частиц.
Рис. 2.
Динамика изменения pH реакционной среды от продолжительности синтеза в присутствии ПВП и CuSO4 (1), CuCl2 (2), Cu(CH3COO)2 (3) и Cu (NO3)2 (4).

Разложение ПВП при нагревании в токе инертного газа происходит в две стадии. До 120°С уходит адсорбированная вода, а основная масса полимера разлагается в интервале температур 380–420°С. При исследовании кривых термодеструкции ПВП и наночастиц меди, сформированных в водных растворах ПВП и исследуемых солей, было отмечено смещение второго порога термодеструкции полимера в сторону меньших температур в случае более слабых ионов и сдвиг порога термодеструкции в высокотемпературную область, когда система создавалась на основе более сильного аниона (рис. 3). Таким образом, по интенсивности влияния анионов на температуру разложения ПВП их можно расположить в ряд CH3COO– < ${\text{SO}}_{4}^{{2 - }}$ < ${\text{NO}}_{3}^{ - }$ < Сl–.
Рис. 3.
Термогравиметрические кривые образцов, полученных восстановлением ионов меди в смеси ПВП и CuCl2 (1), CuSO4 (2), Cu (NO3)2 (3), Cu(CH3COO)2 (4).
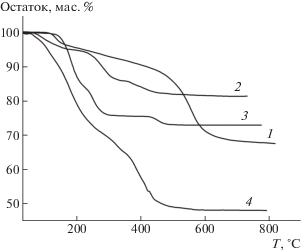
Вероятно, из-за взаимодействия с наночастицами меди сегментарная подвижность полимера замедляется. Деструкция полимера смещается в сторону более высоких температур.
Подобное влияние на термоустойчивость полимера при формировании комплексов с неорганической составляющей наблюдалось и раньше [40]. При формировании комплекса ПММА и гидроксильных групп на поверхности кремниевой частицы за счет кооперативного взаимодействия и образования водородных связей наблюдалось повышение температуры разложения полимера, причем сдвиг начала термодеструкции в высокотемпературную область увеличивался пропорционально росту доли частиц SiO2 в смеси.
При восстановлении ионов меди в присутствии ПВП цвет системы изменялся от голубого до желто-оранжевого, затем становился желто-коричневым в растворе нитрата и лилово-коричневым в растворах хлорида, ацетата или сульфата меди. Интенсивность окраски лилово-коричневых золей усиливалась в ряду: CH3COO––Сl––${\text{SO}}_{4}^{{2 - }}$.
На рис. 4 представлены микрофотографии, а на рис. 5 – гистограммы численного распределения частиц по размерам полученных золей.
Рис. 4.
Микрофотографии золей, полученных на основе CuCl2 (а), Cu(NO3)2 (б), CuSO4 (в) и Cu(CH3COO)2 (г).

Рис. 5.
Гистограммы распределения частиц по размерам золей, полученных на основе CuCl2 (а), Cu(NO3)2 (б), CuSO4 (в), Cu(CH3COO)2 (г).

Микрофотографии (рис. 4а) показывают, что полученная дисперсия содержит наночастицы СuCl2 с узким распределением по размерам, порядка 2–12 нм, и средним диаметром порядка 6.5 нм (рис. 5а).
Агрегативная устойчивость золей и стойкость к окислению наночастиц меди была высокой (более 1 месяца). Золь, полученный на основе нитрата меди, был прозрачным и оказался самым неустойчивым к седиментации. Его устойчивость к окислению также низкая, о чем свидетельствует желто-коричневая окраска, характерная для систем, в которых Cu0 → Cu+1 [41]. Как уже упоминалось выше, данный переход является следствием высокой окислительной способности нитрат иона, для которого реакции восстановления свойственны в широком диапазоне рН. Вероятно, часть восстановителя (ТБАБ) в данной системе расходуется на нитрат ион, и в дальнейшем для получения устойчивых частиц на основе нитрата меди будет необходимо варьировать условия синтеза. В то же время стоит отметить, что по данным электронной микроскопии (рис. 4б) дисперсия из нитрата меди представляла собой комбинацию частиц с распределением по размерам (рис. 5б) от 2 до 7 нм и средним диаметром 3 нм. Также в золе встречались агломераты порядка 300 нм.
На основе сульфата меди были получены темные лилово-коричневые непрозрачные золи. Отсутствие прозрачности указывает на укрупнение частиц по сравнению с ранее описанными золями. На микрофотографии (рис. 4в) видны наночастицы, средний диаметр которых составляет 7 нм, а распределение по размерам колеблется в пределах от 2 до 14 нм (рис. 5в). Золи, полученные из сульфата меди, были устойчивы и не окислялись более одного месяца.
Золь на основе ацетат меди имел светлую лилово-коричневую окраску и был непрозрачным. Верхняя граница золя ниже, чем у остальных образцов, что указывает на наличие процессов перегруппировки частиц меди в матрице ПВП, их укрупнение и формирование агломератов. Результаты электронной микроскопии (рис. 4г) показывают, что полученная дисперсия в основном состояла из частиц диаметром порядка 3 нм, в то время как распределение по размерам колебалось от 2 до 16 нм (рис. 5г). Кроме того, на фотографиях видны агломераты частиц 22–36 нм. Золи на основе ацетата меди были устойчивы в течение трех недель.
По результатам электронной микроскопии можно сделать вывод, что при одинаковых средних диаметрах дисперсия частиц по размерам изменяется в ряду Сl– < ${\text{NO}}_{3}^{ - }$ < CH3COO– < ${\text{SO}}_{4}^{{2 - }}$. Данное наблюдение может быть объяснено тем, что в присутствии более сильных анионов, таких как хлор и нитрат ионы, взаимное узнавание между цепью ПВП и отрицательно заряженной поверхностью частицы происходит на более ранней стадии роста последней и приводит к формированию более прочного комплекса полимер–частица. В случае более крупных анионов, когда полимерная цепь сильнее “скомкана”, комплекс не такой устойчивый, и взаимное узнавание происходит на более поздних стадиях. В результате увеличивается разброс частиц по размерам (как в случае с золями, полученными на основе ацетата и сульфата меди). Кроме того, в наименее вязкой системе – на основе сульфата меди, это приводит к увеличению среднего диаметра частиц. Возможность получения большой доли частиц со средним диаметром порядка 2 нм на основе ацетата меди также можно объяснить меньшим количеством свободных ионов меди, обусловленным спецификой диссоциации соли на ионы и снижением скорости роста частиц наравне с увеличением количества центров кристаллизации в данной системе. В случае ацетат иона и ранее отмечалось свойство этого аниона влиять на структуру синтезируемых медных частиц. Так, в статье [42] авторы, получая медные покрытия методом лазерно-индуцированного осаждения меди из водных растворов медных солей, отмечают, что структуры, образующиеся на основе сульфата меди, отличаются неоднородной морфологией. При использовании хлорида меди образуются агрегаты с более однородной морфологией и лучшей проводящей способностью. Наиболее однородную структуру (непрерывную, единообразную по морфологии) удалось получить на основе ацетата меди, причем ширина этих осаждений оказалась наименьшей, а использование сульфата и хлорида меди способствовало увеличению толщины слоя осаждаемого элемента. Кроме того, авторы отмечают невозможность применения нитрата меди для синтеза медных структур методом лазерно-индуцированного осаждения: в большинстве опытов не удалось получить металлические структуры. Сильное влияние типа аниона соли на ширину осаждаемой структуры авторы связывают с различными величинами перенапряжения при восстановлении меди в исследуемых растворах.
ЗАКЛЮЧЕНИЕ
Настоящая работа дополняет и развивает представления о формировании малых частиц с узким распределением по размерам при восстановлении металлов в полимерных растворах. Результаты подтверждают необходимость установления характера взаимодействия между компонентами системы.
Было проведено сравнительное исследование влияния природы аниона восстанавливаемой соли на процесс формирования наночастиц меди в присутствии полимерного протектора при одинаковых прочих условиях. Установлено, что при синтезе наночастиц необходимо учитывать способность аниона влиять на поведение полимера в растворе. Показано, что вязкость ПВП в присутствии различных анионов снижается с увеличением объема аниона и с уменьшением его активности в ряду Сl– < NO3– < CH3COO– < ${\text{SO}}_{4}^{{2 - }}$, что обусловлено взаимодействием полимерной цепи с анионами. Дисперсия частиц по размерам изменяется в ряду Сl––NO3––${\text{SO}}_{4}^{{2 - }}$–CH3COO–, что связано с влиянием аниона на степень набухания полимера в растворе и его способность к узнаванию растущей частицы меди на более ранней стадии. Отмечено изменение температуры разложения ПВП в присутствии различных анионов: CH3COO– < ${\text{SO}}_{4}^{{2 - }}$ < ПВП< ${\text{NO}}_{3}^{ - }$ < Сl–.
Из полученных результатов следует, что в зависимости от конкретных целей при выборе соли-прекурсора необходимо иметь в виду особенности формирования и свойства образующихся медьсодержащих наночастиц. Несмотря на привлекательность наночастиц меди, полученных из нитрата (минимальный диаметр и узкое распределение по размерам), следует учитывать их быстрое окисление. Наночастицы на основе ацетата меди обладают наибольшей дисперсностью. Часто используемый сульфат меди может оказаться неприемлемым для получения наночастиц, предназначенных для использования, например, в каталитических системах, из-за вероятности присутствия следов серы (отравление катализатора). Наночастицы, полученные восстановлением хлорида меди, характеризуются малым диаметром, узким распределением по размерам, хорошей устойчивостью к агрегации и окислению.
Работа выполнена при финансовой поддержке Министерства науки и высшего образования РФ в рамках государственного задания (тема № FSFM-2020-0010).
Список литературы
Беглецова Н.Н., Селифонова Е.И., Захаревич А.М., Чернова Р.К., Глуховской Е.Г. // Вестн. Южно-Уральского гос. ун-та. Сер. Химия. 2017. Т. 9. № 4. С. 14.
Litmanovich O.E., Marmuzov G.V., Eliseeva E.A., Litmanovich A.A., Bogdanov A.G., Papisov I.M. // Polymer Science A. 2003. V. 45. № 3. P. 287.
Litmanovich O.E., Eliseeva E.A., Litmanovich A.A., Papisov I.M. // Polymer Science A. 2001. V. 43. № 8. P. 813.
Ostaeva G.Yu., Isaeva I.Yu., Morenko I.V., Eliseeva E.A., Litmanovich A.A. // Polymer Science B. 2019. V. 61. № 3. P. 254.
Sharma P., Goyal D., Chudasama B. // Colloid J. 2021. V. 83. № 3. P. 365.
Dadgostar N., Ferdous S., Henneken D. // Mater. Lett. 2010. V. 64. № 1. P. 45.
Авчинникова Е.А., Воробьева С.А. // Вестн. БГУ. 2013. Сер. 2. № 3. С. 12.
Cheng X., Zhang X., Yin H., Wang A., Y. Xu. // Appl. Surf. Sci. 2006. V. 253. № 5. P. 2727.
Ostaeva G.Yu., Papisov I.M., Selishcheva E.D., Arbuzov D.E. // Polymer Science B. 2010. V. 52. № 1–2. P. 86.
Eliseeva E.A., Litmanovich E.A., Ostaeva G.Yu., Chernikova E.V., Papisov I.M. // Polymer Science A. 2014. V. 56. № 6. P. 763.
Орозматова Г.Т., Сатывалдиев А.С., Туратбек К.Н. // Наука, новые технологии и инновации Кыргызстана. 2017. № 2. С. 34.
Орозматова Г.Т., Сатывалдиев А.С., Насирдинова Г.К. // Проблемы современной науки и образования. 2016. № 6 (48). С. 28.
Musa A., Ahmad M.B., Hussein M.Z., Saiman, M.I., Sani H.A. // Nanoscale Res. Lett. 2016. 11:438.
Воробьев С.А., Сайкова С.В., Каримов Е.Э. // Журн. общ. химии. 2016. Т. 86. № 11. С. 1901.
Holubnycha V.M., Trofimenko Y.V., Kalinkevych O.V., Kornienko V.V., Sklyar A.M. // Biomed. Biosocial Anthropology. 2016. № 26. P. 74.
Сименюк Г.Ю. Дис. … канд. хим. наук. Кемерово: Ин-т химии тв. тела и механохимии СО РАН, 2005.
Эфендиева Э.Г., Гаджиева Н.Н., Ильяслы Т.М., Аббасова Р.Ф., Яхьяев Ф.Ф. // Журн. прикл. спектроскопии. 2006. Т. 73. № 3. С. 408.
Huang H.H., Yan F.Q., Kek F.M., Chew C.H. Xu., Ji G.Q., Oh P.S., Tang S.H. // Langmuir. 1997. V. 13. № 2. P. 172.
Tokarek K., Hueso J.L., Kustrowski P., Stocheel G., Kyziot A. // Eur. J. Inorgan. Chem. 2013. V. 2013. № 28. P. 4940.
Solanki J.N., Sengupta R., Murthy Z.V.P. // Solid State Sci. 2010. V. 12. № 9. P. 1560.
Иванова Т.Е., Муслимова А.В. // Изв. вузов. Химия и хим. технология. 2008. Т. 51. № 3. С. 54.
Abduiia-Al-Mamun M., Kusumoto Y., Muruganandham M. // Mater. Lett. 2009. V. 63. № 23. P. 2007.
Valodkar M., Jadeja R.N., Thounaojam M.C., Devkar R.V., Thakore S. // Mater. Chem. Phys. 2011. V. 128. P. 83.
Diaz-Visurraga J., Daza C., Pozo C., Becerra A., Plessing von C., Garcia A. // Int. J. Nanomedicine. 2012. V. 128. P. 3597.
Athawale A.A., Katre P.P., Kuma M., Majumdra M.B. // Mater. Chem. Phys. 2005. V. 91. P. 507.
Kanhed P., Birla S., Gaikwad S., Gade A., Seabra A.B., Rubilar O., Duran N., Rai M. // Mater. Lett. 2014. V. 115. P. 13.
Meshesha B.T., Barrabes N., Madina F., Sueiras J.E. / Proc. 1 WSEAS International Conference on Nanotechnology. Cambridge, 2009. P. 87.
Wen Y., Huang W., Wang B., Fan. J., Gao Z., Yin L. // Mater. Sci. Eng. B. 2012. V. 177. P. 619.
Уточкин С.Д., Шерстнева Т.А., Королёва М.Ю. // Успехи в химии и хим. технологии. 2010. Т. 24. № 7 (112). С. 122.
Кудряшов М.А., Машин А.И., Нежданов А.В., Логунов А.А., Грачева Т.А., Кузьмичева Т.А. // Журн. техн. физики. 2016. Т. 86. № 11. С. 80.
Янилкин В.В., Фазлеева Р.Р., Насретдинова Г.Р., Настапова Н.В., Осин Ю.Н. // Бутлеровские сообщения. 2016. Т. 46. № 4. С. 128.
Синютич Ю.В., Игнатович Ж.В., Королева Е.В., Еремин А.Н., Агабеков В.Е. // Весці Нацыянальнай акадэміі навук Беларусі. Серыя хімічных навук. 2017. № 1. С. 14.
Chandra S., Kumar A., Tomar P.K. // J. Saudi Chem. Soc. 2014. V. 18. № 5. P. 437.
Kapoor S., Joshi R., Mukherjee T. // Chem. Phys. Lett. 2002. V. 354. P. 443.
Prucek R., Kvítek L., Panáček A., Vančurová L., Soukupová J., Jančík D., Zbořil R. // J. Mater. Chem. 2009. V. 19. № 44. P. 8463.
Litmanovich O.E., Litmanovich A.A. // Polymer Science A. 2007. V. 49. № 4. P. 442.
Tom A.M., Vemparala S., Rajesh R., Brilliantov N.V. // Soft Matter. 2017. V. 13. № 9. P. 1862.
Brilliantov N.V., Kuznetsov D.V., Klein R. // Phys. Rev. Lett. 1998. V. 81. № 7. P. 1433.
Ostaeva G.Yu., Isaeva I.Yu., Grushina V.V., Stuzhuk A.N., Odinokova I.V. // Polymer Science B. 2018. V. 60. № 4. P. 455.
Papisov I.M., Grushina V.V., Vygodskii Ya.S., Sapozhnikov D.A., Gritskova I.A. // Polymer Science B. 2008. V. 50. № 3–4. P. 61.
Papisov I.M., Isaeva I.Yu., Ostaeva G.Yu., Eliseeva E.A., Papisova A.I., Kozlovskii V.F. // Colloid J. 2015. V. 77. № 6. P. 780.
Поволоцкий А.В., Поволоцкая А.В., Лесик М.А., Маньшина А.А. // Вестн. СПбГУ. 2010. Сер. 4. № 4. С. 35.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия Б)


