Высокомолекулярные соединения (серия Б), 2022, T. 64, № 1, стр. 43-52
НОВЫЕ МАКРОМОЛЕКУЛЯРНЫЕ ЛИГАНДЫ С ПИРИДИЛ-ХИНОЛИНОВЫМИ ЗВЕНЬЯМИ В ОСНОВНОЙ ЦЕПИ И ИХ МЕТАЛЛ-ПОЛИМЕРНЫЕ КОМПЛЕКСЫ С ЕВРОПИЕМ
М. Я. Гойхман a, *, И. В. Подешво a, Н. Л. Лорецян a, И. В. Гофман a, Р. Ю. Смыслов a, Е. Н. Власова a, А. В. Якиманский a
a Институт высокомолекулярных соединений Российской академии наук
199004 Санкт-Петербург, Большой пр., 31, Россия
* E-mail: goikhman@hq.macro.ru
Поступила в редакцию 01.07.2021
После доработки 14.10.2021
Принята к публикации 30.10.2021
- EDN: SREZFR
- DOI: 10.31857/S2308113922010041
Аннотация
Синтезирован ряд сополиамидов с пиридил-хинолиновыми группами в основной цепи и получены их металл-полимерные комплексы с европием. Все синтезированные полимеры имеют высокие деформационно-прочностные свойства и термостойкость, а металл-полимерные комплексы с европием обладают интенсивной люминесценцией в области 610−620 нм.
ВВЕДЕНИЕ
Среди органонеорганических композитов особое место занимают металл-полимерные комплексы, широко применяющиеся в медицине, биотехнологии и при создании сенсорных, электрo- и фотолюминесцентных устройств [1–3].
Получение металл-полимерных комплексов (МПК) − комплексов переходных металлов с макромолекулярными лигандами − позволяет вводить в полимеры неорганические соединения, создавая гибридные материалы, и придавать полимерам новые или регулировать уже имеющиеся свойства.
В последнее время среди указанных материалов весьма привлекательны МПК на основе лантанидов [4, 5]. Комплексы ионов лантанидов с макромолекулярными лигандами обладают рядом преимуществ как по сравнению с полимерными композитами, содержащими в качестве люминофоров органические молекулы, так и с полимерами, имеющими фрагменты таких молекул в основной или боковой цепях. Это связано, прежде всего, с монохроматичностью излучения (полуширина полосы люминесценции 5−10 нм для комплексов лантанидов, 100 нм и более для органических люминофоров), высокой временной стабильностью излучения, длительным временем жизни возбужденного состояния. Основные требования, предъявляемые к макромолекулярным лигандам, используемым для получения МПК с лантанидами, заключаются в следующем: комплексам на основе таких лигандов необходимо обладать высокой константой устойчивости, а сами лиганды должны препятствовать эффекту тушения люминесценции молекулами растворителя.
Среди многочисленного ряда лантанидных комплексов с полимерами, содержащими органические лиганды в основной цепи, интерес представляют МПК на основе европия и тербия [6]. Введение металлокомплексных фрагментов в полимерную матрицу позволяет регулировать фотофизические свойства материалов в зависимости от природы металла и химической структуры лиганда, сохраняя одновременно такие важные качества полимеров, как технологичность, пленкообразующую способность и другие.
При получении координационных соединений лантанидов часто используют производные пиридина, однако люминесценция данных комплексов подвержена тушению молекулами растворителя. Этот недостаток, в некоторой степени, удается преодолеть, применяя другие азотсодержащие лиганды − 2,2-бихинолин или 1,9-фенантролин, однако стабильность таких комплексов невысока из-за стерических затруднений, вызванных существенными размерами лигандов. В связи с этим, привлекательнее выглядят гораздо менее пространственно затрудненные лиганды – 2-пиридил-хинолин и его производные, благодаря удачному сочетанию структурных и химических свойств [7, 8].
Большинство МПК на основе полимеров с пиридил-хинолиновыми группами представляет собой координационные полимеры, где атом металла входит в основную цепь, образуя координационные связи с низкомолекулярными лигандами, выступающими в роли сомономеров [9, 10].
В некоторых случаях в качестве мономеров используют винильные производные пиридил-хинолина, на основе которых методом радикальной полимеризации получают карбоцепные полимеры с боковыми лигандными группами [11, 12].
Все описанные выше полимеры характеризуются низкой молекулярной массой, невысокими деформационно-прочностными и термическими свойствами.
Сведения о полимерах, содержащих ковалентно-связанные пиридил-хинолиновые группы в основной цепи, в литературе практически отсутствуют. В то же время, известно, что МПК на основе полимеров с лигандными группами в основной цепи обладают не только значимыми фотофизическими, мембранными и электрокаталитическими свойствами [13–15], но и высокой прочностью и термической стабильностью [16]. Таким образом, получение и исследование свойств указанных полимеров представляется актуальной задачей.
Цель настоящей работы − синтез новых бифункциональных мономеров с фрагментами 2-пиридил-хинолина и получение на их основе методом низкотемпературной поликонденсации полимеров, содержащих указанные фрагменты в основной цепи, а также синтез металл-полимерных комплексов европия и изучение их молекулярных, деформационно-прочностных, термических и люминесцентных характеристик.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Очистка исходных соединений и растворителей
В работе использовали 2-ацетилпиридин, о-, м- и п-толуидины, гидроксид калия, сульфолан, окись селена, муравьиную кислоту и перекись водорода − все товарные продукты фирмы “Aldrich”, не подвергаемые дополнительной очистке. Этанол и тионилхлорид очищали простой перегонкой (Ткип = 78°С), 4,4'-диаминодифенилоксид − перегонкой под вакуумом (Тпл = 190°С); N-метилпирролидон сушили гидридом кальция, после чего перегоняли под вакуумом (Ткип = 78°С при 10 мм рт.ст).
Синтез исходных соединений и полимеров
Синтез Еu(TTA)3, где ТТА – теноилтрифторацетон, проводили по методике, описанной в работе [17].
Синтез метилизатинов общей формулы
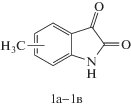
осуществляли по методикам [18] − 1а, 1б и [19, 20] − 1в.
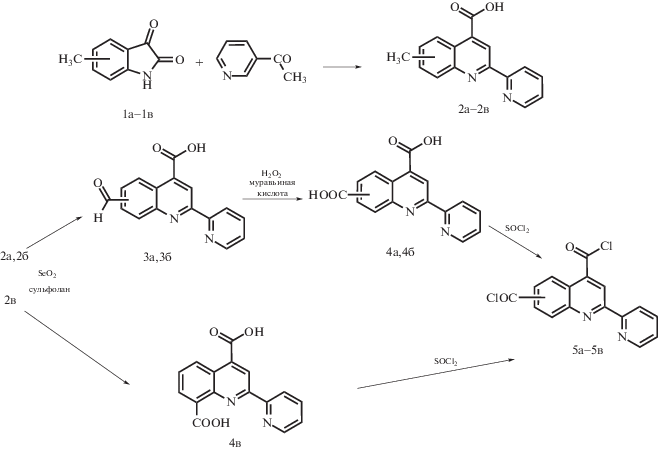
Синтезы 6-, 7- и 8-метил-2-(пиридин-2-ил)хинолин-4-карбоновых кислот 2а−2в выполняли по методике, представленной в работе [12]. В трехгорлую колбу, снабженную мешалкой и обратным холодильником, помещали 2.6 мл 33%-го водного раствора КОН и 0.55 г (3.4 ммоля) метилизатина 1а−1в и перемешивали суспензию до полного растворения осадка. Затем в раствор добавляли 0.97 г (8.02 ммоля) 2-ацетиллпиридина и 5.2 мл этанола. Полученный раствор нагревали при кипении 12 ч, после чего охлаждали до комнатной температуры. Раствор разбавляли 20 мл воды, кипятили без обратного холодильника 30 мин для удаления этанола, охлаждали, экстрагировали серным эфиром и подкисляли 10%-м раствором соляной кислоты до рН 5.
Отфильтрованный осадок сушили и перекристаллизовывали из этанола.
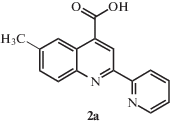
Выход продукта 2а составил 0.63 г (70%). Спектр ЯМР 1Н: (ДМСО-d6, δ, м.д.): 8.97 (c, 1Н), 8.78 (д, 1Н), 8.60 (д, 1Н), 8.55 (с, 1Н), 8.10 (д, 1Н), 8.03 (т, 1Н), 7.73 (д, 1Н), 7.55 (т, 1Н).
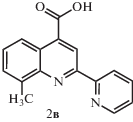
Выход продукта 2б составил 0.61 г (68%). Спектр ЯМР 1Н: (ДМСО-d6, δ, м.д.): 8.95 (c, 1Н), 8.80 (д, 1Н), 8.68 (д, 1Н), 8.60 (д, 1Н), 8.50 (т, 1Н), 8.05 (с, 1Н), 7.61 (д, 1Н), 7.55 (т, 1Н).
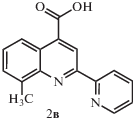
Выход продукта 2в составил 0.56 г (62%). Спектр ЯМР 1Н: (ДМСО-d6, δ, м.д.): 8.98 (c, 1Н), 8.80 (д, 1Н), 8.69 (д, 1Н), 8.58 (д, 1Н), 8.05 (т, 1Н), 7.75 (д, 1Н), 7.67 (т, 1Н), 7.56 (т, 1Н).
Синтез 6- и 7-формил-2-(пиридин-2-ил)хинолин-4-карбоновых кислот 3а, 3б. В одногорлую колбу помещали 0.5 г (1.98 ммоля) 2а или 2б, 0.24 г (2.16 ммоля) диоксида селена, 10 мл сульфолана. Далее колбу нагревали до 205°С за 40 мин, после чего при этой же температуре нагревали еще в течение 2 ч. После охлаждения выпавший серый осадок переносили в 100 мл воды, отфильтровывали, сушили и перекристаллизовывали из ДМФА.
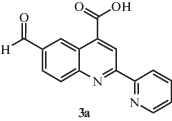
Выход продукта 3а составил 0.45 г (86%). Спектр ЯМР 1Н: (ДМСО-d6, δ, м.д.): 10.25 (с, 1Н), 9.40 (c, 1Н), 9.10 (с, 1Н), 8.81 (д, 1Н), 8.64 (д, 1Н), 8.30 (д, 1Н), 8.22 (д, 1Н), 8.05 (т, 1Н), 7.61 (т, 1Н).
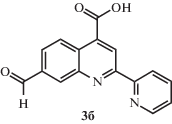
Выход продукта 3б составил 0.44 г (85%). Спектр 1Н ЯМР: (ДМСО-d6, δ, м.д.): 10.30 (с, 1Н), 9.11 (c, 1Н), 8.95 (д, 1Н), 8.83 (д, 1Н), 8.79 (с, 1Н), 8.65 (д, 1Н), 8.12 (д, 1Н), 8.09 (т, 1Н), 7.60 (т, 1Н).
Синтез 2-(пиридин-2-ил)хинолин-4,6- и 2-(пиридин-2-ил)хинолин-4,7-дикарбоновых кислот 4а, 4б. Раствор 0.3 г (1.08 ммоля) 3а или 3б в 32 мл муравьиной кислоты помещали в стакан и охлаждали до 0°С на ледяной бане. Затем при перемешивании по каплям добавляли 3.4 мл 30%-го раствора перекиси водорода так, чтобы температура смеси не превышала 5°С. Далее реакционную смесь помещали в холодильник и выдерживали при температуре 5°С 20 ч, после чего высаживали в 100 мл воды. Выпавший осадок отфильтровывали, сушили и перекристаллизовывали из ДМФА.
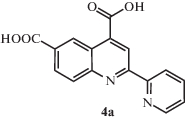
Выход продукта 4а составил 0.28 г (88%). Спектр ЯМР 1Н: (ДМСО-d6, δ, м.д.): 9.50 (c, 1Н), 9.08 (с, 1Н), 8.81 (д, 1Н), 8.55 (д, 1Н), 8.30 (д, 1Н), 8.25 (д, 1Н), 8.08 (т, 1Н), 7.60 (т, 1Н).
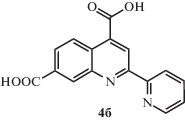
Выход продукта 4б составил 0.27 г (85%). Спектр ЯМР 1Н: (ДМСО-d6, δ, м.д.): 9.10 (c, 1Н), 8.90 (д, 1Н), 8.80 (д, 1Н), 8.72 (c, 1Н), 8.65 (д, 1Н), 8.20 (д, 1Н), 8.09 (т, 1Н), 7.60 (т, 1Н).
Синтез 2-(пиридин-2-ил)хинолин-4,8-дикарбоновой кислоты 4в.
В одногорлую колбу помещали 0.5 г (1.98 ммоля) 2в, 1 г (9.01 ммоля) диоксида селена, 10 мл сульфолана. Колбу нагревали до температуры 205°С за 40 мин, после чего продолжали нагревание при этой же температуре в течение 5 ч. После охлаждения выпал серый осадок, который переносили в 100 мл воды, отфильтровывали, высушивали и перекристаллизовывали из ДМФА.
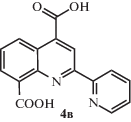
Выход продукта 4в составил 0.46 г (83%). Спектр ЯМР 1Н: (ДМСО-d6, δ, м.д.): 9.02 (c, 1Н), 8.97 (д, 1Н), 8.85 (д, 1Н), 8.50 (д, 1Н), 8.37 (д, 1Н), 8.15 (т, 1Н), 7.90 (т, 1Н), 7.64 (т, 1Н).
Синтез дихлорангидридов 2-(пиридин-2-ил)хинолин-4,6-, 4,7- и 4,8-дикарбоновых кислот 5а−5в. В одногорлую колбу помещали 0.26 г (0.88 моля) дикарбоновой кислоты 4а−4в, 3 мл тионилхлорида и три капли ДМФА. Раствор кипятили в течение 8 ч, после охлаждения выпавший осадок отфильтровывали и сушили. Выход продукта составил 0.25 г (96%). По данным элементного анализа для С16H8Cl2N2O2:
| Вычислено, %: | С | Н | Cl | N | О |
| 58.03 | 2.44 | 21.41 | 8.46 | 9.66 | |
| Найдено, %: | |||||
| для 5а | 58.05 | 2.41 | 21.41 | 8.45 | |
| для 5б | 58.04 | 2.42 | 21.39 | 8.49 | |
| для 5в | 58.0 | 2.47 | 21.45 | 8.42 |
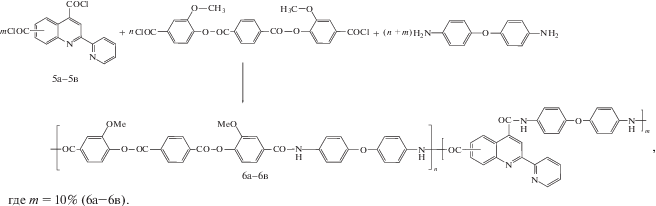
Синтез дихлорангидрида терефталоил-бис-(3-метокси-4-оксибензойной) кислоты 6а−6в проводили по методике, описанной в работе [21].
Синтез сополимеров. К раствору 0.2 г (0.001 моля) 4,4'-диаминодифенилового эфира в 6.07 мл N-метил-2-пирролидона, охлажденному до −15°С, добавляли 0.0336 г (0.0001 моля) дихлорангидрида 5а−5в и 0.4595 г (0.0009 моля) дихлорангидрида терефталоил-бис-(3-метокси-4-оксибензойной) кислоты. Суспензию перемешивали при −15°С в течение 40 мин, после чего снимали охлаждающую баню, вводили 0.1 мл окиси пропилена и, после полного растворения дихлорангидридов, перемешивали при комнатной температуре в течение 4−5 ч. Раствор полимера высаживали в 60 мл этанола. Образовавшиеся полимерные волокна экстрагировали этанолом, затем сушили и растворяли в N-метилпирролидоне. Данные элементного анализа для С3340H2530N220O840:
| Вычислено, %: | C | H | N | O |
| 68.90 | 4.13 | 5.03 | 21.94 | |
| Найдено, %: | ||||
| для 6а | 68.89 | 4.11 | 4.99 | |
| для 6б | 68.87 | 4.11 | 5.02 | |
| для 6в | 68.89 | 4.09 | 5.0 |
Расчет выполнен для сополимеров 6а−6в с (m + n) = 100.
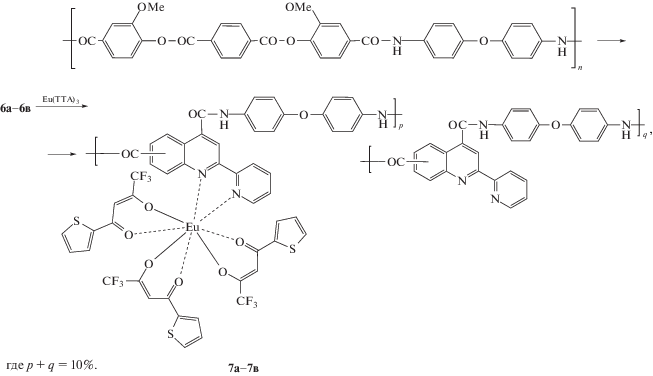
Синтез металл-полимерных комплексов европия 7а−7в. В двугорлую круглодонную колбу, снабженную мешалкой, помещали 0.1508 г (0.239 ммоля) полиамида 6а−6в, содержащего 10% пиридил-хинолиновых звеньев, растворенного в 4 мл N-метилпирролидона. К раствору полимера добавляли 0.0196 г (0.239 ммоля) Eu(TTA)3. Смесь нагревали в течение 10 ч при температуре 90°С. Затем охлаждали до комнатной температуры и высаживали в 60 мл этанола. Образовавшиеся полимерные волокна экстрагировали этанолом, сушили и растворяли в N-метилпирролидоне. По данным элементного анализа:
| Вычислено, %: | C | H | N | O | S | F | Eu |
| 64.98 | 3.82 | 4.43 | 20.74 | 1.38 | 2.46 | 2.19 | |
| Найдено, %: | C | H | N | Eu | |||
| для 7а | 67.68 | 4.03 | 4.84 | 0.69 | |||
| для 7б | 68.01 | 4.06 | 4.89 | 0.51 | |||
| для 7в | 68.65 | 4.11 | 4.99 | 0.1 |
Расчеты выполнены для сополимеров 7а−7в с (m + n) = 100; для сополимеров 7а−7в с (n + p + q) = = 100, для случая прохождения реакции комплексообразования на 100%.
Из полученных растворов полимеров на стеклянных подложках отливали пленки, которые сушили при температуре 100°С до постоянной массы. Толщина пленок 25 мкм.
Методика приведена для металл-полимерного комплекса 7a, содержащего 10% пиридил-хинолиновых звеньев при эквимольном соотношении пиридил-хинолиновое звено : Eu(TTA)3.
Спектры ЯМР 1Н для 1%-х растворов в ДМСО-d6 регистрировали на спектрометре “Аvance-400” (“Вruker”, Германия) с рабочей частотой на ядрах ЯМР 1Н − 400 МГц, внутренний стандарт Me4Si.
ИК-спектры регистрировали на ИК-фурье-спектрометре “Vertex 70” фирмы “Bruker” при комнатной температуре в диапазоне 400–4000 см–1 (разрешение 4 см–1, число сканов − 30) с применением микроприставки однократно нарушенного полного внутреннего отражения (ОНПВО) Pike с рабочим элементом, изготовленным из ZnSe. При регистрации спектров ОНПВО вводили поправку, учитывающую глубину проникновения в зависимости от длины волны. При использовании метода ОНПВО длину пути луча через образец определяли глубиной его проникновения в образец. При одинаковой жесткости пленок и одинаковом прижиме можно также одинаковыми считать и толщину образцов.
Механические характеристики пленок сополиамидов и комплексов при комнатной температуре определяли в режиме одноосного растяжения с помощью универсальной установки для механических испытаний “AG-100kNX Plus” (“Shimadzu”, Япония). В процессе испытаний определяли следующие характеристики пленок: модуль упругости Е, предел пластичности σп, прочность σр и предельную деформацию до разрушения εр.
Термостойкость исследуемых пленок определяли методом термогравиметрического анализа с помощью установки совмещенного термического анализа “DTG-60” (“Shimadzu”, Япония). Образцы массой ~5 мг нагревали в открытом корундовом тигле в воздушной атмосфере до 600°С со скоростью 5 град/мин. По полученным кривым изменения массы в процессе нагревания находили индексы термостойкости материала Т5 и Т10 – температура, по достижении которой в ходе нагревания масса полимера или комплекса снижалась на 5 и 10% соответственно. Одновременно с кривыми ТГА регистрировали тепловые эффекты процессов, проходящих при нагревании образцов (кривые ДТА). Сигнал, фиксируемый на этих кривых – разница температуры образца и контрольного тигля в канале сравнения прибора как функция температуры нагревания.
Молекулярные массы сополимеров определяли методом гель-проникающей хроматографии в соответствии с методикой [22].
Спектры люминесценции полимерных пленок снимали на спектрофлуориметре “LS-100” фирмы “PTI”. Использовали ширину щелей монохроматоров возбуждения и регистрации 1 мм при обратной линейной дисперсии 4 нм/мм. Фотолюминесценцию возбуждали при длине волны 360−380 нм в полосе поглощения формируемого металл-полимерного комплекса с ионами EuI.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Дикарбоновые кислоты пиридил-2-(пиридин-2-ил)хинолинового ряда, которые можно использовать для синтеза полимерных лигандов методом поликонденсации, в литературе не описаны. Для получения их близких аналогов – дикарбоновых кислот с фрагментами 2-фенилхинолина − применяют реакцию Дебнера [23], которая заключается во взаимодействии аминобензойных кислот с бензальдегидом и пировиноградной кислотой, или реакцию Пфитцингера [24], где в качестве исходных соединений выступают эфиры изатинкарбоновых кислот. Оба эти подхода не лишены недостатков, связанных с необходимостью синтеза промежуточных соединений, использованием дорогостоящих реагентов и невысоким выходом целевого продукта.
В настоящей работе предложен новый способ получения 2-(пиридин-2-ил)хинолиндикарбоновых кислот, который состоит в синтезе 6-, 7- или 8-метил-2-(пиридин-2-ил)хинолин-4-карбоновых кислот с последующим окислением метильных групп в карбоксильные. В соответствии с этим подходом на первом этапе были синтезированы 5-, 6- и 7-метилизатины 1а−1в (схема 1), взаимодействием которых с 2-ацетилпиридином в условиях реакции Пфитцингера были получены 6-, 7- и 8-метил-2-(пиридин-2-ил)хинолин-4-карбоновые кислоты 2а−2в соответственно. Метильные группы соединений 2а, 2б окислялись диоксидом селена до альдегидных групп, при этом были получены соответствующие альдегиды 3а, 3б. Окислением альдегидных групп соединений 3а, 3б перекисью водорода синтезированы 2-(пиридин-2-ил)хинолин-4,6- и 2-(пиридин-2-ил)хинолин-4,7-дикарбоновые кислоты 4а, 4б соответственно:
Что же касается 8-формил-2-(пиридин-2-ил)хинолин-4-карбоновой кислоты, то в чистом виде ее выделить не удалось, поскольку метильная группа соединения 2в, находящаяся рядом с атомом азота хинолинового цикла, обладает высокой химической активностью и при окислении ее диоксидом селена в условиях, использованных для получения 3а, 3б, образуется трудноразделимая смесь альдегида и дикарбоновой кислоты. Поэтому 2-(пиридин-2-ил)хинолин-4,8-дикарбоновая кислота 4в была синтезирована непосредственно из 2в с использованием значительного избытка диоксида селена (схема 1).
При синтезе базовых пиридил-хинолинсодержащих полимеров, которые могут выступать в качестве макромолекулярных лигандов, для создания МПК были использованы полиамиды, поскольку эти полимеры характеризуются хорошими деформационно-прочностными свойствами, высокой термической стабильностью и растворимостью в амидных растворителях. Для получения полимеров применялся метод низкотемпературной поликонденсации [25]:
В качестве второго сомономера для проведения реакции поликонденсации был выбран дихлорангидрид терефталоил-бис-(3-метокси-4-оксибензойной) кислоты, поскольку получаемые на его основе полимеры обладают высокой молекулярной массой и хорошими деформационно-прочностными и термическими свойствами. В роли диаминной компоненты выступал 4,4'-диаминодифениловый эфир, так как мостиковый атом кислорода в его структуре оказывает положительное влияние на растворимость полимеров.
Были синтезированы сополиамиды, содержащие 10 мол. % пиридил-хинолиновых звеньев 6а−6в. При выборе соотношения комплексообразующих и нейтральных звеньев в сополимере учитывались следующие соображения: с одной стороны, содержание комплексных фрагментов в МПК должно быть достаточным для проявления заметных люминесцентных свойств, с другой − это содержание не должно быть избыточным во избежание эффекта концентрационного тушения люминесценции. При синтезе сополимеров было выбрано соотношение указанных звеньев 1 : 9, основанием послужили данные предыдущих работ, в которых было показано, что это соотношение является оптимальным [25].
Молекулярная масса сополиамидов, определенная с помощью метода гель-проникающей хроматографии, для 6а составила 41 × 103, для 6б − 39 × 103 и для 6в − 38.5 × 103.
Согласно литературным данным [26, 27], МПК европия обычно получают взаимодействием полимеров (схема 3), содержащих лигандные группы, с низкомолекулярным комплексом Eu(TTA)3:
Степень модификации полимеров была определена с помощью элементного анализа. Показано, что количество пиридил-хинолиновых групп полимерной цепи, вступивших в реакцию с Eu(TTA)3, составляет 29 мол. % для сополимера 6а, 21 мол. % для сополимера 6б и 4% для сополимера 6в. Эти результаты были подтверждены данными ИК-спектроскопии. В ИК-спектрах металл-полимерных комплексов 7а, 7б наблюдается заметное, по сравнению с исходными полимерами 6а и 6б, уменьшение интенсивности полосы 1667 см−1, которую можно отнести к колебанию связи С=N пиридил-хинолинового фрагмента. Причем эти изменения больше для 7а, нежели для 7б. Одновременно с этим в спектрах 7а, 7б увеличивается интенсивность полосы в области 715 см−1, относящаяся к тиофеновому циклу [28], причем интенсивность этого сигнала для 7а выше, чем для 7б. В ИК-спектре 7в после проведения реакции не наблюдается изменений, что указывает на отсутствие комплексообразования.
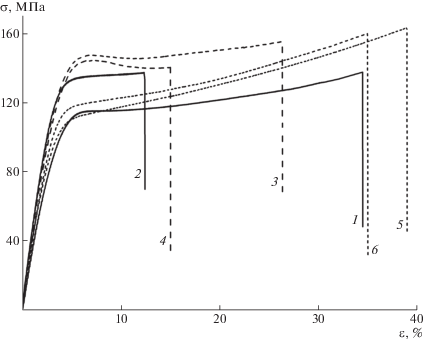
Как видно из табл. 1, все полученные в работе сополиамиды и комплексы на их основе образуют прочные нехрупкие пленки (прочность 130− 160 МПа, а предельная деформация до разрушения – выше 10%), характеризуемые повышенной жесткостью (модуль упругости – выше 4 ГПа).
Таблица 1.
Механические и термические свойства пленок сополиамидов и комплексов с европием
| Полимер | Е, ГПа | σп, МПа | σр, МПа | εр, % | Т5, °С | Т10, °С |
|---|---|---|---|---|---|---|
| 6а | 4.16 ± 0.23 | 119 ± 4 | 132 ± 4 | 35 ± 2 | 346 | 359 |
| 7а | 4.62 ± 0.29 | 132 ± 4 | 137 ± 4 | 12 ± 2 | 346 | 359 |
| 6б | 4.65 ± 0.16 | 153 ± 3 | 155 ± 2 | 26 ± 3 | 328 | 350 |
| 7б | 4.43 ± 0.19 | 143 ± 3 | 141 ± 3 | 15 ± 2 | 347 | 360 |
| 6в | 4.11 ± 0.12 | 107 ± 2 | 163 ± 4 | 39 ± 3 | 348 | 362 |
| 7в | 4.09 ± 0.18 | 118 ± 4 | 158 ± 3 | 35 ± 3 | 347 | 360 |
Формирование комплекса с европием приводит к заметному росту модуля упругости материала по сравнению с пленками соответствующих сополиамидов: значения Е образцов 7а и 7б превышают этот показатель исходных сополиамидов 6а и 6б, а для пленок 6в и 7в − значения Е идентичны (табл. 1). Однако в результате формирования комплекса, зарегистрировано определенное снижение деформационного ресурса материала до разрушения (табл. 1, образцы 6а, 7а и 6б, 7б). По-видимому, формирование на полимерных цепях массивных боковых группировок Eu(TTA)3 препятствует взаимной укладке макроцепей, приводит к определенной гетерогенизации структуры материала и появлению в нем внутренних напряжений.
Испытанные пленки 6а−6в и 7а−7в демонстрируют пластический характер деформирования (рис. 1) с реализацией на деформационных кривых предела пластичности в виде резкого перегиба или локального максимума. Важно отметить, что для всех исследованных материалов разрушение образцов происходит при деформациях, превышающих те, при которых реализуется предел пластичности, т.е. в области необратимых деформаций.
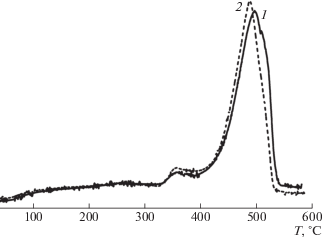
Результаты ТГА (табл. 1) типичны для полимерных материалов со структурой сополиамидов. Пленки характеризуются довольно высокой термостойкостью: значение Т10 для всех испытанных пленок находится в диапазоне температуры 350−360°С. Следует отметить, что формирование комплекса на сополиамидах не отразилось на величине показателей термостойкости материала (табл. 1): эти показатели для пленок 6а и 7а (материал с максимальной концентрацией комплексов) идентичны. Возможной причиной данного эффекта является весьма низкая массовая доля групп Еu(TTA)3 в исследуемых материалах (менее 3% общей массы пленки для наиболее насыщенного комплексами образца 7а). При этом само по себе отщепление − отрыв групп Еu(TTA)3 от полимерных цепей в результате термостимулированного разрушения координационных связей − не приведет к понижению массы образца, регистрируемому в процессе ТГА. Для регистрации массового эффекта должно произойти разрушение самих групп с выделением летучих продуктов, а этот процесс, по-видимому, проходит в той же области температуры, что и интенсивная фаза деструкции полимерных цепей, т.е. при значениях температуры, превосходящих Т10. В силу наложения довольно слабого массового эффекта от деструкции комплекса на гораздо более интенсивное понижение массы образца в процессе деструкции полимера выделить первый из этих процессов на фоне второго на кривых ТГА затруднительно.
Определенное подтверждение сформулированного выше предположения удалось получить при анализе кривых ДТА изучаемых образцов (рис. 2). На этих кривых отчетливо видны два экзотермических процесса в областях температуры 330−390 и 400−545°С. При этом значения температуры максимума первого процесса (356−357°С) полностью совпадают для сравниваемых образцов, в то время как максимум высокотемпературного процесса в пленке комплекса 7а (488°С) смещен на девять градусов в область низких значений температуры по отношению к максимуму интенсивности того же процесса в полимере 6а.
Основной задачей настоящей работы было исследование оптических свойств синтезированных МПК, а именно изучение влияния положения заместителей в хинолиновом фрагменте на интенсивность спектра фотолюминесценции полученных полимерных пленок.
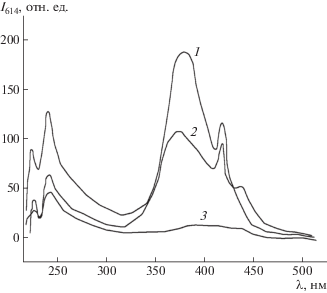
Анализ спектров возбуждения люминесценции МПК 7а−7в (рис. 3) показал, что есть возможность возбуждать люминесценцию как в области 385 нм, так и в видимой области спектра при 418 нм.
Синтезированные МПК 7а и 7б обладают интенсивной люминесценцией в области 610− 620 нм. Исследование спектров люминесценции показало, что полоса люминесценции МПК 7а−7в в диапазоне от 550 до 750 нм представляет квазилинейный спектр с характерными пиками при 580, 593, 616, 652 и 698 нм (рис. 4). Указанные пики могут быть связаны с оптическими переходами из возбужденного состояния 5D0 в основное 7FJ (J = 0–6). Данный факт позволяет полагать природу спектра, связанную именно с Eu3+.
Рис. 4.
Спектры люминесценции МПК 7а (1), 7б (2, 4) и 7в (3). Возбуждение излучением 385 (1−3) и 418 нм (4).
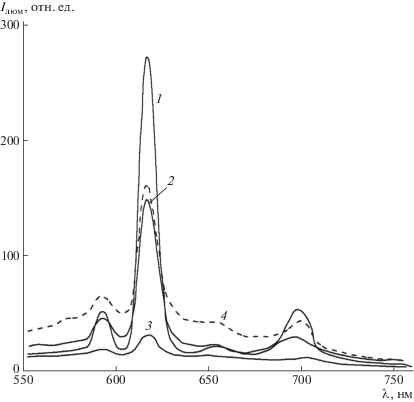
Оказалось, что максимальная интенсивность люминесценции в полосе испускания Eu3+ наблюдается для металл-полимерного комплекса 7а с амидной группой в положении 6 (рис. 3, кривая 1). Минимум интенсивности в спектре испускания прослеживается для металл-полимерного комплекса в основе 7в, содержащего амидную группу в положении 8.
ЗАКЛЮЧЕНИЕ
Синтезированы новые мономеры для поликонденсации – дихлорангидриды 2-(пиридин-2-ил)хинолин-4,6-, 2-(пиридин-2-ил)хинолин-4,7- и 2-(пиридин-2-ил)хинолин-4,8-дикарбоновых кислот, на основе которых получены макромолекулярные лиганды – сополиамиды с пиридил-хинолиновыми звеньями в основной цепи и их металл-полимерные комплексы с Eu(TTA)3. Показано, что интенсивность люминесценции для металл-полимерных комплексов зависит от содержания комплексных фрагментов в сополимере, определяемого, в свою очередь, положением заместителя в пиридил-хинолиновом фрагменте.
Список литературы
He G., Yan N., Kong H., Yin Sh., Ding L., Qu Sh., Fang Y. // Macromolecules. 2011. V. 44. P. 703.
Huang F., Shih P.-I., Shu Ch.-F., Chi Y., Jen A.K.-Y. // Adv. Mater. 2009. V. 21. P. 361.
Lee J.F., Chung Hsu S.L., Lee P., Chuang H.Y., Yang M.L., Chen J.S., Chou W.Y. // Solar Energy Mater. Solar Cells. 2010. V. 94. P. 1166.
Petrochenkova N.V., Mirochnik A.G., Petukhova M.V., Karasev V.E. // Polymer Science B. 2006. V. 48. № 8. P. 194.
Karpenko A.A., Fedorenko E.V., Mirochnik A.G. // Luminescence. 2011. V. 26. P. 223.
Kallistratos G., Pfau A., Ossowski B. // Naturwissenschaften. 1960. V. 47. P. 468.
Laguna E.M., Olsen P.M., Sterling M.D., Eichler J.F., Rheingold A.L., Larsen C.H. // Inorg. Chem. 2014. V. 53. № 23. P. 12231.
Campagna S., Mamo A., Stille J.K.J. // Chem. Soc. 1991. № 10. P. 2545.
Zhang Jun, Yang Wen-Bin, Wu Xiao-Yuan, Kuang Xiao-Fei, Lu Can-Zhong // Dalton Transact. 2015. V. 44. № 30. P. 13586.
Hao Hu-Jun, Lin Cui-Wu, Yin Xian-Hong, Hu Fei-Long, Zhuang Yue // Acta Crystallogr. 2010. V. 66. № 2. P. 113.
Yakimanskii A.V., Goikhman M.Ya., Podeshvo I.V., Anan’eva T.D., Smyslov R.Yu., Nekrasova T.N., Loretsyan N.L., Bochkarev M.N., Il’ichev V.A., Konev A.N. // J. Opt. Technol. 2011. V. 78. № 7. P. 430.
Goikhman M.Ya., Podeshvo I.V., Loretsyan N.L., Anan’eva T.D., Smyslov R.Yu., Nekrasova T.N., Smir-nov M.A., Popova E.N., Yakimanskii A.V. // Polymer Science B. 2011. V. 53. № 1−2. P. 89.
Гойхман М.Я., Подешво И.В., Лорецян Н.Л., Гофман И.В., Смыслов Р.Ю., Некрасова Т.Н., Смирнова В.Е., Полевой А.А., Якиманский А.В. // Изв. РАН. Сер. Хим. 2012. № 5. С. 961.
Pulyalina A.Yu., Polotskaya G.A., Goikhman M.Ya., Podeshvo I.V., Gulii N.S., Shugurov S.M., Tataurov M.V., Toikka A.M. // Polym. Int. J. 2017. V. 66. № 12. P. 1873.
Magdesieva T.V., Dolganov A.V., Latyshev G.V., Yakimanskii A.V., Goikhman M.Ya., Podeshvo I.V., Lukashev N.V. // Russ. J. Org. Chem. 2011. V. 47. № 1. P. 62.
Goikhman M.Y., Gofman I.V., Podeshvo I.V., Aleksandrova E. L., Pozdnyakov A. O., Kudryavtsev V. V. // Polymer Science A. 2003. V. 45. № 7. P. 1045.
Гойхман М.Я., Подешво И.В., Якиманский А.В., Лорецян Н.Л., Ананьева Т.Д., Некрасова Т.Н., Смыслов Р.Ю. Пат. 2450025 Россия // Б.И. 2012. № 13. С. 12.
Pfitzinger W. // Journal für Praktische Chemie. 1902. V. 66. P. 263.
Гойхман М.Я., Гулий Н.С., Подешво И.В., Гофман И.В., Полоцкая Г.А., Лорецян Н.Л., Смирнова В.Е., Якиманский А.В. // Сб. науч. тр. “Физикохимия полимеров: синтез, свойства, применение”. Тверь, 2014. Вып. 20. С. 172.
Grimshaw J., Begley W.J. // Synthesis. 1974. № 7. P. 496.
Гойхман М.Я., Подешво И.В., Михайлов Г.М., Бак-лагина Ю.Г., Кудрявцев В.В., Лукасов С.В., Лебедева М.Ф., Боброва Н.В., Сазанов Ю.Н., Федорова Г.Н., Михайлова М.В., Дейнеко И.П. // Журн. прикл. химии. 1997. Т. 70. № 11. С. 312.
Krasikov V.D., Pokhvoshchev Y.V., Malakhova I.I., Gorshkov N.I., Gulii N.S., Podeshvo I.V., Goikhman M.Ya., Yakimansky A.V. // Int. J. Polym. Anal. Character. 2017. V. 22. № 5. P. 1.
Saeed A.E.M., Elhadi S.A. // Synth. Commun. 2011. V. 41. P. 1435.
Di Fonzo M., Saracini C. // Farmaco, Edizione Scientifica. 1956. V. 11. P. 221.
Goikhman M.Ya., Podeshvo I.V., Borisova N.E., Loretsyan N.L., Gofman I.V., Smyslov R. Yu., Gulii N.S., Valieva I.A., Krasnopeeva E.L., Litvinova L.S., Yakimansky A.V. // Polymer Science B. 2019. V. 61. № 1. P. 42.
Zhao Q., Jianq C., Shi M., Li F., Yi T., Cao Y., Huang C. // Organometallics. 2006. V. 25. P. 3631.
Dandekar M.P., Kondawar S. B., Itankar S.G., Nandanwar D.V. // Proc. Mater. Sci. 2015. V. 10. P. 580.
Тарасевич Б.Н. ИК-спектры основных классов органических соединений. Справочные материалы. М.: МГУ, 2012.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия Б)