Высокомолекулярные соединения (серия Б), 2022, T. 64, № 1, стр. 20-28
НОВЫЕ ПОЛИЭФИРИМИДЫ НА ОСНОВЕ ДИАНГИДРИДА 5-МЕТИЛ-1,3-ФЕНИЛЕН-БИС-4-ОКСИФТАЛЕВОЙ КИСЛОТЫ: СИНТЕЗ И ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА
А. М. Орлова a, *, А. Ю. Цегельская a, Т. И. Колесников a, И. Г. Абрамов b, А. А. Кузнецов a
a Институт синтетических полимерных материалов им. Н.С. Ениколопова Российской академии наук
117393 Москва, ул. Профсоюзная, 70, Россия
b Ярославский государственный технический университет
150023 Ярославль, Московский пр., 88, Россия
* E-mail: orlova_am@ispm.ru
Поступила в редакцию 10.06.2021
После доработки 06.10.2021
Принята к публикации 20.10.2021
- EDN: MVAWGR
- DOI: 10.31857/S230811392201003X
Аннотация
Получен новый мономер для синтеза полиимидов – диангидрид 5-метил-1,3-фенилен-бис-4-оксифталевой кислоты. Синтез мономера проводили в три стадии: реакцией нуклеофильного нитрозмещения 4-нитрофталнитрила с калиевой солью 5-метилрезорцина (орцина) с последующим гидролизом нитрильных групп синтезирована 5-метил-1,3-фенилен-бис-4-оксифталевая кислота, дегидратацией которой был получен соответствующий диангидрид. Одностадийной высокотемпературной каталитической поликонденсацией диангидрида 5-метил-1,3-фенилен-бис-4-оксифталевой кислоты с рядом ароматических диаминов в расплаве бензойной кислоты синтезирована серия новых высокомолекулярных термопластичных полиэфиримидов. Значения логарифмической вязкости и средневесовой молекулярной массы полиэфиримидов лежат в пределах 0.28–1.20 дл/г и 33–114 × 103 соответственно. Полиэфиримиды растворимы в хлороформе, ТГФ, ДМФА, ДМАА, N-метилпирролидоне, ДМСО и обладают пленкообразующей способностью. По результатам ДСК и широкоуглового рентгеновского рассеяния все полиэфиримиды являются полностью аморфными с температурой стеклования в диапазоне 185–307°C.
ВВЕДЕНИЕ
Ароматические полиимиды представляют собой класс полимеров с превосходными термическими, механическими и другими характеристиками, включая высокую химическую и радиационную стойкость [1–3]. Они широко применяются в авиакосмической промышленности, автомобилестроении и электронике, а также используются в качестве газоразделительных мембран, клеев и т.д. [4–6].
Как известно, уникальные свойства ПИ обусловлены достаточно высокой жесткостью их основной цепи и сильным межмолекулярным взаимодействием. Однако для большинства ПИ эти же факторы приводят к плохой растворимости в органических растворителях и высоким значениям температуры размягчения, которые вызывают сложности в их переработке. Для улучшения перерабатываемости применяют введение “шарнирных” фенилэфирных фрагментов в повторяющееся звено ПИ [8]. Эффективным подходом явилась разработка метода синтеза бисэфирных диангидридов нуклеофильным нитрозмещением 4-нитрофталнитрилов различными бисфенолами [9]. В настоящее время имеется большое количество исследований по синтезу термопластичных и растворимых полиэфиримидов на их основе. Наиболее известным коммерческим полиэфиримидом этого ряда можно назвать “Ultem®1000” (“General Electric”, “Sabic IP”) [10]. Известно множество трудов по синтезу бисэфирных диангидридов, содержащих гидроксихиноновый (в том числе хлор-, метил- и фенил-замещенные), резорциновый [11–13], катехиновый [14], а также кардовые [4, 15] фрагменты. В ряде работ по синтезу растворимых и термопластичных полиэфиримидов описано использование 1,3-бис-(3,4-дикарбоксифенокси)бензола (диангидрд Р) [13, 16], причем его сочетание с 4-ядерным диамином, содержащим в своей структуре две эфирные группы и дифенильный фрагмент, приводит к образованию частично-кристаллических полиэфиримидов [17, 18].
Цель настоящей работы – синтез нового шарнирного диангидрида с метильным заместителем в центральном ароматическом кольце, получение на его основе ряда полиэфиримидов на основе ароматических диаминов различного строения и анализ физико-химических свойств этих полиэфиримидов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы
5-Метил-1,3-дигидроксибензол (орцин) (97%) и 4-нитрофталонитрил (99%) использовали для синтеза диангидрида без дополнительной очистки. м-Фенилендиамин (м-ФДА, Тпл = 63°С), п-фенилендиамин (п-ФДА, Тпл = 145°С) и 4,4'-оксидианилин (ОДА, Тпл = 191°С) очищали сублимацией в вакууме. 1,3-Фенилен-бис-(4-оксианилин) (диамин Р, Тпл = 118°С), 2,2'-пропилиден-дифенилоксидианилин (диамин А, Тпл = 129°С), 4,4'-дианилинфлуорен (АФЛ, Тпл = 238°С) и 4,4'-сульфонилдианилин (СДА, Тпл = 176°С) использовали без дополнительной очистки. Все материалы предоставлены фирмой “Aldrich”.
Бензойную кислоту квалификации ч.д.а. перекристаллизовывали из смеси этанол–вода и сушили в вакууме, Tпл = 122°С. Диметилформамид, диметилацетамид, диметилсульфоксид и N-метилпирролидон (N-МП) квалификации ч. сушили над P2O5 и очищали перегонкой в вакууме, температура кипения Ткип составила 153, 165, 189 и 202°С соответственно. Диэтиловый эфир, хлороформ и тетрагидрофуран дополнительной очистке не подвергали.
Методы исследования
ИК-спектры регистрировали на ИК-фурье-спектрометре “Bruker”, модель “Equinox 55/S” в диапазоне 4000–400 см–1. Образцы готовили в виде тонких пленок толщиной 3–5 мкм. Спектры ЯМР 1H снимали на приборе “WM-250” (“Bruker Corporation”) с рабочей частотой 250.13 МГц. Химические сдвиги приведены относительно SiMe4. Термограммы ДСК в интервале температуры 20–400°С записывали на оборудовании “PerkinElmer DSC-7” при скорости нагревания 10 град/мин. Измерения ГПХ выполняли на установке “Stayer” с колонками “Phenogel” (5000–70 000) с использованием ДМФА в качестве элюента, при 60°С и скорости потока 1 мл/мин. В качестве эталона применяли полистирольные стандарты с М = (0.2–7.0) × 104. Обработку данных проводили при помощи программного обеспечения “МультиХром Версия 1.5Х”. Определение логарифмической вязкости осуществляли с применением капиллярного вискозиметра Уббелоде для растворов полимеров в N-МП с концентрацией 0.5 г/100 мл при 25°С. Анализ полимеров методом широкоуглового рентгеновского рассеяния выполняли на дифрактометре “Bruker AXD D8” (Германия) 40 кВ, 40 мА, λ = 0.154 нм.
Синтез диангидрида 5-метил-1,3-фенилен-бис-4-оксифталевой кислоты
В трехгорлую колбу, снабженную мешалкой, обратным холодильником и термометром, вносили 120 мл ДМФА, затем при перемешивании загружали 32.0 г (0.185 моля) 4-нитрофталонитрила и 11.5 г (0.09 моля) орцина. К полученному раствору приливали 33.6 г (0.20 моля) К2СО3 ⋅ 1.5Н 2O в 30 мл воды. Реакционную смесь перемешивали при 80–85°C в течение 1 ч, после чего охлаждали до 5–10°C, образовавшийся осадок отфильтровывали, промывали этанолом и водой, сушили при 70°C. Выход продукта 4,4'-(3,5-(толуилендиокси)дифталонитрила составил 29.3 г (88% от теории) – белого кристаллического порошка с Тпл = = 191–192°С (схема 1 (I)).
На втором этапе в четырехгорлую колбу, снабженную мешалкой, обратным холодильником, капилляром для ввода азота и термометром, последовательно загружали 4.9 г (0.013 моля) 4,4'-(3,5-толуилендиокси)дифталонитрила, 90 мл метанола, 11.6 г (0.208 моля) КОН, растворенного в 60 мл воды. Смесь выдерживали при перемешивании в токе азота при температуре кипения в течение 12 ч. После этого заменяли обратный холодильник на прямой и отгоняли метанол. Затем реакционную массу охлаждали и подкисляли концентрированной соляной кислотой до рН 1. Выпавший осадок отфильтровывали, промывали водой и сушили. Выход продукта 5-метил-1,3-фенилен-бис-4-оксифталевой кислоты (схема 1 (II)) составил 5.5 г (93.5% от теории) – белого кристаллического порошка с Тпл = 206–207°С.
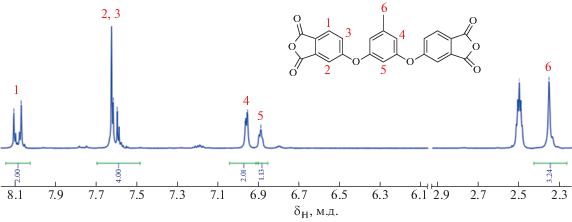
Далее 16.0 г (0.092 моля) 5-метил-1,3-фенилен-бис-4-оксифталевой кислоты кипятили в 60 мл уксусного ангидрида в течение 1 ч, раствор охлаждали до 5–10°С. Образовавшийся осадок отфильтровывали и сушили, получая 11.92 г диангидрида 5-метил-1,3-фенилен-бис-4-оксифталевой кислоты (МРДА) – белого кристаллического порошока с Тпл = 194–198°С. Выход продукта составил 81.0%. Элементный анализ для C23H12O8: рассчитано – C 66.35%, H 2.91%; найдено – C 66.46%, H 2.97%. ИК-спектр (KBr) см–1: 1824, 1777 (C=O), 1260 (С–О–С). Спектр ЯМР 1H (ДМСО-d6, 250 MГц, мод.): 8.10 (dd, 2H, H1), 7.60 (m, 4H, H2, H3), 6.95 (s, 2H, H4), 6.89 (s, 1H, H5), 2.35 (s, 3H, H6).
Синтез полимеров
В трехгорлую стеклянную колбу, снабженную мешалкой и трубкой для подачи аргона, загружали 9 г бензойной кислоты. После полного ее расплавления вводили 0.7161 г (0.00172 моля) диангидрида МРДА. Далее добавляли в систему 0.3444 г (0.00172 моля) 4,4'-оксидианилина. Смесь нагревали при перемешивании в течение 2 ч при 140°С в атмосфере аргона. После окончания синтеза реакционную смесь выливали на чашку Петри и охлаждали. Образующуюся твердую массу измельчали и удаляли бензойную кислоту путем ее обработки ацетоном. Далее продукт многократно промывали ацетоном, фильтровали и сушили под вакуумом при 60°С в течение 2 ч. Аналогичным образом синтезировали ряд полиэфиримидов с диаминами м-ФДА (1), п-ФДА (2), ОДА (3), диамином Р (4), диамином А (5), АФЛ (6) и СДА (7). Структуру полиимидов подтверждали методами ИК- и ЯМР 1Н-спектроскопии.
Полиэфиримид (1). ИК-спектр (CsI, ν, см–1): 2922 (C–H), 1780, 1720 (C=O в имидном фрагменте), 1590 (C–C), 1263 (С–О–С). Спектр ЯМР 1H (хлороформ-d, 250 MГц, δН м.д.): 7.92 (d, J = 10 Hz, 2H, H1), 7.61 (m, 2H, H2), 7.47 (m, 4H, H3, H4, H5), 7.39 (m, 2H, H6), 6.79 (s, 2H, H7), 6.68 (s, 1H, H8), 2.39 (s, 3H, H9).
Полиэфиримид (2). ИК-спектр (CsI, ν, см–1): 2923 (C–H), 1784, 1721 (C=O в имидном фрагменте), 1591 (C–C), 1260 (С–О–С). Спектр ЯМР 1H (хлороформ-d, 250 MГц, δН м.д.): 7.91 (d, J = 7.5 Hz, 2H, H1), 7.62 (m, 2H, H2), 7.50 (m, 4H, H3), 7.38 (m, 2H, H4), 6.80 (s, 2H, H5), 6.68 (s, 1H, H6), 2.39 (s, 3H, H7).
Полиэфиримид (3). ИК-спектр (CsI, ν, см–1): 3065 (C–Har), 2923 (C–H), 1776, 1715 (C=O в имидном фрагменте), 1591 (C–C), 1260 (С–О–С). Спектр ЯМР 1H (хлороформ-d, 250 MГц, δН м.д.): 7.93 (d, J = 8.2 Hz, 2H, H1), 7.43 (m, 8H, H2, H3, H4), 7.18 (d, J = 8.7 Hz, 4H, H5), 6.80 (s, 2H, H6), 6.68 (s, 1H, H7), 2.40 (s, 3H, H8).
Полиэфиримид (4). ИК-спектр (CsI, ν, см–1): 3065, 3037, 3013 (C–Har), 2925 (C–H), 1780, 1721 (C=O в имидном фрагменте), 1590 (C–C).
Полиэфиримид (5). ИК-спектр (CsI, ν, см–1): 3070, 3041, 3020 (C–Har), 2922 (C–H), 1784, 1724 (C=O в имидном фрагменте), 1596 (C–C). Спектр ЯМР 1H (хлороформ-d, 250 MГц, δН м.д.): 7.89 (d, J = 8.2 Hz, 2H, H1), 7.79 (d, J = 7.1 Hz, 2H, H2), 7.37 (m, 18H, H3, H4, H5), 6.80 (s, 2H, H6), 6.66 (s, 1H, H7), 2.23 (m, 3H, H8), 1.71 (m, 6H, H9).
Полиэфиримид (6). ИК-спектр (CsI, ν, см–1): 3067, 3037, 3016 (C–Har), 2920 (C–H), 1779, 1716 (C=O в имидном фрагменте), 1593 (C–C). Спектр ЯМР 1H (хлороформ-d, 250 MГц, δН м.д.): 7.89 (d, J = 8.2 Hz, 2H, H1), 7.79 (d, J = 7.1 Hz, 2H, H2), 7.37 (m, 18H, H3, H4, H5, H6, H7, H8, H9), 6.78 (s, 2H, H10), 6.65 (s, 1H, H11), 2.37 (m, 3H, H12).
Полиэфиримид (7). ИК-спектр (CsI, ν, см–1): 3075 (C–Har), 2931 (C–H), 1781, 1720 (C=O в имидном фрагменте), 1596 (C–C).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Синтезированный ароматический диангидрид, содержащий эфирные мостиковые связи и метильный заместитель в центральном ароматическом фрагменте (МРДА) был получен в три стадии из орцина (схема 1). Промежуточный продукт 4,4'-(3,5-(толуилендиокси)дифталонитрил (I) получали реакцией нитрозамещения из 4-нитрофталонитрила и орцина по методике [19], после чего дифталонитрил гидролизовали с образованием 5-метил-1,3-фенилен-бис-4-оксифталевой кислоты (II). Последующая дегидратация была проведена уксусным ангидридом с образованием конечного продукта – диангидрида МРДА:
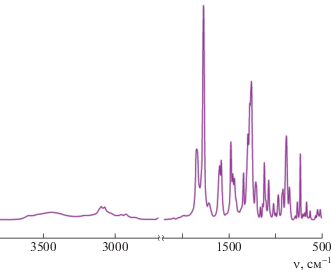
Химическая структура диангидрида была подтверждена методами ИК- и ЯМР 1Н-спектроскопии. На рис. 1 видно, что в его ИК-спектре присутствуют полосы поглощения 1780 и 1850 см–1, характерные для валентных колебаний связи С=О ангидридного фрагмента. Также в спектре имеются полосы поглощения валентных колебаний связи С–О–С (1260 см–1), связи С=Сар (1480, 1590 см–1), связи С–H в метильном заместителе (2920 см–1). В ЯМР 1Н-спектре МРДА (рис. 2) в области слабых полей присутствуют сигналы протонов ароматического цикла, находящиеся вблизи ангидридной группы в виде дублета (8.1 м.д.). Сигналы ароматических протонов вблизи эфирной мостиковой связи наблюдаются в области 7.62 м.д.; протоны центрального ароматического фрагмента дают сигналы при 6.89 и 6.95 м.д. Протоны метильного заместителя выходят в виде синглета в области сильных полей (2.35 м.д.).
Методом одностадийной высокотемпературной каталитической поликонденсации [20] синтезирована серия полиэфиримидов на основе диангидрида МРДА и различных диаминов: м-ФДА (1), п-ФДА (2), ОДА (3), диамин Р (4), диамин А (5), АФЛ (6), СДА (7):
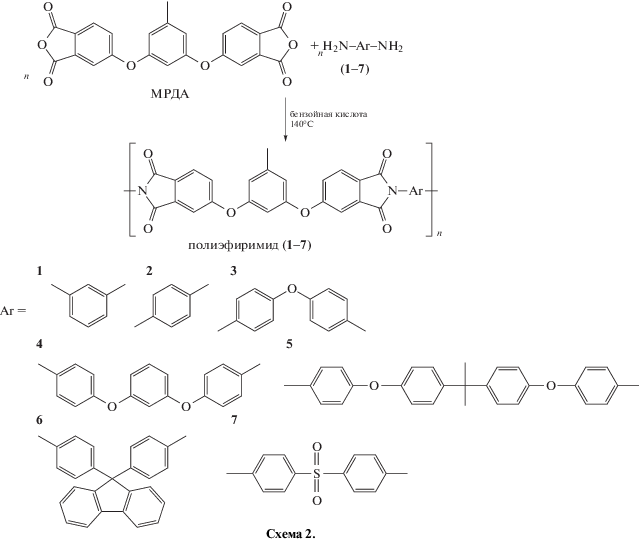
Синтез полиэфиримидов (1–7) был осуществлен в расплаве бензойной кислоты при температуре 140°С в течение 2 ч при интенсивном перемешивании и продувке аргоном для эффективного удаления выделяющейся воды. Реакционная система при получении полиэфиримидов (1–6) представляла собой гомогенный раствор от начала до конца процесса. При синтезе полиэфиримида (7) с участием МРДА и диамина СДА через 10–15 мин выпадал порошкообразный продукт. Далее процесс продолжался в гетерогенной системе. Выделенные продукты представляли собой хлопья либо порошки бежевого или белого цвета. Их строение, молекулярно-массовые характеристики и термические свойства были исследованы методами ИК, ЯМР 1Н-спектроскопии, вискозиметрии, ГПХ и ДСК.
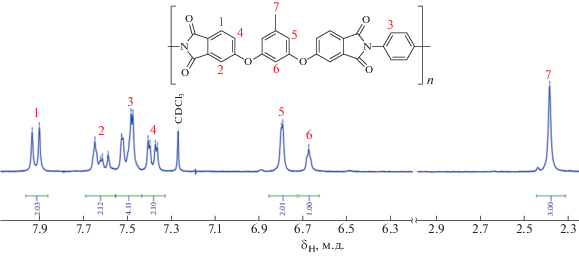
Результаты интегрирования сигналов в ЯМР 1Н-спектре всех полимеров соответствовали заявленной структуре повторяющегося звена. Спектр ЯМР 1Н в хлороформе-d для полиэфиримида (2), синтезированного с участием диамина п-ФДА, представлен на рис. 3.
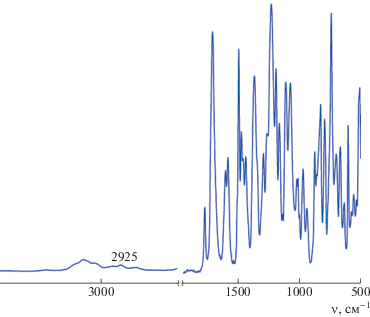
На рис. 4 приведен ИК-спектр полимера, полученного на основе диангидрида МРДА и диамина АФЛ (полиэфиримид (6)). В ИК-спектрах всех синтезированных образцов присутствуют характерные полосы поглощения имидного цикла в области 1780 см–1 (симметричные валентные колебания C=O), 1720 см–1 (асимметричные валентные колебания C=O), 1372 см–1 (валентные колебания C–N), 729 см–1 (деформационные колебания C–N в имидном цикле). В области 2925 см–1 наблюдаются слабоинтенсивные полосы поглощения, характерные для колебаний связи C–H метильного заместителя. Отсутствие полос поглощения, характерных для карбонила амидокислотной группы (1650–1670 см–1) дает основание утверждать, что полученные продукты поликонденсации являются полностью имидизованными.
Логарифмическая вязкость полиэфиримидов (1–7), измеренная в N-МП варьировалась в диапазоне от 0.28 до 1.20 дл/г. Методом ГПХ были изучены образцы на основе диамина А (полиэфиримид (5)) и АФЛ (полиэфиримид (6)), растворимые в используемом элюенте – ДМФА (табл. 1). Средневесовые молекулярные массы Mw леат в диапазоне (33–114) × 103 с коэффициентами полидисперсноти Mw/Mn = 2.1–2.3.
Таблица 1.
Характеристики полиэфиримидов (1–7) на основе диангидрида МРДА
| Полиэфиримид | Диамин | ηln (N-МП, 25°С), дл/г | Tс, °С |
|---|---|---|---|
| 1 | м-ФДА | 0.49 | 232 |
| 2 | п-ФДА | 0.71 | 235 |
| 3 | ОДА | 1.02 | 217 |
| 4 | Диамин Р | 0.75 | 185 |
| 5* | Диамин А | 0.56 | 200 |
| 6** | АФЛ | 1.02 | 307 |
| 7 | СДА | 0.28 | 257 |
Растворимость полиэфиримидов исследована в ряду стандартных органических растворителей (табл. 2). Критерием служила возможность формирования раствора с концентрацией полиэфиримидов 5 мас. %. Наилучшей растворимостью из серии полимеров обладает полиэфиримид (5) на основе диамина, мостиковые группы которого придают молекуле гибкость, а объемные метильные заместители изопропилиденевого фрагмента препятствуют плотной упаковке цепей. Последний фактор, по всей вероятности, оказывает решающее влияние на растворимость полимера, поскольку полиэфиримид (4) на основе двухшарнирного диамина Р, не имеющего изопропилиденового фрагмента, растворим только в N-МП и ДМАА, как и полиэфиримид (3) на основе одношарнирного диамина ОДА. Полиэфиримид (6) на основе диамина АФЛ хорошо растворим как в хлороформе, так и в ряду амидных растворителей (табл. 2). Хотя АФЛ является “жестким” диамином, его кардовая объемная структура не дает возможности образования плотной надмолекулярной упаковки, что, в свою очередь, способствует хорошей растворимости. Полиэфиримиды (1) и (2) на основе м-ФДА и п-ФДА соответственно растворимы только в хлороформе и в N-МП. Свойства полиэфиримидов, содержащих мета- и пара-фениленовые фрагменты в диаминной компоненте, зависят от структуры используемого диангидрида. Двухшарнирный диангидрид МРДА с метильным заместителем в центральном ароматическом кольце обеспечивает растворимость в хлороформе полиэфиримидов не только с мета-фениленовым фрагментом, дающим изгиб полимерной цепи, но и с пара-фениленовым фрагментом. Полиэфиримид (7) на основе серосодержащего одношарнирного СДА растворим только в N-МП. Растворимость всех полиэфиримидов в N-МП дает основание полагать, что данные полимеры могут быть переработаны через раствор.
Таблица 2.
Растворимость полиэфиримидов (1–7) на основе диангидрида МРДА
| Полиэфиримид | Диамин | Растворимость | |||||
|---|---|---|---|---|---|---|---|
| Хлороформ | ТГФ | N-МП | ДМАА | ДМФА | ДМСО | ||
| 1 | м-ФДА | + | – | + | +/– | +/– | – |
| 2 | п-ФДА | + | – | + | +/– | – | – |
| 3 | ОДА | +/– | – | + | + | – | – |
| 4 | Диамин Р | +/– | – | + | + | – | – |
| 5 | Диамин А | + | + | + | + | + | – |
| 6 | АФЛ | + | – | + | + | + | +/– |
| 7 | СДА | – | – | + | – | – | – |
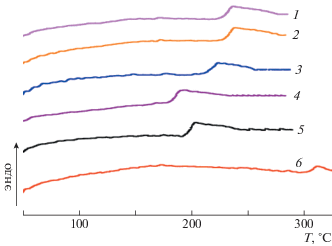
Термические свойства синтезированных полиэфиримидов были изучены методом ДСК при скорости нагревания 10 град/мин (рис. 5). На термограммах ДСК присутствуют скачки теплоемкости, соответствующие расстекловыванию полиимидов в области температуры от 185 до 307°С в зависимости от химического строения диаминного фрагмента. Наибольшее значение температуры стеклования (307°C) демонстрирует полиэфиримид (6). Данный эффект увеличения температуры начала тепловой деформации для этого полиэфиримида связан с высокой жесткостью полиимидной цепи, обусловленной кардовым строением диаминного фрагмента АФЛ. Наименее высокие значения температуры стеклования демонстрируют полиэфиримид (4) на основе диамина Р (185°С) и полиэфиримид (5) на основе диамина А (200°С). Это можно объяснить наличием большого количества гибких эфирных мостиковых фрагментов, присутствующих в структуре исходных диаминов [21]. На термограммах указанных полиимидов отсутствуют эндотермические пики, характерные для процесса плавления.
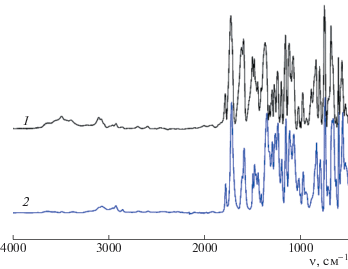
Термограмма ДСК образца полиэфиримида (7), полученного с участием диамина СДА, который выпадает в процессе поликонденсации в виде порошка, представлена на рис. 6. В области значения 318°С имеется высокотемпературный пик плавления, который при втором сканировании исчезает, а появляется скачок теплоемкости в области 260°С, связанный с расстекловыванием полимера. Данный эффект можно объяснить тем, что низкомолекулярный олигоимид, выпадающий в процессе поликонденсации в расплаве бензойной кислоты, при прогревании в ячейке ДСК расплавляется, происходит дальнейшая поликонденсация и образуется высокомолекулярный аморфный полимер. Таким образом, эндотермический пик соответствует не только плавлению, но и поликонденсации олигоимида. При прессовании этого образца в прессе при 350°С была получена гибкая прочная пленка. ИК-спектры продукта поликонденсации и пленки, полученной в прессе, подтверждают приведенные выше выводы. На ИК-спектре порошка МРДА–СДА (рис. 7) отношения плотностей полос поглощения в области 1720 и 1780 см–1, характерных для имидной группы, практически не искажены, как и у пленки, хотя полоса поглощения, характерная для ангидридной группы, отсутствует, а в области 1850 см–1 наблюдается повышенная оптическая плотность, которая на спектре пленки ПИ не обнаружена. Кроме того, на спектре олигомера присутствует полоса валентных колебаний связи N–H аминогруппы (3500 см–1) малой интенсивности. Такой спектр свидетельствует об образовании олигоимида; на спектре пленки полиэфиримидов МРДА–СДА такие полосы поглощения отсутствуют. Описанные выше факты подтверждают, что в результате поликонденсации диангидрида МРДА с диамином СДА образуется продукт в форме олигоимида, способного к увеличению молекулярной массы при нагревании.
Рис. 6.
Термограммы ДСК полиэфиримида (7): 1 – исходный порошок, 2 – порошок, обработанный в термопрессе при 350°С.
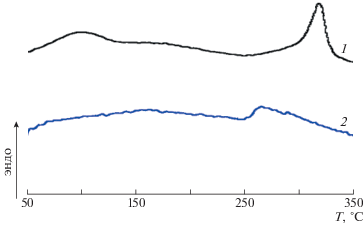
Рис. 7.
ИК-спектры полиэфиримида (7): 1 – исходный порошок, 2 – порошок, обработанный в термопрессе при 350°С.
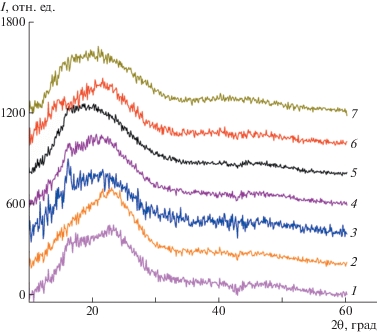
Фазовая морфология для полиэфиримидов (1–7) была изучена методом широкоуглового рентгеновского рассеяния. Дифрактограммы широкоуглового рентгеновского рассеяния порошков полиэфиримидов (1–6) и пленки полиэфиримида (7) представляют собой аморфное гало без явно выраженных рефлексов кристаллической фазы (рис. 8). Результаты исследования серии полиэфиримидов, синтезированных с участием диангидрида МРДА, методами широкоуглового рентгеновского рассеяния и ДСК позволяют сделать вывод о том, что образцы являются полностью аморфными.
Работа выполнена частично при поддержке Российского фонда фундаментальных исследований (код проекта 19-03-00820), а также в рамках госзадания № 0086-2019-0007. Регистрация ИК- и ЯМР-спектров, а также термические исследования проведены при поддержке Министерства науки и высшего образования Российской Федерации с использованием научного оборудования Центра коллективного пользования “Центр исследования полимеров” Института синтетических полимерных материалов им. Н.С. Ениколопова РАН.
Список литературы
De Abajo J., De la Campa J.G. // Prog. Polyimide Chem. I. 1999. P. 23.
Bessonov M.I., Koton M.M., Kudryavtsev V.V., Laius L.A. Polyimides: Thermally Stable Polymers. New York: Springer, 1987.
Advanced Polyimide Materials: Synthesis, Characterization, and Applications / Ed. by S.Y. Yang. Amsterdam: Elsevier, 2018.
Liaw D.J., Wang K.-L., Huang Y.-C., Lee K.-R., Lai J.-Y., Ha C.-S. // Prog. Polym. Sci. 2012. V. 37. № 7. P. 907.
Sanaeepur H., Amooghin A.E., Bandehali S., Moghadassi A., Matsuura T., Van der Bruggen B. // Prog. Polym. Sci. 2019. V. 91. P. 80.
https://doi.org/https://doi.org/10.1002/pol.20210001
Xiao Y.-H. // Chin. Chem. Lett. 2016. V. 27. № 3. P. 454.
Hwan-Chul Y. // J. Macromol. Sci. A. 2017. V. 54. P. 97.
Takekoshi T., Wirth J.G., Heath D.R., Kochanowski J.E., Manello J.S., Webber M.J.J. // J. Polym. Sci. Polym. Chem. Ed. 1980. V. 18. № 10. P. 3069.
Пат. 3983093 США. 1976.
Hsiao S.H., Dai L.R. // J. Polym. Sci., Polym. Chem. 1999. V. 37. № 5. P. 665.
Yang C.P., Su Y.Y., Wen S.J., Hsiao S.H. // Polymer. 2006. V. 47. № 20. P. 7021.
Takekoshi T. // J. Polym. Sci., Polym. Symp. 1986. V. 74. № 1. P. 93.
Eastmond G.C., Paprotny J. // Macromolecules. 1995. V. 28. № 7. P. 2140.
Damaceanu M.D., Constantin C.P., Bruma M., Begu-nov R.S. // Polymer. 2018. V. 151. P. 34.
Svetlichnyi V.M., Zhukova T.I., Kudriavtsev V.V., Gubanova G.N., Yudin V.E., Leksovskii A.M. // Polym. Eng. Sci. 1995. V. 35. № 16. P. 1321.
Yudin V.E., Svetlichnyi V.M., Gubanova G.N., Gri-gor’ev A.I., Sukhanova T.E., Gofman I.V., Didenko A.L., Popova E.N., Fedorova G.N., Kudryavtsev V.V. // Polymer Science A. 2002. V. 44. № 2. P. 148.
Yudin V.E., Svetlichnyi V.M., Gubanova G.N., Didenko A.L., Sukhanova T.E., Kudryavtsev V.V., Ratner S., Marom G. // J. Appl. Polym. Sci. 2002. V. 83. № 13. P. 2873.
Плахтинский В.В., Канинский П.С., Миронов Г.С., Абрамов И.Г., Ясинский О.А. Пат. 1509352 СССР. 1989.
Kuznetsov A.A. // High Perform. Polym. 2000. V. 12. № 3. P. 445.
Tawade B.V., Kulkarni A.D., Wadgaonkar P.P. // Polym. Int. 2015. V. 64. №. 12. P. 1770.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия Б)