Высокомолекулярные соединения (серия Б), 2022, T. 64, № 4, стр. 283-289
ВЫДЕЛЕНИЕ И ФИЗИКО-ХИМИЧЕСКИЕ ХАРАКТЕРИСТИКИ ПЕКТИНА ИЗ СЫРЬЯ INONOTUS HISPIDUS
С. Б. Хайтметова a, *, А. С. Тураев a, Г. А. Халилова a
a Институт биоорганической химии им. А.С. Садыкова Академии наук Республики Узбекистан
100125 Ташкент, ул. Мирзо Улугбека, 83, Узбекистан
* E-mail: xsb75@mail.ru
Поступила в редакцию 26.03.2022
После доработки 23.05.2022
Принята к публикации 14.06.2022
- EDN: CPXLPM
- DOI: 10.31857/S2308113922700085
Аннотация
Выделены пектиновые полисахариды из нетрадиционного сырья природного происхождения базидиального трутового гриба Inonotus hispidus разных субстратов. Приведены данные о содержании в них свободных и этерифицированных карбоксильных групп, метоксильных групп, степени этерификации, УФ- и ИК-спектры, а также сведения о размерах и молекулярной массе пектиновых частиц.
ВВЕДЕНИЕ
К наиболее сложноорганизованным компонентам клеточной ткани растений относятся пектиновые полисахариды – группа полисахаридов, широко представленных в различных растительных источниках [1–6].
Пектиновые вещества входят в состав клеточной стенки срединных пластинок, цитоплазмы растительных клеток. Они присутствуют практически во всех высших растениях. Выполняя, благодаря своим специфическим свойствам, ряд важных функций (регулировка водного режима тканей, транспорт водного тока и другие), они участвуют в процессах растяжения клеточных стенок. Пектины обнаружены в некоторых водорослях и морских травах, наибольшее количество пектиновых веществ находится в плодах и корнеплодах [7, 8].
Пектины состоят из макроцепей полигалактуроновой кислоты, часть карбоксильных групп пектина метоксилированы. Отношение содержания метоксилированных карбоксильных групп к их общему количеству определяет степень этерификации, в зависимости от которой пектины имеют различное практическое применение. Так, высокоэтерифицированные пектины (степень этерификации более 50%) используются в пищевой промышленности как структурообразователи при получении йогуртов, желе, мармелада и других продуктов. Низкоэтерифицированные пектины благодаря тому, что они могут образовывать комплексы с ионами d-металлов, способствуют детоксикации организма человека от ионов тяжелых металлов и радионуклидов [9, 10].
Пектины в растительных тканях никогда не бывают в свободном состоянии. Данный класс биополимеров является составной частью клеточных стенок – оболочек, покрывающих растительные клетки и создающих прочный скелет растения. Растворимый пектин находится в соке вакуоли и межклеточных слоях тканей зрелых плодов. Химический состав и строение первичной клеточной стенки зависит от вида растительной ткани, но в основном в сильно упрощенном виде ее анатомия одинакова, это каркасные фибриллы целлюлозы, покрытые оболочкой из макромолекул гемицеллюлоз ксилоглюкановой природы и погруженные в протопектиновый матрикс. Макромолекулы связаны между собой водородными связями [9, 11, 12]. Кроме того, пектины клеточных стенок образуют ковалентные связи с лигнином [13]. Образно эту конструкцию можно уподобить железобетону: целлюлоза выполняет в ней роль каркаса, а водонасыщенный гемицеллюлозно-пектиновый гель – роль бетона. Таким строением и объясняется высочайшая механическая прочность тканей растительного организма.
В качестве структурного элемента, входящего в состав клеточной ткани, и в качестве важного компонента межклеточного пространства пектин выполняет роль связывающего и упрочняющего элемента в тканях растений для сцепления соседних клеток [14–18]. Пектины представляют собой своеобразные природные ионообменники, способные осуществлять обмен до 70% катионов. Пектин стабилизируется кальцием, формированием гелевого матрикса вокруг целлюлозы и гемицеллюлозы [19].
По современным представлениям пектины – это коллоидные комплексы полисахаридов кислого характера, состоящие из арабинана, галактана и так называемой пектиновой кислоты. ММ пектинов колеблется от 3000 до 300 000 [20].
Пектины входят в большую группу гликаногалактуронанов, основным компонентом которых являются остатки 1,4-α-D-GalpA-кислоты. Моносахаридный состав и структурные элементы пектинов могут различаться не только у различных видов растений, но и в отдельных образцах, выделенных из разных мест одного растения [21, 22].
Пектины различных источников отличаются друг от друга по свойствам. Лучше других изучены пектины плодов и овощей, пектины из базидиальных грибов практически не изучены. Цель настоящей работы – выделить пектин из нетрадиционного сырья природного происхождения и изучить его некоторые свойства.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы и методы
Выделение пектиновых веществ. В качестве природного сырья для извлечения пектиновых веществ были выбраны базидиальные трутовые грибы – трутовик щетинистоволосый (Inonotus hispidus) из разных субстратов.
Использовали высушенные, измельченные, обессмоленные трутовые тела массой 5 г, которые помещали в колбу и заливали гидролизующей смесью (50 мл 1.1%-ного раствора НСl). Гидролиз и экстракцию проводили при температуре 85–90°С, продолжительность гидролиза 2 ч. Далее смесь отфильтровывали, фильтрат упаривали при температуре 60°С. Пектиновые вещества осаждали 96%-ным этиловым спиртом в соотношении фильтрат : этанол = 1 : 2. Пектин отфильтровывали через капроновые мембраны, высушивали на воздухе и измельчали.
Эксклюзионно-жидкостная хроматография. Молекулярно-массовые характеристики пектиновых веществ определяли на жидкостном хроматографе “Agilent 1260 Infinity” с использованием хроматографической колонки “PLAquagelOHMixed” (Англия), длиной 300 мм и внутренним диаметром 8 мм.
Определение физико-химических показателей. С помощью потенциометрического титрования находили содержание свободных и этерифицированных карбоксильных групп, общее количество карбоксильных групп, метоксильных групп и рассчитывали степень этерификации. Потенциометрическое титрование выполняли на основе метода, приведенного в работах [8, 23]. В качестве титранта использовали 0.1 н раствор гидроксида натрия.
ИК-спектроскопия. ИК-спектры исследуемых образцов регистрировали на ИК-фурье-спектрометре “IRTracer-100” (“Shimadzu”, Япония) в комплекте с приставкой нарушенного полного внутреннего отражения (НПВО) MIRacle-10 c призмой diamond/ZnSe (спектральный диапазон по шкале волновых чисел 4000–450 см–1; разрешение 4 см–1, чувствительность соотношения сигнал : шум = 60 000 : 1; скорость сканирования 20 спектров в секунду).
УФ-спектрофотомерия. УФ-спектры снимали на спектрофотометре UV-1280 UV-VIS spectrophotometer, фирмы “Shimadzu” (Япония) в кварцевых кюветах толщиной 1 см относительно воды.
Определение размера частиц. Размер частиц водных растворов пектиновых веществ изучали с помощью анализатора “Litesizer” (“Litesizer 100”, “Anton Paar Сompany”, Austria). Использовали одноразовую измерительную ячейку, угол измерения обратного рассеяния. Измерение проводили при 25°C, время уравновешивания 1 мин, получен быстрый режим и максимальное количество прогонов 30 раз, время измерения 10 с. Показатель преломления водных растворов пектиновых веществ равен 1.56.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Выделение и исследование функциональных свойств пектинов из нетрадиционных сырьевых источников Inonotus hispidus, собранных из разных субстратов, а также изучение их физико-химических свойств, выявление новых областей практического применения является актуальной задачей. Исходя из этого в настоящей работе в качестве сырьевых источников были взяты базидиальные трутовые грибы [24].
В результате кислотного гидролиза из базидиального гриба Inonotus hispidus были выделены пектиновые вещества. Сухой пектин представляет собой светло-желтый или светло-коричневый порошок, обладает слабокислым вкусом, не имеет запаха. По органолептическим свойствам он не уступает яблочному пектину, 1%-ный водный раствор этого пектина имеет значение рН от 3.0 до 3.2 [25].
Как следует из табл. 1, максимальный выход пектиновых веществ, выделенных из базидиального гриба Inonotus hispidus, оказывается разным и зависит от вида субстратов, ММ образцов находятся в пределах (5.4–5.7) × 103.
Таблица 1.
Максимальный выход пектиновых веществ из базидиального гриба Inonotus hispidus разных субстратов (гидролизующий агент 1.1% раствор НСl, продолжительность гидролиза 2 ч)
| Субстрат | Коэффициент извлечения % | Выход, мас. % | Влажность, % | М × 10–3 |
|---|---|---|---|---|
| Софора японская (Styphnolоbium japоnicum) | 23 | 4.6 | 8.6 | 5.60 |
| Тополь (Populus) | 10.5 | 2.1 | 8.9 | 5.40 |
| Грецкий орех (Jиglans rеgia) | 22.75 | 4.55 | 8.5 | 5.56 |
| Тутовник (Morus) | 23 | 4.6 | 8.7 | 5.70 |
| Клен (Аcer) | 11.5 | 2.3 | 8.3 | 5.47 |
Исследованы ИК-спектры пектинов из базидиального гриба Inonotus hispidus разных субстратов, которые дают обширную информацию о строении пектиновых веществ [10, 26]. Благодаря сравнительной простоте и универсальности эксперимента ИК-спектроскопия стала распространенным методом исследования структуры растительных полисахаридов.
На рис. 1 приведен типичный ИК-спектр пектина из базидиального гриба Inonotus hispidus разных субстратов, полученный экстракцией солянной кислотой.
Рис. 1.
ИК-спектры пектиновых веществ из базидиального трутового гриба Inonotus hispidus разных субстратов: 1 – софора японская, 2 – грецкий орех, 3 – тутовник, 4 – клен, 5 – тополь. Цветные рисунки можно посмотреть в электронной версии.
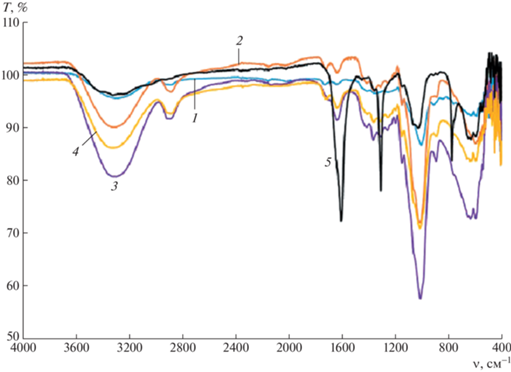
Проведенный статистический анализ ИК-спектров образцов разных субстратов базидиального и яблочного пектина как впервые полученных и исследованных нами, так и описанных в литературе, позволило выявить основные функциональные группы полос поглощения полученных образцов пектина (табл. 2).
Таблица 2.
Положение максимумов полос (см–1) яблочного и базидиального пектина разных субстратов
| Яблочный пектин | Пектин из Inonotus hispidus, субстрат Софора японская (Styphnolоbium japоnicum) | Пектин из Inonotus hispidus, субстрат Тополь (Populus) | Пектин из Inonotus hispidus, субстрат Тутовник (Morus) | Пектин из Inonotus hispidus, субстрат Клен (Аcer) | Пектин из Inonotus hispidus, субстрат Грецкий орех (Jиglans rеgia) | Преимуществен-ные типы колебаний |
|---|---|---|---|---|---|---|
| 3226–3443 | 3298 | 3329 | 3327 | 3338 | 3317 | ν(ОН)С, ν(Н2О) |
| 2935 | – | – | – | – | – | Вазелиновое масло |
| 2919 | 2900 | 2993 | 2899 | 2891 | 2893 | ν (СН) |
| 2846 | 2160 | – | – | – | 2150 | ν (СН) |
| 1742 | 1739 | 1733 | 1732 | 1732 | 1730 | ν (С=О)Е |
| 1617 | 1647 | 1647 | 1645 | 1645 | 1637 | |
| 1435 | 1419 | 1435 | 1423 | 1419 | δas(CH3)Е | |
| 1374 | 1363 | 1368 | 1371 | 1367 | 1363 | δs(CH)Е |
| 1305 | – | – | 1317 | 1317 | – | δ (СН)К |
| 1276 | 1259 | 1259–1276 | 1259 | 1259 | 1259 | |
| 1146 | – | 1152 | 1153 | 1155 | 1155 | ν (С–О–С) |
| 1103 | – | – | – | – | – | νδ(С–ОН)С ν (С–С, С–О)К |
| 1021 | 1010 | 1020 | 1020 | 1018 | 1020 | ν (С–С, С–О)К |
| 955 | 918 | 894 | 896 | 896 | – | γ (ОН)С |
| 882 | – | – | – | – | – | ρ(CH3)Е |
| 782, 721, 667, 619, 535, 514, 502 | 767, 644, 567, 545 | 607 | 646, 596, 422 | 644, 594, 457 | 607, 563 | Пульсационные колебания пиранозных колец |
В области 3000–3600 см–1 наблюдается интенсивная широкая асимметричная полоса, соответствующая валентным колебаниям групп –ОН. Воздушно-сухие пектины содержат влагу, поэтому валентные колебания воды n(Н2О) перекрываются полосами n(ОН)С гидроксилов пектина.
Область 2000–1500 см–1 относится к колебаниям групп С=О. Здесь возможно поглощение, относящееся к валентным колебаниям n(С=О) трех групп: 1717–1733, 1636–1647 см–1 [25]. При подготовке образцов пектина для записи спектров происходит замещение водорода карбоксильной группы на ионы калия. Это приводит к появлению удвоения некоторых полос и к уменьшению интенсивности полосы 1740 см–1. Интенсивность полос поглощения при 1550 см–1 согласуется с содержанием метоксильных групп в образцах, при 1317–1435 см–1 интенсивная полоса поглощения наблюдается у базидиального пектина.
В табл. 3 представлены физико-химические свойства полученных нами пектиновых веществ из базидиальных грибов Inonotus hispidus различных субстратов.
Таблица 3.
Физико-химические показатели пектина Inonotus hispidus разных субстратов
| Пектин из трутовика щетинистоволосого (Inonotus hispidus) разных субстратов | Содержание, % | Степень этерификации, % | |||
|---|---|---|---|---|---|
| свободные карбоксиль-ные группы | этерифици-рованные карбоксиль-ные группы | общее количество карбоксиль-ных групп | –ОСН3 | ||
| Софора японская (Styphnolоbium japоnicum) | 2.25 ± 0.13 | 1.8 ± 0.13 | 4.05 ± 0.12 | 7.56 ± 0.13 | 44.44 ± 0.13 |
| Тополь (Populus) | 2.7 ± 0.15 | 2.25 ± 0.13 | 4.95 ± 0.13 | 7.73 ± 0.15 | 45.45 ± 0.11 |
| Грецкий орех (Jиglans rеgia) | 2.25 ± 0.11 | 1.12 ± 0.15 | 3.37 ± 0.11 | 5.72 ± 0.12 | 33.33 ± 0.12 |
| Тутовник (Morus) | 3.15 ± 0.13 | 1.35 ± 0.10 | 4.5 ± 0.13 | 5.16 ± 0.13 | 30.00 ± 0.14 |
| Клен (Аcer) | 3.37 ± 0.14 | 1.8 ± 0.11 | 5.17 ± 0.14 | 5.96 ± 0.11 | 34.78 ± 0.13 |
Выделенные пектиновые вещества в одинаковых условиях из базидиального гриба Inonotus hispidus из разных субстратов по внешним данным представляют собой порошки от светло-желтого до светло-коричневого цвета. По степени этерификации их можно отнести к средноэтерифицированным пектинам. Значения степени этерификации изученных пектинов находятся в пределах 30–45.45%, содержание метоксильных групп – в интервале 5.16–7.73%, содержание свободных карбоксильных групп достигает 2.25–3.37%.
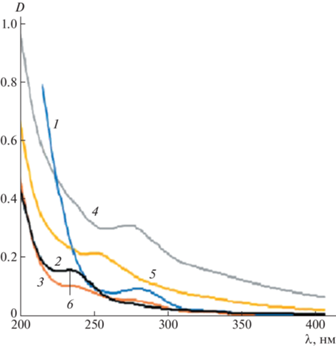
Пики поглощения УФ-спектров, характерные для пектиновых веществ, выделенных из базидиальных грибов, по сравнению с яблочным пектином, находятся в диапазоне от 239 до 284 нм (рис. 2).
Рис. 2.
УФ-спектры пектиновых веществ из базидиального трутового гриба Inonotus hispidus разных субстратов и яблочного пектина: : 1 – софора японская, 2 – грецкий орех, 3 – тутовник, 4 – клен, 5 – тополь, 6 – яблочный пектин.
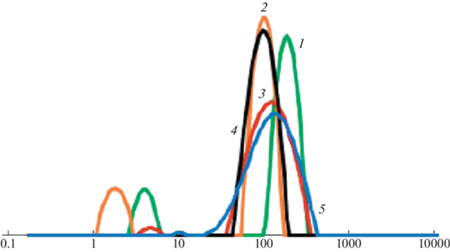
В работе изучен размер частиц образцов пектиновых веществ.
Из табл. 4 видно, что параметры гидродинамического диаметра изученных пектинов лежат в интервале 100.087–145.349 нм, индекс полидисперсности достигает 16.69–24.08%, коэффициент диффузии находится в диапазоне 3.375–4.901. Исследования показали, что образцы пектинов состоят из компонентов разной молекулярной массы.
Таблица 4.
Распределение размера частиц полученных пектинов Inonotus hispidus из разных субстратов
| Пектин из Inonotus hispidus разных субстратов | Гидродинамический диаметр, нм | Полидисперсность, % | Коэффициент диффузии |
|---|---|---|---|
| Софора японская (Styphnolоbium japоnicum) | 116.703 | 19.429 | 4.203 |
| Тополь (Populus) | 132.468 | 24.08 | 3.703 |
| Грецкий орех (Jиglans rеgia) | 111.346 | 17.21 | 4.059 |
| Тутовник (Morus) | 145.349 | 21.29 | 3.375 |
| Клен (Аcer) | 100.087 | 16.69 | 4.901 |
ЗАКЛЮЧЕНИЕ
Таким образом, из базидиального трутового гриба Inonotus hispidus, собранного из разных субстратов, в лабораторных условиях выделены пектиновые вещества в чистом виде.
Установлено, что выход пектиновых веществ из базидиального трутового гриба Inonotus hispidus зависит от вида субстрата.
Выделенные из базидиального трутового гриба Inonotus hispidus–разных субстратов пектиновые вещества охарактеризованы комплексом физико-химических методов анализа, на основе которых вычислено содержание свободных и этерифицированных карбоксильных групп, общее количество карбоксильных групп, метоксильных групп, степень этерификации и определена ММ, а также размер частиц их водных растворов.
Показано, что по основным характеристикам выделенные в настоящей работе продукты сопоставимы с пектинами, выделяемыми из традиционного сырья.
Список литературы
Li Y.H., Niu Y.B., Wu H.J., Sun Y., Li Q.A., Kong X.H., Liu L., Mei Q. // J. Food Sci. 2010. V. 75. № 8. P. 224.
Cheng H., Li S., Fan Y., Gao X., Hao M., Wang J., Zhang X., Tai G., Zhou Y. // Medical Oncology. 2011. V. 28. № 1. P. 175.
Yapo B.M. // Carbohydr. Polym. 2011. V. 86. P. 373.
Guo X., Meng H., Zhu S., Tang Q., Pan R., Yu S. // Carbohydr. Polym. 2016. V. 136. P. 316–321.
Westereng B., Michaelsen T.E., Samuelsen A.B., Knutsen S.H. // Carbohydr. Polym. 2008. V. 72. № 1. P. 32.
Maxwell E.G., Belshaw N.J., Waldron K.W., Morris V.J. // Trends Food Sci. Technol. 2012. V. 24. № 2. P. 64.
Золотарева А.М., Чуркина Т.Ф., Цыбикова Д.Ц., Бабуева Ц.М. // Химия растительного сырья. 1998. № 1. С. 29.
Аверьянова Е.В., Школьникова М.Н. Пектин: методы выделения и свойства. Бийск: Изд-во Алтайского гос. техн. ун-та им. И.И. Ползунова, 2015.
Донченко Л.В. Технология пектина и пектинопродуктов. М.: Дели, 2000.
Минзанова С.Т., Миронов В.Ф., Коновалов А.И., Выштакалюк А.Б., Цепаева О.В., Миндубаев А.З., Миронова Л.Г., Зобов В.В. Пектины из нетрадиционных источников: технология, структура, свойства и биологическая активность. Казань: Печать Сервис-XXI век, 2011.
Mc Cann M.C., Roberts K. // Pectins and Pectinases: Proceedings of an International Symposium. Wageningen, the Netherlands, 1996. P. 91.
Carpita N.C., Gibeaut D.M. // Plant J. 1993. P. 1130.
Cathala B., Chabbert B., Joly C., Dole P., Monties B. // Phytochem. 2001. V. 56. № 2. P. 195.
Galant A.L., Luzio G.A., Widmer W.W., Cameron R.G. // Food Hydrocolloids. 2014. V. 35. P. 661.
Oechslin R., Lutz M.V., Amado R. // Carbohydr. Polym. 2003. V. 51. P. 301.
Abdel-Massih R.M., Rizkallah H.D., Saif Al-Din R., Baydoun E.A.H., Brett C.T. // J. Plant Physiol. 2007. V. 164. P. 1.
Wu Y., Ai L., Wu J., Cui S.W. // Int. J. Biol. Macromol. 2013. V. 56. P. 76.
Oomen R.J.F.J., Doeswijk’-Voragen C.H.L., Bush M.S., Vincken J.P., Borkhardt B., van den Broek L.A.M., Corsar J., Ulvskov P., Voragen A.G.J., McCann M.C., Visser R.G.F. // Plant J. 2002. V. 30. № 4. P. 403.
McKenna B.A., Nicholson T.M., Wehr B.J., Menzies N.W. // Carbohydr. Res. 2010. V. 345. P. 1174.
Ефремов А.А., Кондратюк Т.А. // Химия растительного сырья. 2008. № 4. С. 171.
Горшкова Т.А. Растительная клеточная стенка как динамичная система. М.: Наука, 2007.
Ovodov Yu.S. // Russ. J. Bioorganic Chem. 2009. V. 35. № 3. P. 269.
Бодякина И.М., Багрянцев В.А., Котов В.В., Лукин А.Л. // Вестн. ВГУ, серия: Химия. Биология. Фармация. 2012. № 2. С. 9.
Иванова Н.В., Попова О.В., Бабакин В.А. // Химия растительного сырья. 2003. № 4. С. 43.
Хайтметова С.Б., Тураев А.С., Мухитдинов Б.И., Халилова Г.А. // Химия растительного сырья. 2021. № 4. С. 75.
Филиппов М.П. Инфракрасные спектры пектиновых веществ. Кишинев: Штиинца, 1978.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия Б)