Водные ресурсы, 2021, T. 48, № 1, стр. 61-69
Распределение химических элементов между компонентами экосистемы в губе Белой (озеро Имандра, Мурманская область)
А. С. Павлова a, *, С. С. Сандимиров a, Л. П. Кудрявцева a
a Институт проблем промышленной экологии Севера КНЦ РАН
184209 г. Апатиты, Россия
* E-mail: as.pavlova@ksc.ru
Поступила в редакцию 08.07.2019
После доработки 17.03.2020
Принята к публикации 09.06.2020
Аннотация
Рассмотрено влияние крупного горнорудного комплекса АО “Апатит” на водную экосистему оз. Имандра. Приведены гидрохимические данные, характеризующие зону загрязнения, показано распределение и накопление химических элементов между абиотическими и биотическими компонентами экосистемы: вода, донные отложения, сестон, рыба. Приведены доказательства, что субарктическое озеро в результате загрязнения по содержанию биогенных элементов стало соответствовать эвтрофному статусу, возросли концентрации Al, Sr и Mn в 2–3 раза, Cu и Ni − в 4–6 раз по сравнению с их условно “фоновыми” значениями. Дана оценка биогенного и минерального вклада в формирование донных отложений, а также биодоступности и аккумуляции металлов водными организмами.
ВВЕДЕНИЕ
Добыча апатит-нефелиновых руд Хибинского щелочного массива приводит к интенсивным процессам выщелачивания химических элементов, содержащихся в этих породах, и к увеличению их поступления в водную среду. Оценить качество среды водных экосистем, а также степень антропогенного влияния можно как по абиотическим параметрам, так и по биотическим с применением биоиндикации. При этом многие химические элементы, входящие в состав загрязняющих веществ, естественным образом включаются в биогеохимические циклы. В поверхностных водах планктонные организмы и рыбы взаимодействуют с растворенными и взвешенными формами микроэлементов через различные процессы: активное биологическое поглощение, адсорбцию-десорбцию, питание зоопланктона, агрегацию частиц, микробиологическое разложение и т.д. Корректная оценка накопления того или иного элемента в организме животных должна быть основана на сравнении его содержания в тканях и на усредненном пищевом субстрате (включая воду).
Цель настоящего исследования – современная характеристика химического состава поверхностных вод, донных отложений (ДО) и изучение особенностей распределения химических элементов, поступающих со стоками горнопромышленного производства, между абиотическими и биотическими компонентами экосистемы губы Белой оз. Имандра.
МАТЕРИАЛЫ И МЕТОДЫ
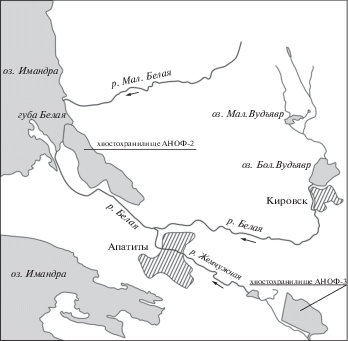
Имандра − самый крупный водоем в Мурманской области: длина озера – 109 км, средняя ширина – 3.2 км, площадь с островами – 880.5 км2, средняя глубина – 13 м, объем воды – 10.9 км3. Площадь территории водосбора (1379 водотока) составляет 12 300 км2 [12]. Губа Белая расположена в юго-восточной части плеса Большая Имандра, и в настоящее время на ее берегах сформировался ландшафт, представленный серией отстойников – “хвостов” обогащения апатитового сырья (рис. 1). После отсечения части ее акватории дамбой с целью складирования там отходов апатит-нефелиновых обогатительных фабрик (АНОФ) АО “Апатит” губа представляет собой довольно узкий залив, в который впадает р. Белая. АО “Апатит” с 1930 г. (на протяжении 90 лет) сбрасывает по р. Белой сточные воды (производственные, шахтные, ливневые), содержащие тысячи тонн взвешенных веществ, сульфатов, хлоридов, десятки тонн фосфора, нефтепродуктов и других загрязняющих веществ, применяемых в процессе флотации апатит-нефелиновых руд (ОП-4, талловые масла и др.). Сюда также сбрасываются коммунально-бытовые сточные воды городов Кировска и Апатиты [11].
Отбор проб воды и образцов сестона в губе Белой проводился в летне-осенний период 2011 г. Всего отобрано 20 проб воды и 3 пробы сестона для химического анализа. Пробы воды отбирали с разных горизонтов батометром Рутнера. ДО отобраны в августе 2012 г. пробоотборником открытого гравитационного типа “Skogheim” [18]. ДО делили на слои высотой 1 см. Отбор проб для определения видового состава фитопланктона проводился по общепринятым методикам гидробиологического мониторинга [15]. Сестон отбирался с помощью планктонной сети Апштейна методом траления за лодкой по водоему в толще воды на глубине ~3 м в течение 1–3 ч, чтобы собрать необходимую для химического анализа массу образца 30–50 г в сыром весе. По конструкции планктонная сеть близка к классической зоопланктонной сети Апштейна с планктонным стаканом, диаметром 400 мм, длиной 1000 мм и с размерами пор 29 мкм.
Отлов сига обыкновенного (Coregonus lavaretus L.) проводился в 2012 г. с использованием стандартного набора ставных сетей длиной 25 м и высотой 1.5 м с размерами ячеи 10, 16, 20, 31, 36, 40, 45 мм из нейлонового монофиламента с диаметром нити 0.15 мм для сетей с малой ячеей и 0.17 мм для сетей с большой ячеей.
Аналитические методы исследования вод, включая химический анализ компонентов и их первичную подготовку, проводились по стандартным сертифицированным методикам измерений. Анализ воды включал в себя определение pH, щелочности, ионного состава (Na+, K+, Ca2+, Mg2+, Cl–, ${\text{SO}}_{4}^{{2 - }}$) и биогенных компонентов (${\text{NH}}_{4}^{ + }$, Si, ${\text{NO}}_{3}^{ - },$ ${\text{PO}}_{4}^{{3 - }}$). Катионы Na+, K+, Ca2+, Mg2+ определялись на атомно-абсорбционном спектрофотометре “Perkin-Elmer360” в режиме пламенной атомизации. Анионы Cl–, ${\text{SO}}_{4}^{{2 - }}$, ${\text{NO}}_{3}^{ - }$ определялись методом жидкостной хроматографии “WatersHPLS” с кондуктометрическим детектором “Waters 432”. Si, ${\text{PO}}_{4}^{{3 - }}$, Pобщ, ${\text{NO}}_{3}^{ - },$ Nобщ и ${\text{NH}}_{4}^{ + }$ определялись фотометрическим методом.
Концентрации металлов (Al, Fe, Mn, Sr, Cu, Ni, Zn, Co, Cr, Cd) в воде, ДО, сестоне и рыбе определяли атомно-абсорбционным методом с атомизацией в графитовой печи на приборе “Aanalyst 800”, а также с использованием атомно-абсорбционного спектрофотометра “Perkin-Elmer 360” в режиме пламенной атомизации. Содержание ртути определяли методом атомно-абсорбционной спектроскопии холодного пара на приборе “FIMS-100 Perkin-Elmer”.
По методике И.В. Родюшкина [14] определялись формы металлов Al, Fe, Mn, Sr и Cu: взвешенные и растворимые (лабильные формы − истинные ионы, гидратированные ионы и ионы в составе неустойчивых комплексов, нелабильные − устойчивые комплексные соединения металлов).
Пробы ДО также высушивались при 105°С, далее для определения общих концентраций металлов навеску образца (0.4 г) разлагали в 4 мл HNO3конц в автоклаве с тефлоновым вкладышем при 140°С в течение 4 ч. В пробах сестона и ДО также определяли зольность [4].
Первичная подготовка проб сестона и рыбы проводилась методом разложения высушенных при 105°С образцов в смеси кислот HNO3конц и HClконц в микроволновой системе “Speedwave™ MWS-3”.
Для контроля качества измерений элементов в воде использовались государственные стандартные образцы (ГСО). Для внутреннего контроля качества процедуры пробоподготовки и качества измерений донных отложений и планктонных образцов общей массой 30–50 г в сыром виде проводилась минерализация сертифицированного образца морского седимента PACS-2 (Canada 08/1997), для контроля ихтиологических проб использовались сертифицированные образцы мышцы акулы DORM-2 (Canada09/1999) и DORM-3 (Canada02/2007) [13].
Для оценки степени загрязнения пресноводного озера химическими веществами использованы коэффициенты загрязнения (Cf) Hákanson для донных отложений [17].В качестве модели минеральной взвеси взяты кларки элементов в земной коре по А.П. Виноградову [3].
Для каждого элемента вклад биогенной доли (Мебио) определялся в общем виде, согласно выражению [6]:
Степень накопления химических элементов различными компонентами экосистемы оценивалась с помощью безразмерного коэффициента накопления (Кн) как отношение концентрации элемента в данном компоненте к его концентрации в воде [2, 6]:
Исследуемые формы элементов и их соединений определялись расчетным путем с использованием программного комплекса “CHEAQS” [19] по набору гидрохимических параметров пробы воды.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Гидрохимическая характеристика губы Белой оз. Имандра
Вода оз. Имандра в природном ее состоянии относилась к нейтральной с pH от 6.4 до 7.2 [9]. В конце 1990-х–начале 2000-х гг. pH вод в губе Белой менялся от 7.33 до 7.82 в зависимости от гидрологического сезона [10, 11]. В настоящее время рН воды в губе Белой увеличился в сторону подщелачивания – 7.27–8.74. Минерализация составляет в среднем 81 мг/л, что в 3 раза превышает естественное природное значение (20–30 мг/л). Для природных вод Кольского Севера типично преобладание ${\text{HCO}}_{3}^{ - }$ в анионном составе и Ca2+− в катионном. Поступление промышленных сточных вод в водоем обусловливает не только повышение общего содержания солей, но и изменение соотношения главных ионов в воде губы Белой. В минерализации воды отмечается повышение доли сульфатов, среди катионов – натрия:
В доиндустриальный период оз. Имандра характеризовалось как олиготрофный водоем с достаточно низким содержанием соединений азота (NO3 до 35 мкг/л) и фосфора (PO4 до 8 мкг/л). Обогащение воды биогенными элементами – основной критерий процесса эвтрофирования. Развитие промышленности на территории побережья озера способствует интенсивному поступлению в него промышленных, а также хозяйственно-бытовых сточных вод. Концентрация общего фосфора и азота в осенний период в губе Белой варьировали от 19 до 97 мкгP/л и от 200 до 661 мкгN/л, а среднее содержание фосфатов и нитратов составляло 15 и 347 мкгN/л соответственно. По классификации С.П. Китаева [5], вода в губе Белой в настоящее время соответствует эвтрофному статусу. Концентрация кремния в среднем составляет 0.28 мг/л.
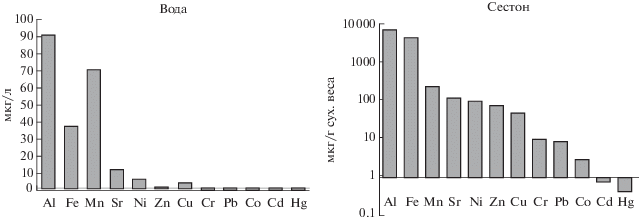
Для оценки степени загрязнения озера металлами в качестве условно-фоновых приняты усредненные концентрации в удаленных от промышленных узлов водоемах Кольского п-ова: Al < 30, Sr < 26, Ni < 1, Cu < 1 мкг/л [11]. В период интенсивного антропогенного воздействия поступление в водоем стоков от АО “Апатит” привело к увеличению в нем содержания тяжелых металлов. В период исследования концентрации Al и Sr превысили “фоновые” значения в среднем в 3 раза. Эти элементы – основные компоненты сточных вод АО “Апатит” – поступают в губу Белую в составе тонкодисперсных взвесей нефелина после фильтрации технологических стоков через дамбу хвостохранилища, а также в результате пыления хвостохранилищ. Наблюдается увеличение содержания Cu и Ni в 4–6 раз (табл. 1). Повышение концентраций Cu и Ni связано с их поступлением в водоем в составе сточных вод медно-никелевого комбината, расположенного в северной части оз. Имандра на расстоянии от него ~30 км, а также воздушным путем. Содержание Fe и Mn составляет в среднем 37 и 12 мкг/л соответственно. По данным [11] приняты условно-фоновые концентрации Fe (34 мкг/л) и Mn (5.6 мкг/л). Таким образом, наблюдается превышение содержания Mn в 2 раза. Концентрация Zn в губе Белой составляет ~ 1.5 мкг/л, что соответствует ее условно-фоновым значениям (2 мкг/л). Содержание Co, Pb и Cr – в пределах обнаружения концентрации − 0.2 мкг/л, а Cd − 0.05 мкг/л.
Таблица 1.
Гидрохимические показатели губы Белой (здесь и в табл. 3 в числителе – среднее, в знаменателе – минимальное–максимальное значения)
| Показатель, размерность | Значение | Показатель, размерность | Значение |
|---|---|---|---|
| pH | $\frac{{7.65}}{{7.27{\kern 1pt} - {\kern 1pt} 8.74}}$ | Na, мгл–1 | $\frac{{17.0}}{{16.0{\kern 1pt} - {\kern 1pt} 18.0}}$ |
| Электропроводность, (20°С), мкСмсм–1 | $\frac{{104}}{{103{\kern 1pt} - {\kern 1pt} 135}}$ | K, мгл–1 | $\frac{{3.60}}{{3.16{\kern 1pt} - {\kern 1pt} 4.40}}$ |
| Щелочность, мкэквл–1 | $\frac{{454}}{{391{\kern 1pt} - {\kern 1pt} 570}}$ | Mg, мгл–1 | $\frac{{1.01}}{{0.89{\kern 1pt} - {\kern 1pt} 1.09}}$ |
| Органическое вещество, мгСл–1 | $\frac{{3.4}}{{2.9{\kern 1pt} - {\kern 1pt} 3.8}}$ | Al, мкг/л | $\frac{{91}}{{46{\kern 1pt} - {\kern 1pt} 175}}$ |
| Pобщ, мкгл–1 | $\frac{{55}}{{19{\kern 1pt} - {\kern 1pt} 97}}$ | Fe, мкг/л | $\frac{{37}}{{13{\kern 1pt} - {\kern 1pt} 62}}$ |
| ${\text{PO}}_{4}^{{3 - }},$ мкгPл–1 | $\frac{{15}}{{2{\kern 1pt} - {\kern 1pt} 51}}$ | Mn, мкг/л | $\frac{{12}}{{4.9{\kern 1pt} - {\kern 1pt} 31}}$ |
| Nобщ, мкгл–1 | $\frac{{406}}{{200{\kern 1pt} - {\kern 1pt} 661}}$ | Sr, мкг/л | $\frac{{67}}{{55{\kern 1pt} - {\kern 1pt} 87}}$ |
| ${\text{NO}}_{3}^{ - },$ мкгNл–1 | $\frac{{347}}{{176{\kern 1pt} - {\kern 1pt} 478}}$ | Cu, мкг/л | $\frac{{4.1}}{{3.7{\kern 1pt} - {\kern 1pt} 4.6}}$ |
| ${\text{NH}}_{4}^{ + },$ мкгNл–1 | $\frac{{34}}{{3{\kern 1pt} - {\kern 1pt} 85}}$ | Ni, мкг/л | $\frac{{6.2}}{{4.9{\kern 1pt} - {\kern 1pt} 8.6}}$ |
| ${\text{HCO}}_{3}^{ - },$ мгл–1 | $\frac{{26}}{{24{\kern 1pt} - {\kern 1pt} 30}}$ | Zn, мкг/л | $\frac{{1.5}}{{0.4{\kern 1pt} - {\kern 1pt} 4.5}}$ |
| ${\text{SO}}_{4}^{{2 - }},$ мгл–1 | $\frac{{22}}{{20{\kern 1pt} - {\kern 1pt} 23}}$ | Cd, мкг/л | $\frac{{0.05}}{{0.01{\kern 1pt} - {\kern 1pt} 0.18}}$ |
| Cl– , мгл–1 | $\frac{{5.6}}{{5.4{\kern 1pt} - {\kern 1pt} 5.7}}$ | Co, мкг/л | <0.2 |
| Si, мгл–1 | $\frac{{0.28}}{{0.05{\kern 1pt} - {\kern 1pt} 0.66}}$ | Pb, мкг/л | $\frac{{0.2}}{{0.1{\kern 1pt} - {\kern 1pt} 0.3}}$ |
| Ca, мгл–1 | $\frac{{4.21}}{{3.95{\kern 1pt} --{\kern 1pt} 4.60}}$ | Cr, мкг/л | $\frac{{0.2}}{{0.1{\kern 1pt} - {\kern 1pt} 0.6}}$ |
Al и Fe находились преимущественно во взвешенных формах – от 80 до 90% от общего содержания (табл. 2), которые представлены в виде гидроксидных и оксидных соединений этих металлов, в том числе с сорбированными пленками органических веществ гумусовой природы. Лабильные формы Al и Fe представлены соединениями с ионами хлоридов и гидроксогруппами. Основная форма Sr – лабильная, в наиболее токсичной ионной форме Sr содержится более чем на 97%. Mn находился преимущественно во взвешенной форме, образованной окислами с соединениями Fe, органическим веществом и сорбированными ионами других металлов.
Таблица 2.
Формы нахождения металлов в водной толще губы Белой и долевое распределение взвешенной и растворимой форм металлов (%)
| Элемент | Горизонт | pH | Взвешенная форма | Растворимая форма | Растворимая, расчетные данные | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| мкг/л | доля, % |
расчет, % |
нелабильная, мкг/л |
лабильная, мкг/л |
доля, % | нелабильная, % |
лабильная, % |
всего, % | |||
| Al | Поверхность | 7.54 | 92.2 | 81 | 75 | 1.6 | 20.2 | 19 | 2.9 | 22.1 | 25 |
| 10 м | 7.36 | 154 | 88 | 87 | 2.9 | 18.3 | 12 | 1 | 12 | 13 | |
| Fe | Поверхность | 7.54 | 24 | 86 | 85 | 2.6 | 1.4 | 14 | 8.5 | 6.5 | 15 |
| 10 м | 7.36 | 56.2 | 91 | 89 | 4.3 | 1.5 | 9 | 6.5 | 4.5 | 11 | |
| Sr | Поверхность | 7.54 | 11.6 | 14 | 10 | 0.1 | 70.3 | 86 | 5 | 85 | 90 |
| 10 м | 7.36 | 11.6 | 13 | 10 | 0.3 | 75.1 | 87 | 5 | 85 | 90 | |
| Mn | Поверхность | 7.54 | 9.8 | 98 | 99 | 0.1 | 0.1 | 2 | 0.3 | 0.7 | 1 |
| 10 м | 7.36 | 30.2 | 97 | 99 | 0.3 | 0.5 | 3 | 0.3 | 0.7 | 1 | |
| Cu | Поверхность | 7.54 | 1.6 | 30 | 29 | 1 | 1.1 | 70 | 16 | 55 | 71 |
| 10 м | 7.36 | 1.6 | 38 | 42 | 1.2 | 1.4 | 62 | 13 | 45 | 58 | |
Распределение Cu по формам в результате последовательного разделения согласуется с данными проведенных расчетов и указывает на более высокое содержание растворенных форм – в том числе комплексов с гумусовыми лигандами и неорганическими анионами (хлориды, гидроксогруппы).
Ионы Zn в большей степени находятся в лабильной форме в виде гидроксо-соединений. Лабильная ионная форма Ni2+ составляет >90%. Pb представлен как в лабильной, так и в нелабильной форме, >50% его соединений – лабильные гидроксо-соединения.
Химический состав ДО
Попадая в водную экосистему, химические вещества распределяются между компонентами этой водной среды – часть растворяется в воде, образуя ионы металлов, гидратированные ионы и ионы в составе неустойчивых комплексов, часть находится в виде взвесей. Также элементы сорбируются и аккумулируются гидробионтами, а большая их доля удерживается ДО [7–9, 14]. В ДО губы Белой отмечается максимальное содержание большинства металлов среди других компонентов экосистемы (табл. 3).
Таблица 3.
Содержание металлов в ДО губы Белой (Cf – коэффициенты загрязнения; Мебио – вклад биогенной доли металлов через сестон в ДО, %; кларки элементов в земной коре по [3])
| Элемент | ДО, мкг/гсух в, n = 10 | Cf | Мебио, % | Кларки | |
|---|---|---|---|---|---|
| 0–3 см | нижний слой | ||||
| Зольность, % | 87.5 | 91 | ≈100 | ||
| Al | $\frac{{54{\kern 1pt} 803}}{{36{\kern 1pt} 393{\kern 1pt} - {\kern 1pt} 80{\kern 1pt} 145}}$ | $\frac{{39{\kern 1pt} 163}}{{23{\kern 1pt} 000{\kern 1pt} - {\kern 1pt} 52{\kern 1pt} 551}}$ | 1.4 | 3 | 80 500 |
| Fe | $\frac{{24{\kern 1pt} 377}}{{22{\kern 1pt} 247{\kern 1pt} - {\kern 1pt} 26{\kern 1pt} 364}}$ | $\frac{{20{\kern 1pt} 615}}{{13{\kern 1pt} 770{\kern 1pt} - {\kern 1pt} 22{\kern 1pt} 210}}$ | 1.2 | 5 | 46 500 |
| Mn | $\frac{{2975}}{{1045{\kern 1pt} - {\kern 1pt} 6566}}$ | $\frac{{2016}}{{909{\kern 1pt} - {\kern 1pt} 2846}}$ | 2 | 2 | 1000 |
| Sr | $\frac{{2303}}{{1083{\kern 1pt} - {\kern 1pt} 5242}}$ | $\frac{{792}}{{281{\kern 1pt} - {\kern 1pt} 1600}}$ | 3.2 | 2 | 340 |
| Cu | $\frac{{272}}{{190{\kern 1pt} - {\kern 1pt} 389}}$ | $\frac{{112}}{{87{\kern 1pt} - {\kern 1pt} 126}}$ | 3.1 | 4 | 47 |
| Ni | $\frac{{855}}{{498{\kern 1pt} - {\kern 1pt} 1574}}$ | $\frac{{82.6}}{{25.7{\kern 1pt} - {\kern 1pt} 165}}$ | 12 | 3 | 58 |
| Zn | $\frac{{125}}{{88{\kern 1pt} - {\kern 1pt} 146}}$ | $\frac{{91}}{{69.2{\kern 1pt} - {\kern 1pt} 113}}$ | 1.4 | 13 | 83 |
| Cd | $\frac{{0.44}}{{0.21{\kern 1pt} - {\kern 1pt} 0.73}}$ | $\frac{{0.1}}{{0.04{\kern 1pt} - {\kern 1pt} 0.17}}$ | 5.2 | 45 | 0.13 |
| Co | $\frac{{28.7}}{{25.8{\kern 1pt} - {\kern 1pt} 38.7}}$ | $\frac{{18}}{{13.2{\kern 1pt} - {\kern 1pt} 21.8}}$ | 1.6 | 3 | 18 |
| Pb | $\frac{{12.8}}{{10.1{\kern 1pt} - {\kern 1pt} 14.5}}$ | $\frac{{5.50}}{{1.82{\kern 1pt} - {\kern 1pt} 9.92}}$ | 3.5 | 17 | 16 |
| Cr | $\frac{{33.5}}{{24.4{\kern 1pt} - {\kern 1pt} 41.4}}$ | $\frac{{48}}{{38.7{\kern 1pt} - {\kern 1pt} 58.1}}$ | 0.7 | 8 | 83 |
| Hg | $\frac{{0.27}}{{0.16{\kern 1pt} - {\kern 1pt} 0.38}}$ | $\frac{{0.06}}{{0.02{\kern 1pt} - {\kern 1pt} 0.24}}$ | 8.2 | 39 | 0.083 |
В верхних слоях ДО губы Белой содержание Al, Fe, Mn, Zn и Co в среднем в 1.5 раза выше, чем в нижних “условно-фоновых” слоях. Аккумуляция металлов Sr, Cu, Pb в слое 0–3 см увеличиваeтся в 2.5–3 раз, а Cd и Hg – до 4 раз по отношению к нижним слоям ДО. Отмечается высокое содержание Ni в верхних слоях – до 10 раз относительно “условно фоновых” концентраций. Это увеличение, как отмечалось выше, связано с их накоплением в результате поступления в составе сточных вод медно-никелевого комбината, а также с аэротехногенным переносом. По рассматриваемым элементам степень загрязнения ДО в губе Белой меняется от умеренной (по Al, Fe, Mn, Zn и Co) до значительной (по Sr, Cu, Cd и Pb). Высокая степень загрязнения отмечена по Ni и Hg (Cf > 6).
При оценке вклада биогенной и минеральной форм металлов, поступающих через сестон в ДО озера, установлено, что от 39 до 45% Hg и Cd поставляется через органическое вещество сестона. На долю биогенной составляющей Zn и Pb приходится от 10 до 20%. Для большинства рассматриваемых металлов Мебио не превышает 10%. ДО в губе Белой формируются главным образом за счет минеральных компонентов, однако не исключается и некоторый вклад конституционных (биогенных) элементов скелетных и покровных тканей планктонных организмов. Как отмечено в [6], существует методическая проблема геохимической интерпретации вещественного состава проб планктона с целью отнесения их либо к чисто планктонным образцам, либо к пробам сестона (смесь планктона, органического детрита и минеральной взвеси), для ее решения необходимы более углубленные исследования.
Таксономический и химический состав сестона
В составе фитопланктонного сообщества – главной части сестона – обнаружено 104 таксона водорослей: Bacillariophyta – 53, Chlorophyta – 24, Cyanophyta – 15, Chrysophyta – 4, Dinophyta – 3, C-harophyta – 5. В течение всего вегетационного периода в общей биомассе фитопланктона доминировали диатомовые водоросли. Массовые представители (до 80% численности) фитопланктона – 4 вида диатомовых водорослей: Aulacoseiraislandicavar. helvetica O. Müll., DiatomatenueAg. var. tenue, AsterionellaformosaHass. var. formosa, FragilariacrotonensisKitt. var. Crotonensis [1].
Химический анализ вод и сестона губы Белой показал, что содержание металлов варьирует в широких пределах (рис. 2) и распределяется для сестона в ряду: Al > Fe > Mn > Sr > Ni > Zn > Cu > > Cr ≥ Pb > Co > Cd > Hg. Наиболее большое накопление отмечено для элементов Al (в среднем 6838 мкг/гсух в) и Fe (в среднем 4302 мкг/гсух в). Содержание Mn составляет в среднем 234 мкг/гсух в.
Содержание металлов в органах и тканях сига (Coregonuslavaretus L)
Металлы неравномерно накапливаются в органах и тканях рыб. Наиболее высокие содержания Al отмечены в жабрах (до 46.9 мкг/гсух в), что, вероятно, связано с адсорбированием взвешенных частиц металла на жаберном аппарате. Cu главным образом депонируются в печени рыб. Приоритетным органом – накопителем металлов Fe, Ni, Cd, Co, Pb и Hg в организме сига являются почки. В скелетной ткани максимально аккумулируются Sr (в среднем 859 мкг/гсух в) и Mn (до 41.5 мкг/гсух в). Аккумуляция Sr и Mn в скелете обусловлена биологическими свойствами элементов, оказываeт влияние на процессы костеобразования [16]. Cr накапливается в скелетных тканях: составляя в жабрах 0.55, в скелете – 0.44 мкг/гсух в.
Элементы Sr, Zn и Hg в большей степени накапливаются в организме сига, что, вероятно, обусловлено биологическими свойствами самих элементов. Так, соединения Sr близки по свойствам к соединениям Ca и оказывают влияние на процессы костеобразования, полностью заменяя последний, а также на активность ряда ферментов – каталазы, карбоангидразы и щелочной фосфатазы. Zn активно включается в биологические циклы, являясь металлоферментом, достаточно равномерно распределяется между органами и тканями рыб. Ртуть преимущественно концентрируется в жировой и мышечной тканях до 70% [16].
Расчеты коэффициентов накопления Кнd и Кнt показали, что биодоступность металлов для водных организмов, в частности для рыб, определяется преимущественно их растворимыми формами миграции в водной массе (табл. 4). Так, например, Sr, для которого основной формой является наиболее токсичная – лабильная, полностью накапливается из воды системами организма рыб, главным образом костными тканями.
Таблица 4.
Коэффициенты накопления в компонентах среды (Кнt − относительно общего содержания металла, Кнd – относительно растворимой формы металла)
| Компонент | Коэффициент | Fe | Al | Sr | Mn | Cu | Ni | Cd | Co | Zn | Pb | Cr | Hg |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Сестон | Кнt | 5.2 | 4.9 | 3.2 | 4.3 | 4 | 5.2 | 4.5 | 4.2 | 5.2 | 4.7 | 4.5 | 3.8* |
| Мышцы | Кнt | 2.6 | 1.4 | 2.2 | 2.2 | 2.3 | 2 | 1.9 | 2.3 | 4.4 | 1.8 | 2.9 | 3.5* |
| Кнd | 3.5 | 2.1 | 2.3 | 3.5 | 2.5 | – | – | – | – | – | – | – | |
| Печень | Кнt | 3.7 | 1.8 | 1.9 | 2.9 | 3.7 | 2.4 | 3.1 | 2.7 | 5.2 | 2.4 | 2.8 | 3.6* |
| Кнd | 4.6 | 2.6 | 2 | 4.3 | 4 | – | – | – | – | – | – | – | |
| Почки | Кнt | 4 | 2.1 | 2.1 | 2.7 | 3.3 | 2.8 | 4.1 | 3.7 | 5.2 | 2.8 | 3.2 | 3.7* |
| Кнd | 4.8 | 2.7 | 2.2 | 4 | 3.5 | – | – | – | – | – | – | – | |
| Жабры | Кнt | 3.7 | 2.6 | 3.5 | 3.4 | 2.8 | 2.6 | 3 | 2.9 | 5.4 | 2.9 | 3.5 | 3.4* |
| Кнd | 4.6 | 3.5 | 3.5 | 4.8 | 2.9 | – | – | – | – | – | – | – | |
| Скелет | Кнt | 2.8 | 1.8 | 4.1 | 3.6 | 2.3 | 2.7 | 2.2 | 2 | 5.2 | 2.4 | 3.4 | 3.2* |
| Кнd | 3.7 | 2.4 | 4.1 | 4.9 | 2.7 | – | – | – | – | – | – | – |
Высокие коэффициенты накопления Al, Fe и Mn, а также элементов Ni, Cd, Pb и Cr в сестоне губы Белoй, вероятно, связаны не только с бионакоплением металлов в живых планктонных организмах, но также с процессами сорбции ионов металлов (в частности, адсорбции тонкодисперсных взвесей, представленных как минеральной, так и органической составляющей, на поверхности клеточных мембран организмов) и их способностью вступать в комплексообразование с органическими (например, продуктами метаболизма фитопланктона) и органоминеральными веществами [7, 16].
Проведенные исследования показали, что химические элементы, поступающие в губу Белую оз. Имандра, интенсивно накапливаются в различных компонентах его экосистемы. Причем, уровни накопления неодинаковы и определяются специфическими свойствами как самих элементов, так и особенностями систем организмов, в которых происходит их аккумуляция [2, 6].
Для анализа малых выборок и оценки степени зависимости между переменными были применены методы непараметрической статистики. Анализ содержания загрязняющих веществ в воде, ДО и рыбе, а также коэффициента загрязнения показал высокие корреляционные зависимости: коэффициент корреляции Пирсона: R2 = = 0.645 – 0.973 (p < 0.002). Пространственное распределение также показало высокую степень зависимости исследуемых параметров при сравнении с гидрохимическими показателям.
Таким образом, антропогенное загрязнение в губе Белой, накладываясь на природные процессы, оказывает существенное влияние на них, стимулируя процессы эвтрофирования, а также обогащения вод токсичными микроэлементами, когда водоем подвергается воздействию прямых промышленных стоков.
ВЫВОДЫ
В результате долговременного воздействия горнопромышленного комплекса АО “Апатит” на воду в губе Белой она претерпела техногенную трансформацию. Величина pH воды увеличилaсь в сторону подщелачивания, изменилось соотношение главных ионов минерализации: в анионном составе преобладающими стали сульфаты, в катионном – натрий. В настоящее время вода по содержанию биогенных элементов имеет эвтрофный статус. Концентрации Al, Sr и Mn увеличились в 2–3 раза, Cu и Ni − в 4–6 раз по сравнению с их условно “фоновыми” значениями в удаленных от промышленных узлов водоемах Кольского п-ова.
Al, Fe, а также Mn преимущественно находятся во взвешенном состоянии. Cu преобладает в растворимой форме: в комплексах с гумусовыми лигандами и неорганическими анионами – хлориды, гидроксогруппы. Основной формой Sr является лабильная, представленная Sr2+ более чем на 97%. В лабильной форме преобладает Zn и Ni.
Степень загрязнения ДО оз. Имандра в районе губы Белой меняется от умеренной (Al, Fe, Mn, Zn и Co) до значительной (Sr, Cu, Cd и Pb). Высокая степень загрязнения отмечена для Ni и Hg (Cf > 6). Поступление рассматриваемых металлов в ДО связано, главным образом, с химическими элементами минерального происхождения и менее значимо – с органическим веществом сестона.
Биодоступность металлов водными организмами определяется преимущественно их формой нахождения в водной среде, а также их физико-химическими особенностями.
В организмах рыб выявлены следующие закономерности: приоритетным органом – накопителем тяжелых металлов являются почки; для печени характерна высокая степень обогащения Zn, Hg и Cu; Cd концентрируется в печени и почках; костные ткани обогащены Sr.
Список литературы
Вандыш О.И., Денисов Д.Б., Черепанов А.А., Горбачева Т.А., Кашулин Н.А. Особенности планктонных сообществ губы Белой озера Имандра при долговременном воздействии сточных вод горнорудного производства // Тр. КНЦ РАН. Прикладная экология Севера. Апатиты: Изд-во КНЦ РАН, 2013. Вып. 3. С. 35–67.
Ветров В.А., Кузнецова А.И. Микроэлементы в природных средах региона озера Байкал / Под ред. М.И. Кузьмина. Новосибирск: Изд-во СО РАН, НИЦ ОИГГМ, 1997. 234 с.
Виноградов А.П. Средние содержания химических элементов в главных типах изверженных горных пород земной коры // Геохимия. 1962. № 7. С. 555–571.
Даувальтер В.А. Исследование физического и химического состава донных отложений при оценке экологического состояния водоемов: учеб. пособие по дисциплине “Геохимия окружающей среды”. Мурманск: Изд-во МГТУ, 2006. 84 с.
Китаев С.П. Основы лимнологии для гидробиологов и ихтиологов / Под ред. Л.В. Карабановой. Петрозаводск: Изд-во КарНЦ РАН, 2007. 395 с.
Леонова Г.А. Геохимическая роль планктона континентальных водоемов Сибири в концентрировании и биоседиментации микроэлементов. Новосибирск: Гео, 2012. 314 с.
Линник П.Н., Набиванец Б.И. Формы миграции металлов в пресных поверхностных водах. Л.: Гидрометеоиздат, 1986. 270 с.
Малиновский Д.Н. Особенности миграции загрязняющих веществ в районах разработки апатитонефелиновых месторождений Мурманской области. Дис. … канд. геогр. наук. Апатиты: КНЦ РАН, 1999. 236 с.
Материалы к изучению вод Кольского полуострова. Мурманск: Кольская база АН СССР, 1940. С. 45–98.
Моисеенко Т.И., Гашкина Н.А. Формирование химического состава вод Мурманской области в условиях функционирования горнорудных и металлургических производств // Арктика: экология и экономика. 2015. № 4 (20). С. 4–13.
Моисеенко Т.И., Даувальтер В.А., Лукин А.А., Кудрявцева Л.П., Ильяшук Б.П., Ильяшук Е.А., Сандимиров С.С., Каган Л.Я., Вандыш О.И., Шаров А.Н., Шарова Ю.Н., Королева И.М. Антропогенные модификации экосистемы озера Имандра // Отв. ред. Т.И. Моисеенко. М.: Наука, 2002. 403 с.: ил.
Моисеенко Т.И., Яковлев В.А. Антропогенные преобразования водных экосистем Кольского Севера. Л.: Наука, 1990. 220 с.
Павлова А.С., Кашулин Н.А., Денисов Д.Б., Терентьев П.М., Кашулина Т.Г., Даувальтер В.А. Распределение химических элементов между компонентами экосистемы арктического озера Большой Вудъявр (Хибины, Мурманская область) // Сибирский экол. журн. 2019. № 3. С. 348–366.
Родюшкин И.В. Формы нахождения металлов в воде озера Имандра // Проблемы химического и биологического мониторинга экологического состояния водных объектов Кольского полуострова. Апатиты: КНЦ РАН, 1995. С. 55–64.
Руководство по методам гидробиологического анализа поверхностных вод и донных отложений / Под ред. В.А. Абакумова. СПб.: Гидрометеоизат, 1992. 305 с.
Чистяков Ю.В. Основы бионеорганической химии // М.: Химия, Колос-с, 2007. 539 с.
Hakanson L. An ecological risk index for aquatic pollution control – sedimentological approach // Water Res. 1980. V. 17. № 36. P. 663.
Skogheim O.K. Rapport fra Arungenprosjektet. Oslo: NLH, 1979. № 2. 7 p.
Verweij W. CHemical Equilibria in AQuatic Systems (CHEAQS) Next program. 2014. [Электронный ресурс]. URL: http://www.cheaqs.eu/index.html (дата обращения: 20.05.2019)
Дополнительные материалы отсутствуют.