Химия высоких энергий, 2019, T. 53, № 2, стр. 100-105
Сенсибилизированная бензофеноном долгоживущая фосфоресценция при комнатной температуре нафталина-d8 в комплексе с бета-циклодекстрином и циклогексаном
В. Б. Назаров a, *, В. Г. Авакян b, c, **, М. В. Алфимов b, c
a Федеральное государственное бюджетное учреждение науки Институт проблем химической физики РАН
142432 Черноголовка, просп. Акад. Семенова, 1, Россия
b Центр фотохимии РАН, ФГУ ФНИЦ “Кристаллография и фотоника РАН”
119421 Москва, ул. Новаторов, 7а, кор. 1, Россия
c Федеральное государственное автономное образовательное учреждение высшего образования “Московский физико-технический институт” (Государственный университет)
141700 Долгопрудный, Институтский пер. 9, Россия
* E-mail: vnazarov@icp.ac.ru
** E-mail: avak@photonics.ru
Поступила в редакцию 27.06.2018
После доработки 26.10.2018
Принята к публикации 22.10.2018
Аннотация
Сенсибилизированная фосфоресценция нафталина-d8 с временем жизни 14.7 с при 22°С получена в супрамолекулярном комплексе “нафталин-d8–β-циклодекстрин–циклогексан–бензофенон” за счет Т-Т переноса энергии при возбуждении на 365 нм бензофенона. Геометрическая структура этого комплекса, энергии синглетных переходов и силы осцилляторов рассчитаны методами квантовой химии.
ВВЕДЕНИЕ
Долгоживущая фосфоресценция аренов при комнатной температуре (ФКТ) привлекает внимание исследователей [1] благодаря возможностям применения в фотовольтаике [2], для создания органических светодиодов (OLEDs) [3] и в хемосенсорике [4, 5]. Максимальное время жизни фосфоресценции аренов наблюдается обычно для замороженных до 77 К растворов аренов, в которых за счет жесткости системы подавляются безызлучательные процессы и тушение кислородом. Однако в последнее время для наблюдения долгоживущей ФКТ c τphos > 1 с все чаще прибегают к использованию комплексов типа “гость–хозяин”, в которых излучающая молекула арена, выступающая в качестве “гостя”, имплементирована в полость молекулы “хозяина”. В таком комплексе безызлучательные процессы оказываются в значительной степени подавлены за счет жесткости матрицы “хозяина”. Примером таких матриц являются циклодекстрины (ЦД) и цеолиты. Использование комплексов аренов (нафталин, фенантрен, флуорен) с β- и γ-ЦД позволило получить долгоживущую ФКТ (τphos > 1–10 с). Повышение жесткости матрицы достигалось путем добавления к водному раствору комплекса арен–ЦД насыщенного углеводорода (циклогексан, гексан и др.), что приводило к образованию агрегированного трехкомпонентного комплекса, существовавшего в виде водной суспензии, а связывание растворенного кислорода осуществлялось добавкой сульфита натрия [6–8]. При добавлении адамантана [9] и его производных [10] к комплексу нафталин-d8 – βЦД удалось получить долгоживущую ФКТ (τphos > 10 с) даже в присутствии кислорода. Удаление кислорода из образца комплекса нафталин-d8–βЦД–адамантан привело к росту τphos до 15 с [9]. Для системы коронен-d12 – цеолит ZIF-8 была получена ФКТ со временем τphos= 22.4 с при 300 К [11]. В этих работах генерирование ФКТ осуществлялось за счет возбуждения арена на S1 уровень с последующим заселением триплетного уровня Т1 путем интеркомбинационной конверсии.
Другим путем заселения уровня Т1 является триплет-триплетный (T-T) перенос возбуждения по нижним триплетным уровням двух аренов, из которых один является донором (Д) энергии и другой акцептором (А) [11–13]. Последнее, в принципе, возможно при соблюдении следующих соотношений между уровнями энергии Д и А: ${\text{S}}_{1}^{{\text{Д }}}$ < ${\text{S}}_{1}^{{\text{А }}}$ и ${\text{T}}_{1}^{{\text{Д }}}$ > ${\text{T}}_{1}^{{\text{А }}}.$ Для полиароматических соединений (нафталин, фенантрен и др.), которые являются акцепторами триплетной энергии, наиболее подходящими донорами энергии являются ароматические кетоны (бензофенон, бензальдегид и др.), обладающие n-π* поглощением в длинноволновой области, где синглет-сиглетное поглощение акцепторов энергии отсутствует. Для этих доноров выполняется приведенное выше условие по уровням энергии, причем возбуждение Д приводит к 100% заселению его нижнего триплетного уровня. Ранее T-T перенос между бензофеноном и нафталином наблюдался в замороженных растворах при 77 К [12], в примесных кристаллах бензофенон-нафталин [13], а также вследствие внутримолекулярного переноса возбуждения в специально синтезированном линейном углеводороде, содержавшем в α-положении бензофеноновый Д, а в ω-положении – нафталиновый А. Д и А заместители были разделены от одной до трех молекул флуорена, которые за счет π-π стекинг-взаимодействия обеспечивали перенос возбуждения от Д к А [14]. Однако триплет-триплетный перенос энергии в супрамолекулярных системах, в которых возможно образование долгоживущего триплетного состояния аренов при комнатной температуре, остается мало изученным [6].
В настоящей работе, использовав добавку бензофенона в качестве донора триплетной энергии, мы попытались осуществить сенсибилизированное генерирование долгоживущей ФКТ нафталина-d8, в изученной ранее супрамолекулярной системе нафталин-d8–βЦД. Кроме того, нами были выполнены квантово-химические расчеты на разных уровнях теории структурных моделей предполагаемых комплексов, а также рассчитаны энергии возбуждения и орбитальная структура комплексов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Вещества и образцы. Нафталин-d8 (“Изотоп”) очищали возгонкой. Для приготовления комплексов использовали дважды дистиллированную воду, без дополнительной очистки использовали βЦД (“Aeros organics”), бензофенон (“Реахим” марки ХЧ) и циклогексан “Sigma-Aldrich”. Комплекс нафталин-d8–βЦД готовили путем добавления βЦД к разбавленному вдвое насыщенному водному раствору нафталина-d8. После добавления к этому комплексу циклогексана кювету с образцом помещали на 1 ч в термостат при 50°С с одновременным ультразвуковым облучением. Для приготовления комплекса с бензофеноном навеску последнего добавляли в кювету с водной суспензией комплекса нафталин-d8–βЦД–циклогексан и подвергали воздействию описанной выше процедуры в термостате. Концентрации βЦД, бензофенона и циклогексана в образцах составляли 10–2 М и концентрация нафталина-d8 10–4 М.
Измерения. Спектры электронного поглощения растворов измерены на спектрофотометре Specord M40. Для ограничения светорассеяния при измерении спектров образцы с суспензиями трехкомпонентных комплексов размещали в держателе рядом с ФЭУ. Экспериментальная установка для измерения времени жизни долгоживущей ФКТ [7, 8] была модернизирована добавлением подключенного к ФЭУ усилителя У7-1 и АЦП L-CARD в компьютере. Облучение образцов осуществляли ртутной лампой ДРШ-500 со светофильтрами БС7 + УФС6 для выделения линии 365 нм. Все измерения выполнены при 22°С. Поскольку цель работы состояла в обнаружении сенсибилизированной бензофеноном долгоживущей ФКТ нафталина-d8, а сам спектр ФКТ нафталина-d8 хорошо известен (см. [9, 10]), то для увеличения чувствительности установки регистрировалось время жизни интегральной фосфоресцентной эмиссии нафталина-d8.
Квантово-химические расчеты. Оптимизацию геометрии многокомпонентных комплексов циклодекстрина с нафталином, циклогексаном и бензофеноном проводили полуэмпирическим методом PM6-DH+, параметризованным для получения разумных значений теплот образования (ΔHf), вклада энергии ван-дер-Ваальсового взаимодействия и водородных связей в полную энергию комплексообразования по программе OpenMopac 2016 [17]. Расчет энергии переходов S0 → S1 для структур комплексов нафталина, циклогексана и бензофенона разного типа, во взаимных расположениях, предварительно зафиксированных расчетом комплексов с циклодекстрином, проводили методом ab initio CIS 6-31** с учетом всех однократно возбужденных конфигураций по программе Firefly [18].
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Измерения ФКТ. На первом этапе была предпринята попытка наблюдать Т-Т перенос энергии от бензофенона на нафталин-d8 непосредственно в комплексе нафталин-d8–βЦД–бензофенон, в котором Д и А находились в непосредственном контакте. Однако в таком комплексе даже при возбуждении нафталина-d8 в области электронного поглощения вообще не была обнаружена ФКТ, хотя он был приготовлен так же, как и обладающий долгоживущей ФКТ комплекс нафталин-d8–βЦД–циклогексан. Вероятной причиной этого является существование в бензофеноне π‑системы, способной к стекинг-взаимодействию с молекулой нафталина-d8, что, по-видимому, приводит к увеличению константы скорости перехода. Подтверждением этого, по нашему мнению, является тот факт, что при замене в комплексе бензофенона толуолом ФКТ также отсутствовала, а при замене на пара-третбутилтолуол, обладающий объемным заместителем с насыщенными связями, появилась долгоживущая ФКТ комплекса нафталин-d8–βЦД–пара-третбутилтолуол.
Поэтому на следующем этапе бензофенон был добавлен к комплексу нафталин-d8–βЦД–циклогексан (I), который всегда демонстрирует долгоживущую ФКТ при возбуждении нафталина-d8 S0 → S1 ~ T1 ~ → → ФКТ [6–8]. Первоначально критерием существования Т-Т переноса энергии с бензофенона на нафталин-d8 в комплексе нафталин-d8–βЦД–циклогексан–бензофенон (II) считалось наличие длительного свечения в течение нескольких секунд после возбуждении образца в области 330–370 нм, где поглощает бензофенон и нет поглощения S0 → S1 нафталина-d8. Длительное свечение могло принадлежать только ФКТ нафталина-d8, поскольку время жизни фосфоресценции нафталина-d8 (τphos > 10 с) на три порядка больше τphos бензофенона (6 мс). Поэтому проверка существования такого переноса осуществлялась на экспериментальной установке измерения времени жизни ФКТ и не требовала измерения спектров фосфоресценции бензофенона и нафталина. Однако неожиданно выяснилось, что при возбуждении светом с λ = 365 нм долгоживущая ФКТ наблюдается в образце и без добавленного бензофенона, т.е. за счет прямого возбуждения нафталина-d8 в полосе синглет-триплетного перехода. Поэтому для доказательства существования Т-Т переноса энергии потребовалось сравнение ФКТ, измеренной в одинаковых условиях до и после добавления бензофенона к комплексу I. Такой метод доказательства не использовался раньше [6].
На рис. 1 показана кривая деактивации 1 ФКТ нафталина-d8 после возбуждения комплекса I светом с λ = 365 нм. Наиболее вероятной причиной существования ФКТ этого комплекса является слабое поглощение S0→Ti нафталина-d8, поскольку другого пути заселения триплетного уровня нафталина-d8 при таком возбуждении не существует. Действительно, спектры синглет-триплетного поглощения ароматических кетонов [15] и ароматических углеводородных соединений [16] регистрировались по спектрам возбуждения фосфоресценции в растворах при 77 К.
Рис. 1.
Кривые деактивации ФКТ нафталина-d8 после возбуждения светом с λ = 365 нм комплексов I (1) и II (3); комплексов I (2) и II (4) при возбуждении в области синглет-синглетного поглощения нафталина-d8 и снижении чувствительности регистрации в 100 раз.
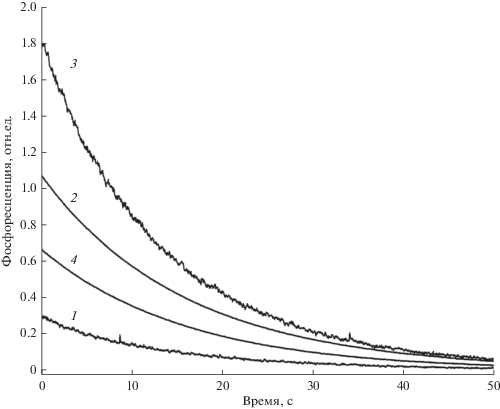
При возбуждении образца только через светофильтр УФС6, который недостаточно ослабляет свет в области 300–311 нм поглощения нафталина-d8, сигнал ФКТ возрастает в 360 раз (спад 2). Поскольку сигнал ФКТ вызван возбуждением на 365 нм через запрещенный переход S0 → T1, необходимо было проверить отсутствие возбуждения ртутными линиями в области синглет-синглетного поглощения нафталина-d8 при использовании светофильтров БС7 + УФС6.
Спектры поглощения использованных в экспериментах соединений, светофильтров и комплексов приведены на рис. 2. Добавление к светофильтрам БС7 и УФС6 светофильтра на основе водного раствора NiSO4, который ослабляет излучение на λ = 365 нм в 1000 раз, а в области синглет-синглетного поглощения нафталина-d8 всего в 1.6 раза, приводит к полному подавлению ФКТ. Следовательно, ФКТ комплекса I вызвана не наблюдавшимся ранее возбуждением светом с λ = 365 нм вне в области синглет-синглетного поглощения нафталина-d8.
Рис. 2.
Спектры поглощения нафталина-d8 (1) и бензофенона (2) в этанольных растворах, светофильтров БС7-3мм (3), УФС6-5мм (4), водного раствора NiSO4 (5), водной суспензии комплексов I (6) и II (7). Ртутные линии показаны в виде вертикальных линий.
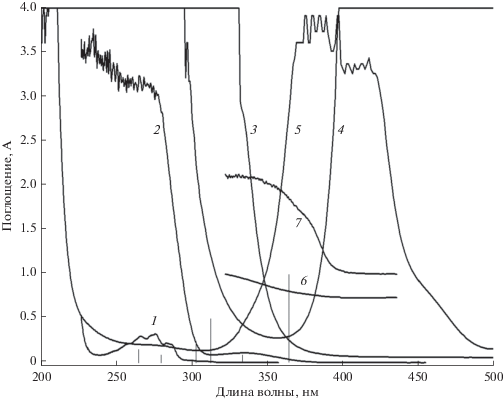
Добавление бензофенона к комплексу I приводит к образованию комплекса II и увеличению поглощения на 365 нм за счет бензофенона (рис. 2, спектры 6 и 7). Если предположить, что бензофенон не является сенсибилизатором, то вероятность возбуждения нафталина-d8 на 365 нм должна снизиться за счет поглощения бензофенона, и, следовательно, интенсивность ФКТ в комплексе II должна уменьшиться. Наоборот, увеличенная интенсивность ФКТ комплекса II укажет на то, что бензофенон в нем является сенсибилизатором.
В табл. 1 приведены времена жизни ФКТ комплексов и амплитуды спадов. Из таблицы (первый столбец) видно, что при возбуждении ФКТ с использованием только фильтра УФС6 добавление поглощающего бензофенона приводит к ослаблению амплитуды спада в 1.6 раза. При использовании комбинации фильтров УФС6 + БС7 амплитуда спада ФКТ в комплексе I составляет 0.3 отн. ед., но после добавления бензофенона и образования комплекса II амплитуда ФКТ возрастает в 6 раз. Такой рост свидетельствует о существовании сенсибилизированной бензофеноном фосфоресценции нафталина-d8 за счет Т-Т переноса энергии в супрамолекулярном комплексе нафталин-d8–βЦД–циклогексан–бензофенон.
Таблица 1.
Времена жизни (с) и амплитуды ФКТ спадов (отн. ед.) нафталина-d8 в комплексах I и II на рис. 1
| КОМПЛЕКС | Время жизни ФКТ, амплитуда/100 | Время жизни ФКТ, амплитуда |
|---|---|---|
| Нафталин-d8–βЦД–циклогексан (I) | 16.5а, 1.08 | 16б, 0.3 |
| Нафталин-d8–βЦД–циклогексан–бензофенон (II) | 15.9а, 0.68 | 14.7б, 1.8 |
Квантово-химические расчеты. С целью выяснения вопроса о механизме передачи возбуждения между Д и А нами был предпринят квантово-химический расчет предполагаемой структуры комплекса II, поскольку только для него наблюдается сенсибилизированная ФКТ. Второй важной задачей было выяснение структуры молекулярных орбиталей, расчет энергий первых синглетных переходов и силы осцилляторов для теоретической оценки вероятности первичного возбуждения инкорпорированного в комплекс бензофенона, являющегося сенсибилизатором ФКТ нафталина.
Расчеты полностью оптимизированных структур (программа MOPAC 2016, [17]) показали, что в водном растворе βCD в присутствии указанных органических субстратов могут существовать комплексы двух типов бензофенон–циклогексан–нафталин-d8–2βЦД (Bnp−CH−NPh@2βCD) (IIа) и бензофенон–нафталин-d8–циклогексан–2βЦД (Bnp−NPh−CH@2βCD) (IIб), в которых максимальное расстояние между Д и А не превышает 8 Å. Так как оценка [12] показала, что радиус Т-Т переноса энергии по нижним триплетным уровням составляет 11–13 Å, взаимное расположение Д и А в комплексах IIа и IIб не должно препятствовать переносу триплетной энергии. Заметим, что комплекс IIб (рис. 3б), в котором осуществляется непосредственный контакт нафталина и бензофенона при расстоянии между ними 3.4 Å, термодинамически выгоднее на 12.5 ккал/моль комплекса IIa, где Д и А разделены молекулой циклогексана (рис. 3а).
Рис. 3.
(а) Структура комплекса Bnp−CH−NPh@2βCD (IIа). Расчет PM6-DH+. (б) Структура комплекса Bnp−NPh−CH@2βCD (IIб). Расчет PM6-DH+.
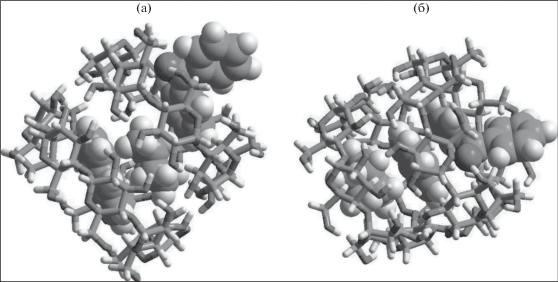
Поскольку в образцах, где наблюдалась сенсибилизированная ФКТ нафталина-d8, бензофенон добавлялся к уже образовавшемуся комплексу I, то более вероятной структурой, в которой осуществляется Т-Т перенос, является комплекс IIа (рис. 3а). В нем расстояние между разделенными циклогексаном Д и А составляет 7.6 Å. Как было показано в работе [14], T-T перенос энергии осуществляется либо за счет сильно зависящего от расстояния туннельного перехода между молекулами Д и А, либо вследствие слабо зависящего от расстояния многостадийного “прыжкового” процесса. Поскольку в нашем комплексе циклогексан, разделяющий донор и акцептор, не содержит π-связей, то возможность “прыжкового” процесса исключается. Поэтому следует принять, что в комплексе IIа Т-Т перенос возбуждения осуществляется по туннельному механизму.
Расчет энергии переходов S0 → Sn (n = 1–3) для комплексов Bnp−CH−NPh (IIа') и CH−Bnπ−NPh (IIб') со структурой, которую они имеют в димере βCD (комплексы IIа и IIб, рис. 3), проведен методом ab initio CIS 6–31** с учетом всех однократно возбужденных конфигураций (программа Firefly [18]). Энергии первых трех переходов, отнесения и силы осцилляторов приведены в табл. 2.
Таблица 2.
Рассчитанные методом ab initio 6-31** CIS значения максимумов поглощения λmax, и сил осцилляторов f, S0 → Sn (n = 1–3) переходов для тройных комплексов Bnp−CH−NPh (IIа') и CH−Bnp−NPh (IIб')
| Комплекс, n перехода | λmax, нма | f | Отнесения по орбиталям компонентов и типам переходов |
|---|---|---|---|
| IIа', S1 | 366 | 0.00166 | HOMO → LUMO, Bnp (n-π*) |
| IIб', S1 | 364 | 0.00028 | HOMO → LUMO, Bnp (n-π*) |
| IIа', S2 | 333 | 0.06688 | HOMO → LUMO, NPh (π-π*) |
| IIб', S2 | 340 | 0.04721 | HOMO → LUMO, NPh (π-π*) |
| IIа', S3 | 325 | 0.00049 | HOMO → LUMO, NPh (π–1-π*) |
| IIб', S3 | 330 | 0.00187 | HOMO → LUMO, NPh (π–1-π*), NPh + Bnp (πNPh – π* + π*NPh + Bnp) |
а Рассчитанные значения λmax разделены на стандартный масштабирующий коэффициент 0.7 [19].
Из табл. 2 видно, что возбуждение S0 → S1 в IIа' и IIб' соответствует переходам типа n-π* с участием HOMO и LUMO бензофенона (λmax 366 и 364 нм, соответственно), что согласуется с экспериментом (рис. 2). Переходы S0 → S2 и S0 → S3 в IIа′ и IIб′ связаны с возбуждением типа π-π* нафталина‑d8. Для первого – это возбуждение HOMO → LUMO, для второго HOMO-1 → LUMO (λmax = 325 нм), что близко к первой полосе поглощения нафталина (320 нм [20]). В то же время переход S0→S3 для IIб', помимо участия π-1-π* орбиталей нафталина включает также участие связывающей π*-орбитали NPh-Bnp, возникновение которой обусловлено наличием π-стекинга. Все рассчитанные энергии переходов характеризуются очень малыми значениями сил осцилляторов, что также соответствует эксперименту.
π-Стекинг между нафталином-d8 и бензофеноном в IIб' влияет следующим образом на характеристики переходов. Хотя максимум первого перехода в IIб' смещен всего на 2 нм в синюю область спектра по сравнению с IIа', более существенным является снижение на порядок силы осциллятора т.е. вероятности S0 → S1 перехода. Второй переход, связанный с возбуждением нафталина, претерпевает красное смещение на 7 нм, величина f этого перехода снижается не существенно. В то же время третий переход претерпевает значительное синее смещение на 23 нм и резко возрастает значение f. Таким образом, влияние π-стекинга приводит к перераспределению вероятностей переходов между двумя парами HOMO на LUMO бензофенона: падает вероятность первого S0 → S1 перехода бензофенона, наиболее значимого для запуска процесса Т-Т переноса возбуждения, и растет вероятность высокоэнергетического S0 → S3 перехода при возбуждении нафталина-d8, чье влияние на сенсибилизацию не так очевидно. Поэтому отсутствие ФКТ для комплекса нафталин-d8–βЦД–бензофенон связано, в первую очередь, со снижением вероятности поглощения света с λmax = 365 нм, инициирующего Т-Т перенос.
ЗАКЛЮЧЕНИЕ
Сенсибилизированная фосфоресценция нафталина-d8 с временем жизни 14.7 с при 22°С получена в супрамолекулярном комплексе нафталин-d8–β‑циклодекстрин–циклогексан–бензофенон за счет Т-Т переноса энергии при возбуждении бензофенона на λ = 365 нм. Возможная структура этого комплекса рассчитана квантово-химическим методом. Показано, что комплекс нафталин-d8–циклогексан–бензофенон, образующийся в водном растворе после добавления бензофенона, помещается внутри димера β-циклодекстрина, обеспечивая достаточную жесткость структуре, ответственной за проявление длительной ФКТ. Поскольку в комплексе донор и акцептор разделены насыщенной молекулой циклогексана, а расстояние между Д и А не превышает 8 Å, Т-Т перенос энергии между ними осуществляется по туннельному механизму.
Работа выполнена при поддержке Министерства науки и высшего образования в рамках выполнения работ по Государственным заданиям ФНИЦ “Кристаллография и фотоника” РАН в части “квантово-химических расчетов”, ИПХФ РАН (№ 01201361847) в части “исследование комплексов “арен–циклодекстрин”, (грант РФФИ-офи_м 16-29-11765) в части “фотохимические исследования”.
Список литературы
Liu Y., Zhan G., Liu Z.-W., Bian Z.-Q., Huang C-H. // Chinese Chemical Letters. 2016. V. 27. № 8. P. 1231.
Congreve D.N., Lee J., Thompson N.J., Hontz E., Yost S.R., Reusswig P.D., Bahlke M.E., Reineke S., Voorhis T.V., Baldo M.A. // Science. 2013. V. 340. № 6130. P. 334.
Kabe R., Noutsuka N., Yoshida K., Adachi C. // Adv. Mater. 2016. V. 28. № 4. P. 655.
Zhang G., Chen J., Payne S.J., Kooi S.E., Demas J.N., Fraser C.L. // J. Am. Chem. Soc. 2007. V. 129. № 29. P. 8942.
Shu X.X., Chen Y., Yuan H., Gao S., Xiao D. // Anal. Chem. 2007. V. 79. P. 3695.
Назаров В.Б., Герко В.И., Вершинникова Т.Г. // Изв. АН. Сер. хим. 1995. Т. 44. № 10. С. 1966.
Назаров В.Б., Герко В.И., Алфимов М.В. // Изв. АН. Cер. хим. 1996. Т. 45. № 4. С. 1014
Назаров В.Б., Герко В.И., Алфимов М.В. // Изв. АН. Cер. хим. 1996. Т. 45. № 9. С. 2225.
Назаров В.Б., Авакян В.Г., Алфимов М.В., Вершинникова Т.Г. // Изв. АН, Cер. хим. 2003. Т. 52. № 4. С. 869.
Назаров В.Б., Авакян В.Г., Багрий Е.И., Вершинникова Т.Г., Алфимов М.В. // Изв. АН. Сер. хим. 2005. Т. 54. № 12. С. 2661.
Mieno H., Kabe R., Notsuka N., Allendorf M.D., Adachi C. // Adv. Optical Materials. 2016. V. 4. № 4. P. 1015.
Ермолаев В.Л. // Успехи физических наук. 1963. Т. 80. № 1. С. 3.
Nakamura T., Hayakawa S. // Japan J. Appl. Physics. 1969. V. 10. № 1. P. 85.
Vura-Weis J., Abdelwahed S.H., Shukla R., Rathore R., Ratner M.A., Wasielewski M.R. // Science. 2010. V. 328. P. 1547.
Kearns D.R., Case W.A. // JACS. 1966. V. 88. № 22. P. 5087.
Marchetti A.P., Kearns D.R. // JACS. 1967. V. 89. № 4. P. 768.
openmopac.net/MOPAC2016.html.
Firefly, version 8.2.0. © 1994, 2016 by Alex Granovsky. http://classi.chem.msu.su/gran/firefly/index.html.
Broo A., Holmén A. // J. Phys. Chem. A. 1997. V. 101. № 19. P. 3589.
Кусаков М.М., Шиманко Н.А., Шишкин М.В. Ультрафиолетовые спектры поглощения ароматических углеводородов. М.: Изд-во АН СССР, 1963.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий


