Химия высоких энергий, 2019, T. 53, № 2, стр. 95-99
Роль комплексообразования между молекулами монометиламина и триплетного нитрометана в реакции переноса водорода
Д. В. Овсянников a, *, С. В. Зеленцов a
a Федеральное государственное автономное образовательное учреждение высшего образования
“Национальный исследовательский Нижегородский государственный университет им. Н.И. Лобачевского”
603950 Н. Новгород, пр. Гагарина, д. 23, корп. 2, Россия
* E-mail: ovsyannikov@chem.unn.ru
Поступила в редакцию 05.10.2018
После доработки 26.10.2018
Принята к публикации 24.10.2018
Аннотация
Исследован механизм фотохимического переноса атома водорода от амина к триплетному нитросоединению на примере монометиламина и триплетного нитрометана. Рассматриваются два варианта протекания реакции: перенос водорода от аминогруппы и от метильной группы. Моделирование проводится методами квантовой химии с использованием функционала B2PLYP/cc-pVDZ. С помощью теории атомов в молекулах показано комплексообразование в пред- и постреакционных комплексах. Восстановлены профили поверхностей потенциальной энергии реакций. Сделан вывод, что реакция переноса водорода от метильной группы энергетически более выгодна. Установлено, что в ходе реакции образуется прочный комплекс с водородной связью.
Нитросоединения (НС) под действием УФ-излучения способны к синглет-синглетным переходам с последующей интеркомбинационной конверсии (ИКК) с образованием триплетного НС. Далее возможны реакции триплетного НС с переносом атома водорода. К примеру, нитробензол в водном растворе пропанола-2 и хлороводорода способен к фотохимической реакции с выходом ацетона и 2,4-дихлоранилина [1]. При облучении УФ-светом с длиной волны 313 нм, квантовый выход достигает 0.15.
При взаимодействии триплетного 1-нитронафталина с триэтиламином квантовый выход достигает 0.12 [2]. Эксперимент проводился в бензоле в насыщенной аргоном атмосфере. 2-Нитронафталин реагирует аналогично, причем, квантовый выход достигает 0.10. В насыщенной воздухом атмосфере квантовый выход реакции с 1-нитронафталином и 2-нитронафталином падает до 0.002. Это может говорить о том, что НС реагирует в триплетном состоянии. Таким образом, в присутствии триплетного кислорода происходит триплет-триплетная аннигиляция.
Нитрометан (НМ) имеет [3] стационарную точку в основном триплетном состоянии T1 с симметрией Cs. Для него возможны реакции разложения по связи углерод–азот с образованием радикалов CH3 и NO2 [4].
Фотохимический перенос атома водорода возможен при участии не только НС, но других классов соединений, например, кетонов, хинонов. Триплетный 1,4-нафтахинон способен реагировать с триэтиламином [5].
Для сравнения энергий, проведено теоретическое исследование отрыва атома водорода от аминов с помощью радикала HO2 [6]. Отмечаются низкие энергии комплексообразования – 4.39 кДж моль–1 – и сравнительно небольшие энергии активации переноса водорода: 62.72 кДж моль–1 для отрыва атома водорода от аминогруппы, и 49.20 кДж моль–1 для метильной группы. Переходный комплекс при переносе водорода от аминогруппы имеет частоту колебания 1442 см–1i. При переносе водорода от метильной группы переходный комплекс имеет частоту 1529 см–1i.
Текущая работа ставит своей целью сравнить реакции фотохимического переноса атома водорода от метильной группы и аминогруппы метиламина к триплетному нитрометану.
МЕТОДОЛОГИЧЕСКАЯ ЧАСТЬ
Все квантово-химические вычисления проводились в программе NWChem-6.6 [7]. Вычисление параметров электронной плотности выполнено в программе Multiwfn [8]. Для визуализации результатов вычислений использовалась программа Avogadro [9, 10].
В качестве рабочего метода был выбран B2PLYP/cc-pVDZ. Все триплетные состояния являются наинизшими.
В табл. 1 приведено сравнение вычисленных и экспериментальных геометрических параметров молекулы метиламина в основном синглетном состоянии.
Таблица 1.
Сравнение геометрических параметров метиламина в синглетном состоянии при использовании различных методов
| Параметр | B2PLYP/cc-pVDZ1 | B3LYP/cc-pVDZ1 | TPSSh/cc-pVDZ1 | MP4/cc-pVDZ1 | CCSD(T)/cc-pVDZ1 | Эксперимент2 |
|---|---|---|---|---|---|---|
| r(N-C)* | 1.464 | 1.464 | 1.467 | 1.472 | 1.473 | 1.471 |
| r(N-H) | 1.021 | 1.023 | 1.025 | 1.025 | 1.026 | 1.018 |
| r(C-H) | 1.101 | 1.023 | 1.022 | 1.112 | 1.106 | 1.093 |
| a(HNH)** | 104.6 | 104.8 | 104.3 | 103.9 | 103.8 | 105.8 |
| a(HNC) | 108.9 | 109.3 | 108.7 | 107.9 | 107.9 | 111.0 |
| a(HCH) | 107.5 | 107.3 | 107.6 | 107.7 | 107.7 | 108.4 |
* r – расстояние между атомами, Å. ** a – валентный угол между атомами, град. 1https://cccbdb.nist.gov/geom2x.aspю 2Kuchitsu K. Structure of Free Polyatomic Molecules: Basic Data. Berlin Heidelberg: Springer-Verlag, 1998.
Из табл. 1 следует, что метод B2PLYP/cc-pVDZ дает значения длин связей и углов максимально близкие к экспериментальным. Дважды гибридный функционал B2PLYP содержит поправку MP2 в корреляционной части, поэтому в качестве сравнения приведена теория возмущений более выского порядка – MP4. Она дает очень хорошее соответствие эксперименту по длинам связей, но уступает теории матриц плотности по соответствию валентных углов. Кроме того, теория Меллера–Плессета четвертого порядка требует значительно больше времени для вычислений по сравнению с теорией функционала плотности. В табл. 2 приведено сравнение вычисленных геометрических параметров метиламина одним функционалом, но при разных базисных наборах. Наилучшие результаты дает базис Даннинга aug-cc-pVDZ. Однако, он требует больших временных затрат при вычислениях, поэтому был выбран базис cc-pVDZ.
Таблица 2.
Сравнение геометрических параметров метиламина в синглетном состоянии при использовании различных базисных наборов
| Параметр | B2PLYP/6-31+G**1 | B2PLYP/aug-cc-pVDZ1 | B2PLYP/TZVP1 | B2PLYP/cc-pVDZ1 | Эксперимент2 |
|---|---|---|---|---|---|
| r(N−C)* | 1.464 | 1.468 | 1.462 | 1.464 | 1.471 |
| r(N−H) | 1.013 | 1.017 | 1.011 | 1.021 | 1.018 |
| r(C−H) | 1.098 | 1.014 | 1.097 | 1.101 | 1.093 |
| a(HNH)** | 107.4 | 106.3 | 107.1 | 104.6 | 105.8 |
| a(HNC) | 111.1 | 110.5 | 110.8 | 108.9 | 111.0 |
| a(HCH) | 108.0 | 108.1 | 107.9 | 107.5 | 108.4 |
* r – расстояние между атомами, Å. ** a – валентный угол между атомами, град. 1 https://cccbdb.nist.gov/geom2x.asp 2 Kuchitsu K. Structure of Free Polyatomic Molecules: Basic Data. Berlin Heidelberg: Springer-Verlag, 1998.
В качестве объекта исследования выбрана реакция переноса атома водорода в системе монометиламин–триплетный нитрометан. Она имеет два возможных маршрута:
(1)
$\begin{gathered} ^{3}{\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{N}}{{{\text{O}}}_{2}} + {\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{N}}{{{\text{H}}}_{2}} \to \, \\ \to \,{{\,}^{3}}{\kern 1pt} \left\{ {{\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{N}}{{{\text{O}}}_{2}} + {\text{N}}{{{\text{H}}}_{{\text{2}}}}{\text{C}}{{{\text{H}}}_{{\text{3}}}}} \right\} \to \\ \to \,\,{\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{N}}{{{\text{O}}}_{{\text{2}}}}{{{\text{H}}}^{\centerdot }} + {\text{ N}}{{{\text{H}}}^{ \bullet }}{\text{C}}{{{\text{H}}}_{3}}, \\ \end{gathered} $(2)
$\begin{gathered} ^{3}{\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{N}}{{{\text{O}}}_{2}} + {\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{N}}{{{\text{H}}}_{2}} \to \,\, \\ \to \,{{\,}^{3}}\left\{ {{\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{N}}{{{\text{O}}}_{2}} + {\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{N}}{{{\text{H}}}_{{\text{2}}}}} \right\} \to \\ \to \,\,{\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{N}}{{{\text{O}}}_{{\text{2}}}}{{{\text{H}}}^{ \bullet }} + {\text{CH}}_{2}^{\centerdot }{\text{N}}{{{\text{H}}}_{2}}. \\ \end{gathered} $В случае реакции 1, атом водорода отрывается от NH2-группы. В ходе реакции 2 происходит отрыв атома водорода от CH3-группы.
Выбор данной системы обусловлен двумя факторами: а) метиламин как донор водорода позволяет сравнивать отрыв водорода от аминогруппы и от метильной группы; б) система не содержит большого числа электронов, что позволяет увеличивать точность, сохраняя разумное время вычислений.
Профили поверхностей потенциальной энергии (ППЭ) построены на основе вычисленных энергий с учетом поправок на нулевые колебания.
Применяемые методы авторы считают достаточными для достижения поставленных целей.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Рассмотрим профили ППЭ реакции (1) на рис. 1. На первой стадии молекулы триплетного НМ и синглетного метиламина соединяются в предреакционный комплекс РК1а. При этом выделяется энергия 25.74 кДж моль–1. На второй стадии происходит перенос атома водорода через переходный комплекс ПКа. Энергия активации переноса водорода составляет всего 0.06 кДж моль–1. Затем образуется пост-реакционный комплекс РК2а, энергия которого ниже ПКа на 59.65 кДж моль–1. Энергия разрыва связей пост-реакционного комплекса для удаления продуктов Па на бесконечно большое расстояние составляет 27.20 кДж моль–1. Стадии РК1а и ПКа имеют близкую к нулю разницу в энергиях. Кроме того, абсолютная энергия ПКа ниже, чем сумма абсолютных энергий исходных веществ. Профиль ППЭ имеет нестандартный для химии вид. Это может быть обусловлено комплексообразованием в ходе реакции.
Рис. 1.
Профили ППЭ реакций переноса атома водорода к триплетному нитрометану от метиламина. Путь РК1а–ПКа–РК2а–Па относится к переносу водорода от аминогруппы. Путь РК1б–ПКб–РК2б–Пб относится к переносу водорода от метильной группы.

На рис. 2 изображена структура предреакционного комплекса РК1а. Расстояние между азотом N1 и водородом H2 в предреакционном комплексе составляет 1.01 Å. Между кислородом O3 и водородом H2 расстояние составляет 1.99 Å. Расстояние между азотом N1 и кислородом O5 составляет 2.15 Å. Теперь обратимся к распределению электронной плотности в предреакционном комплексе реакции (1). По теории атомов в молекулах [11] можно определить локализацию критических точек и классифицировать их следующим образом: (–3,–3) – центр атома, (–3,–1) – точка связи, (–3,+1) – кольцевая точка. Точка 1 (типа (–3,–1) – связевая точка) указывает на образование связи между реагирующими молекулами, то есть, она обозначает образование предреакционного комплекса РК1а. Кроме точки 1, на пути переноса атома водорода между атомами азота и кислорода находится точка 3 (типа (–3,–1) – связевая точка). В соответствии с правилом Пуанкаре–Хопфа, должна образоваться кольцевая точка. Действительно, образуется точка 2 типа (–3, 1) – кольцевая точка. Подобная электронная структура предреакционного комплекса уже была отмечена раньше [12, 13]. Это говорит о сложном механизме взаимодействия между реагирующими молекулами. Обратимся к структуре переходного комплекса ПКа, изображенной на рис. 3.
Рис. 2.
Строение предреакционного комплекса для реакции переноса атома водорода от аминогруппы метиламина к триплетному нитрометану.

Рис. 3.
Строение предреакционного комплекса для реакции переноса атома водорода от метильной группы метиламина к триплетному нитрометану.
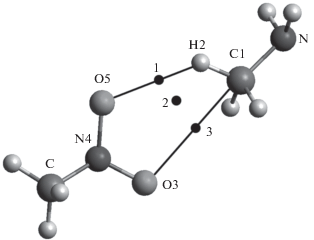
Расстояние N1–H2 увеличивается очень мало: до 1.10 Å. Но резко сокращается расстояние O3‒H2 до 1.45 Å. Увеличивается расстояние N1‒O5 до 2.25 Å. Малое удлинение связи N1–H2 подтверждает низкое значение энергии активации переноса водорода.
Рассмотрим изменение стандартных энтальпий реакций (1) и (2) при температуре 298.15 К. Для реакции (1) вычисленное изменение энтальпии равно –4.54 кДж моль–1. Реакция (2) имеет меньший тепловой эффект –1.59 кДж моль–1. Отрицательные значения говорят о выделении энергии – слабом экзотермическом характере реакции.
Обратим также внимание на изменение энергий Гиббса реакции (1). Изменение стандартной функции Гиббса при температуре 298.15 К реакции составляет –5.70 кДж моль–1. Аналогично, для реакции (2) величина изменения энергии Гиббса составляет –2.14 кДж моль–1. Отрицательные значения говорят о самопроизвольном характере протекания реакций. Иными словами, перенос атома водорода от метиламина к нитрометану разрешен термодинамически.
На рис. 1 также представлен профиль ППЭ реакции (2). На первой стадии образуется предреакционный комплекс РК1б 3{CH3NO2 + CH3NH2}. Энергия образования этого комплекса составляет 1.89 кДж моль–1. Энергия активации переноса водорода в комплексе ПКб составляет 0.29 кДж моль–1. После переноса атома водорода образуется пост-реакционный комплекс РК2б. При этом выделяется энергия 73.81 кДж моль–1. Удаление продуктов реакции Пб на бесконечно большое расстояние требует 10.51 кДж моль–1. Подобный профиль ППЭ также имеет нестандартный вид. Постреакционный комплекс РК2б имеет очень низкое расположение уровня энергии по отношению к переходному состоянию ПКб, что может свидетельствовать о низкой вероятности обратной реакции.
Обратимся к структуре предреакционного комплекса РК1б реакции (2). Она изображена на рис. 3. Расстояние между водородом H2 и углеродом C1 составляет 1.10 Å. Между водородом H2 и кислородом O2 – 2.64 Å. Взаимодействия между атомами азота метиламина и кислородом O5 нет из-за большого расстояния – 4.82 Å. Рассмотрим топологию комплекса реакции (2) на рис. 3. Можно отметить наличие точки 1 (типа (–3,–1) – связевая точка) на пути переноса атома водорода H2 к кислороду O5. Однако, есть и точка 3 (типа (–3,–1) – связевая точка) между атомом кислорода O3 и углеродом C1. Подобная картина электронной плотности была отмечена в реакции (1). Аналогично, образуется кольцевая точка 2 типа (–3,1).
В табл. 3 представлены длины связей в предреакционных комплексах РК1а и РК1б. Нумерация атомов аналогична изображенной на рис. 2 и 3. По этим данным можно проследить тенденцию к увеличению длины связи между водородом и отдающим его азотом или кислородом. Для реакции (1) длина N1–H2 увеличивается на 8.5%, а для реакции (2) – на 9.8%. Но увеличение связи между водородом и принимающим его азотом O3–H2 для реакции (1) увеличивается на 38.0%, а для реакции (2) – на 90.3%. Это говорит о том, что расстояние между реагирующими молекулами в предреакционном комплексе достаточно большое. В переходном состоянии оно сокращается почти вдвое. Предреакционный комплекс РК1а реакции (1) связывается значительно сильнее, поэтому и изменение расстояния между реагирующими молекулами в переходном состоянии мало. Это подтверждается крайне низкой энергией активации 0.06 кДж моль–1.
Таблица 3.
Сравнение геометрических параметров реакционных комплексов в реакции переноса атома водорода между метиламином и триплетным нитрометаном
| Геометрические параметры | РК1а | ПКа | РК1б | ПКб |
|---|---|---|---|---|
| r(O3–H2)* | 1.997 | 1.447 | 2.642 | 1.388 |
| r(O3–N4) | 1.258 | 1.300 | 1.392 | 1.373 |
| r({N,C}1–H2) | 1.013 | 1.099 | 1.103 | 1.211 |
| r(N4–C) | 1.459 | 1.453 | 1.459 | 1.460 |
| a(O3–N4–O5)** | 120.4 | 119.4 | 114.0 | 115.7 |
| d(O3–N4–O5–C)*** | 142.1 | 146.4 | 135.0 | 136.2 |
Из табл. 3 можно заключить, что реакция (2) выгоднее по энергии. Это обусловлено выделением большей энергии при образовании постреакционного комплекса и гораздо меньшей энергии, необходимой для расхождения продуктов реакции на бесконечно большое расстояние.
Профили реакций (1) и (2) имеют общую особенность: энергии активаций имеют крайне низкие значения. Предреакционные комплексы реакций (1) и (2) обладают схожей структурой и топологией. Важным отличием является то, что реагирующие молекулы в РК1а расположены ближе друг к другу, чем в РК1б. Это является при-чиной более высокой энергии активации реакции (2). Тем не менее, это может говорить о безактивационном характере протекания подобных реакций.
ЗАКЛЮЧЕНИЕ
При взаимодействии триплетного нитрометана с метиламином происходит перенос атома водорода. Методами квантовой химии были получены реакционные комплексы и восстановлены пути реакций. Показано, что передача атома водорода от метильной группы выгоднее по энергии, чем передача водорода от аминогруппы. Это обусловлено схожим электронным строением предреакционного комплекса и выигрышем по энергии при переносе водорода.
Реакция (1) отличается более сильным связыванием в предреакционный комплекс, чем в реакции (2). Об этом говорят как значения энергий, так и изменения длин связей.
Отрицательные значения изменений функции Гиббса говорят о том, что реакция должна протекать самопроизвольно при комнатной температуре.
Сделано предположение о безактивационном характере протекания реакций (1) и (2).
БЛАГОДАРНОСТИ
Результаты экспериментов получены с использованием узла кластера [14], содержащего два восьмиядерных процессора Intel Sandy Bridge E5-2660 2.2 GHz, 64GB RAM, работающего под управлением ОС Linux CentOS 7.2.
Список литературы
Wubbels G.G., Jordan J.W., Mills N.S. // J. Am. Chem. Soc. 1973. T. 95. № 4. C. 1281
Görner H. // J. Chem. Soc. Perkin Trans. 2. 2002. T. 0. № 10. C. 1778.
Arenas J.F., Otero J.C., Peláez D., и Soto J. // J. Chem. Phys. 2005. T. 122. № 8. C. 84324.
Butler L.J., Krajnovich D., Lee Y.T., Ondrey G.S., Bersohn R. // J. Chem. Phys. 1983. T. 79. № 4. C. 1708.
Amada I., Yamaji M., Tsunoda S., Shizuka H. // J. Photochem. Photobiol. Chem. 1996. T. 95. № 1. C. 27.
Shi J.C., Shang Y.L., Du S., Luo S.N. // Chem. Phys. Lett. 2018. T. 691. C. 307.
Valiev M. et al. // Comput. Phys. Commun. 2010. T. 181. № 9. C. 1477.
Lu T., Chen F. // J. Comput. Chem. 2012. T. 33. № 5. C. 580.
Avogadro: an open-source molecular builder and visualization tool. Version 1.2.0. http://avogadro.cc/.
Hanwell M.D., Curtis D.E., Lonie D.C., Vandermeersch T., Zurek E., Hutchison G.R. // J. Cheminformatics. 2012. T. 4. C. 17.
Bader R.F.W. // Atoms in Molecules: A Quantum Theory. // Oxford, New York: Oxford University Press, 1994. C. 458.
de Lucas N.C. et al. // J. Photochem. Photobiol. Chem. 2009. T. 201. № 1. C. 1.
Овсянников Д.В., Зеленцов С.В. // Химия Высоких Энергий. 2018. Т. 52. № 3. С. 199.
Суперкомпьютер ННГУ „Лобачевский“: http://hpc-educ.unn.ru/ru/ресурсы.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий


