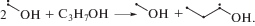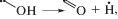Химия высоких энергий, 2019, T. 53, № 4, стр. 308-314
Влияние кипения на радиолиз 1-пропанола
А. В. Пономарев a, *, С. И. Власов a, Е. М. Холодкова a
a ФГБУН Институт физической химии и электрохимии им. А.Н.Фрумкина Российской Академии наук
119071 Москва, Ленинский просп., 31, корп. 4, Россия
* E-mail: ponomarev@ipc.rssi.ru
Поступила в редакцию 21.01.2019
После доработки 21.01.2019
Принята к публикации 18.02.2019
Аннотация
Исследован радиолиз 1-пропанола без нагрева и в кипящем состоянии под действием ускоренных электронов (8 МэВ). При комнатной температуре среди молекулярных продуктов доминируют альдегиды. В отличие от γ-радиолиза, второй по значимости фракцией являются одноатомные спирты. В кипящем 1-пропаноле выходы образования альдегидов, одноатомных спиртов и диолов примерно одинаковы. Кипение увеличивает массовую долю продуктов, которые тяжелее 1-пропанола, до 74%, тогда как при комнатной температуре эта доля была 57%. Как следует из анализа продуктов, кипение ускоряет диссоциацию радикалов и катион-радикалов, облегчает радикальные процессы обмена и комбинации. Выход убыли 1-пропанола составляет 10.1 ± 0.9 при комнатной температуре и 13.3 ± 0.9 молек/100 эВ в кипящем состоянии.
ВВЕДЕНИЕ
1-Пропанол – типичный представитель алифатических одноатомных спиртов, широко применяемых в органическом синтезе и в радиационно-химических исследованиях [1–5]. По сравнению с другими C1–C3 спиртами, 1-пропанол обладает более низкой точкой плавления (–127°С), большей плотностью (0.8 г/см3), более высокой температурой кипения (97.4°С) и весьма высоким октановым числом (118), что нередко предопределяет выбор 1-пропанола в качестве растворителя и синтетической среды.
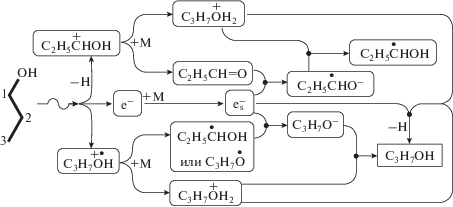
Выход ионизации 1-пропанола составляет около 4.4 1/100 эВ [6]. Соответственно, ионные процессы играют ключевую роль в превращениях 1-пропанола на начальных стадиях радиолиза (рис. 1). Они вносят основной вклад в разрывы С–Н связей, порождая пропаналь, пропокси-радикалы и значительную фракцию гидроксипропильных радикалов. Гомолитические разрывы С–С и С–О связей в 1-пропаноле вызваны преимущественно распадом возбужденных состояний, возникающих либо посредством прямой передачи энергии от налетающего электрона, либо в результате геминальной нейтрализации ионов [7, 8]. Ионные процессы завершаются намного быстрее, чем радикальные реакции и, соответственно, меньше зависят от условий облучения. В свою очередь, именно реакции обмена, диспропорционирования и комбинации радикалов определяют разнообразие конечных молекулярных продуктов радиолиза. В процессе облучения в 1-пропаноле образуются 11 типов первичных радикалов, которые относятся к числу наиболее реакционно-способных интермедиатов, контролирующих радиолиз множества органических соединений.
Рис. 1.
Главные ионные процессы в облучаемом 1-пропаноле (в реакциях псевдо-первого порядка обозначен как М).
Сведения о конечных продуктах радиолиза 1‑пропанола весьма малочисленны и противоречивы. Выход радиолитической убыли 1-пропанола – 8.6 молек/100 эВ – и выходы разрыва связей оценивались из результатов γ-радиолиза [7, 9], где единственным продуктом комбинации спиртовых радикалов считался 3,4-гександиол. Очевидно, заниженное значение выхода разложения спирта обусловлено, прежде всего, недостаточной информацией о продуктах комбинации радикалов [7].
Настоящая работа посвящена определению полного состава конечных продуктов радиолиза 1-пропанола и выявлению изменений радикальных процессов в условиях кипения, когда обеспечивается эффективное перемешивание облучаемой системы, ослабляется межмолекулярное притяжение, и разрушаются водородные связи. Радиолиз кипящего вещества может служить моделью ядерно-химических, астрохимических и геохимических процессов, а также информационной основой для совершенствования безопасности радиохимических и радиационно-химических производств, для оптимизации органического синтеза, где реализуются аналогичные радикальные и ионные процессы, а кипячение служит обычным приемом.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
1-Пропанол (от РЕАХИМ) очищали посредством осушки с CaS04, кипячением с 2,4-динитрофенилгидразином и последующей трехкратной перегонкой в атмосфере аргона с отбором средней фракции. По данным ИК спектроскопии и хроматографии содержание остаточных примесей в очищенном спирте не превышало 0.05 мас. %. Непосредственно перед облучением образцы продували очищенным аргоном в течение 40–45 мин. Одноатомные спирты, диолы, эфиры и карбонильные соединения (от Sigma-Aldrich и Reachem, 5–8 соединений из каждой гомологической группы) использовались как образцы сравнения для количественного хроматографического анализа облученного 1-пропанола.
Источником излучения служил линейный ускоритель УЭЛВ10-10T (энергия электронов 8 МэВ; длительность импульса 6 мкс; частота повторения импульсов 300 Гц; средний ток пучка 600 мкА; ширина развертки 245 мм; частота сканирования 1 Гц). Образцы облучались при 16 ± 2°С (режим ХО) и в состоянии кипения при 97–98°С (режим РК). Облучение проводилось с использованием лабораторной установки [10] в аргоне при атмосферном давлении. Объем образца составлял 35–40 мл (степень заполнения реактора ≈60%). Непосредственно перед облучением в режиме РК спирт нагревали до устойчивого пузырькового кипения. Мощность поглощенной дозы составляла 5–7 кГр/мин. Для дозиметрии использовали пленочный дозиметр СО ПД(Ф)Р-5/50 (ГСО 7865-2000).
Анализ состава образцов выполнялся сразу после завершения облучения с помощью хроматомасс-спектрометра (Agilent 5977EMSD/7820AGC; носитель – гелий, колонка – стеклянная капиллярная, длиной 60 м с внутренним диаметром 0.25 мкм) и хроматографа Биохром-1 (определение Н2 и других газов; катарометр в качестве детектора; аргон как газ-носитель; 3-м колонка из нержавеющей стали, наполненная молекулярным ситом 13Х, 80-110 меш; внутренний диаметр 2 мм). Идентификация молекулярных продуктов осуществлялась с помощью библиотеки масс-спектров NIST. Ионный ток, соответствующий каждому хроматографическому пику, анализировался посредством программы AMDIS software (Automated Mass Spectral Deconvolution and Identification System) для выявления и идентификации перекрывающихся пиков.
Радиационно-химические выходы G, приводимые в тексте, выражены в единицах молекула/100 эВ, что соответствует 0.1036 мкмоль/Дж. Выходы определялись для продуктов первого поколения на начальном участке кривых их накопления путем экстраполяции к нулевой дозе. Экспериментальные данные усреднялись по результатам 5–7 независимых облучений при каждой дозе в каждом режиме.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
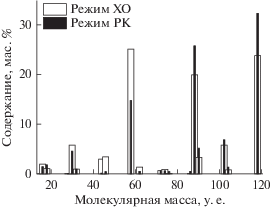
К рассматриваемым молекулярным продуктам первого поколения относятся соединения, кривые накопления которых не имеют индукционного периода и которые, соответственно, образуются в элементарных реакциях непосредственно из первичных ионных и радикальных интермедиатов (в том числе, интермедиатов, претерпевших термализацию, сольватацию и трансформацию при мгновенном обмене радикалов). Радиолиз 1‑пропанола в обоих режимах генерирует около 40 таких первичных молекулярных продуктов. С наибольшими радиационно-химическими выходами образуются продукты фрагментации, чья молекулярная масса меньше, чем у 1-пропанола (74 и 64 мол. % в режимах ХО и РК соответственно). Однако совокупная масса более тяжелых продуктов оказывается выше, чем у продуктов фрагментации – 57 и 74 мас. % соответственно. Распределение продуктов, показанное на рис. 2, выявляет доминирование фракций с молекулярными массами (М) 58, 88 и 118, которые относятся к пропаналю, одноатомным спиртам и диолам соответственно. В режиме ХО наиболее весома фракция пропаналя (М = 58), тогда как в режиме КР эта фракция сравнительно невелика, а наибольшую массовую долю приобретают продукты комбинации с М 88 и 118.
В процессе радиолиза, при распаде возбужденных молекул, возможен гомолитический разрыв любой из связей в 1-пропаноле с образованием 11 радикалов. Вероятно образование пяти гидроксиалкильных радикалов: при разрыве С–Н связей, наряду с Н, образуются α-, β- и γ-гидроксипропильные радикалы, а при разрыве С–С связей – α-гидроксиметильный и β-гидроксиэтильный радикалы. Разрывы С–С связей также порождают два алкильных радикала, метильный и этильный, а при разрыве С–О связи возникают пропил-радикал и ОН. В свою очередь разрыв О–Н связи может образовывать пропокси-радикал. Для радикалов Н, ОН и СН3 наиболее характерно взаимодействие с растворителем – отрыв Н с образованием Н2, Н2О и СН4 соответственно [7]. Алкокси-радикал также способен абстрагировать водород от 1-пропанола, быстро превращаясь в гидроксиалкильный радикал [8]
Остальные радикалы, по-видимому, гибнут преимущественно в процессах комбинации и диспропорционирования. Конечные молекулярные продукты первого поколения можно подразделить на пять групп: диолы, одноатомные спирты, альдегиды, углеводороды и пропокси-производные (рис. 3, табл. 1).
Таблица 1.
Начальные радиационно-химические выходы основных продуктов радиолиза 1-пропанола при комнатной температуре (режим ХО) и в кипящем состоянии (режим РК), молекул/100 эВ (±7%)
| Продукт | ХО | РК | Продукт | ХО | РК |
|---|---|---|---|---|---|
| Диолы | Углеводороды | ||||
| 3,4-Гександиол | 1.17 | 1.91 | Метан | 0.87 | 0.84 |
| 1,2-Этандиол | 0.16 | 0.08 | Этан | 0.54 | 0.33 |
| 1,2-Бутандиол | 0.09 | 0.23 | Бутан | 0.17 | 0.08 |
| 2-Метил-1,3-пентандиол | 0.05 | 0.34 | Пентан | 0.07 | 0.08 |
| 1,4-Бутандиол | 0.03 | 0.10 | Пропан | 0.06 | 0.01 |
| Одноатомные спирты | Альдегиды | ||||
| 3-Пентанол | 1.01 | 1.61 | Пропаналь | 2.96 | 2.22 |
| Этанол | 0.54 | 0.10 | Метаналь | 0.85 | 1.04 |
| 2-Метил-1-бутанол | 0.44 | 0.80 | Этаналь | 0.43 | 0.02 |
| 3-Гексанол | 0.22 | 0.26 | Пропокси-производные | ||
| Метанол | 0.22 | 0.25 | |||
| 2-Метил-1-пентанол | 0.09 | 0.26 | Этоксипропан | 0.14 | 0.15 |
| 1-Пентанол | 0.05 | 0.10 | 1-Пропокси-1-метанол | 0.12 | 0.14 |
| Другие | |||||
| Водород | 4.90 | 6.07 | Вода | 0.45 | 0.91 |
Диолы являются продуктами комбинации гидроксиалкильных радикалов. Формально можно предсказать образование 14 различных диолов. Вместе с тем, только у пяти диолов G ≥ 0.1 (табл. 1). Следует отметить, что вклад β-гидроксипропильного радикала в образование диолов, включая 2‑метил-1,3-пентандиол и димер 2,3-диметил-1,4-бутандиол, в ХО режиме довольно мал – 0.16, но в режиме РК он возрастает до 0.53. При этом выход димера остается невысоким – около 0.01 и 0.06 соответственно. Вероятно, комбинация с участием β-гидроксипропильного радикала в ХО режиме затруднена из-за стерических ограничений, тогда как кипящее состояние ослабляет эти ограничения.
С другой стороны, комбинация β-гидроксипропильных радикалов с алкильными радикалами в обоих режимах происходит легче, чем с гидроксиалкильными радикалами. Например, в ХО режиме образуются 2-метил-1-бутанол и 2-метил-1-пентанол с общим выходом около 0.5, что в 3 раза выше выхода соответствующих диолов. В свою очередь, в РК режиме выход спиртов, производных от β-гидроксипропильного радикала, составляет около 1.1. Суммарный выход одноатомных спиртов в ХО и РК режимах составляет 2.6 ± 0.3 и 3.4 ± 0.3 соответственно. Причем большая часть этих выходов относятся к спиртам, более тяжелым, чем 1-пропанол – 1.9 ± 0.2 и 3.1 ± 0.3 соответственно. Тяжелые спирты образуются преимущественно с участием этильного и пропильного радикалов.
Гидроксиметильный и β-гидроксиэтильный радикалы, по-видимому, являются предшественниками легких спиртов, метанола и этанола соответственно. Этанол образуется преимущественно в результате диспропорционирования, тогда как существенная часть метанола может возникать в процессе радикального обмена
В частности, снижение выхода легких спиртов и увеличение выхода тяжелых спиртов может указывать на снижение относительной роли реакций диспропорционирования в режиме РК.
Данные табл. 1 свидетельствуют, что связи С(1)–Н и С(1)–С(2) в 1-пропаноле наиболее подвержены радиолитическому расщеплению. Кипящее состояние увеличивает общий выход диолов в 1.7 раза, прежде всего, за счет повышения выхода гександиолов. Такой эффект может свидетельствовать о повышении выхода разрыва С–Н связей и, с другой стороны, о более благоприятных условиях для комбинации гидроксипропильных радикалов. В свою очередь, интенсификация разрыва С(1)–С(2) и С(2)–С(3) связей в режиме РК подтверждается увеличением выхода 1,2-бутандиола и 1,4-бутандиола. В отличие от других диолов, режим РК уменьшает выход 1,2-этандиола (табл. 1), который, в случае радиолиза метанола образуется при димеризации гидроксиметильных радикалов [7, 8]. Очевидно, такая димеризация в 1-пропаноле ослаблена из-за относительно низкого выхода гидроксиметильных радикалов и их участия в нескольких конкурентных реакциях.
Среди продуктов радиолиза имеются пропокси-производные, чьи суммарные выходы в режимах ХО и РК составляет 0.45 и 0.50 соответственно. Алкильные радикалы участвуют в образовании пропоксиметана, пропоксиэтана и пропоксипропана. Одновременно возникают пропокси-спирты – 1‑пропокси-1-метанол, 2-пропокси-1-этанол и 3‑пропокси-1-пропанол. Начальный выход пропокси-радикалов в 1-пропаноле составляет около 1.1 [11], но большинство из них гибнут еще на стадии негомогенных реакций в шпорах (треках) [8] – в том числе, в реакции (1) и при взаимодействии с сольватированным электроном. В 1-пропаноле почти 2/3 сольватированных электронов исчезают внутри шпор [6]. Вероятно, наблюдаемые пропокси-производные также образуются в шпорах. Радиолиз спиртов порождает преимущественно мульти-парные шпоры, т.е. шпоры, содержащие продукты двух и более ионизаций или возбуждений [12–14]. Соответственно, одновременное пребывание пропокси-радикала и какого-либо другого радикала в шпоре является весьма вероятным, обеспечивая возможность их комбинации. Общие выходы пропокси-производных в 1‑пропаноле не зависят от режима облучения, что также может указывать на их быстрое образование во внутритрековых процессах.
Метаналь, этаналь и пропаналь являются единственными представителями альдегидов в облученном 1-пропаноле. Выход пропаналя при комнатной температуре выше, чем других продуктов радиолиза, за исключением водорода. Источниками метаналя могут являться распад возбужденных молекул и диспропорционирование гидроксиметильного радикала при взаимодействии с другими радикалами. В случае радиолиза метанола, гидроксиметильные радикалы представляют собой единственный продукт расщепления С–Н связей. Будучи наиболее долгоживущими интермедиатами, они, главным образом, димеризуются, тогда как метаналь формируется преимущественно в результате диссоциации возбужденных молекул и ионов [7, 15]. В свою очередь в 1-пропаноле в режиме РК, выход образования метаналя возрастает по сравнению с режимом ХО. Но выход 1,2-этандиола уменьшается, а выход метанола остается почти неизменным. Такой эффект может быть связан с термостимулируемой диссоциацией гидроксиметильного радикала [10, 16]
которая ведет к росту выхода гидроксипропильных радикалов вследствие реакции атомарного водорода с 1-пропанолом (Н-отрыв). Вместе с тем, гидроксиметильные радикалы частично избегают диссоциации и, потому, участвуют в образовании 1,2‑этандиола, 1,2-бутандиола и метанола.
Кипящее состояние 1-пропанола препятствует образованию этаналя (табл. 1), тогда как в режиме ХО выход этаналя составляет около 0.43. Скорее всего, кипящее состояние способствует ускорению реакции β-гидроксиэтильного радикала с 1-пропанолом (Н-отрыв), также как ускорению его комбинации с другими радикалами.
Наиболее вероятными источниками пропаналя являются нейтрализация ионов (рис. 1), диспропорционирование гидроксипропильных радикалов, а также распад возбужденных молекул. Более низкий выход пропаналя в режиме РК может указывать на снижение роли диспропорционирования. В кипящем 1-пропаноле, когда водородные связи отсутствуют и процессы конформационной релаксации ускоряются, переходный комплекс, образуемый рекомбинирующими радикалами, вероятно, легче стабилизируется в форме димера. Соответственно, димеризация в режиме РК становится выгоднее, чем диспропорционирование. В частности, такое явление подтверждается общим увеличением выхода продуктов комбинации по сравнению с продуктами диспропорционирования в кипящем 1-пропаноле (рис. 2 и 3).
Оцененные выходы расщепления связей в режимах ХО и РК показаны на рис. 4. Химическое строение продуктов радикальной комбинации и длина молекулярного скелета легких продуктов дают ясное представление о предшествующих им радикалах и, соответственно, о разрыве связей. Выход разрыва О–Н связи, приведенный на рис. 4, учитывает наблюдаемый выход формирования пропокси-производных, а также выход пропаналя, поскольку структура последнего формально соответствует разрыву двух связей, С(1)–Н и О–Н. Рис. 4 показывает, что связи С(1)–С(2) и С(1)–Н являются наиболее подверженными радиолитическому разрыву в 1-пропаноле. Оба режима облучения приводят к расщеплению С–Н связей вдвое чаще, чем С–С связей.
Увеличение наблюдаемого выхода Н2 (табл. 1) в режиме РК указывает на возможность дополнительного образования Н в результате термической диссоциации радикалов, подобно реакции (3). Следствием такой диссоциации является увеличение выхода гидроксипропильных радикалов и, тем самым, увеличение выходов продуктов их комбинации, таких как одноатомные и двухатомные спирты. Вероятно, кипение способствует ускорению обмена радикалов. Более того, некоторые более крупные радикалы, например этильные и гидроксиметильные, могут вовлекаться в радикальный обмен в кипящем 1-пропаноле, как это наблюдалось в кипящем диглиме [10]. Также вероятно, что следствием высокой температуры и состояния кипения может являться дополнительная диссоциация первичных ионов 1-пропанола и, тем самым, увеличение выхода фрагментарных радикалов, таких как Н, ОН, СН3 и С2Н5.
Несомненно, из-за реакций обмена радикалов, выход деградации спирта G(–PrOH) может быть выше суммы выходов первичного разрыва связей, обусловленного ионизацией и возбуждением. Эффективный выход радиолитической деградации 1-пропанола G(–PrOH) может быть оценен на основе выходов конечных молекулярных продуктов. Формула [7], предложенная на основе анализа механизма γ-радиолиза, включает четыре слагаемых, но с разными коэффициентами:
(4)
$G(--{\text{PrOH}}) = {\text{ }}{1 \mathord{\left/ {\vphantom {1 3}} \right. \kern-0em} 3}(6{{G}_{1}} + 3{{G}_{2}} + 2{{G}_{3}} + {{G}_{4}}),$При дозах ≈50 кГр и выше в кипящем 1-пропаноле обнаруживаются измеримые количества вторичных высокомолекулярных продуктов, которые, очевидно, возникают вследствие присоединения радикалов к альдегидам. В результате такого присоединения образуются укрупненные алкокси-радикалы, способные отрывать Н от молекул спирта. Кипящее состояние ускоряет образование алкокси-радикалов и, тем самым, облегчает синтез высокомолекулярных соединений и обеспечивает цепное разложение 1-пропанола. При дозах выше 100 кГр выход деградации 1-пропанола G(–PrOH) становится выше 20.
ЗАКЛЮЧЕНИЕ
При радиолизе 1-пропанола реализуются разрывы любой из его связей. Как и в случае γ-радиолиза, связи С(1)–С(2) и С(1)–Н являются наиболее подверженными радиолитическому разрыву. В отличие от γ-радиолиза, электронный пучок генерирует более высокую мощность дозы и, как следствие, порождает более высокую скорость радикальной рекомбинации. Следствием этого являются высокие выходы образования одноатомных и двухатомных спиртов и пониженные выходы альдегидов и углеводородов. Небольшая фракция продуктов (до G ≈ 0.5) представлена простыми эфирами, которые, вероятно, образуются в результате внутритрековой негомогенной комбинации пропокси-радикалов с другими первичными радикалами.
По сравнению с радиолизом при комнатной температуре, состояние кипения существенно увеличивает выходы водорода и продуктов радикальной комбинации. Общий выход продуктов синтеза, которые тяжелее, чем 1-пропанол, возрастает в 1.6 раза. В свою очередь, выход продуктов фрагментации и диспропорционирования уменьшается примерно в 1.2 раза.
Повышение выхода продуктов радикальной комбинации в кипящем 1-пропаноле проистекает из нескольких процессов. Увеличенные выходы молекулярного водорода и продуктов комбинации гидроксипропильных радикалов указывает на появление дополнительного атомарного водорода вследствие термической диссоциации радикалов и катион-радикалов. Однако прирост выхода продуктов комбинации гидроксипропильных радикалов в кипящем 1-пропаноле выше, чем прирост выхода молекулярного водорода. Этот эффект может иметь место вследствие ускорения реакций обмена радикалов, поскольку большее число радикалов приобретает способность отрывать Н от молекул 1-пропанола. Существенное увеличение общего выхода тяжелых продуктов и уменьшение выхода легких продуктов свидетельствует о благоприятном влиянии кипения на радикальную комбинацию. Чем тяжелее синтезируемый спирт или диол, тем больше приращение его выхода в условиях кипения. Вероятно, кипящее состояние ослабляет стерические ограничения и ускоряет структурную релаксацию переходных комплексов, образуемых комбинирующими радикалами.
Настоящая работа выполнено в рамках государственной темы АААА-А16-116121410087-6 с помощью оборудования, предоставленного Центром коллективного пользования физическими методами исследования ИФХЭ РАН.
Список литературы
Singh A., Rath M.C. // Radiat. Phys. Chem. 2018. V. 152. P. 49–55.
Rath M.C., Keny S.J., Naik D.B. // Radiat. Phys. Chem. 2016. V. 126. P. 85–89.
Alam M., Rao B.S., Janata E. // Radiat. Phys. Chem. 2003. V. 67. P. 723–728.
Han Z., Katsumura Y., Lin M., He H., Muroya Y., Kudo H. // Radiat. Phys. Chem. 2008. V. 77. P. 409–415.
Hilczer M., Steblecka M. // Radiat. Phys. Chem. 2003. V. 67. P. 263–268.
Пономарев А.В., Пикаев А.К. // Химия высоких энергий. 1986. Т. 20. № 3. С. 215–220.
Freeman G. The radiolysis of alcohols, in: Haissinsky M. (Ed.), Actions Chimiques et Biologiques Des Radiations. Masson et Cie, Paris. 1970. P. 73–134.
Woods R., Pikaev A. Applied Radiation Chemistry. Radiation Processing. Wiley, N.Y. 1994.
Basson R.A., van der Linde H.J. // J. Chem. Soc. A Inorganic, Phys. Theor. 1969. P. 1618.
Власов С. И., Холодкова Е. М., Пономарев А. В. // Химия высоких энергий. 2018. Т. 52. № 4. С. 293–300.
Белевский В.Н. // Химия высоких энергий. 1981. Т. 15. С. 3–25.
Бугаенко В.Л., Бяков В.М., Гришкин В.Л., Пикаев А.К., Пономарев А.В. // Докл. АН СССР. 1987. Т. 295. № 5. С. 1148–1152.
Пономарев А.В., Макаров И.Е., Пикаев А.К. // Химия высоких энергий. 1991. Т. 25. № 4. С. 311–317.
Pimblott S.M., LaVerne J.A. // Radiat. Phys. Chem. 2007. V. 76. P. 1244–1247.
Baxendale J.H., Wardman P. // NSRDS-NBS. 1975. V. 54. P. 1–26.
Feldman V., Sukhov F., Orlov A., Tyulpina I. // Phys. Chem. Chem. Phys. 2003. V. 5. P. 1769–1774.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий