Химия высоких энергий, 2019, T. 53, № 5, стр. 349-353
Влияние кукурбит[7]урила на окислительно-восстановительные фотопроцессы тионина в воде
Г. В. Захарова a, *, Л. С. Атабекян a, В. Н. Гутров a, А. К. Чибисов a, **
a Центр фотохимии РАН, Федеральное государственное учреждение “Федеральный научно-исследовательский центр “Кристаллография и фотоника“ Российской академии наук”
119421 Москва, Россия
* E-mail: gvzakharova@gmail.com
** E-mail: alexander.chibisov@gmail.com
Поступила в редакцию 23.04.2019
После доработки 23.04.2019
Принята к публикации 08.05.2019
Аннотация
Приведены данные о влиянии кукурбит[7]урила (КБ7) на окислительно-восстановительные реакции тионина (ThH+) в триплетном состоянии в отсутствие и в присутствии донора (FeSO4) и акцептора (п-нитроацетофенон) электрона. Образование комплекса включения тионина с КБ7 состава 1 : 1 приводит к увеличению времени жизни триплетного состояния тионина. В отсутствие экзогенных донора и акцептора электрона триплетные молекулы тионина в комплексе включения вступают в реакции дисмутации и концентрационного тушения с образованием полуокисленной и полувосстановленной форм тионина. Выход и время жизни полуокисленной и полувосстановленной форм тионина превышают выход и время жизни полуокисленной и полувосстановленной форм свободного тионина. Комплексообразование тионина с КБ7 приводит к уменьшению эффективности фотовосстановления тионина ионами Fe2+ в 5 раз и эффективности восстановления ионами Fe2+ полуокисленной формы в 2.5 раза.
Тионин применяется в медицине как бактерицидное средство, как индикатор оксидиметрии, в качестве биосенсора, входит в состав элементов солнечных батарей, а также широко используется в композиционных материалах на основе графена [1–5]. При фотовозбуждении молекулы тионина обнаруживают способность к интеркомбинационному переходу в триплетное состояние с квантовым выходом 0.55 при рН 7.2. Сведения о фотофизических процессах и свойствах молекулы тионина в возбужденном состоянии представлены в работах [6–11].
Кукурбитурилы выступают в роли молекул-хозяев, образуя комплексы включения с молекулами гостей, что сопровождается изменением их спектрально-люминесцентных и фотохимических свойств. Исследованию спектрально-люминесцентных свойств тионина в присутствии кавитандов посвящен ряд работ [12–16]. В этих работах отсутствуют данные по влиянию кавитандов на кинетику фотохимических реакций тионина. Ранее нами было установлено влияние кукурбит [7, 8]урилов на свойства промежуточных короткоживущих продуктов фотореакций тионина в водных растворах [17]. В настоящей работе приведены результаты по влиянию кукурбит[7]урила на окислительно-восстановительные реакции тионина в воде в присутствии донора и акцептора электрона.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Использовали тионин и кукурбит[7]урил фирмы Aldrich. Измерения спектров поглощения и кинетики превращения промежуточных продуктов лазерного возбуждения тионина проводили на установке наносекундного лазерного фотолиза [18, 19]. Спектры поглощения тионина в основном состоянии регистрировали на спектрофотометре Agilent 8453, спектры флуоресценции измеряли на спектрофлуориметре Varian Cary Eclips. В качестве растворителей использовали воду, очищенную с помощью системы Direct–Q3 Millipore. Отдельные измерения выполняли в фосфатном буфере (рН 6.86). Все измерения проводили с обескислороженными растворами при комнатной температуре. Удаление кислорода воздуха осуществляли путем продувки раствора аргоном. В качестве донора электрона использовали сульфат двухвалентного железа (FeSO4 ⋅ 7H2O), а в качестве акцептора – п-нитроацетофенон (п-НАФ) (Aldrich).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
При облучении лазерным импульсом обескислороженного раствора тионина имеют место кратковременные обратимые изменения в спектре поглощения красителя, обусловленные интеркомбинационным переходом в триплетное состояние и последующими реакциями тионина в триплетном состоянии [18]. Молекулы тионина в триплетном состоянии в отсутствие экзогенных доноров и акцепторов электрона вступают в окислительно-восстановительные реакции, продуктами которых являются одноэлектронно окисленная и одноэлектронно восстановленная формы тионина. В результате переноса электрона между двумя триплетными молекулам 3ТhН+ (реакция 1) и/или между триплетной и невозбужденной молекулами 1ТhН+ (реакция 2) образуются нейтральный радикал 2ТhН• (одноэлектронно восстановленная форма) и дикатион радикал 2ТhН2+• тионина (одноэлектронно окисленная форма). Нейтральный радикал при рН 3–7 присоединяет протон [20] с образованием катион радикала $^{2}{\text{Т hН }}_{2}^{{ + \centerdot }}$ (реакция 3)
(1)
$^{3}{\text{Т h}}{{{\text{Н }}}^{ + }} + \,{{\,}^{3}}{\kern 1pt} {\text{Т h}}{{{\text{Н }}}^{ + }}{{ \to }^{2}}{\text{Т h}}{{{\text{Н }}}^{ \bullet }} + \,{{\,}^{2}}{\kern 1pt} {\text{Т h}}{{{\text{Н }}}^{{2 + \bullet }}},$(2)
$^{3}{\text{Т h}}{{{\text{Н }}}^{ + }} + \,{{\,}^{1}}{\kern 1pt} {\text{Т h}}{{{\text{Н }}}^{ + }} \to \,{{\,}^{2}}{\kern 1pt} {\text{Т h}}{{{\text{Н }}}^{ \bullet }} + \,{{\,}^{2}}{\kern 1pt} {\text{Т h}}{{{\text{Н }}}^{{2 + \bullet }}},$(3)
$^{2}{\text{Т h}}{{{\text{Н }}}^{ \bullet }} + {{{\text{H}}}^{ + }} \to \,\,{{\quad}^{2}}{\text{Т h}}{{{\text{Н }}}_{2}}^{{ + \bullet }}$На первом этапе работы исследовали влияние кукурбит[7]урила на реакцию образования радикалов тионина в результате реакций дисмутации (1) и концентрационного тушения (2) молекул красителя в триплетном состоянии в отсутствие экзогенных доноров и акцепторов электрона. Исследования проводили в фосфатном буфере (рН 6.86), т.к. добавление кукурбит[7]урила в раствор приводит к уменьшению значения рН раствора. Известно, что тионин образует с КБ7 комплекс внедрения состава 1 : 1 (ThH+@КБ7) [16] (реакция 4)
(4)
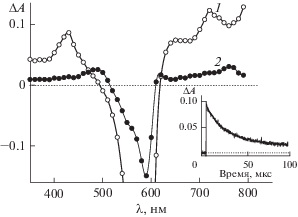
${\text{Th}}{{{\text{H}}}^{ + }} + {\text{К Б 7}}\quad \leftrightarrow {\text{Th}}{{{\text{H}}}^{ + }}@{\text{К Б 7}}{\text{.}}$Комплексообразование приводит к изменению спектрально-кинетических свойств красителя. На рис. 1 (кривая 1) приведены разностные спектры триплет-триплетного (Т-Т) поглощения тионина в фосфатном буфере в присутствии КБ7, измеренные к различным моментам времени после лазерного возбуждения. Разностный спектр, измеренный через 1.2 мкс (кривая 1), относится к спектру триплет-триплетного поглощения тионнина в комплексе ThH+@КБ7 [18]. Разностный спектр поглощения, измеренный через 90 мкс, (рис. 1, кривая 2) относится к поглощению полуокисленной (λмакс = 490 нм [20]) и полувосстановленной (λмакс = 770 нм [21]) форм тионина.
Рис. 1.
Разностные спектры поглощения обескислороженного раствора тионина (1.2 × 10–5 моль/л) в присутствии КБ7 (1 × 10–4 моль/л) в фосфатном буфере (рН 6.86), измеренные через 1.2 мкс (1) и 90 мкс (2) после лазерного импульса. На вставке кинетика дезактивации триплетного состояния тионина в присутствии КБ7 (λ = 700 нм).
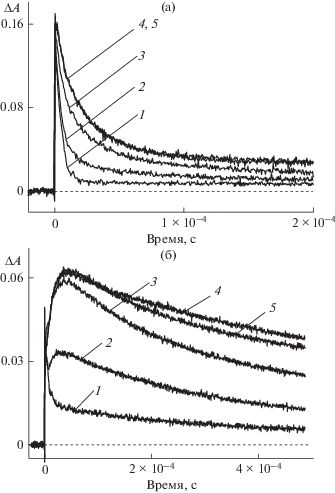
На рис. 2 приведены кинетические кривые дезактивации триплетного состояния тионина (короткоживущий компонент) и образования его полувосстановленной формы (долгоживущий компонент, “ступенька”) (а), а также кинетические кривые образования и гибели полуокисленной формы тионина (б) при различных концентрациях КБ7. Из рис. 2 следует, что с ростом концентрации КБ7 происходит, во-первых, изменение времени жизни молекул тионина в триплетном состоянии (а) и, во-вторых, увеличение выхода полувосстановленной (а) и полуокисленной (б) форм тионина. Следует отметить, что при концентрации КБ7 свыше 1 × 10–4 моль/л кавитанд не оказывает влияния ни на время жизни молекул тионина в триплетном состоянии, ни на выход полуокисленной и полувосстановленной форм. Последнее свидетельствует о достижении максимальной концентрации комплексов ThH+@КБ7 в результате смещения равновесия (4) в сторону ThH+@КБ7. Время жизни молекул свободного тионина в триплетном состоянии составляет 5 мкс и увеличивается до 20 мкс в комплексе ThH+@КБ7. При этом выходы полуокисленной ΔАокисл и полувосстановленной ΔАвосст форм тионина в комплексе составляют 0.06 и 0.03 соответственно.
Рис. 2.
Кинетические кривые дезактивации триплетного состояния и образования полувосстановленной формы (λ = 700 нм) тионина (2 × 10–5 моль/л) (a) и образования и гибели полуокисленной формы (λ = 480 нм) тионина (б) при рН 6.86 в отсутствие (1) и в присутствии КБ7 в концентрации 1 × 10–5 (2), 3 × 10–5 (3), 1 × 10–4 (4), 2.5 × 10–4 моль/л (5).
Таким образом, молекулы тионина в комплексе ThH+@КБ7 в триплетном состоянии способны вступать в реакции (1) и (2) с образованием полуокисленной и полувосстановленной форм тионина.
На втором этапе работы исследовали влияние КБ7 на реакцию фотовосстановления тионина в триплетном состоянии ионами Fe2+ (реакция 5). Добавление КБ7 в водный раствор тионина приводит к снижению значения рН и протонированию триплетных молекул тионина (рК 6.3 [20]). Тионин в триплетном состоянии в протонированной форме ($^{3}{\text{Т hН }}_{2}^{{2 + }}$) в комплексе с КБ7 вступает в реакцию восстановления (6)
(5)
$^{3}{\text{Т h}}{{{\text{Н }}}^{ + }}\quad + {\;F}{{{\text{e}}}^{{2 + }}} \to \,{{\,}^{2}}{\text{Т h}}{{{\text{Н }}}^{ \bullet }}\quad + \quad{\text{F}}{{{\text{e}}}^{{3 + }}},$(6)
$\begin{gathered} ^{3}{\text{Т hН }}_{2}^{{2 + }}@{\text{К Б 7}} + {\text{F}}{{{\text{e}}}^{{2 + }}} \to \\ \to \,{{\,}^{2}}{\text{Т hН }}_{2}^{{ + \centerdot }}{\kern 1pt} @{\text{К Б 7}} \ldots {\text{F}}{{{\text{e}}}^{{3 + }}} \to \,{{\,}^{2}}{\text{Т hН }}_{2}^{{ + \centerdot }}{\kern 1pt} @{\text{К Б 7}} + {\text{F}}{{{\text{e}}}^{{3 + }}}. \\ \end{gathered} $Исследования проводили при концентрации кукурбитурила, соответствующей условию максимального образования комплексов ThH+@КБ7. Найденное значение константы скорости тушения триплетного состояния тионина ионами Fe2+ в отсутствие КБ7 составляет 1.3 × 108 л моль–1 с–1 и уменьшается до 2.7 × 107 л моль–1 с–1 в присутствии КБ7. На рис. 3 приведены кинетические кривые дезактивации триплетного состояния ионами Fe2+ и образования полувосстановленной формы тионина в отсутствие и в присутствии КБ7. Из рис. 3 следует, что выход полувосстановленной формы красителя в комплексе с КБ7 заметно меньше по сравнению с выходом полувосстановленной формы свободного красителя. Наблюдаемые отличия могут быть обусловлены, во-первых, экранированием кукурбитурилом граничных орбиталей тионина, участвующих в переносе электрона, во-вторых, изменением величины окислительно-восстановительного потенциала при образовании комплексов включения, как это было установлено для комплексов производных ферроцена и метилвиологена с кукурбит[7]урилом [22–24]. Кроме того, уменьшение значения рН при добавлении КБ7 в водный раствор приводит к протонированию молекул тионина в триплетном состоянии и увеличению положительного заряда комплекса тионина с КБ7, что в свою очередь ослабляет электростатическое взаимодействие между комплексами и ионами Fe2+. Уменьшение выхода полувосстановленной формы красителя может быть связано с преобладанием процесса геминальной рекомбинации в ион-радикальной паре $^{2}{\text{Т hН }}_{2}^{{ + \centerdot }}$@КБ7…Fe3+, образующейся в реакции (6), над процессом ее диссоциации на исходные реагенты ТhН+@КБ7 и Fe3+ (реакция 7)
(7)
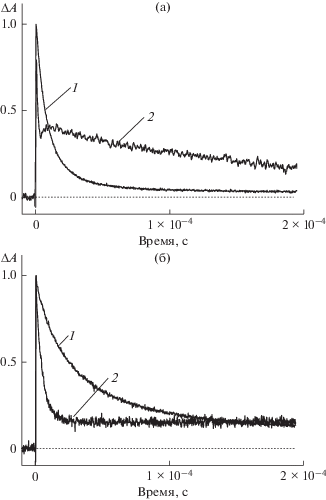
$\begin{gathered} ^{2}{\text{Т hН }}_{2}^{{ + \centerdot }}@{\text{К Б 7}} \ldots {\text{F}}{{{\text{e}}}^{{3 + }}} \to \\ \to \,\,{\text{Т h}}{{{\text{Н }}}^{ + }}{\kern 1pt} @{\text{К Б 7}} + {\text{F}}{{{\text{e}}}^{{2 + }}}\quad + \quad{{{\text{H}}}^{ + }}. \\ \end{gathered} $Рис. 3.
Нормированные кинетические кривые дезактивации триплетного состояния тионина (3 × 10–5 моль/л) и образования и гибели полувосстановленной формы тионина в отсутствие (1) и в присутствии (2) FeSO4 (5 × 10–3 моль/л). (a) – В отсутствие КБ7, (б) – в присутствии КБ7 (4 × 10–4 моль/л). λ = 770 нм.
В работе также исследовали влияние КБ7 на восстановление полуокисленной формы тионина ионами Fe2+ (реакции 8, 9)
(8)
$^{2}{\text{Т h}}{{{\text{Н }}}^{{2 + \bullet }}}\quad + \quad{\text{F}}{{{\text{e}}}^{{2 + \quad}}} \to \quad{\text{Th}}{{{\text{H}}}^{ + }}\quad + \quad{\text{F}}{{{\text{e}}}^{{3 + }}},$(9)
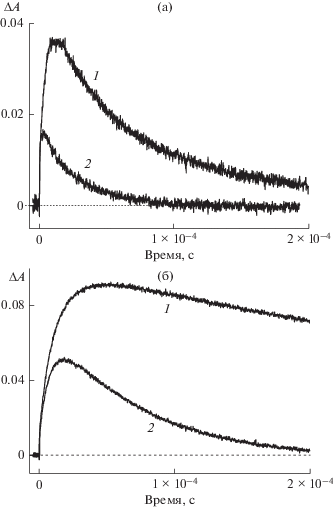
$^{2}{\text{Т h}}{{{\text{Н }}}^{{2 + \bullet }}}{\kern 1pt} @{\text{К Б 7}} + {\text{F}}{{{\text{e}}}^{{2 + }}}\quad \to \quad{\text{Т h}}{{{\text{Н }}}^{ + }}{\kern 1pt} @{\text{К Б 7}}\quad + \quad{\text{F}}{{{\text{e}}}^{{3 + }}}.$На рис. 4 приведены кинетические кривые образования и гибели полуокисленной формы тионина, измеренные в отсутствие и в присутствии Fe2+, а также в отсутствие и в присутствии КБ7. По данным кинетики гибели полуокисленной формы, измеренной в отсутствие и в присутствии Fe2+, были оценены константы скорости восстановления полуокисленной формы тионина ионами Fe2+. Значения констант скоростей составляют 2.5 × 107 и 1 × 107 л моль–1с–1 в отсутствие и в присутствии КБ7 соответственно. Обращает внимание, что время жизни полуокисленной формы в комплексе заметно больше по сравнению с временем жизни полуокисленной формы свободного тионина.
Рис. 4.
Кинетические кривые образования и гибели полуокисленной формы тионина в отсутствие (1) и в присутствии (2) Fe2SO4. (a) – В отсутствие КБ7, (б) – в присутствии КБ7. Концентрация тионина – 5 × 10–5, Fe2SO4 – 1 × 10–3, КБ7 – 5 × 10–4 моль/л. λ = 480 нм.
На третьем этапе работы исследовали влияние КБ7 на реакцию фотоокисления тионина п-нитроацетофеноном (п-НАФ). В работе не было обнаружено динамическое тушение триплетного состояния тионина п-нитроацетофеноном в концентрации меньше 1 × 10–3 моль/л как в отсутствие, так и в присутствии КБ7, что указывает на то, что реакция фотоокисления тионина п-нитроацетофеноном не имеет места. Однако было найдено, что п-НАФ ускоряет процесс гибели полувосстановленной формы тионина, протекающий с константой скорости 1.7 × 107 л моль–1 с–1
ВЫВОДЫ
1. Молекулы тионина в комплексе с кукурбит [7]урилом (ThH+@КБ7) в триплетном состоянии способны вступать в реакцию переноса электрона в отсутствие экзогенных донора и акцептора электрона с образованием полуокисленной и полувосстановленной форм тионина. Выход полуокисленной и полувосстановленной форм тионина в комплексе ThH+@КБ7 превышает выход полуокисленной и полувосстановленной форм свободного тионина.
2. Комплексообразование с кукурбит[7]урилом приводит к снижению константы скорости тушения триплетного состояния ионами Fe2+ в 5 раз и уменьшению выхода полувосстановленной формы красителя по сравнению со свободным красителем.
3. Кукурбит[7]урил уменьшает в 2.5 раза константу скорости восстановления полуокисленной формы тионина ионами Fe2+.
Работа выполнена при финансовой поддержке Министерства науки и высшего образования в рамках выполнения работ по Государственному заданию ФНИЦ “Кристаллография и фотоника” РАН в части исследования фотопереноса электрона в присутствии экзогенных донора и акцептора электрона и при финансовой поддержке Российского фонда фундаментальных исследований (проект № 18-03-00183) в части исследования реакций дисмутации и концентрационного тушения.
Список литературы
Passos M., Saraiva M., Lima J. // Anal. Chim. Acta. 2010. V. 668. № 1. P. 41.
Mackay R.A., Lai W.Ch. // Colloids Surf. A. 2005. V. 254. № 1–3. P. 115.
Dong H., Zou F., Li H., Zhu H., Koh K., Yin Y., Chen H. // Electrochim. Acta. 2018. V. 267. P. 206.
Lai G., Yin C., Tan X., Zhang H., Yu A. // Anal. Methods. 2014. V. 6. № 7. P. 2080.
Zhu L., Luo L., Wang Z. // Biosens. Bioelectron. 2012. V. 35. № 1. P. 507.
Коробов В.Е., Чибисов А.К. // Успехи химии. 1983. Т. 52. Вып. 1. С. 43.
Nicotra V.E., Mora M.F., Iglesias R.A., Baruzzi A.M. // Dyes Pigm. 2008. V. 76. № 2. P. 315.
Uddin F. // Eur. J. Org. Chem. 2000. V. 7. № 7. P. 1345.
Bhowmik B.B., Mukhopadhyay M. // J. Photochem. Photobiol. A. 1994. V. 78. № 2. P. 173.
Lai W.C., Dixit N.S., Mackay R.A. // J. Phys. Chem. 1984. V. 88. № 22. P. 5364.
Kramer H.E.A. // Photosensibilisierte Sauerstoffubertragung nach einem Redoxmechanismus: Das System Thionin, 18Allylthioharnstoff und Sauerstoff, Doctor Dissertation. Stuttgart, 1970. 137 p.
Hamai S. // Bull. Chem. Soc. Jpn. 2000. V. 73. № 4. P. 861.
Tong X.Q., Lo J.Q., Juan S., Gong Z.H. // Spectrosc. Spectral Anal. 2007. V. 27. № 12. P. 2538.
Sueishi Y., Mori H., Inazumi N. // J. Incl. Phenom. Macrocycl. Chem. 2013. V. 75. № 1–2. P. 235.
Xi Y.Y., Tang Q., Huang Y., Tao Z., Xue S.F., Zhu Q.J. // Spectrosc. Spectral Anal. 2016. V. 36. № 6. P. 1809.
Montes-Navajas P., Corma A., Garcia H. // Chem. Phys. Chem. 2008. V. 9. P. 713.
Атабекян Л.С., Авакян В.Г., Захарова Г.В., Чибисов А.К. // Химия высоких энергий. 2018. Т. 52. № 2. С. 103
Атабекян Л.С., Чибисов А.К., Алфимов М.В. // Химия высоких энергий. 1997. Т. 31. № 5. С. 381.
Захарова Г.В., Авакян В.Г., Маркелов В.П., Святославский Н.Л., Святославская Т.А., Чибисов А.К. // Химия высоких энергий. 2015. Т. 49. № 6. С. 451.
Kishore K., Guna S.N., Moorthy P.N. / Proc. Indian Acad, Sci. (Chem Sci.). 1987. V. 99. № 5–6. P. 351.
Guna S.N., Moorthy P.N., Kishore K., Naik D.B., Rao K.N. // Proc. Indian Acad, Sci. (Chem Sci.). 1987. V. 99. № 4. P. 261.
Wang R., Yuan L., Macartney D.H. // Organometallics. 2006. V. 25. P. 1820.
Qiu Y., Kaifer A.E. // Isr. J. Chem. 2011. V. 51. P. 830.
Li W., Kaifer A.E. // Langmuir. 2012. V. 28. № 42. P. 15075.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий


