Химия высоких энергий, 2019, T. 53, № 6, стр. 448-452
Изменение спектрально-люминесцентных свойств стирилового красителя в ходе золь-гель синтеза силикатного гидрогеля
А. В. Кошкин a, b, *, А. А. Медведева a, b, Н. А. Лобова a, b
a Центр Фотохимии РАН ФНИЦ “Кристаллография и фотоника” РАН
119421 Москва, ул. Новаторов, д. 7А, корп. 1, Россия
b Московский физико-технический институт (Государственный университет)
141701 Московская область, Долгопрудный, Институтский пер., д. 9, Россия
* E-mail: avk@photonics.ru
Поступила в редакцию 03.06.2019
После доработки 17.06.2019
Принята к публикации 19.06.2019
Аннотация
Проведены исследования изменения спектрально-люминесцентных характеристик стирилового красителя иодида 4-диметиламиностирилпиридиния (4-DASPI) в процессе золь-гель синтеза трехмерной силикатной матрицы на основе тетракис-(2-гидроксиэтил)ортосиликата (THEOS).
ВВЕДЕНИЕ
Одним из наиболее удобных методов исследования полимерных и гелеобразных материалов является их зондирование с помощью органических молекул-флуорофоров. Данный метод позволяет оценить различные параметры ближнего окружения молекул-зондов, например, полярность [1], pH [2] или вязкость микроокружения красителя [3]. В основном, в качестве молекул-флуорофоров в таких исследованиях применяются флуоресцентные органические красители с ярко выраженным сольватохромным эффектом, что позволяет проводить анализ данных с помощью сравнительно простых и чувствительных методов флуоресцентной спектроскопии. Отдельное место среди флуоресцентных молекул-зондов занимают так называемые молекулярные роторы [4], красители, квантовый выход флуоресценции которых зависит от вязкости микроокружения молекулы. Одним из наиболее хорошо изученных представителей молекулярных роторов является краситель иодид 4-диметиламиностирилпиридиния (4‑DASPI), широко использующийся в качестве маркера в исследованиях биологических объектов [5, 6]. В водном растворе данный краситель обладает низким квантовым выходом флуоресценции, значительно возрастающим при увеличении вязкости микроокружения [4, 7]. В литературе известны примеры успешного исполь-зования 4-DASPI для мониторинга процессов образования силикатных гелей на основе тетраалкоксисиланов [8] путем слежения за изменением времени жизни возбужденного состояния молекулы красителя. Однако данных по изменению времени жизни красителя недостаточно для получения достоверной информации об основных факторах, влияющих на вязкость микроокружения, поскольку краситель может находиться как в адсорбированной форме, так и в жидкой фазе гидрогеля, состав которой в процессе синтеза может изменяться. В нашей работе впервые получены данные по влиянию образования твердой фазы силикатного гидрогеля на спектры флуоресценции и поглощения 4-DASPI в процессе золь-гель синтеза силикатной матрицы на основе тетракис-(2-гидроксиэтил)ортосиликата (THEOS), водорастворимого исходного соединения, не требующего введения катализаторов для протекания реакции гидролиза и поликонденсации.
МЕТОДИКА ЭКСПЕРИМЕНТА
Общая схема проведения исследований заключалась в приготовлении в пластиковых флуориметрических кюветах с длиной хода луча 1 см образцов реакционной смеси, содержащей 500 мкл THEOS, синтезированного в соответствии с методикой, описанной в [9] и 2.5 мл водного раствора красителя 4-DASPI (Aldrich). Для получения растворов использовалась деионизованная вода с проводимостью 18 МОм/см. Итоговая концентрация красителя в реакционной смеси составляла 1 × 10–5 моль/л. Время протекания реакции гелеобразования составляло 6–10 ч при температуре 23°C.
Спектры поглощения регистрировались на спектрофотометре “Shimadzu UV-3101PC”, в качестве образца сравнения использовались аналогичные кюветы с деионизованной водой. Спектры флуоресценции образцов были получены на приборе “Agilent Cary Eclipse”, длина волны возбуждения флуоресценции составляла 450 или 500 нм.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
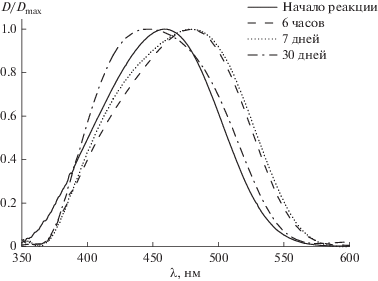
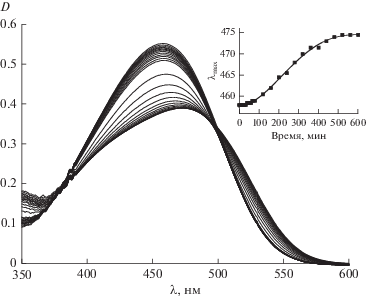
Краситель 4‑DASPI (рис. 1) относится к соединениям, обладающим обратным сольватохромизмом, с ростом полярности окружения молекулы, его спектр поглощения смещается гипсохромно [10]. В условиях эксперимента в течение 600 мин наблюдался сдвиг максимума спектра поглощения в длинноволновую область спектра, что соответствует уменьшению полярности окружения красителя (рис. 2). Это необычный факт, поскольку известно, что полярность окружения молекул-флуорофоров, полученных при образовании силикатных гидрогелей на основе тетраэтоксисилана значительно возрастает [11]. Поскольку в процессе гидролиза THEOS выделяется этиленгликоль, можно сделать предположение об изменении состава сольватной оболочки 4-DASPI за счет вытеснения молекул воды этиленгликолем. Максимальный батохромный сдвиг спектра поглощения, зафиксированный в ходе эксперимента, составил 21 нм, в результате чего положение максимума полосы поглощения составило 478 нм. Согласно литературным данным [10], такое положение максимума спектра поглощения соответствует практически 100% раствору этиленгликоля, что указывает на изоляцию молекул красителя от жидкой фазы гидрогеля, поскольку в условиях протекания реакции в жидкой фазе находится значительный избыток воды. Помимо сдвига в батохромную область, при протекании золь-гель процесса наблюдается уширение спектра поглощения красителя. Разложение спектра поглощения на два компонента дало два пика с максимумами на 434 и 494 нм (коэффициент корреляции 0.96) и интенсивностями поглощения 0.2 и 0.17 соответственно. Абсолютные значения положения максимумов не дают информации об истинном окружении молекул красителя, однако, высокий коэффициент корреляции позволяет утверждать, что краситель в системе может находиться, по меньшей мере, в двух различных окружениях: неполярном и сильно полярном. Можно предположить, что средой с высокой полярностью являются полностью гидролизованные фрагменты твердой фазы, тогда как неполярное окружение соответствует молекулам красителя, избирательно сольватированного этиленгликолем или находящегося в окружении непрореагировавших гидроксиэтильных фрагментов на поверхности твердой фазы.
Рис. 1.
Структурa флуоресцентного зонда 4-DASPI и исходного соединения для синтеза матрицы силикагеля THEOS.
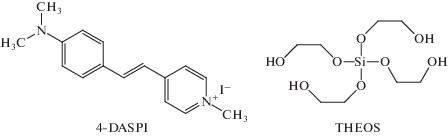
Рис. 2.
Изменение спектров поглощения 4-DASPI в процессе образования твердой фазы. На вставке изменение положения максимума с течением времени.
Спектры поглощения гидрогелей, выдержанных в темноте в течение 30 суток демонстрировали сдвиг в гипсохромную область спектра, максимум спектра поглощения образцов находился в области 445 нм (рис. 3). Поскольку образцы созревших гидрогелей обладают значительным рассеянием в видимой области спектра, провести точное сравнение формы спектров и интенсивности поглощения не представляется возможным. Однако такой спектральный сдвиг может быть обусловлен замещением этиленгликоля в ближнем окружении флуорофора на молекулы воды и взаимодействием молекулы-зонда с силанольными группами на поверхности сформировавшейся твердой фазы. Такое поведение подтверждает версию о двух преобладающих сольватных окружениях молекул красителя.
Таблица 1.
Длины волн максимумов спетров поглощения, флуоресценции и Стоксов сдвиг 4-DASPI в различных средах
| Среда/матрица | λmax abs, нм | λmax fl, нм | Стоксов сдвиг, нм/см–1 |
|---|---|---|---|
| Реакционная смесь в начале процесса синтеза | 457 | 607 | 150/5342 |
| Гидрогель | 478 | 591 | 113/3960 |
| Этиленгликоль | 478 | 607 | 132/4511 |
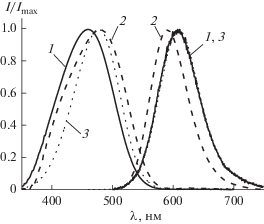
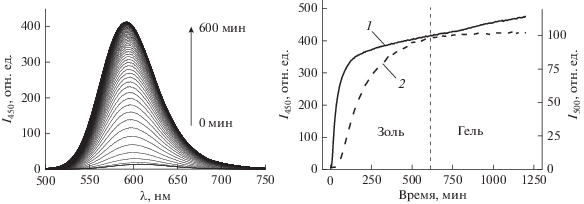
Спектр флуоресценции красителя в ходе золь-гель синтеза не претерпевает серьезных изменений и представляет собой неструктурированный спектр, максимум которого в процессе образования твердой фазы геля смещается с 608 до 595 нм (рис. 4а). Поскольку интенсивность флуоресценции красителя зависит от эффективности поглощения на длине волны возбуждения, были получены кинетические зависимости для возбуждения сигнала флуоресценции на двух длинах волн: в области максимума поглощения красителя в водном растворе (450 нм) и на 500 нм, в области наименьшего изменения оптической плотности образцов (рис. 4б). Ранее нами были проведены попытки интерпретации данных по кинетике изменения интенсивности флуоресценции 4-DASPI [9]. Медленный рост сигнала флуоресценции в течение длительного времени был сопоставлен с продолжением формирования твердой фазы внутри пор гидрогеля. Проведение эксперимента при возбуждении на длине волны 500 нм позволило исключить сольватохромный эффект изменения положения максимума спектра поглощения красителя и позволило установить, что медленный рост интенсивности был связан с изменением оптической плотности на длине волны возбуждения флуоресценции в результате сдвига спектра поглощения сначала в длинноволновую, а затем в коротковолновую область спектра. Более того, было установлено, что интенсивность флуоресценции практически не меняется после окончания процесса формирования трехмерной сетки геля. Это позволяет предположить, что основной вклад в изменение квантового выхода 4-DASPI вносит именно образование наночастиц силикагеля, формирующих трехмерную структуру гидрогеля, а не изменение состава сольватной оболочки молекул в жидкой фазе.
Рис. 4.
Изменение спектров флуоресценции красителя 4-DASPI в процессе золь-гель синтеза (а); кинетика изменения интенсивности флуоресценции на 595 нм при возбуждении на длинах волн 450 (1) и 500 (2) нм (б).
Дополнительные доказательства того, что основной вклад в изменение спектральных свойств 4-DASPI в процессе золь-гель синтеза вносит взаимодействие с твердой фазой гидрогеля были получены путем сравнения спектров поглощения и флуоресценции реакционной смеси в начале и конце процесса золь-гель синтеза со спектрами 4-DASPI в этиленгликоле (рис. 5). Спектр флуоресценции красителя в этиленгликоле практически полностью соответствовал спектру реакционной смеси в начале синтеза, а максимум спектра поглощения совпадал с положением максимума спектра поглощения силикатного гидрогеля (табл. 1). По-видимому, в результате сильного взаимодействия молекулы зонда с твердой фазой гидрогеля происходит стабилизация возбужденного состояния конфигурации молекулы 4-DASPI, в которой либо аминофенильный, либо пиридиниевый фрагмент повернуты относительно планарной конфигурации по одинарным связям. Согласно расчетам, приведенным в работе [7], такие возбужденные состояния должны обладать несколько большей энергией по сравнению с планарным, что и наблюдается в результате эксперимента.
ВЫВОДЫ
Таким образом, в результате проделанной работы проведен анализ изменений в спектрах флуоресценции и поглощения 4-DASPI в процессе золь-гель синтеза трехмерной силикатной матрицы из водорастворимого исходного соединения. Показано, что основной вклад в изменение квантового выхода молекул-зондов в гидрогеле несет не изменение состава сольватной оболочки молекулы-флуорофора, а формирование твердой фазы геля. Было установлено, что после формирования трехмерной матрицы гидрогеля процессы изменения окружения молекулы-зонда продолжаются в течение продолжительного времени, достигая равновесного состояния спустя 30 дней с момента начала реакции. Обнаружено, что взаимодействие с твердой фазой гидрогеля приводит к искажению геометрии молекулы, в результате чего процесс излучательной релаксации возбужденного состояния 4-DASPI происходит из скрученной конформации в отличие от планарной, наблюдаемой в растворителях.
Работа выполнена при поддержке Министерства науки и высшего образования в рамках выполнения работ по Государственному заданию ФНИЦ “Кристаллография и фотоника” РАН в части исследования флуоресцентных свойств молекулы-зонда и РФФИ ОФИ-м № 16-29-11765 в части проведения золь-гель синтеза и исследования микроокружения методом электронной спектроскопии.
Список литературы
Pilipenko M.S., Koshkin A.V., Sazhnikov V.A., Alfimov M.V. // High Energy Chemistry. 2015. T. 49. № 4. C. 249.
Hornig S., Biskup C., Grafe A., Wotschadlo J., Liebert T., Mohr G.J., Heinze T. // Soft Matter. 2008. T. 4. № 6. C. 1169.
Miller E., Wandelt B., Wysocki S., Jozwik D., Mielniczak A. // Biosensors & Bioelectronics. 2004. T. 20. № 6. C. 1196.
Antonious M.S. // Spectrochimica Acta Part a-Molecular and Biomolecular Spectroscopy. 1997. T. 53. № 3. C. 317.
Kumar S., Alibhai D., Margineanu A., Laine R., Kennedy G., McGinty J., Warren S., Kelly D., Alexandrov Y., Munro I., Talbot C., Stuckey D.W., Kimberly C., Viellerobe B., Lacombe F., Lam E.W.F., Taylor H., Dallman M.J., Stamp G., Murray E.J., Stuhmeier F., Sardini A., Katan M., Elson D.S., Neil M.A.A., Dunsby C., French P.M.W. // Chemphyschem. 2011. T. 12. № 3. C. 609.
Alhassawi F.M., Corradini M.G.,. Rogers M.A, Ludescher R.D. //Critical Reviews in Food Science and Nutrition. 2018. T. 58. № 11. C. 1902.
Kim J., Lee M., Yang J.H., Choy J.H. //Journal of Physical Chemistry A. 2000. T. 104. № 7. C. 1388.
Hungerford G., Allison A., McLoskey D., Kuimova M.K., Yahioglu G., Suhling K. // J. Physical Chemistry B. 2009. T. 113. № 35. C. 12067.
Koshkin A.V., Aleksandrova N.A., Ivanov D.A. // J. Sol-Gel Science and Technology. 2017. T. 81. № 1. C. 303.
Panigrahi M., Dash S., Patel S., Mishra B.K. // J. Physical Chemistry B. 2011. T. 115. № 1. C. 99.
Pilipenko M.S., Koshkin A.V., Sazhnikov V.A., Alfimov M.V. // High Energy Chemistry. 2014. T. 48. № 2. C. 127.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий