Химия высоких энергий, 2020, T. 54, № 4, стр. 263-268
Спектрально-люминесцентное исследование биологически активных 2-амино-1,3-тиазолов, содержащих дитерпеновый фрагмент в растворах ацетонитрила
С. С. Остахов a, *, Р. М. Султанова a, Г. А. Масягутова a, С. Л. Хурсан a
a Уфимский Институт химии УФИЦ РАН
450054 Уфа, Россия
* E-mail: chemlum@anrb.ru
Поступила в редакцию 31.01.2020
После доработки 31.01.2020
Принята к публикации 16.02.2020
Аннотация
Проведено спектрально-люминесцентное исследование ряда 2-амино-1,3-тиазолов, содержащих дитерпеновый фрагмент, полученных на основе химических трансформаций малеопимаровой кислоты и обладающих широким спектром биологической активности: противоопухолевой, антимикробной и антиоксидантой. Определены их спектральные UV- и флюоресцентные характеристики, а также квантовые выходы люминесценции в растворах ацетонитрила. Установлено нарушение правила зеркальной симметрии спектров поглощения и флюоресценции полученных соединений.
Способность биологически активных азотсодержащих гетероциклических соединений флюоресцировать (FL) [1, 2], а также тушить FL аминокислотного остатка белков – триптофана [3, 4], может быть использована при идентификации примесей в лекарственных препаратах [5], изучении фармакокинетики [3] и в биохимических исследованиях с целью сравнительной оценки их биологической активности [4].
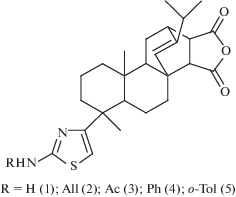
Ранее нами был синтезирован ряд 1,3-тиазолпроизводных малеопимаровой кислоты (МПК) (рис. 1) с широким спектром биологической активности: противоопуxoлевой, антимикробной и антиоксидантой [6].
Известно, что тиазолы и их производные обладают люминесценцией [2, 7, 8]. В работе [9] нами была обнаружена люминесценция 2-метил-1,3-тиазола МПК в растворе ДМСО, полученного пу-тем химических трансформаций МПК по гидроксильной функции, с максимумами FL (λem) при 356 и 414 нм. Флюоресценция при λem = 414 нм коррелирует с областью эмиссии бензотиазолов (413–438 нм) в толуоле [10], в то время как природа доминирующего коротковолнового максимума λem = 356 нм не была установлена и требует дополнительных спектрально-люминесцентных обоснований.
Предметом данного исследования является изучение спектрально-люминесцентных свойств биологически активных 2-амино-1,3 тиазолов 1–5, содержащих дитерпеновый фрагмент (рис. 1).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез и очистку МПК и ее 1,3-тиазолсодежащих производных 1–5 проводили по методике [9]. Триптофан (Fluka, ≥99.0%), малеиновый ангидрид (МА) и ацетонитрил (Криохим, сорт 0) использовали без предварительной очистки.
Cпектры поглощения регистрировали на спектрофотометре “Specord M-40”, скорректированные спектры возбуждения и излучения FL на спектрофлюориметре “СМ-2203”. Квантовые выходы FL (φ) определяли по известной методике [11] с использованием внешнего стандарта триптофана (Trp) по уравнению: φi = φTrp(SiATrp)/(STrpAi), где φi – квантовый выход FL, φTrp – квантовый выход FL Trp (φTrp= 0.14, Н2О, pH 7, 298 К [12]), Si и Ai – светосумма под полосой FL и оптическая плотность поглощения субстрата на длине волны возбуждающего света (λex), соответственно, STrp и ATrp – аналогично для триптофана.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
На рис. 2 приведены спектры поглощения соединений 1–5, а их спектральные UV-характеристики представлены в табл. 1. Обращает на себя внимание существенный батохромный сдвиг в соединениях 4, 5, обусловленный присутствием тиазольного фрагмента, содержащего вторичную ароматическую аминогруппу во втором положении гетероцикла (рис. 2, табл. 1).
Рис. 2.
Спектры поглощения исследуемых соединений: 1 – 1; 2 – 2; 3 – 3; 4 – 4; 5 – 5 (10–4 моль/л, l = 1 см, CH3CN, 298 К).
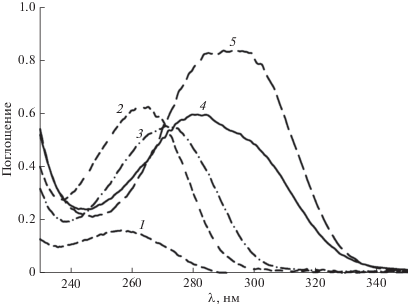
Таблица 1.
Спектральные UV и FL характеристики соединений 1–5, малеопимаровой кислоты и малеиноговго ангидрида (10–4 моль/л, CH3CN, 298 К)
| Соединение | λabs, нм | ε ×10–3, M–1×см–1 | λex, нм | λem, нм | φ ×104 |
|---|---|---|---|---|---|
| 1 | 257 | 1.6 | 245 282 |
304 332 |
19 |
| 2 | 265 | 6.2 | 238 299 |
342 | 5.6 |
| 3 | 271 | 5.5 | 244 310 |
343 | 7,6 |
| 4 | 294 | 8.4 | 245 | 340 | 5.2 |
| 5 | 280 | 6.0 | 244 | 350 403 |
7.7 |
| МПК | – | 236 264 |
309 338 |
26 | |
| МА | 205 | 11.6 | 236 279 |
306 342 |
6.0 |
На рис. 3 представлены спектры FL 2-амино-1,3-тиазолсодержащих производных малеопимаровой кислоты 1–5. Спектральные характеристики соединений 1–5 приведены в табл. 1.
Рис. 3.
Скорректированные спектры FL 1,3-тиазолпроизводных малеопимаровой кислоты: 1 – 1; 2 – 2; 3 – 3; 4 – 4; 5 – 5 (10–4 моль/л, λex = 235 нм, CH3CN, 298 К).
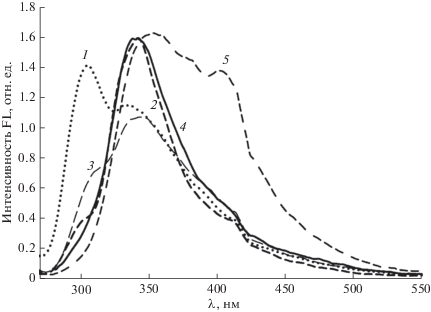
Следует отметить, что для всех полученных соединений регистрируется максимум FL на длине волны эмиссии λem ≈ 340 ± 10 нм (рис. 3, табл. 1). В то же время, модификация тиазольного хромофора сопровождается изменениями спектрального состава FL в коротковолновой и длинноволновой областях спектров (рис. 3). В ряду изученных 1,3-тиазолов, содержащих дитерпеновый фрагмент заслуживают внимания следующие спектрально-люминесцентные характеристики. Во-первых, перегиб в длинноволновой области FL для соединений 1–4 (рис. 3), который для тиазола 5 проявляется в виде максимума λem = 403 нм (рис. 3, спектр 5). На основании литературных данных [9, 10] FL в этой спектральной области логично было отнести к эмиссии 1,3-тиазольного фрагмента. Во-вторых, для соединений 1–3 в коротковолновой области λem ≈ 300 нм также наблюдается перегиб, который для 2 становится доминирующим максимумом λem = 304 нм (рис. 3).
Из сравнения значений квантовых выходов FL соединений 1–5, приведенных в табл. 1, следует, что наличие тиазольного заместителя приводит к тушению их флюоресценции, которое обусловлено процессами безызлучательного переноса энергии.
Наряду с отмеченными выше закономерностями, как следует из сравнения данных, приведенных на рис. 2 и 3, наблюдается нарушение правила Левшина о зеркальной симметрии UV и FL спектров [13]. Отсутствие симметрии UV и FL спектров регистрируется у молекул, обладающих различными формами потенциальных кривых и расположением колебательных уровней электронно-возбужденного и основного состояния [13]. На форму спектров FL соединений 1–5, вероятно, могут оказывать влияние концевые группы дитерпеноида – малеиновый ангидрид и заместители во втором положении тиазольного цикла. Наиболее характерно отклонение от закона зеркальной симметрии выражено для соединений 1, 5 и проявляется, как отмечалось выше, в виде максимумов при λem = 304 нм и λem = 403 нм соответственно.
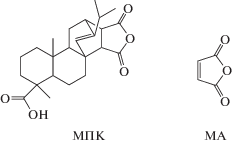
Если объяснение FL соединений 4–5 в области λem ≈ 400 нм (рис. 3, спектры 4, 5) влиянием вторичной ароматической группы во втором положении 1,3-тиазольного фрагмента представляется, основываясь на литературных данных [9, 10], непротиворечивым, то интерпретация коротковолновой эмиссии λem ≈ 300 нм требует дополнительных обоснований. Предположительно, FL соединений 1–5 в области λem ≈ 300 нм определяется влиянием дитерпенового фрагмента или малеинового ангидрида. Ответ на этот вопрос может дать спектрально-люминесцентное исследование МПК и малеинового ангидрида, структурные формулы, которых приведены ниже:
Спектры люминесценции МПК и МА представлены на рис. 4.
Рис. 4.
Скорректированные нормированные спектры FL: МПК – (1); МА – (2) (10–4 моль/л, λex = 235 нм, CH3CN, 298 К).
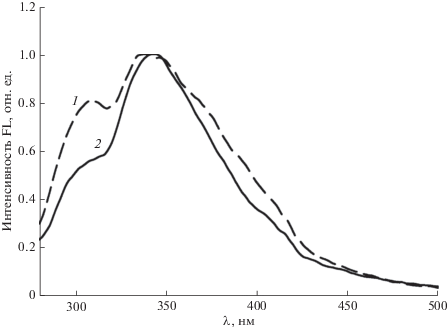
В схожих по параметрам спектрах люминесценции МПК и МА регистрируются доминирующие максимумы при λem = 345 нм и минорные в области ~310 нм, коррелирующие с таковыми для соединений 1–3 (рис. 4, табл. 1). Следует отметить, что квантовый выход FL МПК (φ = 26 × 10–4) значительно выше, нежели МА (φ = 6.0 × 10–4), по-видимому, вследствие фотосенсибилизации последнего по механизму безызлучательного переноса энергии с дитерпеноида на малеиновый ангидрид.
Для FL соединения 1, в отсутствии тиазольного фрагмента, характерно не только совпадение со спектром эмиссии МПК (рис. 3, 4, спектры 1), но также наивысший квантовый выход FL в ряду тиазолпроизводных МПК 2–5 (φ = 7.7–5.2 × 10–4 (табл. 1)), равный φ = 19 × 10–4. Таким образом, анализ экспериментальных результатов позволяет предположить, что флюоресценция в области λem ≈ 345 нм может быть отнесена к излучению МПК, а тушение FL и нарушение закона зеркальной симметрии определяется 1,3-тиазольными заместителями малеопимаровой кислоты. Аргументом в пользу корректности вышеприведенной интерпретации спектров FL соединений 1–5 могут служить спектры возбуждения их люминесценции (рис. 5).
Рис. 5.
Скорректированные спектры возбуждения FL 1,3-тиазолпроизводных малеопимаровой кислоты: 1 – 1; 2 – 2; 3 – 3; 4 – 4; 5 – 5 (10–4 моль/л, CH3CN, 298) К).
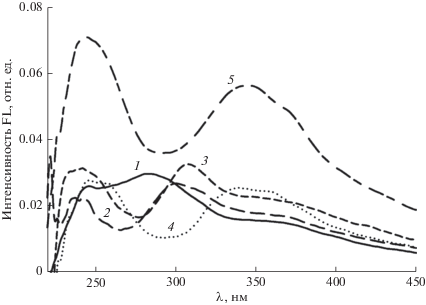
Вероятно, длинноволновые максимумы в спектрах возбуждения FL соединений 4–5 (${\lambda }_{{{\text{ex}}}}^{{{\text{max}}}}$ ≈ ≈ 345 нм) (рис. 5), аналогично спектрам излучения FL (рис. 3), определяются вторичной ароматической аминогруппой тиазольного кольца, в то время как коротковолновые (${\lambda }_{{{\text{ex}}}}^{{{\text{max}}}}$ ≈ 245 нм) малеиновым ангидридом в малеопимаровой кислоте (табл. 1). Cравнение спектров поглощения (рис. 2) и возбуждения FL (рис. 5) соединений 1–5, подобно спектрам излучения FL (рис. 3), также, и даже в большей степени, указывает на отклонение от правила зеркальной симметрии UV и FL спектров [13].
В результате проведенных исследований установлено, что спектральный состав FL и нарушение правила зеркальной симметрии 1,3-тиазолилсодержащих производных МПК, на основании литературных данных [13], могут быть объяснены конкурирующим влиянием тиазольного заместителя и МА в дитерпеноиде на форму потенциальных кривых и расположение колебательных уровней электронно-возбужденного и основного состояния соединений 1–5. Полученные результаты демонстрируют высокую чувствительность и информативность спектрально-люминесцентного метода по сравнению со спектрофотометрией. Знание спектрально-люминесцентных характеристик может быть использовано при идентификации примесей в лекарственных препаратах на основе 2-амино-1,3-тиазолсодержащих производных МПК, обладающих высокой противоопуxoлевой, антимикробной и антиоксидантой активностью, а также в изучении их фармакокинетики и в биохимических исследованиях.
ИСТОЧНИКИ ФИНАНСИРОВАНИЯ
Спектрально-люминесцентных измерения выполнены на оборудовании ЦКП “Химия” УфИХ РАН и РЦКП “Агидель” УФИЦ РАН. Работа выполнена в рамках Государственного задания по темам НИР УфИХ УФИЦ РАН AAAA-A20-120012090030-6 (серийный номер 0246-2018-0018) и AAAA-A20-120012090026-9 (порядковый в ГЗ 0246-2018-0023, 0246-2019-0027).
Список литературы
Красовицкий Б.М., Болотин Б.М. // Органические люминофоры. М.: Химия, 1984. С. 336.
Täuscher E., Wei, D., Beckert R., Fabian J., Assumpção A., Görls H. // Tetrahedron Lett. 2011. V. 52. № 18. P. 2292.
Kayumova R.R., Sultanbaev A.V., Ostakhov S.S., Khursan S.L., Abdullin M.F., Gantsev Sh.K., Sakaeva D.D. // J. Lumin. 2017. V. 192. P. 424.
Borisevich S.S., Kayumova R.R., Tsypysheva I.P., Ostakhov S.S., Khursan S.L. // J. Photochem. Photobiol. A: Chemistry. 2017. V. 344. P. 192.
Остахов С.С., Цырлина Е М., Юнусова С.Г., Юнусов М.С., Казаков В.П. // Известия Академии наук. Сер. хим. 1997. № 4. С. 736.
Sultanova R.M., Lobov A.N., Shumadalova A.V., Meshcheryakova S.A., Zileeva Z.R., Khusnutdinova N.S., Vakhitov V.A., Vakhitova Yu.V. // Nat. Prod. Res. 2019. P. 1.
Täuscher E., Calderón-Ortiz L., Weiß D., Beckert R., Görls H. // Synthesis. 2011. V. 2011. №14. P. 2334.
Stippich K., Weiss D., Guether A., Görls H., Beckert R. // J. Sulfur Chem. 2009. V. 30. № 2. P. 109.
Султанова Р.М., Билалова Л.Ф., Мухаметьянова А.Ф. // Башкирский химический журн. 2018. Т. 25. № 2. С. 24.
Карабаева Л.К., Платонова И.А., Заварзин И.В., Луйксаар С.И., Яровенко В. Н., Набатов Б.В., Краюшкин М.М., Барачевский В.А. // Химия гетероциклических соединений. 2011. № 2. С. 287.
Parker C.A., Rees W.T. // Analyst. 1960. V. 85. № 1013. P. 587.
Tatischeff I., Klein K. // Photochem. Photobiol. 1975. V. 22. № 6. P. 221.
Левшин В.Л. // Фотолюминесценция жидких и твердых тел. Л.: Государственное издательство технико-теоретической литературы, 1951. С.456.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий