Химия высоких энергий, 2021, T. 55, № 5, стр. 374-379
Фотокаталитические реакции воды на суспензиях окисно-титановых полупроводниковых материалов
Т. С. Джабиев a, *, Л. В. Авдеева a, З. М. Джабиева a
a Федеральное государственное бюджетное учреждение науки Институт проблем химической физики Российской академии наук
142432 Московская обл., Черноголовка, просп. акад. Семенова, 1, Россия
* E-mail: dzhabiev@icp.ac.ru
Поступила в редакцию 01.03.2021
После доработки 28.04.2021
Принята к публикации 11.05.2021
Аннотация
Рассмотрены полуреакции фотокаталитического восстановления и окисления воды в присутствии экзогенных доноров и акцепторов электронов, а также реакция разложения воды на элементы на поверхности окисно-титановых полупроводниковых материалов с целью создания преобразователя солнечной энергии в энергию химического топлива – водорода. При фотоиндуцированном разложении воды использован катализатор двухэлектронного восстановления протонов среды в молекулу водорода, а одноэлектронное окисление воды осуществляется на поверхности полупроводникового материала.
ВВЕДЕНИЕ
В связи с ростом потребления энергии и ограниченностью ее источников на Земле в начале семидесятых годов прошлого века Н.Н. Семёнов пришел к выводу, что “быстрое исчерпание ресурсов топлива и опасность увеличения углекислого газа в атмосфере настоятельно ставят перед человечеством проблему создания принципиально новой базы мировой энергетики” [1]. Поэтому “использование солнечной энергии относится к наиболее важным глобальным проблемам человечества” [1]. Способы преобразования солнечной энергии (СЭ) Н.Н. Семёнов делил условно на четыре типа: 1) теплотехнические, 2) фотоэлектрические, 3) биологические, 4) химические [2].
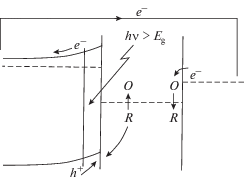
Львиную долю преобразователей СЭ составляют полупроводниковые (ПП) солнечные батареи и другие ПП устройства, в частности, фотоэлектрохимические (ФЭХ). Повышенный интерес к ФЭХ преобразователям появился после осуществления авторами работ [3–5] фотоэлектролиза воды на кислород и водород при освещении окисно-титанового ПП электрода. В результате этой фотоэлектрохимической реакции происходит запасание энергии солнечного света в виде химического топлива – водорода. Создание химической модели оксигенного фотосинтеза сдерживается из-за отсутствия достаточно эффективно работающей молекулярной конструкции, позволяющей предотвратить быструю рекомбинацию фотогенерированных зарядов противоположного знака. Именно с задачей разделения зарядов прекрасно справляются ПП преобразователи. В твердотельных солнечных батареях разделение электронов и дырок происходит в градиенте потенциала в области p-n-перехода. В ФЭХ преобразователях такое разделение фотогенерированных электронно-дырочных пар h-e происходит в электрическом поле приповерхностной области ПП электрода на границе раздела ПП–электролит. Схема искусственного ПП фотоэлектросинтеза представлена на рис. 1.
Согласно этой схеме на ПП материале n-типа происходит фотоокисление редокс-пары, служащей акцептором электронов. На другом ПП электроде идет фотовосстановление протонов среды (химическая модель фотосистемы I (ФС I) оксигенного фотосинтеза), причем образующиеся дырки захватываются редокс-парой, которая ранее была восстановлена на окислительном электроде. В этой ПП модели фотосинтеза вода разлагается на Н2 и О2. Реакция очень напоминает природный процесс, если вместо темнового восстановления СО2 в углеводы (цикл Кальвина), рассматривать восстановление протонов среды в Н2.
Фотоиндуцированные реакции воды на полупроводниковых материалах до сих пор вызывают большой интерес [6–12].
В данной работе изучены фотокаталитические полуреакции восстановления воды экзогенными донорами электронов H2S и Na2S ⋅ 9Н2О на SrTiO3 с образованием Н2 и окисления воды акцепторами электронов AgNO3 и K3Fe(CN)6 с образованием О2, а также реакция разложения воды на TiO2 и SrTiO3 с целью создания искусственного преобразователя световой энергии в энергию химического топлива.
Под действием кванта света в ПП материале образуются свободные электроны в зоне проводимости и дырки в валентной зоне. Эти элементарные восстановители и окислители могут быть использованы в редокс-реакциях. Таким образом, на поверхности ПП веществ могут быть осуществлены все фотохимические реакции, которые протекают в химических молекулярных системах. В отличие от ФЭХ ячеек, где можно за счет внешнего источника менять уровень Ферми в ПП электроде, мы рассмотрим лишь такие вещества, которые способны осуществлять фоторазложение воды без приложения дополнительного напряжения на электроды.
Проблема утилизации СЭ путем фотоэлектролиза воды будет решена, как только будет создан ПП материал с достаточно узкой шириной запрещенной зоны и с высокой фотокоррозионной стойкостью. По оценкам Геришера [13], при подборе ПП с шириной запрещенной зоны около 2 эВ и удачно расположенными уровнями можно рассчитывать на фоторазложение воды с к.п.д. 20%. Для технического использования фоторазложения воды необходимо достичь к.п.д. 10%, чтобы можно было серьезно говорить о водородной энергетике.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ПП материалы TiO2 (анатаз) и SrTO3 получили по методикам, описанным в работах [14, 15]. Нанесение Pt на поверхность ПП проводили согласно методике [15].
Реакции воды осуществляли в кварцевом реакторе, соединенном с вакуумной установкой. Растворы продувались гелием, затем откачивались на вакуумной установке для удаления остатков воздуха. После этого растворы подвергались фотолизу. Источником света служила ртутная лампа сверхвысокого давления ДРШ-1000. Для выделения нужной длины волны использовали интерференционные и стеклянные светофильтры. Для предотвращения разогрева реакционной смеси под действием света применялся водный слой толщиной 10 см. Интенсивность падающего на образец света Io определялась по методике [16] с помощью ферриоксалатного актинометра при комнатной температуре и в тех же условиях, в которых проводился фотолиз исследуемых образцов. Квантовые выходы О2 и Н2 определяли по формуле γ = w/Io, где w – скорость образования продуктов. Анализ продуктов реакции осуществляли с помощью насоса Теплера и хроматографа ЛХМ-8МД. Чувствительность хроматографа порядка 10–9 моль по О2 и 10–10 моль по Н2.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Фотокаталитическое восстановление воды экзогенными донорами электронов на поверхности полупроводника
Восстановление воды в Н2, сенсибилизированном ПП, можно рассматривать по аналогии с физико-химическими моделями фотосистемы I (ФС I) фотосинтеза. Если дно зоны проводимости ПП р-типа лежит выше окислительно-восстановительного потенциала (ОВП) атомарного водорода (–2.1 В), то образовавшийся при поглощении кванта света электрон в зоне проводимости термодинамически способен образовать атом Н при восстановлении протона среды. В тех же случаях, когда энергетический уровень электрона в зоне проводимости расположен ниже –2.1 В, но выше уровня редокс-пары Н+/Н2, выделения водорода можно добиться с помощью катализатора формирования Н2. ПП представляет собой фотосенсибилизатор, который при поглощении кванта света с ħω > ΔEg (ширины запрещенной зоны) создает одноэлектронный восстановитель – электрон в зоне проводимости. Одновременно образуется и одноэлектронный окислитель – дырка в валентной зоне. Для эффективного использования электронов в восстановительных реакциях фотогенерированные дырки должны быть убраны из зоны реакции, поскольку они могут рекомбинировать с электронами. В качестве перехватчиков дырок можно использовать подходящие доноры электрона, реагирующие с дырками с достаточно большой скоростью. Тогда электроны будут расходоваться на полезные реакции восстанвления протонов среды. Хотя потенциал электрода при освещении становится отрицательным, Н2 не выделяется, поскольку на ПП из-за большого перенапряжения реакция разряда Н3О+ происходит при потенциалах – 0.8…–1.0 В, т.е. значительно отрицательнее потенциала плоских зон (ппз) [17]. Однако если модифицировать поверхность электрода металлической платиной, то можно наблюдать выделение Н2 при освещении погруженного в раствор электрода. Связано это с тем, что платина обладает очень малым водородным перенапряжением, и развиваемого на освещенном электроде потенциала (ппз ПП около –0.5 В в условиях наших опытов) вполне достаточно для образования Н2 на платиновых островках. Таким образом, модифицирование ПП–электрода платиной представляет собой введение в систему катализатора формирования Н2, что позволяет использовать два одноэлектронных восстановителя (е–) в концертном двухэлектронном процессе образования молекулы Н2. Реакция выделения Н2 относится в этом случае (когда энергетический уровень электрона лежит ниже –2.1 В) к катализу некомплементарных процессов, осуществляемому в соответствии с принципом переключения стадийного механизма в коллективный. Этот принцип был сформулирован Н.Н. Семёновым, А.Е. Шиловым и Г.И. Лихтенштейном (в том числе применительно к проблеме фотосинтеза [18] (принцип СШЛ)).
Была изучена реакция восстановления воды в водород при облучении водной суспензии SrTiO3 светом с различной длиной волны. Из рис. 2 видно, что начальные скорости растут с нуля при λ = = 313 нм до 0.33 мкмоль/мин при λ = 248 нм.
Рис. 2.
Кинетика образования водорода при облучении суспензии SrTiO3 квантами света рузличной длины волны. SrTiO3 77 мг в 30 мл раствора, рН 13, конц. донора (H2S или Na2S∙9H2O) 0.1 М, комн. температура. Указаны использовавшиеся стеклянные светофильтры или длины волны интерференционных све-тофильтров: 1 – УФС-5, 2 – λ = 280 нм, 3 – ПС-11, 4 – λ = 248 нм, 5 – полный свет лампы ДРШ-1000.
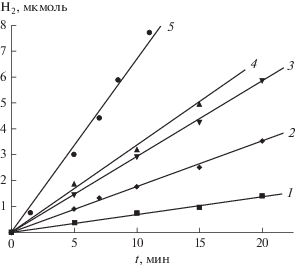
Донорами электрона в этой фотореакции служат H2S или Na2S ⋅ 9Н2О. Фотореакция проводилась при рН 13, причем скорость выделения Н2 не зависела от того, имеется ли на поверхности ПП катализатор (платина) или нет. Отсутствие влияния платинового катализатора на процесс формирования Н2, объясняется тем, что в присутствии SH– ппз смещается в катодную область на величину порядка –0.4 В при [H2S] = 0.1 М [19]. В этих условиях катализатор становится ненужным, т.к. сам электрод выступает в его роли и способствует рекомбинации двух фотогенерированных атомов водорода в молекулу Н2.
Квантовый выход Н2 при λ = 248 нм (прямая 4) в расчете на каждый перенесенный электрон равен 30%, т.е. соответствует максимальному значению, полученному в ФЭХ ячейках [20]. Отметим, что в отсутствие SH– фотовыделение Н2 при фотолизе воды на поверхности SrTiO3 возможно только с Pt-катализатором [19], поскольку в этом случае нет смещения ппз и для снижения водородного перенапряжения необходима Pt.
Фотоиндуцированное окисление воды на поверхности полупроводника
Окисление воды в О2 различными акцепторами на поверхности окисных ПП изучено Красновским с сотрудниками [21–23]. Механизм реакции включает промежуточное образование ОН-радикала при одноэлектронном окислении воды или гидроксильного иона. Очевидно, что катализатор необходим в тех случаях, когда силы окислителя недостаточно для одноэлектронного окисления воды в ОН-радикал, хотя ее вполне достаточно для многоэлектронного процесса, т.е. для образования О2 или Н2О2 и др. Большинство окисных ПП имеют не только большие значения ΔЕg, но и низко расположенные уровни валентной зоны. Это приводит к тому, что фотогенерированные в ПП дырки обладают более высоким ОВП, чем редокс-пара ОН/Н2О. Поэтому одноэлектронное окисление воды будет протекать гладко без катализатора.
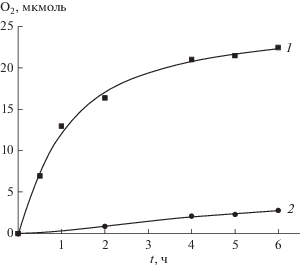
При облучении суспензии TiO2 и SrTiO3 УФ светом в присутствии акцепторов электронов выделяется кислород. На рис. 3 приведены кинетические кривые образования О2 с акцепторами K2PtCl6 и Ru(OH)Cl3 на разных ПП.
Рис. 3.
Выделение кислорода в ходе фотоосаждения металлов на поверхность полупроводника. Системы: TiO2 + K2PtCl6 (1), SrTiO3 + Ru(OH)Cl3 (2), количество акцептора 3 × 10–7 моль, полный свет лампы ДРШ-1000, ПП 80 мг в 30 мл воды. Начальное значение рН 6, комн. температура.
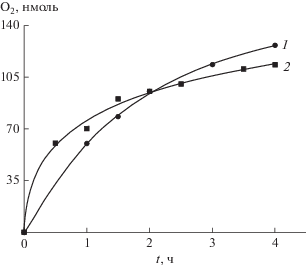
Количество выделившегося О2 за 4 ч соответствует приблизительно половине взятого акцептора. В данном случае окислители расходуются необратимо, и таким образом можно получать металлические покрытия на поверхности ПП. На рис. 4 приведены аналогичные кривые для Sr-TiO3, легированного кобальтом (2%). Этот образец был предварительно модифицирован металлической Pt, осажденной фотохимически. Видно, что необратимый окислитель AgNO3 реагирует с электронами из зоны проводимости эффективнее, чем обратимый акцептор K3Fe(CN)6.
Рис. 4.
Кинетика окисления воды при облучении Sr-TiO3/Pt через светофильтр ЖС-4. ПП 70 мг, легирован 2% кобальта, V = 30 мл, акцептора 10–4 моль: 1 – AgNO3, 2 – K3Fe(CN)6.
При этом в случае AgNO3 выделяется почти стехиометрическое количество О2, тогда как за такое же время с K3Fe(CN)6 образуется значительно меньше О2 (12%). По мере выделения кислорода рН раствора уменьшается, также уменьшаются скорости процесса (рис. 4). Сильное различие в скоростях процесса в случае двух акцепторов (рис. 4) можно объяснить разной эффективностью поверхностной рекомбинации фотогенерированных зарядов. Действительно, если предположить наличие поверхностных уровней рекомбинации, расположенных ниже дна зоны проводимости [24], то эти уровни окажутся в значительной мере заполненными электронами в случае “привязывания” уровня Ферми ПП к ОВП Fe(CN)3–/4–. В результате становится возможной быстрая поверхностная рекомбинация зарядов, что снижает эффективность процесса. При переходе к другой редокс-паре Ag+/Ag уровень Ферми опустился в результате изгиба зон на ~0.4 эВ ниже, опустошив поверхностные уровни рекомбинации и, таким образом, снизив интенсивность гибели избыточных дырок с электронами. Это скажется на повышении скорости выделения О2.
Наличие поверхностных энергетических уровней при осаждении платины на поверхности TiO2 на 0.8–1.0 эВ ниже дна зоны проводимости было подтверждено методом элекроотражения [25].
Скорость образования О2 меняется при разных длинах волн поглощаемого ПП света. Следует отметить, что спектр действия SrTiO3 отличается от спектра его отражения, в котором при 370 нм достигается плато [26]. Точно так же он отличается от спектра действия платинированного анатаза в реакции выделения Н2 из раствора ЭДТА, который почти совпадает со спектром отражения SrTiO3 [27]. Полученный нами спектр действия очень напоминает спектральную зависимость квантового выхода барьерного фотоэффекта на границе ПП−раствор электролита для пленочных образцов TiO2 (рутил) [19] или монокристаллических фотоанодов из SrTiO3 [27]. Максимум квантового выхода барьерного фотоэффекта в TiO2 наблюдался при 290–330 нм [19], что совпадает с максимум скорости выделения О2 в нашем случае, нормированном на число попадающих в реактор квантов.
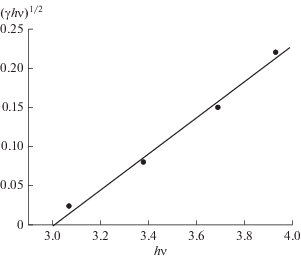
Таким образом, вблизи края основного поглощения должна наблюдаться линейная зависимость между (γħω)1/2 и ħω, где γ = Wo/Iо [28]. Полученная нами зависимость скорости выделения кислорода от длины волны возбуждающего света в случае SrTiO3/Pt, представленная на рис. 5, спрямляется в этих координатах, причем прямая отсекает на оси абсцисс величину 3 эВ, соответствующую ширине запрещенной зоны нашего образца.
Аналогичная обработка кривой для SrTiO3, легированного двуокисью рутения (0.045%) [29], дает значение ΔEg = 3 эВ, т.е. такое же, какое у нас получилось для модифицированного платиной образца SrTiO3. Это указывает на то, что в обоих случаях образуются примесные уровни вблизи дна зоны проводимости SrTiO3.
Фотокаталитическое разложение воды на полупроводниковых материалах
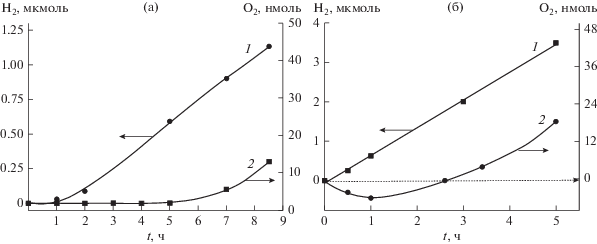
Фотоэлектролиз воды при облучении электродов из ПП окислов был подробно изучен в работах [15, 30–32]. Было показано, что эффективность процесса фотоэлектролиза резко возрастает при платинировании ПП материала с целью снятия большого водородного перенапряжения. На рис. 6 показаны кривые образования Н2 и О2 при фотолизе воды в присутствии покрытых родием суспензий SrTiO3. Убыль О2 в начале реакции соответствует эффективной фотоадсорбции кислорода при облучении УФ светом образцов SrTiO3. Первые порции образующегося кислорода оказываются связанными с суспензией ПП и не могут быть обнаружены хроматографированием газовой фазы. Скорость фотокаталитического образования Н2 и О2 сильно зависит от рН раствора. При рН < 2 реакция на SrTiO3 вообще не идет. Возможно, отсутствие реакции при рН < 2 связано с перезарядкой поверхности частицы SrTiO3 в кислых растворах. Вид кислородной кинетической кривой при фотолизе воды зависит от многих факторов. Так, при замене осажденной на поверхность SrTiO3 платины родием в щелочной среде (рис. 6а) наблюдается значительно меньшая фотоадсорбция О2, а при добавлении в раствор нейтральной соли при рН 6 (рис. 6б) увеличивается скорость выделения Н2, а также сокращается время выхода кислорода. На начальных стадиях процесса не только не наблюдается образования О2 в газовой фазе, а, наоборот, видно его поглощение (рис. 6б).
Рис. 6.
Изменения содержания водорода и кислорода в газовой фазе при облучении УФ светом суспензии SrTiO3, модифицированной родием (0.1 ат. %): (а) при [KOH] = 1.0 M, (б) при рН 6, добавлено 0.1 М Na2CO3. ПП 70 мг в 30 мл раствора.
В изучаемых окисных ПП образцах дырки в валентной зоне способны окислять воду одноэлектронно с образованием ОН-радикалов. Далее ОН-радикалы рекомбинируют с образованием Н2О2. Образование О2 возможно либо при дальнейшем окислении Н2О2, либо при диспропорционировании 2Н2О2 на Н2О и О2. При фоторазложении воды в водных суспензиях TiO2 электрохимическими методами было доказано образование Н2О2 на первых стадиях процесса [33]. Механизм процесса можно представить схемой:
1. 2H+ + 2е– → H2 – образование водорода на катализаторе Rh.
2. OH– + h+ → OH· – одноэлектронное окисление воды до ОН-радикала;
3. OH· + OH· → H2O2 – рекомбинация двух радикалов с образованием пероксида водорода;
4. а) 2H2O2 → O2 + 2H2O – диспропорционирование пероксида водорода;
б) Н2O2 + 2h+ → O2 + 2Н+ – окисление пероксида водорода.
ЗАКЛЮЧЕНИЕ
Таким образом, фотостимулированное разложение воды на широкозонных ПП требует присутствия катализатора формирования молекулы Н2, а окислительная часть реакции осуществляется в одноэлектронном фотоиндуцированном процессе.
Квантовые выходы Н2 и О2 при облучении SrTiO3 в присутствии доноров (H2S или Na2S∙9H2O) или акцептора (AgNO3) электрона достигают 30%.
Список литературы
Семенов Н.Н. Молодежь и будущее. М.: Вектор-ТиС, 2010. 260 с.
Семенов Н.Н. Преобразование солнечной энергии. Сб. статей, Черноголовка, 1981. 188 с.
Fujishima A., Honda K. // Bull. Chem. Soc. Japan. 1971. V. 44. P. 1148.
Bard A.J. // J. Photochem. 1979. V. 10. P. 59.
Красновский А.А. Преобразование энергии света при фотосинтезе. М.: Наука, 1974. 64 с.
Patial S., Hasija V., Raizada P. et al. // J. Environmental Chem. Engineering. 2020. V. 8. № 3. P. 103791.
Nong S., Dong W., Yin J. et al. // J. Amer. Chem. Soc. 2018. V. 140. P. 5719.
Chen Y., Yu G., Chen W. et al. // J. Amer. Chem. Soc. 2017. V. 139. P. 12370.
Matheu R., Moreno-Hernandez I.A., Sala X. et al. // J. Amer. Chem. Soc. 2017. V. 139. P. 11345.
Willinger E., Massue C., Schlogel R., Willinger M.G. // J. Amer. Chem. Soc. 2017. V. 139. P. 12093.
Lin Y., Yuan G., Liu R. et al. // Chem. Phys. Letters. 2011. V. 507. P. 209.
Grätzel M. // Accounts Chem. Res. 2009. V. 42. № 11. P. 1788.
Gerischer H. // Ber. Bunsenges. Physik. Chem. 1976. B. 80. № 11. S. 1046.
Горощенко Я.Г. Химия титана. Киев: Наукова думка, 1970. 416 с.
Lehn J.-M., Sauvage, J.-P., Ziessel R. // Nouv. J. Chim. 1984. V. 4. № 11. P. 623.
Беккер Г.О. Введение в фотохимию органических соединений. М.: Химия, 1976. 384 с.
Бендерский В.А., Золотовицкий Я.М, Коган Я.Л. и др. // Докл. АН СССР. 1975. Т. 222. № 3.С. 606.
Семенов Н.Н., Шилов А.Е., Лихтенштейн Г.И. // Докл. АН СССР. 1975. Т. 221. № 6. С. 1374.
Borgarello E., Erbs W., Grätzel V. et al. // Nouv. J. Chim. 1983. V. 7. № 3. P. 195.
Carr R.C., Somorjai G.A. // III International conference on photochemical conversion and storage of solar energy. Univ. of Colorado, Boulder, 1980, Book of Abstracts, p. 399.
Красновский А.А., Брин Г.П. // Докл. АН СССР 1962. Т. 147. № 4. С. 656.
Красновский А.А., Брин Г.П. // Докл. АН СССР. 1966. Т. 168. № 1. С. 1100.
Красновский А.А., Брин Г.П. // В сб.: Молекулярная фотоника. Л.: Наука, 1970. 235 с.
Бабенко С.Д., Бендерский В.А., Бородько Ю.Г. и др. // Хим. физика. 1984. Т. 3. № 4. С. 584.
Стрельцов Е.А., Пахомов В.П., Лазаренко-Маневич Р.М., Кулак А.И. // Электрохимия. 1983.Т. 19. № 3. С. 365.
Matsumura M., Hiramoto M., Iehara T., Tsubomura H. // J. Phys. Chem. 1984. V. 88. № 2. P. 248.
Mills A., Porter G. // J. Chem. Soc., Faraday Trans. 1. 1982. V. 78. P. 3659.
Гуревич Ю.А, Плесков Ю.В. Фотоэлекрохимия полупроводников. М.: Наука, 1983. 312 с.
Фомин Г.В., Брин Г.П., Генкин М.В. и др. // Докл. АН СССР. 1973. Т. 212. № 2. С. 424.
Wrighton M.C., Wolczanski P.T., Ellis A.B. // J. Solid State Chem. 1977. V. 22. № 1. P. 17.
Kalyanasundaram K., Borgarello E., Grätzel M. // Helv. Chim. Acta. 1981. V. 64. № 35. P. 362.
Никиша В.В., Шелимов Б.Н., Казанский В.Б. // Кинетика и катализ. 1974. Т. 15. № 3. С. 676.
Hemminger J.C., Carr R., Somorjai G.A. // Chem. Phys. Lett. 1978. V. 57. № 1. P. 100.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий