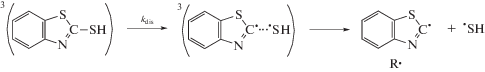Химия высоких энергий, 2021, T. 55, № 5, стр. 361-365
Влияние поверхностно-активных веществ на фотосенсибилизированную красителями реакцию распада 2-меркаптобензотиазола
В. Л. Иванов a, *, С. Ю. Ляшкевич a
a Московский государственный университет имени М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
* E-mail: fotochem@yandex.ru
Поступила в редакцию 08.02.2021
После доработки 30.03.2021
Принята к публикации 11.05.2021
Аннотация
Показано, что при облучении красителей в присутствии поверхностно-активных веществ (CPCl, CPBr, CTAB, SDS, TX100) наблюдается увеличение квантового выхода фотосенсибилизированного красителями распада 2‑меркаптобензотиазола (MBT) в водных растворах как для молекулярной, так и для ионной формы MBT. Предложен механизм фотосенсибилизированного распада 2-меркаптобензотиазола красителями в присутствии ПАВ.
2-Меркаптобензотиазол и его производные используются в качестве фунгицидов и гербицидов в сельском хозяйстве [1, 2]. 2‑Меркаптобензотиазол, являясь хорошим инициатором радикальных реакций, применяется при производстве полимерных материалов [3], а также используется при вулканизации каучука [4]. В связи с широким использованием MBT в промышленности и сельском хозяйстве большое его количество попадает в окружающую среду. Он был обнаружен в поверхностных водах и в сточных водах очистных сооружений [5, 6]. Поскольку MBT обладает канцерогенными свойствами [7], а его отходы попадают в окружающую среду, встает вопрос о его дезактивации. Одним из способов дезактивации MBT является его фотохимическое разложение. В работе [8] было показано, что красители разных классов при их облучении сенсибилизируют распад MBT в водных растворах. Целью данной работы является изучение фотосенсибилизированного красителями распада MBT в водных растворах в присутствии поверхностно-активных веществ. Поведение некоторых красителей в присутствии ПАВ было изучено в работах Чибисова [9–11].
МЕТОДИКА ЭКСПЕРИМЕНТА
2-Меркаптобензотиазол, C7H5NS2 (97%), Sigma-Aldrich Co., красители, а также поверхностно-активные вещества использовали марки “ч. д. а”. Все эксперименты проводили в дистиллированной воде при pH 9.2 в присутствии буры (0.05 М) и при pH 5.6 в присутствии ацетатного буфера. Растворы MBT с красителями в зависимости от их спектров поглощения облучали в видимой области спектра либо светом ртутной лампы ДРШ‑500 с фильтрами для выделения ртутных линий, либо светом галогенной лампы с фильтрами ЖС17 + СЗС22 или ЖС11 + СЗС22. Для облучения образцов использовали кварцевые кюветы 10 × 10 мм. За кинетикой фотохимической реакции (распад MBT) следили по спектрам поглощения. Спектры поглощения растворов регистрировали на спектрофотометре “Shimadzu UV-2101PC”.
Квантовые выходы фотохимической реакции определяли по расходованию MBT от дозы поглощенного света с помощью программы Mathcad 15. Точность определения квантовых выходов составляла 10%. Интенсивность поглощенного света при использовании ртутной лампы определяли с помощью фотоэлемента Ф 4, прокалиброванного ферриоксалатным актинометром [12]. Интенсивность света галогенной лампы с комбинацией светофильтров СС5 + ЖС4 определили с помощью фотореакции рибофлавина в растворе буры (0.05 М) с квантовым выходом 0.032 при облучении светом ртутной лампы 436 нм с известной интенсивностью и светом галогенной лампы с светофильтрами СС5 + ЖС4. Интенсивность света галогенной лампы с другими светофильтрами определили с учетом данных для светофильтров СС5 + ЖС4 и зависимости интенсивности света галогенной лампы от длины волны, измеренной с помощью флуориметра Perkin Elmer LS55.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
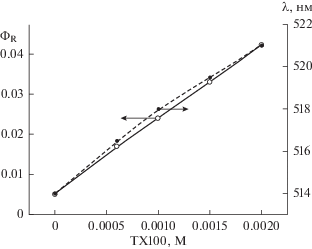
В работе [8] было показано, что при облучении красителей видимым светом в присутствии 2‑меркаптобензотиазола как в нейтральном, так и в щелочном водном растворе наблюдается распад MBT. В данной работе было изучено влияние ПАВ на фотосенсибилизированную ксантеновыми (эозин, эритрозин) и тиазиновыми (метиленовый синий) красителями, реакцию распада MBT. Обнаружено, что в присутствии ПАВ: цетилтриметиламмоний бромида (CTAB), цетилпиридиний хлорида (CPCl), цетилпиридиний бромида (CPBr), додецилсульфата натрия (SDS), тритона X100 (TX100) наблюдается увеличение квантового выхода фотосенсибилизированного красителями распада MBT как для ионной (pH 9.2), так и для молекулярной (pH 5.6) формы (рис. 1). При этом квантовый выход реакции не зависит ни от интенсивности света, ни от концентрации красителя. Следует отметить, что красители при их облучении в присутствии MBT и ПАВ не расходуются (рис. 2). Зависимость квантового выхода реакции распада MBT в присутствии катионных ПАВ симбатна зависимости максимума спектра поглощения красителя от концентрации ПАВ. Рост квантового выхода реакции распада MBT и изменение максимума спектра поглощения красителя наблюдается при концентрации ПАВ в области ККМ (критическая концентрация мицеллообразования), то есть когда образуются мицеллы, о чем свидетельствует, например, изменение максимума спектра поглощения красителя [13]. Максимум спектра поглощения эозина в водном растворе при концентрации ПАВ меньше ККМ равен 514 нм, а после ККМ, когда краситель находится в мицелле, максимум спектра поглощения равен 526 нм. При дальнейшем увеличении концентрации ПАВ как квантовый выход реакции, так и максимум спектра поглощения красителя остаются постоянными. Следует отметить, что в щелочной среде после ККМ изменяется максимум спектра поглощения MBT. В щелочном растворе максимум спектра поглощения ионной формы MBT при концентрации ПАВ до ККМ равен 307–308 нм, тогда как после ККМ максимум спектра поглощения равен 316–317 нм. Это связано с тем, что MBT в мицелле находится в молекулярной форме. Зависимость квантового выхода распада MBT, сенсибилизированного эозином или метиленовым синим в присутствии CPBr, имеет свои особенности по сравнению с CTAB и CPCl (рис. 3). В присутствии малых концентраций ПАВ сначала квантовый выход реакции распада MBT падает, а затем, как и в случае других ПАВ, резко возрастает, и при дальнейшем увеличении CPBr практически остается постоянным. При этом максимальное значение квантового выхода реакции распада MBT достигается при ККМ соответствующего ПАВ. В отличие от катионных ПАВ (CTAB, CPCl и CPBr) в присутствии неионогенного ПАВ (TX100) квантовый выход реакции распада MBT возрастаeт линейно от концентрации ПАВ, а максимум спектра поглощения красителя возрастает нелинейно и не связан с ККМ (рис. 4). Линейная зависимость квантового выхода реакции, а также зависимость максимума спектра поглощения красителя в случае TX100 обусловлена отличием структуры образующихся мицелл от мицелл катионных ПАВ. Мицеллы CTAB, CPCl и CPBr имеют сферическую форму, а мицеллы TX100 имеют пластинчатую форму, которая не является замнуктой.
Рис. 1.
Зависимость квантового выхода фотосенсибилизированного эозином распада MBT от концентрации CTAB при pH 9.2 (1), при pH 5.6 (2) и от концентрации CPCl при pH 9.2 (3), а также зависимость длины волны максимума спектра поглощения эозина от концентрации ПАВ.
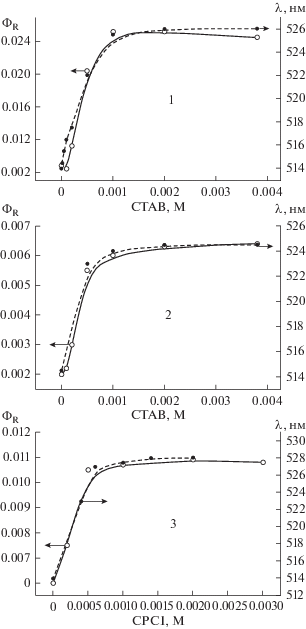
Рис. 2.
Фотолиз MBT при облучении эозина галогенной лампой с фильтрами ЖС17 + СЗС22 в присутствии CTAB (1 × 10–3 М) : 0, 60, 120, 240, 360, 480 с.
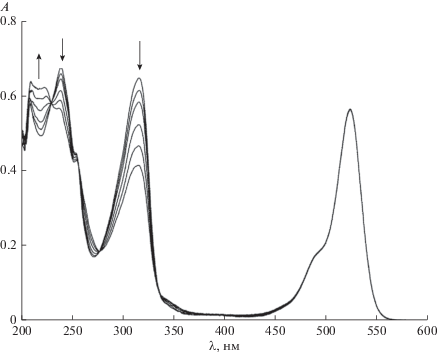
Рис. 3.
Зависимость квантового выхода фотосенсибилизированного эозином распада MBT при pH 9.2 от концентрации CPBr, а также зависимость длины волны максимума спектра поглощения эозина от концентрации ПАВ.
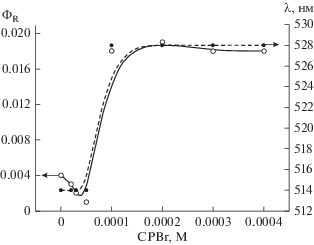
Рис. 4.
Зависимость квантового выхода фотосенсибилизированного эозином распада MBT при pH 9.2, а также зависимость длины волны максимума спектра поглощения эозина от концентрации TX100.
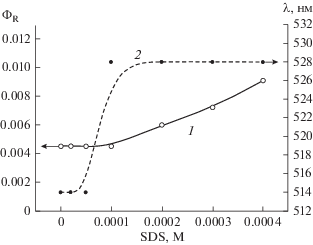
Принципиальным отличием от катионных ПАВ является анионное ПАВ SDS (рис. 5). В случае SDS наблюдается увеличение квантового выхода фотосенсибилизированного распада ионной формы MBT при pH 9.2 от концентрации ПАВ. Однако при этом, в отличие от катионных ПАВ, зависимость квантового выхода реакции не коррелирует с зависимостью изменения длины волны максимума спектра поглощения эозина от концентрации SDS. Это может быть связано с высокой поверхностной плотностью отрицательного заряда мицеллы SDS [14], что приводит к существенному локальному снижению рН в поверхностном слое мицеллы и часть MBT переходит в молекулярную форму и остается на поверхности мицеллы. Это подтверждается тем, что квантовый выход рекции для молекулярной формы MBT при pH 5.6 не меняется в присутствии SDS.
Рис. 5.
Зависимость квантового выхода фотосенсибилизированного эозином распада MBT при pH 9.2 (1), а также зависимость длины волны максимума спектра поглощения эозина (2) от концентрации SDS.
При взаимодействии MBT с триплетной молекулой красителя происходит перенос триплетной энергии с красителя на MBT [8]. Уменьшение квантового выхода фотосенсибилизированной эозином реакции распада MBT. В присутствии CPBr в водном растворе до ККМ (рис. 3), по-видимому, связано с тушением триплетной молекулы эозина анионом брома. Однако после образования мицелл ионы брома, находясь с внешней стороны мицеллы, не могут тушить трипленую молекулу красителя, которая находится внутри мицеллы. Триплетная молекула MBT диссоциирует на радикалы с образованием триплетной радикальной пары. Затем триплетная радикальная пара диссоциирует на свободные радикалы: радикал R• и радикал •SH. Синглетные радикальные пары, которые образуются из триплетных в результате спин-орбитального взаимодействия, с большой вероятностью рекомбинируют [15].
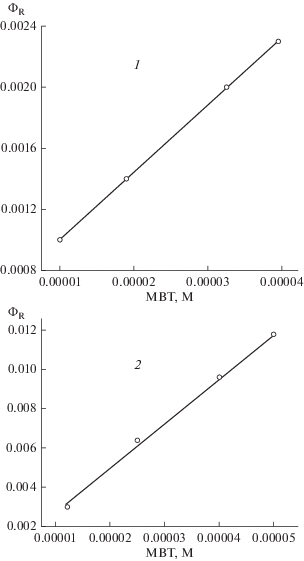
При этом следует отметить, что квантовый выход сенсибилизированной красителями реакции распада MBT в присутствии ПАВ линейно зависит от концентрации MBT (рис. 6) в отличие от сенсибилизированной реакции в отсутствие ПАВ, когда наблюдалась линейная зависимость в обратных координатах квантового выхода реакции и концентрации MBT [8]. Это различие связано с тем, что в мицеллах MBT находится в контакте с красителем и для протекания фотосенсибилизированной реакции диффузии не требуется в отличие от реакции в водных растворах. Кроме того, образующийся радикал MBT в мицелле находится в окружении органических цепей, поэтому быстро реагирует с образованием продукта реакции.
Рис. 6.
Зависимость квантового выхода фотосенсибилизированного эозином распада MBT от его концентрации в присутствии CTAB (1 × 10–3 M) при pH 5.6 (1) и фотосенсибилизированного метиленовым синим в присутствии CPCl (5 × 10–4 M) при pH 9.2 (2).
Таким образом, показано, что в присутствии различных ПАВ (катионных, анионных и неионных) наблюдается увеличение квантового выхода фотосенсибилизированного красителями (эозин, эритрозин, метиленовый синий) распада 2‑меркаптобензотиазола, находящегося как в ионной, так и в молекулярной форме. Рост квантового выхода фотосенсибилизированного красителями распада MBT в присутствии ПАВ связан с тем, что реакция протекает в мицеллах.
Список литературы
Malouki M.A., Giry G., Besse P., Combourieu B., Sancelme M., Bonnemoy F., Richard C., Delort A.-M. // Environ. Toxicol. Chem. 2003. V. 22. № 9. P. 2013.
De Wever H, Besse P., Verachtert H. // Appl. Microbiol. Biotechnol. 2001. V. 57. № 5. P. 620.
Suzuki S., Emilie P., Urano T., Takahara S., Yamaoka T. // Polymer. 2005. V. 46. № 7. P. 2238.
Stephensen E., Adolfsson-Erici M., Hulander M., Parkkonen J., Forlin L. // Aquatic Toxicology. 2005. V. 75. № 2. P.136.
Antonopoulou M., Evgenidou E., Lambropoulou D., Konstantinou I. // Water research. 2014. V. 53. P. 215.
Fries E., Gocht T., Klasmeier J. // J. Environ. Monit. 2011. V. 13. № 10. P. 2838.
Sorahan T. // Occup. Environ. Med. 2009. V. 66. № 4. P. 269.
Ivanov V.L., Lyashkevich S.Yu. // High Energy Chemistry. 2018. V. 52. № 6. P. 451.
Atabekyan L.S., Chibisov A.K. // High Energy Chemistry. 2007. V. 41. № 2. P. 91.
Micheau J.C., Zakharova G.V., Chibisov A.K. // Phys. Chem. Chem. Phys. 2004. V. 6. № 9. P. 2420.
Chibisov A.K., Prokhorenko V.I., Görner H. // Chem. Phys. 1999. V. 250. P. 47.
Экспериментальные методы химии высоких энергий. Под общ. ред. М.Я. Мельникова, М.: Изд-во МГУ. 2009. 824 с.
Shinoda K., Nakagawa T., Tamamushi B., Isemura T. // Colloidal Surfactants. Academic Press, N.Y. 1963.
Бородин О.О., Ильяшенко Р.Ю., Дорошенко А.О. // Химия гетероциклических соединений. 2014. № 3. С. 413.
Бучаченко А.Л., Сагдеев Р.З., Салихов К.М. // Магнитные и спиновые эффекты в химических реакциях. Новосибирск: Наука, 1978. 297 с.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий